Les condylomes sont des verrues génitales externes dues à l’infection par des papillomavirus humains, HPV- 6 et HPV- 11 dans plus de 90 % des cas (génotypes à faible risque oncogène) et, plus rarement, HPV- 30, 42, 43…
De transmission sexuelle, ils touchent indifféremment les deux sexes. Il s’agit des IST les plus fréquentes dans le monde : près de 5 % de la population a des lésions cliniques et une infection latente est estimée chez 25 % de la population de moins de 25 ans. Leur incidence est particulièrement élevée au début de la vie sexuelle (prévalence maximale entre 20 et 25 ans).
Très élevé, le risque de contamination après un seul contact sexuel est de l’ordre de 60 à 70 %. Si, dans la grande majorité des cas, une élimination virale naturelle spontanée s’effectue en quelques mois – dans les 2 ans chez plus de 90 % des personnes –, l’infection persiste dans 10 % des cas et induit des lésions visibles. La période d’incubation peut aller de quelques semaines à plusieurs années.
Les condylomes sont plus fréquents chez les patients immunodéprimés, infectés par le VIH et en cas de multipartenariat, mais toute personne en période d’activité sexuelle peut être concernée.
Un diagnostic clinique
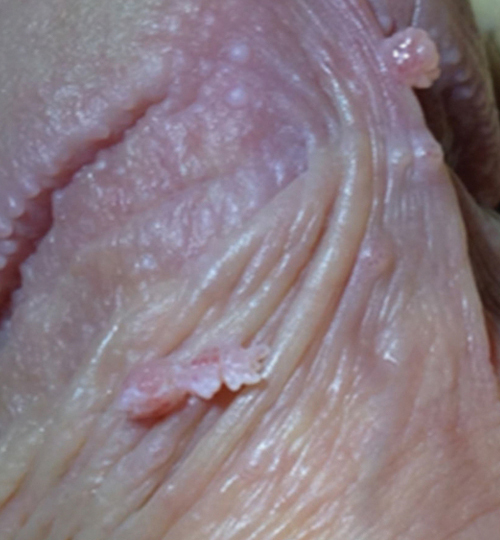
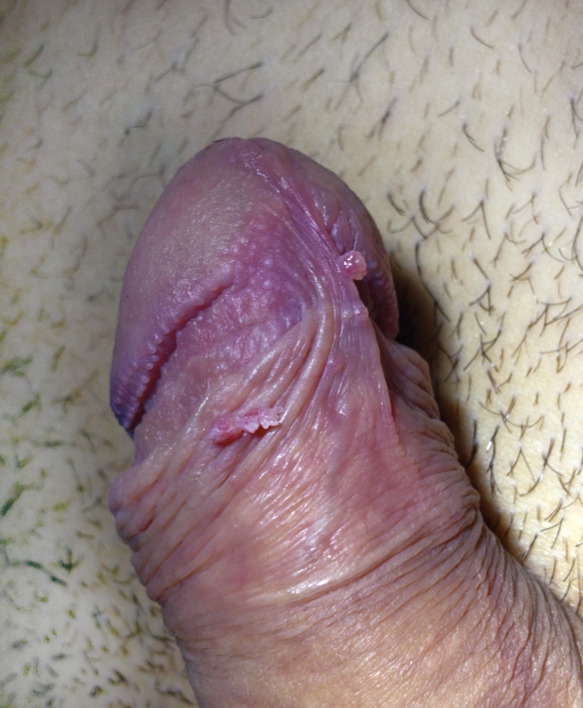
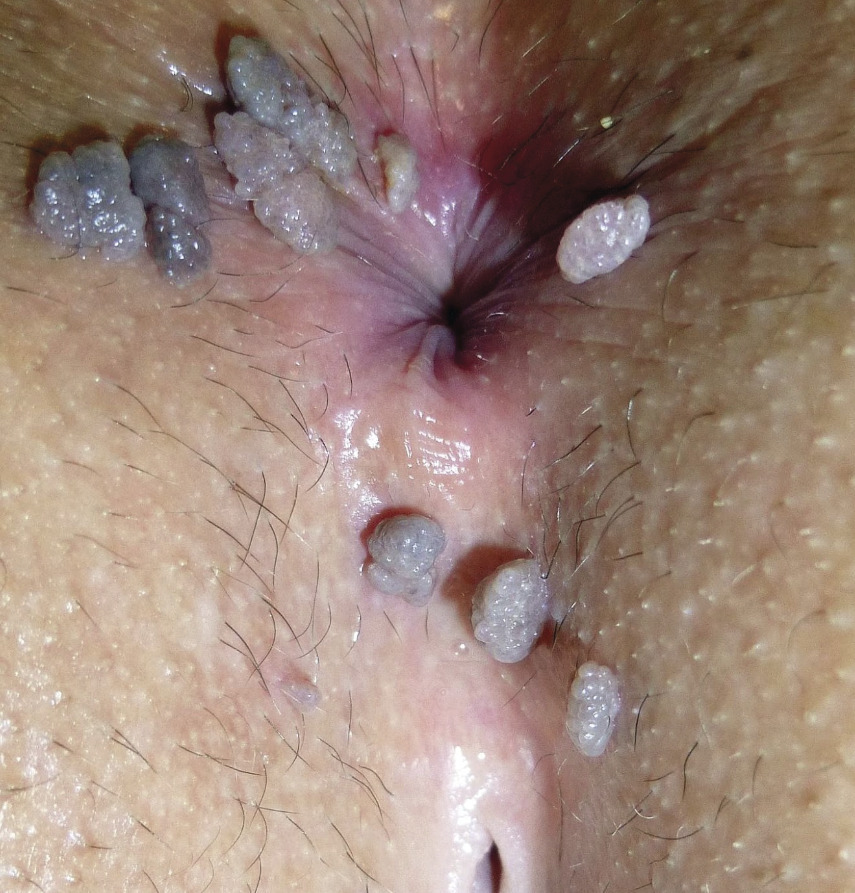
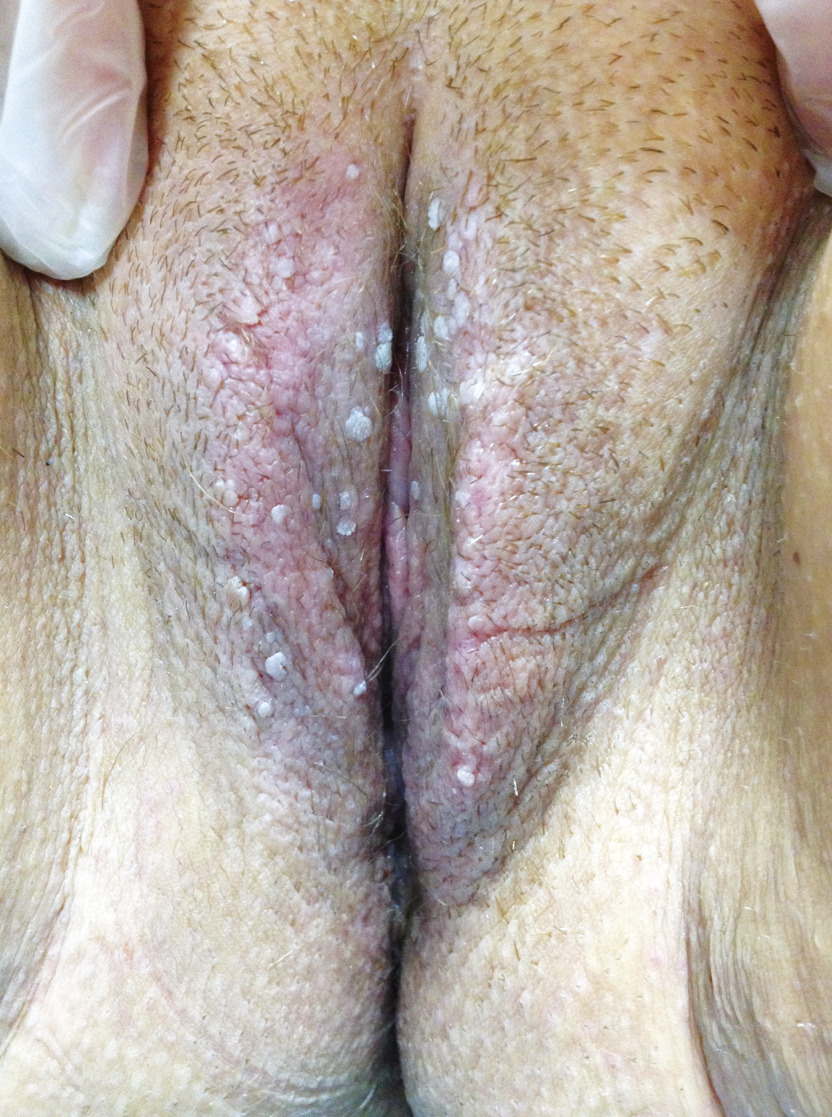
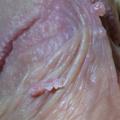
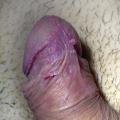
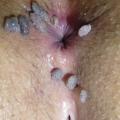
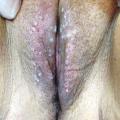
Le diagnostic de condylomes est clinique, le plus souvent simple car les lésions, très caractéristiques, sont visibles à l’œil nu. Elles peuvent être isolées ou en grappe, de la taille d’une tête d’épingle à plusieurs centimètres, de couleur rosée, grisâtre voire blanchâtre… On en distingue trois types :
- les condylomes acuminés (fig. 1, 2 et 3) : exophytiques, plus ou moins kératosiques, blanchâtres, papillomateux, souvent multiples, parfois confluents dits en « crête de coq » ;
- les condylomes papuleux (fig. 4) : petites papules infracentimétriques, couleur chair ;
- les condylomes plans : lésions à peine visibles, mais mieux identifiées après application d’acide acétique à 5 %, sous forme de macules blanches.
Forme particulière : le condylome géant de Buschke-Löwenstein, dont l’aspect clinique tumoral est inquiétant mais l’évolution généralement bénigne.
Les localisations les plus fréquentes sont : chez l’homme, le pénis, le prépuce externe et interne, le gland et la région périanale (30 % des cas même en l’absence de pratique sexuelle anale), plus rarement le scrotum et les plis inguinaux ; chez la femme, la vulve, le périnée et la région périanale (chez 20 % des femmes ayant une atteinte vulvaire), ces lésions externes sont associées dans un tiers des cas à des atteintes cervicales ou vaginales. Les localisations orales, laryngées ou conjonctivales sont très rares chez les patients immunocompétents.
La palpation des lésions à la recherche d’une infiltration fait partie de l’examen. Elle est particulièrement utile pour les lésions vulvaires et celles de la marge anale.
Les principaux diagnostics différentiels sont les marisques, les molluscums contagiosums, les kystes sébacés, les papilles endo-anales et certains cancers débutants.
Quel bilan complémentaire ?
Si ces lésions externes bénignes sont provoquées par les génotypes à bas risque oncogène, elles sont associées dans 20 à 30 % des cas à une infection par des génotypes à haut risque pouvant engendrer des lésions précancéreuses (un antécédent de condylomes anaux multiplie par 10 le risque de cancer anal, par exemple). Il est donc indispensable de réaliser un bilan locorégional aux sites pour lesquels le risque néoplasique est identifié, en portant attention au terrain (immunodépression, pratiques sexuelles à risque…), et de dépister les partenaires.
Chez les sujets infectés par VIH, en particulier, ces lésions sont plus fréquentes, extensives, souvent multifocales et associées à d’autres MST. Le risque de lésions dysplasiques et d’infections par des HPV oncogènes est plus important aussi.
Chez l’enfant, si les condylomes témoignent le plus souvent de contaminations non sexuelles (verrues des mains), la recherche de sévices sexuels doit être envisagée en présence de lésions génitales.
Rechercher d’autres localisations
Le bilan loco-régional recherche une atteinte multifocale.
L’urétroscopie est indiquée en cas de symptômes urinaires ou si le pôle supérieur des lésions n’est pas visualisé par éversion des berges du méat. Une atteinte méatique ou urétrale est présente dans 20 à 25 % des cas.
L’anuscopie est indiquée en cas de lésions périanales, de rapports réceptifs anaux et d’immunodépression. Les lésions anales siègent rarement au-delà de la ligne pectinée.
Le frottis cervico-vaginal à la recherche de lésions précancéreuses ou cancéreuses du col de l’utérus doit être systématique.
Un avis spécialisé (urologue, proctologue, gynécologue) peut être nécessaire.
Les indications de la biopsie sont limitées : doute diagnostique, infiltration lésionnelle, lésions atypiques (atteinte maculo-papuleuse rouge ou leucoplasique, macules acidophiles sur base érythémateuse…), formes résistantes au traitement. Les lésions endocanalaires anales sont plus volontiers biopsiées.
Dépistage des MST et examen des partenaires
Au minimum : Chlamydia sur 1er jet urinaire ou prélèvement vaginal, syphilis, hépatite B, VIH.
En fonction du contexte, des facteurs de risque et des pratiques sexuelles, d’autres examens peuvent être indiqués, par exemple dépistage de Chlamydia sur localisation anale.
Le bilan des partenaires est le plus souvent normal :
- partenaire masculin : un examen clinique sous bon éclairage à l’œil nu et à la loupe suffit ;
- partenaire féminine : examen gynécologique complet (périnée, vulve, vagin, col) et frottis cervico-utérin.
Quels traitements aujourd’hui ?
L’objectif du traitement est de faire disparaître les lésions visibles (leur régression spontanée est possible mais imprévisible). L’éradication virale est illusoire puisqu’il n’existe pas de traitement antiviral efficace contre les HPV.
Il existe 3 grands types de traitement : immunomodulateurs, chimiques, physiques destructeurs ou ablatifs. Le choix est fonction de la localisation, du type lésionnel, de l’expérience du praticien et de l’accessibilité des technologies, mais aussi des souhaits du patient (auto-application ou non…). Tous les traitements ont un taux d’échec considérable (de l’ordre de 30 %) et des taux élevés de récidives (30 à 50 % à 3 mois ; presque toutes surviennent dans la première année et plus de 80 % dans les 6 mois suivant la rémission initiale), qui rendent la surveillance indispensable.
L’information du patient est cruciale avant tout traitement : elle permet d’éviter les confusions (infection par HPV/maladie/cancer) en soulignant le caractère bénin des condylomes ; d’expliquer les modes de contamination et le degré de contagiosité élevé (transmission possible de condylomes externes « non couverts » par le préservatif ou lors des « préliminaires » sans préservatif) ; de préciser les délais d’incubation, notamment pour éviter des malentendus dans des couples stables dans des couples stables (v. encadré « idées reçues » ci-dessous) ; d’insister sur la fréquence des formes asymptomatiques qui expliquent des survenues retardées ou la négativité du bilan chez le(s) partenaire(s)…
Traitement immunomodulateur
L’imiquimod crème à 5 % est le traitement qui limite le plus les récidives lorsque les condylomes sont suffisamment localisés (efficace chez un patient sur deux environ ; taux de récidive d’environ 13 % à 3 mois, 23 % à 6 mois). Il a l’AMM chez le sujet immunocompétent ; ses résultats sont moyens chez les sujets infectés par le VIH contrôlés par trithérapie ; il est inefficace en cas d’immunodépression sévère.
L’application est locale, 3 fois par semaine, le soir au coucher avec rinçage soigneux le matin, pendant 4 à 16 semaines maximum. En pratique, l’efficacité clinique est rarement significative avant 2 mois (poursuivre le traitement avant de conclure à un échec). Un érythème local est fréquent (deux tiers des cas), rarement sévère (< 6 %) : pour éviter un arrêt intempestif, un topique cicatrisant en pommade peut être prescrit, à appliquer les jours sans imiquimod ; les applications d’imiquimod peuvent être transitoirement espacées.
Traitements chimiques
La podophyllotoxine à 5 % peut être employée en première intention pour les condylomes de petite taille et de nombre limité, mais elle est difficilement utilisable sur les lésions vulvaires et anales. Elle a une action antimitotique et cytolytique conduisant à une nécrose des condylomes. Elle est contre-indiquée chez la femme enceinte. L’auto-application par le patient est possible, à l’aide d’applicateurs spéciaux ou d’un coton-tige, matin et soir, 3 jours consécutifs par semaine, pendant 4 semaines. Les effets secondaires sont locaux : irritation, douleurs, érosions et ulcérations (50 %).
Deux autres agents chimiques sont moins fréquemment prescrits :
- l’acide trichloracétique, plus efficace sur les localisations muqueuses que cutanées, parfois utile sur des lésions méatiques ou urétrales distales ; il est appliqué par le médecin au coton tige 1 à 2 fois par semaine pendant 3 semaines et n’est pas contre-indiqué chez la femme enceinte ;
- le 5 -fluorouracile, employé de préférence sur les lésions vulvaires, peut aussi être utilisé pour diminuer la surface lésionnelle ou en postopératoire pour diminuer les récidives, ou sur des lésions intra-urétrales, vaginales ou du canal anal ; il peut entraîner un érythème et parfois des nécroses à l’origine d’ulcérations douloureuses.
Traitements physiques et chirurgicaux
La cryothérapie à l’azote liquide est le traitement de choix souvent en première intention pour les lésions externes et exophytiques de petite taille. La fréquence et le nombre d’applications sont variables, en fonction du type des lésions, de leur localisation, de leur étendue, du statut immunitaire du patient et des délais de cicatrisation après la première séance test (1 séance par semaine à 1 séance par mois). Elle peut entraîner douleurs et ulcérations.
D’autres techniques (laser CO2, électrocoagulation), existent, praticables sous anesthésie locale ou générale.
L’excision chirurgicale est rarement pratiquée en première intention.
Intérêt de la vaccination anti-HPV
Recommandée en France chez les filles et les garçons entre 11 et 14 ans (rattrapage entre 15 et 19 ans inclus) et jusqu’à 26 ans chez les HSH, cette vaccination a montré non seulement son efficacité contre les cancers et lésions précancéreuses HPV-induites, mais aussi contre l’apparition des condylomes dans les deux sexes. Récemment, l’Académie de médecine et plusieurs sociétés savantes, collèges et associations ont appelé à étendre cette recommandation jusqu’à 26 ans pour tous.
Pour rappel, lorsque la vaccination est effectuée avant le début de la vie sexuelle, la protection contre les souches couvertes par le vaccin (6, 11, 16, 18, 31, 33, 45, 52 et 58 pour le nonavalent) est proche de 100 %.
Enfin, l’efficacité de la vaccination pour diminuer les récidives de condylomes ou traiter ceux qui résistent aux thérapeutiques usuelles est en cours d’étude : des essais randomisés se déroulent actuellement en France, promus par l’AP-HP (CONDYVAC, VAC-WARTS).
Démentir les idées reçues sur les condylomes
« Les condylomes sont uniquement contagieux par voie sexuelle »
Vrai et faux : si le mode de contamination est le plus souvent sexuel, une transmission indirecte est possible en cas d’utilisation d’objets de toilette souillés, de sauna, jacuzzi, etc., les HPV étant très résistants aux écarts de température et aux agents chlorés.
« Le préservatif est utile pour se protéger des condylomes »
Vrai et faux : il n’est que partiellement efficace contre les condylomes car ceux-ci peuvent être localisés sur des zones génitales non couvertes par le préservatif. De plus, de simples caresses sont également contaminatrices. Son utilisation permet cependant de réduire le risque de lésions génitales chez le partenaire, et elle est recommandé durant le traitement, jusqu’à la disparition totale des lésions et pendant les 2 à 3 mois qui suivent.
« Les condylomes sont la preuve d’une infidélité sexuelle »
Faux : la période d’incubation du virus pouvant être très longue (entre trois mois et plusieurs années), la présence d’un condylome ne signe pas nécessairement une contamination récente. En dehors des périodes d’éruption, aucune précaution particulière n’est nécessaire au sein d’un couple stable – étant donné la prévalence élevée de l’infection par HPV, il est probable que les deux partenaires soient déjà porteurs.male
Ly S. Les condylomes : MST à Papilloma-Virus Humain (HPV). Dermato info 2 décembre 2019.
Joubert H, de Parades V. Condylomes. Société nationale de française de gastro-entérologie novembre 2018
Bouscarat F, Pelletier F, Fouéré S, et al. Verrues génitales (condylomes) externes. Société française de dermatologie février 2016.
Higuero T. Prise en charge pratique des condylomes. Association française de formation médicale continue en hépato-gastro-entérologie 16 décembre 2022.
SNFCP. Les condylomes de l’anus.
Alam A, Spindler L, de Parades V. Condylomes. Rev Prat Med Gen 2022;36(1067);253.
Vaccination info service.fr. Infections à Papillomavirus humains (HPV). 25 janvier 2024.

 Encadrés
Encadrés