L’infection urinaire est l’infection bactérienne la plus fréquente chez la femme enceinte : une colonisation urinaire par une ou plusieurs espèces bactériennes est retrouvée chez 2 à 10 % des femmes enceintes. Alors qu’il est généralement recommandé de ne pas traiter une colonisation urinaire asymptomatique chez la femme (sauf cas particulier), le contexte de grossesse modifie cette recommandation en raison d’un risque évolutif vers la pyélonéphrite aiguë. Une vigilance particulière doit se porter sur le dépistage et le traitement de la bactériurie asymptomatique (ci-après appelée colonisation urinaire). Toute infection urinaire chez une femme enceinte est en effet par définition une infection à risque de complications, maternelles et/ou fœtales, et ne doit pas être négligée. Les recommandations de décembre 2015 modifient de manière significative les stratégies thérapeutiques.
Épidémiologie et physiopathologie
Prévalence des infections urinaires chez la femme enceinte
Les pyélonéphrites aiguës ont un impact important en termes de morbidité chez la femme enceinte : 1 infection gravidique sur 5 est d’origine urinaire.
Facteurs favorisant les infections urinaires dans le contexte de grossesse
La grossesse favorise les infections urinaires par différents mécanismes, et ceci très précocement (dès le 2e mois de grossesse).
Tout d’abord, il existe des facteurs anatomiques et hormonaux étroitement intriqués : l’imprégnation en progestérone a une action myorelaxante sur les fibres lisses des uretères ; l’utérus gravide comprime les uretères, en particulier l’uretère droit du fait de la dextrorotation de l’utérus. La vessie prend une position plus abdominale et l’étirement latéral des uretères raccourcit leur trajet sous-muqueux dans la paroi de la vessie. Tous ces éléments favorisent les reflux vésico-urétéraux et donc les pyélonéphrites aiguës, qui prédominent à droite.
De plus, on note des facteurs physicochimiques urinaires : l’augmentation du pH urinaire pendant la grossesse pourrait altérer le pouvoir bactéricide de l'urine.
Enfin, il ne faut pas oublier que la femme enceinte présente une immunodépression physiologique.
D’autres facteurs de risque de colonisation urinaire ont été mis en évidence chez la femme enceinte, comme les antécédents d’infection urinaire, l’activité sexuelle et le bas niveau socio- économique. Des facteurs de risque identifiés dans d’anciennes études comme l’âge, le diabète, et l’âge gestationnel n’ont pas été retrouvés dans des études plus récentes ayant réalisé une analyse multivariée.
Complications de l’infection urinaire dans le contexte de grossesse
Chez le fœtus, la fièvre engendre une tachycardie fœtale avec une baisse des mouvements du fœtus. Elle provoque une augmentation de la contractilité utérine, ce qui, en fonction du terme, peut mener à un avortement spontané précoce ou tardif ou à un accouchement prématuré. Les infections sont la première cause d’accouchement prématuré.
Cependant, du fait principalement de la méthodologie souvent rétrospective des études et du caractère parfois contradictoire des études entre elles, le lien direct entre colonisation urinaire et prématurité est toujours controversé. De même, l’association entre pyélonéphrite aiguë et accouchement prématuré est possible mais non établie de manière formelle. Il semblerait que le traitement des colonisations urinaires réduise l’incidence des pyélonéphrites aiguës mais pas de la prématurité. De même, l’association entre infections urinaires gravidiques et faible poids de naissance relevée par d’anciennes études est sujette à controverse.
Notons que la plupart des infections materno-fœtales bactériennes du nouveau-né (Escherichia coli, streptocoque B) sont des infections transmises lors de l’accouchement par contamination lors du passage dans la filière génitale de la mère sans être imputables de façon directe à une infection urinaire maternelle.
Germes impliqués dans les infections urinaires communautaires de la femme enceinte et sensibilité aux antibiotiques
E. coli est l’espèce bactérienne majoritairement retrouvée dans les infections urinaires. E. coli est responsable de 70 à 95 % des cystites aiguës simples et 85 à 90 % des pyélonéphrites aiguës simples.
Staphylococcus saprophyticus est impliqué dans 5 à 10 % des cystites simples, surtout chez la femme jeune.
Proteus spp est retrouvé dans 5-10 % des autres formes d’infections urinaires.
D’autres entérobactéries telles que Klebsiella, Enterobacter, Serratia ou les entérocoques sont plus rares.
La résistance des bactéries aux antibiotiques est croissante en milieu hospitalier, mais également en milieu communautaire. Même si l’exposition antérieure à des antibiotiques favorise l’émergence de germes résistants chez un patient, ces résistances peuvent survenir en l’absence d’exposition préalable aux antibiotiques, ou d’hospitalisation.
E. coli est naturellement sensible aux antibiotiques suivants : pénicillines A, céphalosporine, quinolones, carbapénèmes, fosfomycine, aminosides, nitrofurantoïne. Il est nécessaire de connaître les prévalences des résistances acquises d’E. coli afin de faire un bon choix d’antibiothérapie probabiliste. Les données ci-après sont issues des études chez la femme jeune non enceinte extrapolées à la situation gravidique. Actuellement, E. coli est résistant à l’amoxicilline dans 45 % des cas d’infections urinaires communautaires. Sa résistance à l’association amoxicilline-acide clavulanique est comprise entre 25 et 35 %. La résistance d’E. coli aux céphalosporines est d’environ 5 % principalement par production d’une bêtalactamase à spectre étendu (BLSE) ou d’une céphalosporinase. La résistance des E. coli au cotrimoxazole semble stable, aux alentours de 23 %. La résistance aux quinolones de première génération (acide nalidixique) est d’environ 16-20 %, celle aux fluoroquinolones est de 3-5 %. E. coli communautaire en France est associé à des prévalences de résistances faibles à la nitrofurantoïne (2 %), l’association fosfomycine-trométamol (3 %), et le pivmécillinam (3 %).
Infections urinaires de la femme enceinte : trois tableaux cliniques
Une synthèse des données cliniques, diagnostiques et du suivi est faite dans le
Les molécules antibiotiques privilégiées dans les recommandations sont celles qui combinent un fort taux de sensibilité des germes les plus fréquents à cette molécule, une bonne diffusion de l’antibiotique sur le site infecté, une bonne tolérance pour la mère et une innocuité pour le fœtus. Devant une efficacité similaire entre deux schémas thérapeutiques, la hiérarchie proposée par les nouvelles recommandations avantage les molécules à spectre étroit et à faible impact sur le microbiote intestinal.
Le
Colonisation urinaire : « infection » particulière chez la femme enceinte
Définition
La bactériurie se définit par la présence d’une bactérie dans les urines sans symptômes associés, en particulier ni signes fonctionnels urinaires ni fièvre. En population générale, il n’y a pas de seuil de bactériurie pour définir une colonisation urinaire. En revanche, chez la femme enceinte, un seuil de 105 UFC/mL est retenu quel que soit le germe (ce seuil est plus élevé qu’en cas d’infection urinaire symptomatique afin de ne pas prendre en compte une éventuelle contamination du prélèvement). La leucocyturie n’intervient pas dans la définition de la colonisation urinaire.Pourquoi instaurer systématiquement un traitement antibiotique devant une bactériurie gravidique asymptomatique ?
La nécessité du traitement antibiotique des bactériuries gravidiques asymptomatiques est consensuelle, le risque d’évolution important vers une pyélonéphrite aiguë justifiant à lui seul le traitement antibiotique de la femme enceinte. De plus, contrairement à ce qui est décrit chez la femme en dehors du contexte de grossesse, cette colonisation ne disparaît pas spontanément en l’absence de traitement antibiotique. L’efficacité du traitement antibiotique sur la colonisation urinaire et sur la diminution du risque d’évolution vers une pyélonéphrite aiguë a été montrée.Il faut évoquer également le cas particulier chez la femme enceinte de la colonisation urinaire à streptocoque du groupe B. Ce germe peut être à l’origine de pyélonéphrite aiguë, mais cette colonisation urinaire à streptocoque du groupe B reflète surtout un fort portage vaginal. Cette colonisation vaginale est associée à des complications obstétricales (menace d’accouchement prématuré, accouchement prématuré, rupture prématurée des membranes, fièvre puerpérale et chorioamniotite). Il est donc important de prendre en compte cette colonisation et de la traiter. Il existe une limite importante au traitement : une recolonisation après traitement a été mise en évidence chez 20 à 30 % des patientes traitées. Chez une femme enceinte correctement traitée pour une colonisation urinaire et/ou vaginale à streptocoque du groupe B, il n’est pas recommandé de réaliser le prélèvement vaginal indiqué entre 34 et 38 semaines d’aménorrhée à la recherche d’un portage vaginal à streptocoque du groupe B. Il faut dans ce cas, du fait des recolonisations fréquentes, effectuer de manière systématique le traitement per-partum par amoxicilline intraveineuse comme recommandé en cas de portage vaginal à streptocoque du groupe B.
Quelle antibiothérapie proposer ?
Le traitement antibiotique en l’absence de symptomatologie urinaire n’est pas probabiliste. Un traitement antibiotique adapté au germe identifié est nécessaire mais sans caractère d’urgence, sa prescription doit attendre le rendu des résultats de l’antibiogramme.Les bêtalactamines ne sont ni fœtotoxiques ni tératogènes. En première intention, l’amoxicilline est proposée du fait de sa bonne tolérance, du spectre étroit et de son faible impact sur le microbiote intestinal, si la souche isolée dans les urines est sensible.
En deuxième intention, l’utilisation du pivmécillinam est préconisée. La prévalence de la résistance d’E. coli au pivmécillinam est faible, l’impact sur le microbiote intestinal est minime, sa tolérance maternelle et fœtale excellente. C’est donc un antibiotique de choix qui a prouvé son efficacité dans cette indication et qui est remboursé depuis 2013 en France. Certains pays européens l’ont positionné en première intention dans cette indication.
En troisième intention, l’association fosfomycine-trométamol est apparue dans les recommandations de décembre 2015 du fait d’une bonne tolérance pendant la grossesse (surtout documentée pour les 2e et 3e trimestres), d’un faible impact sur le microbiote, et d’une bonne sensibilité. Les traitements « minute » n’étaient pas recommandés chez la femme enceinte avant 2015, mais il a été prouvé qu’un traitement monodose par fosfomycine-trométamol est aussi efficace qu’un traitement de 5 jours par amoxicilline-acide clavulanique ou par céphalosporine de 2e génération. Il faut noter également l’intérêt de ce schéma en prise unique dans l’observance du traitement. Néanmoins, rappelons que cette association n’est pas active sur Staphylococcus saprophyticus.
En quatrième intention, un traitement par triméthoprime (TMP) est proposé. Cet antibiotique est de nouveau commercialisé en France depuis 2016. Tout comme l’association commercialisée triméthoprime-sulfaméthoxazole, la prescription de triméthoprime doit être évitée durant les deux premiers mois de la grossesse du fait d’un potentiel risque malformatif. Il est mieux toléré que le triméthoprime-sulfaméthoxazole. En l’absence d’alternative, en cas de prescription de triméthoprime ou de triméthoprime-sulfaméthoxazole en début de grossesse, il faut alors associer une supplémentation en acide folique et réaliser un suivi échographique rapproché du fœtus.
En dernière intention dans cette indication, les antibiotiques suivants peuvent être utilisés en fonction de l’antibiogramme (sans ordre de préférence) : nitrofurantoïne, triméthoprime-sulfaméthoxazole, amoxicilline-acide clavulanique, céfixime, ciprofloxacine. Il faut éviter les traitements itératifs par nitrofurantoïne en raison de la majoration du risque d’effets secondaires hépatiques et pulmonaires. L’utilisation de l’amoxicilline-acide clavulanique, de la ciprofloxacine ou de la céfixime n’est pas retenue en première intention du fait de leur impact sur le microbiote intestinal et elle est réservée à des situations particulières (antécédents d’allergie, phénotypes particuliers de résistance).
Quelle durée de l’antibiothérapie ?
En l’absence de données sur la durée optimale de traitement des colonisations urinaires gravidiques, la durée de traitement recommandée est de 7 jours sauf pour la fosfomycine-trométamol qui est prescrite en dose unique.Un contrôle par ECBU est-il nécessaire ?
Il faut vérifier la stérilisation des urines 8-10 jours après la fin du traitement. Puis une surveillance mensuelle par un examen cytobactériologique des urines (ECBU) est nécessaire pendant toute la durée de la grossesse.Le dépistage de la colonisation urinaire gravidique est détaillé plus loin.
Cystite aiguë gravidique
Définition
La patiente présente des signes fonctionnels urinaires à type de pollakiurie, brûlures mictionnelles, impériosité mictionnelle. Chez la femme enceinte, une cystite peut engendrer des contractions utérines qui dominent le tableau clinique. La patiente reste apyrétique. L’ECBU est positif avec une leucocyturie supérieure ou égale à 104/mL et un seuil de bactériurie significative qui varie selon les germes en cause : 103 UFC/mL en cas d’E. coli ou de Staphylococcus saprophyticus. Le seuil est plus élevé 104 UFC/mL dans les cas où sont isolées des entérobactéries autres que E. coli, Enterococcus, Corynebacterium urealyticum, Pseudomonas spp ou de Staphylococcus aureus. Ces valeurs seuils sont identiques à ceux déterminés chez la femme non enceinte.Prise en charge
Chez la femme en dehors du contexte de grossesse, une prévalence de résistance inférieure à 20 % semble acceptable pour une utilisation en probabiliste du fait d’un risque moindre d’évolution vers une pyélonéphrite aiguë. Dans le cas des cystites de la femme enceinte, la prévalence de résistance du germe à un antibiotique doit être inférieure à 10 %, dans l’utilisation probabiliste de cet antibiotique.Les taux élevés de résistance à l’amoxicilline, amoxicilline-acide clavulanique, sulfaméthoxazole-triméthoprime ne permettent pas une utilisation de ces antibiotiques en probabiliste.
En cas de cystite aiguë gravidique, du fait du risque d’évolution vers une pyélonéphrite aiguë, il ne faut pas attendre l’antibiogramme pour démarrer un traitement antibiotique probabiliste.
En première intention, comme pour les cystites simples, on préfère l’association fosfomycine-trométamol en prise unique, même en cas de cystite récidivante. Puis le pivmécillinam est positionné en deuxième intention et la nitrofurantoïne en troisième intention.
On note un changement notable dans le positionnement de la céfixime qui n’est plus placée qu’en quatrième position dans les nouvelles recommandations, avec la ciprofloxacine, du fait de son impact non négligeable sur le microbiote intestinal. La résistance aux quinolones est très variable selon le type d’infection urinaire et le terrain sur lequel elle survient. En cas de résistance à l’acide nalidixique (résistance de faible niveau), la prescription d’autres quinolones, même rendues sensibles par l’antibiogramme, est déconseillée car l’émergence de mutants résistant à l’ensemble des quinolones est alors facilitée par l’accumulation de mutations. La présence d’une sonde urinaire, d’une pathologie urologique, ou la prise de quinolone dans les 6 mois précédents sont des facteurs de risque indépendants de résistance aux quinolones. Du fait d’un impact important sur le microbiote intestinal, et d’un taux de résistance relativement important, les quinolones ne sont pas des antibiotiques de choix en probabiliste. Si le choix se porte sur une fluoroquinolone, la ciprofloxacine est à privilégier dans le contexte gravidique du fait d’une plus grande expérience de son usage pendant la grossesse.
Ensuite, après obtention des données de sensibilité du germe, soit on continue le même traitement pendant une durée totale de 7 jours (sauf pour la fosfomycine-trométamol, qui est en prise unique), soit on réalise un switch d’antibiotique par une molécule pour laquelle le germe est sensible. Le choix hiérarchique proposé est identique à celui des colonisations urinaires.
De même que pour la colonisation urinaire, la vérification de la stérilisation des urines 8-10 jours après la fin du traitement, ainsi qu’un ECBU mensuel sont nécessaires.
Pyélonéphrite aiguë gravidique
Définition
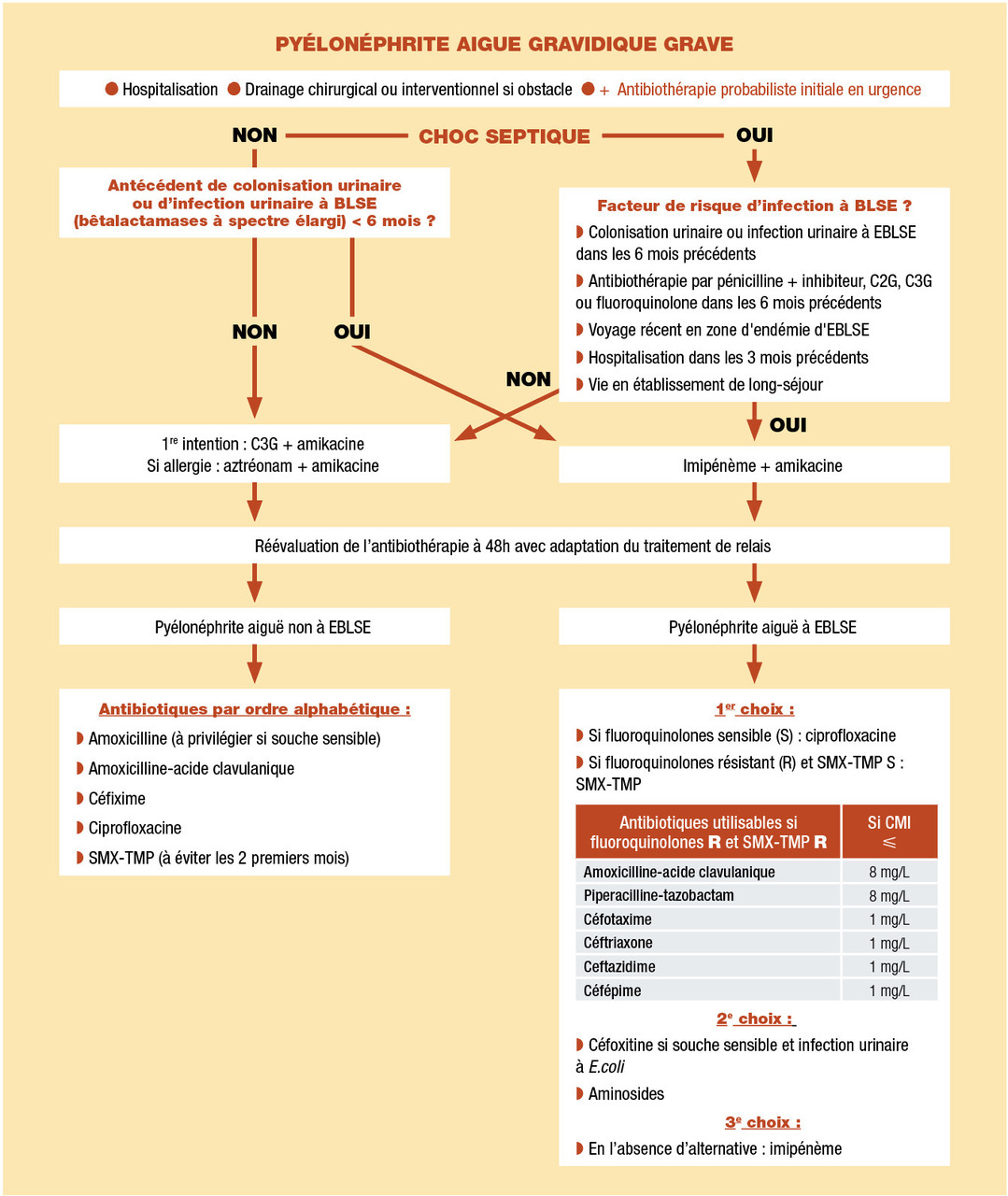
La fièvre s’ajoute aux signes cliniques de la cystite, la patiente est fébrile, avec parfois des frissons. Elle peut présenter des douleurs lombaires, le plus souvent unilatérales (prédominant à droite), avec une douleur à l’ébranlement de la fosse lombaire. Un contact lombaire est parfois retrouvé. La réalisation systématique d’une échographie est recommandée et doit prendre en compte la possibilité d’une dilatation physiologique des cavités pyélocalicielles. Les signes de gravité de la pyélonéphrite aiguë sont les mêmes qu’en population générale, soit le sepsis grave (ou sepsis dans sa définition depuis mars 2016), le choc septique ou l’indication à un drainage chirurgical ou interventionnel.Prise en charge
En cas de pyélonéphrite aiguë gravidique, une évaluation hospitalière initiale est préconisée. Un traitement ambulatoire est ensuite envisageable lorsque l’ensemble des conditions suivantes sont réunies : bonne tolérance clinique, caractère non hyperalgique de la pyélonéphrite aiguë, absence de vomissement, examen obstétrical normal, patiente entourée au domicile permettant une surveillance par des proches, absence d’immunodépression et de malformation urologique connue, et absence d’antécédent d’infections urinaires récidivantes. Si ces conditions ne sont pas remplies, une hospitalisation initiale est préférable avec possible retour à domicile à 48-72 heures sous réserve de l’absence de signes de gravité, d’une évolution favorable et de disponibilité des résultats de l’ECBU.En l’absence de signes de gravité, en première intention, il est proposé un traitement par une céphalosporine de 3e génération (C3G) par voie injectable, ou, en cas d’allergie aux céphalosporines, une antibiothérapie par aztréonam (antibiotique faisant partie des monobactames, à utiliser dans le cadre d’une hospitalisation car non rétrocédable) ou la ciprofloxacine en l’absence de traitement par quinolones dans les 6 derniers mois (risque de sélection de mutant résistant).
En présence de signes de gravité, on ajoutera à l’antibiothérapie un aminoside ; l’amikacine est à préférer en raison d’une plus grande sensibilité des entérobactéries productrices de bêtalactamases à spectre étendu. En cas d’obstacle, il faut bien sûr réaliser un drainage des voies urinaires. En cas de colonisation ou d’infection urinaire à entérobactérie productrice de bêtalactamases à spectre étendu dans les 6 derniers mois, ou de choc septique avec facteur de risque d’infection à entérobactérie productrice de bêtalactamases à spectre étendu, il faut préférer un traitement par imipénème et amikacine. L’imipénème est l’antibiotique de la famille des pénèmes le mieux étudié pendant la grossesse. Les facteurs de risque d’infection à entérobactérie productrice de bêtalactamases à spectre étendu à prendre en compte en cas de choc septique sont les suivants : colonisation urinaire ou infection urinaire à entérobactérie productrice de bêtalactamases à spectre étendu dans les 6 mois précédents, antibiothérapie par pénicilline associée à un inhibiteur de pénicillinase, ou céphalosporine de deuxième ou troisième génération, ou fluoroquinolone dans les 6 mois précédents, en cas de voyage récent en zone d’endémie d’entérobactérie productrice de bêtalactamases à spectre étendu, d’hospitalisation dans les 3 mois précédents, de vie en établissement de long séjour.
On relaiera l’antibiothérapie par un traitement adapté à spectre plus étroit dès réception de l’antibiogramme, en choisissant parmi les molécules suivantes : amoxicilline (à privilégier), amoxicilline-acide clavulanique, céfixime, ciprofloxacine, sulfaméthoxazole-triméthoprime. En cas d’infection documentée à entérobactérie productrice de bêtalactamases à spectre étendu, il faut préférer l’utilisation d’alternatives aux carbapénèmes
La durée de traitement est semblable à celle de la pyélonéphrite aiguë de la femme non enceinte, soit 10-14 jours. À 48-72 heures de traitement, il paraît opportun de refaire une évaluation obstétricale.
Comme pour la colonisation urinaire et la cystite, il faut vérifier la stérilisation des urines 8-10 jours après la fin du traitement et faire un ECBU mensuel jusqu’à l’accouchement, d’autant plus que 20 % des femmes récidiveront d’ici leur accouchement.
En cas de nouvelle infection urinaire pendant la grossesse, les mêmes stratégies thérapeutiques sont applicables. Il convient cependant de ne pas prescrire de manière rapprochée des quinolones ou de la nitrofurantoïne.
Surveillance et dépistage des colonisations urinaires durant la grossesse
Pour certaines patientes à risque, c’est directement l’ECBU qui est indiqué dès la première consultation de début de grossesse, puis dans le dépistage mensuel systématique à partir du 4e mois : en cas d’antécédents de cystite aiguë récidivante, d’uropathie sous-jacente organique ou fonctionnelle (autre que les modifications physiologiques en lien avec la grossesse citées ci-dessus), ou de diabète.•
Chez la femme enceinte, la colonisation (ou bactériurie asymptomatique) doit être systématiquement recherchée en raison d’un risque évolutif élevé (au moins 20 %) vers la pyélonéphrite aiguë.
Chez la femme enceinte sans antécédent de cystite aiguë récidivante, ni uropathie ni diabète, la colonisation doit être recherchée par bandelette urinaire tous les mois à compter de M4, un ECBU étant réalisé en cas de positivité.
Chez la femme enceinte, présentant un antécédent de cystite aiguë récidivante, d’uropathie ou de diabète, la recherche d’une colonisation doit être faite par ECBU dès la première consultation, puis tous les mois à compter du 4e mois.
Dans le cas particulier des colonisations urinaires à streptocoque du groupe B, il existe une colonisation vaginale systématiquement associée ; au-delà de la prise en charge thérapeutique de la colonisation urinaire, il importe d’identifier ces situations comme des indications à la prévention usuelle per-partum de l’infection materno-fœtale à streptocoque du groupe B.
Contrairement à d’autres situations cliniques, il est nécessaire de vérifier l’ECBU 8 à 10 jours après la fin du traitement chez la femme enceinte.
La survenue d’une pyélonéphrite chez une femme enceinte doit conduire à une évaluation obstétricale en milieu hospitalier ; un traitement ambulatoire pourra alors être décidé chez certaines patientes sélectionnées.
Dossier
Infections urinaires
Rev Prat 2014;64(7):963-88
Mais aussi :
POINTS FORTS À RETENIR
Chez la femme enceinte, la colonisation (ou bactériurie asymptomatique) doit être systématiquement recherchée en raison d’un risque évolutif élevé (au moins 20 %) vers la pyélonéphrite aiguë.
Chez la femme enceinte sans antécédent de cystite aiguë récidivante, ni uropathie ni diabète, la colonisation doit être recherchée par bandelette urinaire tous les mois à compter de M4, un ECBU étant réalisé en cas de positivité.
Chez la femme enceinte, présentant un antécédent de cystite aiguë récidivante, d’uropathie ou de diabète, la recherche d’une colonisation doit être faite par ECBU dès la première consultation, puis tous les mois à compter du 4e mois.
Dans le cas particulier des colonisations urinaires à streptocoque du groupe B, il existe une colonisation vaginale systématiquement associée ; au-delà de la prise en charge thérapeutique de la colonisation urinaire, il importe d’identifier ces situations comme des indications à la prévention usuelle per-partum de l’infection materno-fœtale à streptocoque du groupe B.
Contrairement à d’autres situations cliniques, il est nécessaire de vérifier l’ECBU 8 à 10 jours après la fin du traitement chez la femme enceinte.
La survenue d’une pyélonéphrite chez une femme enceinte doit conduire à une évaluation obstétricale en milieu hospitalier ; un traitement ambulatoire pourra alors être décidé chez certaines patientes sélectionnées.
Recommandations de bonne pratique : infections urinaires au cours de la grossesse. Société de pathologie infectieuse de langue française, déc. 2015.

 Encadrés
Encadrés