Fertilité. Toute personne en âge de procréer exposée à un traitement ou à une pathologie potentiellement gonatoxique doit être informée des risques pour sa fertilité et des possibilités de conservation de ses gamètes par un CECOS en vue de leur utilisation ultérieure au moyen d’une assistance médicale à la procréation.
Qui peut conserver des gamètes ?
Les hommes et les femmes peuvent conserver leurs gamètes (spermatozoïdes, ovocytes), qu’ils soient célibataires ou en couple, dans le cadre du traitement d’un cancer ou d’une autre pathologie médicale ou chirurgicale pouvant altérer leur fertilité.1 Pour les femmes, la cryoconservation des ovocytes par vitrification n’est autorisée en France que depuis 2011. Pour les hommes, la congélation des spermatozoïdes est maîtrisée sur le plan technique depuis plusieurs décennies. En 2015, la Fédération française des centres d’étude et de conservation des œufs et du sperme humains (CECOS) a réalisé environ 6 500 congélations de sperme, dont 40 % dans le cadre du cancer (indications principales : cancer du testicule, lymphomes hodgkinien et non hodgkinien et leucémies) et 60 % pour des affections non cancéreuses (altérations secondaires de la qualité du sperme, risque chirurgical d’atteinte de la spermatogenèse et/ou de l’éjaculation, ou avant vasectomie). Le nombre de nouveaux cas annuels de cancer chez l’homme en France entre 15 et 49 ans est d’environ 13 800. Les cancers du poumon, de la sphère oto-rhino-laryngée et les mélanomes, bien que fréquents dans cette tranche d’âge, sont rarement reçus dans les CECOS pour préserver leur fertilité. Le nombre de cryoconservations ovocytaires augmente progressivement ces dernières années, mais l’information aux patientes sur cette possibilité doit être davantage développée.
Quand doit-on conserver des gamètes ?
La conservation des gamètes étant réalisée en vue de leur utilisation ultérieure en assistance médicale à la procréation (AMP), elle doit être réservée à des patients en âge de procréer. Il est inscrit dans la loi1, 2 que « toute personne dont la fertilité risque d’être altérée du fait d’une pathologie ou de ses traitements ou dont la fertilité risque d’être préma- turément altérée doit être informée des risques pour sa fertilité et des possibilités de conservation de ses gamètes ». Le Plan cancer 3 inscrit très clairement l’obligation de cette information aux patients. La cryo- conservation de gamètes est à réaliser impérativement avant la mise en œuvre du traitement potentiel- lement gonadotoxique (chimiothérapie, radiothérapie…) afin d’éviter les effets délétères de ces traitements sur l’ADN des gamètes.4 Si l’urgence thérapeutique a empêché cette conservation, une conservation de gamètes peut être proposée en période de rémission à distance de l’arrêt du traitement.
Comment doit-on conserver les gamètes ?
Principales étapes
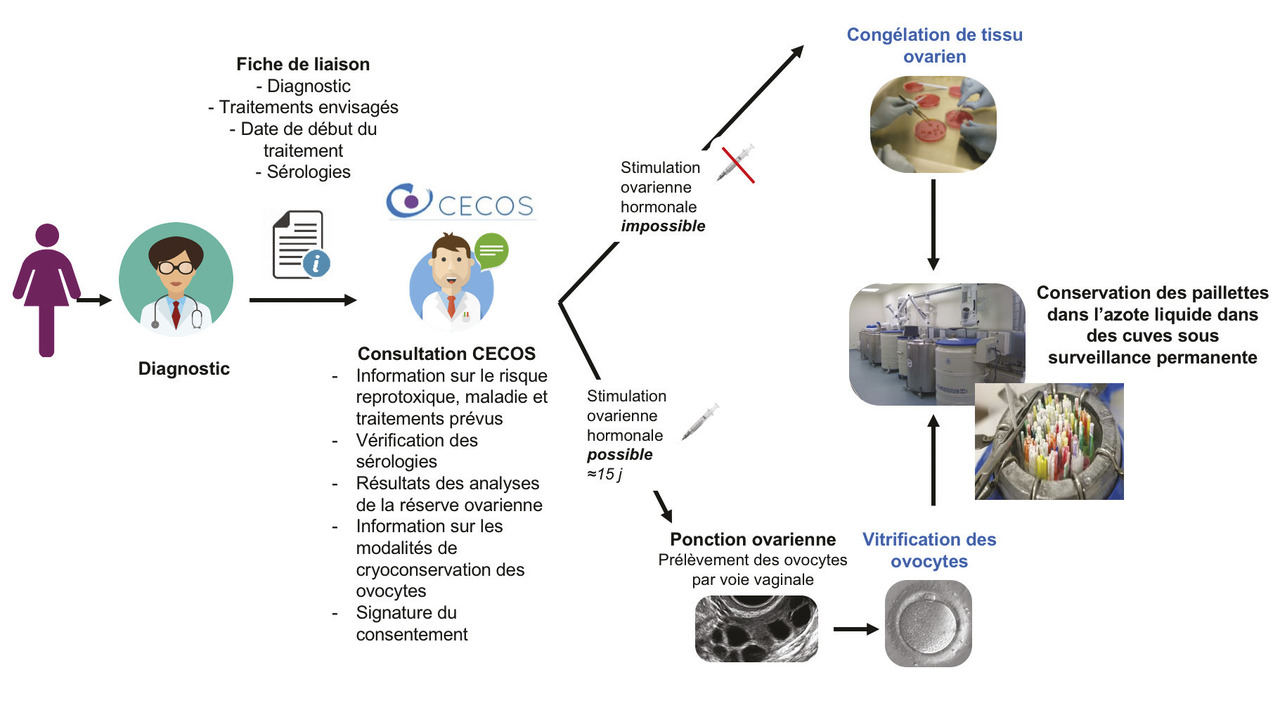
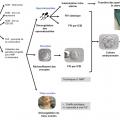
Le parcours du(ou de la) patient(e) est résumé dans les figures 1 et 2.
Dans le cadre de la préservation de la fertilité avant le traitement d’un cancer, une coordination entre l’équipe d’oncologie et le CECOS est indispensable. Le(ou la) patient(e) est adressé(e) au CECOS après la consultation d’annonce, avant le début des traitements, avec une fiche de liaison comportant le diagnostic et les traitements envisagés. Il rencontre le médecin du CECOS pour une consultation d’information sur le risque reprotoxique encouru en raison du traitement envisagé, sur les possibilités de conservation et d’utilisation des gamètes, sur la vérification des sérologies régle- mentaires (sérologies pour les hépatites B et C, le virus de l’immuno- déficience humaine, et la syphilis) et sur la signature du contrat d’autoconservation de gamètes. En cas de sérologies positives, la conservation est réalisée dans un circuit spécifique au laboratoire.
Dans tous les cas, un compte-rendu de la conservation est adressé au(à la) patient(e) et au médecin correspondant.
Dans le cadre de la préservation de la fertilité avant le traitement d’un cancer, une coordination entre l’équipe d’oncologie et le CECOS est indispensable. Le(ou la) patient(e) est adressé(e) au CECOS après la consultation d’annonce, avant le début des traitements, avec une fiche de liaison comportant le diagnostic et les traitements envisagés. Il rencontre le médecin du CECOS pour une consultation d’information sur le risque reprotoxique encouru en raison du traitement envisagé, sur les possibilités de conservation et d’utilisation des gamètes, sur la vérification des sérologies régle- mentaires (sérologies pour les hépatites B et C, le virus de l’immuno- déficience humaine, et la syphilis) et sur la signature du contrat d’autoconservation de gamètes. En cas de sérologies positives, la conservation est réalisée dans un circuit spécifique au laboratoire.
Chez l’homme
Les hommes réalisent au moins un prélèvement de sperme par masturbation, avant le début des traitements. Après réalisation d’un spermogramme puis la mise en contact du sperme avec un milieu cryoprotecteur,5 le sperme est conditionné dans des paillettes qui sont soudées par un système haute sécurité puis congelées et stockées dans des cuves d’azote liquide. En cas d’azoospermie (environ 5 % des patients atteints de cancer), une ponction chirurgicale testiculaire peut être envisagée ; elle est de préférence couplée à une intervention chirurgicale programmée dans le cadre du traitement. Si des spermatozoïdes sont retrouvés, ils sont alors cryoconservés comme les spermatozoïdes éjaculés (fig. 1). Dans le cadre de la préservation de la fertilité hors cancer, environ 20 % des indications sont des troubles de l’éjaculation avec principalement des éjaculations rétrogrades (blessés médullaires, diabétiques, lésions post-chirurgicales). Il est alors possible de congeler des spermatozoïdes récupérés dans la vessie, après une alcalinisation des urines (un traitement oral par bicarbonate la veille et le jour du prélèvement est nécessaire pour assurer une bonne survie des spermatozoïdes).Chez la femme
Pour les femmes, la congélation embryonnaire a longtemps été la seule possibilité de préserver la fertilité. Cette technique n’était possible que pour les femmes adultes et en couple jusqu’à la réutilisation des embryons ainsi conçus. La congélation des ovocytes6 par vitrification et la congélation du tissu ovarien7 sont deux avancées techniques qui permettent actuellement d’offrir cette possibilité de préserver leur fertilité aux femmes sans conjoint et aux jeunes filles prépubères. La conservation des ovocytes est actuellement principalement réalisée chez les femmes, quel que soit leur statut marital, par vitrification ovocytaire (v. infra). Cette technique nécessite au préalable une stimulation ovarienne hormonale, à l’aide d’injections quotidiennes de gonadotrophines pendant en moyenne 10 à 15 jours, suivie d’une ponction ovarienne par voie vaginale. Toutefois, lorsqu’une stimulation ovarienne est impossible (chez les jeunes filles prépubères), contre-indiquée, ou lorsqu’il y a nécessité de débuter en urgence un traitement potentiellement gonadotoxique, une congé- lation de tissu ovarien est proposée. La cryoconservation de tissu ovarien nécessite lors d’un projet de grossesse une autogreffe des fragments ovariens plus ou moins associée à une fécondation in vitro, technique déjà réalisée avec succès. En cas d’urgence et lorsqu’il existe un risque de réintroduire des cellules cancéreuses lors de la réutilisation, une étape de maturation in vitro des gamètes est alors possible avant leur conservation.Dans tous les cas, un compte-rendu de la conservation est adressé au(à la) patient(e) et au médecin correspondant.
Congélation lente et progressive des spermatozoïdes
Les spermatozoïdes ont été les premières cellules germinales à être congelées et conservées efficacement dans l’azote liquide.5 La cryoconservation est un procédé de conservation des cellules et des tissus à -196 °C. À cette température la machinerie cellulaire est stoppée, y compris les réactions provoquant la mort cellulaire, permettant la conservation des échantillons sans limite de temps. Les spermatozoïdes, qu’ils soient issus d’un éjaculat, de l’urine ou extrait d’une ponction épididymaire et/ou d’une biopsie testiculaire, sont congelés selon la même technique.
Ils sont congelés dans un milieu adapté pour leur assurer la meilleure qualité de conservation et éviter la formation de cristaux de glace trop nombreux ou trop volumineux. Le milieu de congélation est ajouté à température ambiante et progres- sivement aux spermatozoïdes afin de réduire les chocs osmotiques et mécaniques liés à la déshydratation cellulaire. Les spermatozoïdes sont conservés dans des contenants appelés des paillettes identifiées au préalable et qui sont soudées aux deux extrémités (fig. 1). La congélation est réalisée par une descente en température lente et contrôlée. Cette étape peut être programmée à l’aide un congélateur automatique contrôlé par ordinateur (fig. 1) ou réalisée par une descente progressive dans les vapeurs de l’azote liquide.
Ils sont congelés dans un milieu adapté pour leur assurer la meilleure qualité de conservation et éviter la formation de cristaux de glace trop nombreux ou trop volumineux. Le milieu de congélation est ajouté à température ambiante et progres- sivement aux spermatozoïdes afin de réduire les chocs osmotiques et mécaniques liés à la déshydratation cellulaire. Les spermatozoïdes sont conservés dans des contenants appelés des paillettes identifiées au préalable et qui sont soudées aux deux extrémités (fig. 1). La congélation est réalisée par une descente en température lente et contrôlée. Cette étape peut être programmée à l’aide un congélateur automatique contrôlé par ordinateur (fig. 1) ou réalisée par une descente progressive dans les vapeurs de l’azote liquide.
Vitrification des ovocytes
La congélation des ovocytes est complexe car leur contenu en eau est très important. En gelant, l’eau prend du volume et se cristallise, créant des altérations irréversibles des ovocytes. La mise au point d’un nouveau procédé de congélation ultrarapide, la vitrification, permet de lever cet obstacle en empêchant la formation des cristaux de glace. En effet, la vitrification6 est un processus physique au cours duquel un liquide passe à un état solide, dit « vitreux », sans la formation de cristaux de glace. Cette transformation est permise par la combinaison de deux paramètres : l’utilisation de milieux cryoprotecteurs à concentration élevée permettant une déshydratation cellulaire maximale, et l’application d’une descente en température ultrarapide.
Le projet de conserver plusieurs ovocytes nécessite une stimulation ovarienne à l’aide de traitements hormonaux en doses supraphysio- logiques. À la fin de ce traitement, les ovocytes sont récupérés au sein des follicules par une ponction ovarienne qui se fait par voie vaginale, sous contrôle échographique et sous anesthésie locale ou générale. Puis il est nécessaire de retirer les cellules qui entourent les ovocytes (cellules folliculeuses) afin de vérifier la maturité des ovocytes, de permettre l’action des cryoprotecteurs et un refroidissement efficace. Ce retrait s’effectue à l’aide d’un traitement enzymatique (la hyaluronidase).
Le projet de conserver plusieurs ovocytes nécessite une stimulation ovarienne à l’aide de traitements hormonaux en doses supraphysio- logiques. À la fin de ce traitement, les ovocytes sont récupérés au sein des follicules par une ponction ovarienne qui se fait par voie vaginale, sous contrôle échographique et sous anesthésie locale ou générale. Puis il est nécessaire de retirer les cellules qui entourent les ovocytes (cellules folliculeuses) afin de vérifier la maturité des ovocytes, de permettre l’action des cryoprotecteurs et un refroidissement efficace. Ce retrait s’effectue à l’aide d’un traitement enzymatique (la hyaluronidase).
Stockage des gamètes cryoconservés
Une fois la congélation lente ou la vitrification terminées, les paillettes contenant les spermatozoïdes ou les ovocytes sont stockées dans une cuve d’azote liquide (fig. 1 et 2). Ce mode de stockage permet de conserver les gamètes jusqu’à utilisation en AMP sans altération de leur qualité liée à la durée de stockage. L’identification des paillettes de spermatozoïdes et d’ovocytes se fait par l’attribution d’un numéro unique attribué à chaque prélèvement,1 qui peut être une forme alphanumérique ou un code-barres.
Modalités d’utilisation
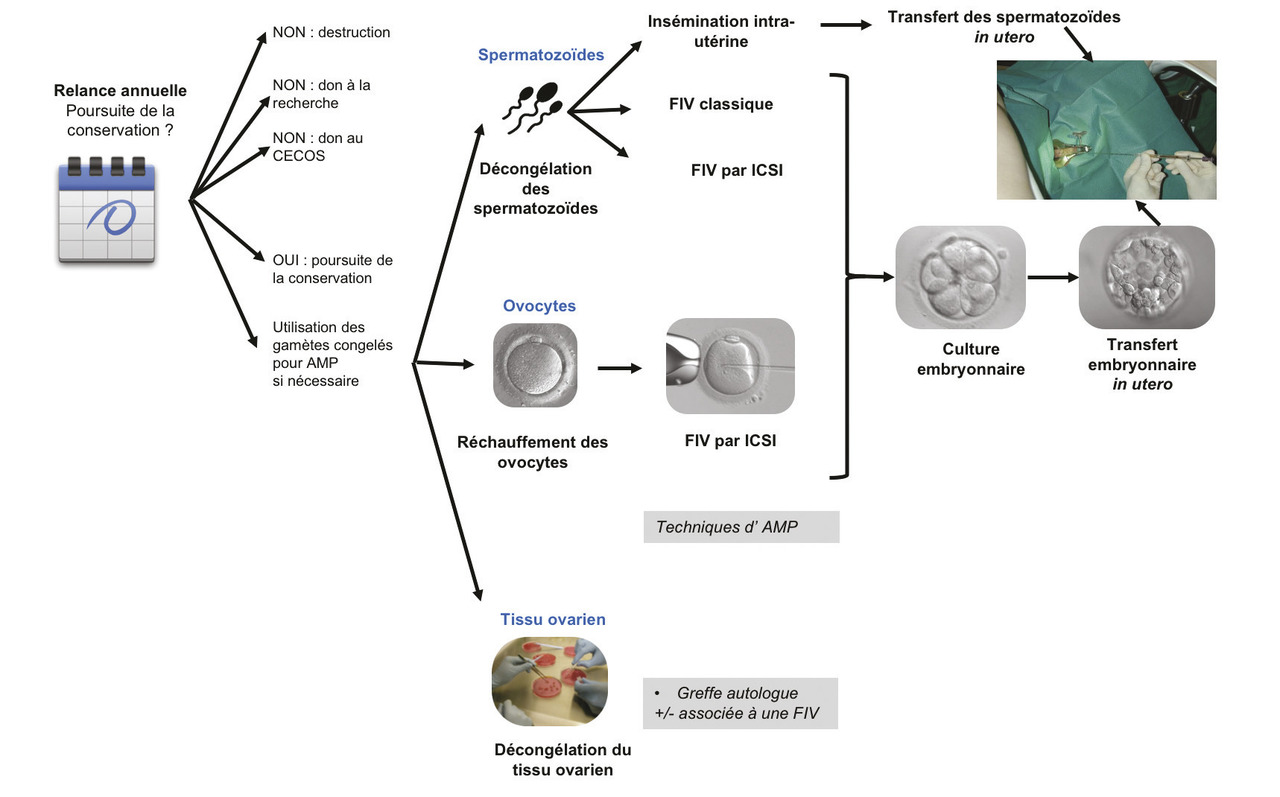
Les modalités d’utilisation sont reportées dans la fig. 3.
Si le(ou la) patient(e) a un projet parental, les gamètes congelés peuvent être utilisés si sa fertilité est altérée ou si le projet parental est trop proche d’un traitement potentiellement tératogène ou génotoxique.4 Les gamètes ne sont utilisés qu’après accord de la personne les ayant conservés, et de son vivant. Il n’existe pas de critères prédictifs de récupération de la fertilité, qui dépend à la fois de la pathologie, du traitement et de la personne elle-même. Les gamètes autoconservés sont décongelés et utilisés en AMP après la demande du couple et l’accord d’une équipe multidisciplinaire. Pour obtenir la fécondation des ovocytes vitrifiés et décongelés, il est nécessaire de recourir à une fécondation in vitro avec micro-injection d’un spermatozoïde dans le cytoplasme de chaque ovocyte (intra cyptoplasmic sperm injection [ICSI]) [fig. 3]. Pour les spermatozoïdes, la technique d’AMP utilisée est choisie en fonction de la qualité des spermatozoïdes conservés et notamment au nombre de spermatozoïdes mobiles et du bilan de fertilité de la conjointe. Lorsque le nombre de spermatozoïdes mobiles le permet et qu’il n’y a aucune contre-indication féminine, l’insémination intra-utérine est la technique la plus simple et la moins invasive. Dans le cas contraire, la fécondation in vitro classique ou avec injection de spermatozoïdes (ICSI) peut être utilisée quel que soit le nombre de spermatozoïdes disponible. Après fécondation, le ou les embryons obtenus après culture in vitro sont transférés dans l’utérus (dans la grande majorité, pas plus de 2 embryons sont transférés). Une fois cette grossesse déclarée, son suivi est le même que lors d’une grossesse hors AMP.
Si le(ou la) patient(e) a un projet parental, les gamètes congelés peuvent être utilisés si sa fertilité est altérée ou si le projet parental est trop proche d’un traitement potentiellement tératogène ou génotoxique.4 Les gamètes ne sont utilisés qu’après accord de la personne les ayant conservés, et de son vivant. Il n’existe pas de critères prédictifs de récupération de la fertilité, qui dépend à la fois de la pathologie, du traitement et de la personne elle-même. Les gamètes autoconservés sont décongelés et utilisés en AMP après la demande du couple et l’accord d’une équipe multidisciplinaire. Pour obtenir la fécondation des ovocytes vitrifiés et décongelés, il est nécessaire de recourir à une fécondation in vitro avec micro-injection d’un spermatozoïde dans le cytoplasme de chaque ovocyte (intra cyptoplasmic sperm injection [ICSI]) [fig. 3]. Pour les spermatozoïdes, la technique d’AMP utilisée est choisie en fonction de la qualité des spermatozoïdes conservés et notamment au nombre de spermatozoïdes mobiles et du bilan de fertilité de la conjointe. Lorsque le nombre de spermatozoïdes mobiles le permet et qu’il n’y a aucune contre-indication féminine, l’insémination intra-utérine est la technique la plus simple et la moins invasive. Dans le cas contraire, la fécondation in vitro classique ou avec injection de spermatozoïdes (ICSI) peut être utilisée quel que soit le nombre de spermatozoïdes disponible. Après fécondation, le ou les embryons obtenus après culture in vitro sont transférés dans l’utérus (dans la grande majorité, pas plus de 2 embryons sont transférés). Une fois cette grossesse déclarée, son suivi est le même que lors d’une grossesse hors AMP.
Modalités réglementaires
Le CECOS qui conserve les gamètes interroge chaque année les patients concernés sur leurs souhaits de poursuivre la conservation.1, 2 La personne peut renoncer à l’autoconservation en consentant soit au don de gamètes, soit au don pour la recherche, ou en demandant l’arrêt de la conservation. Les gamètes sont conservés dans des cuves d’azote sous surveillance permanente à l’aide de sondes mesurant la température et/ou le niveau d’azote. Les gamètes pourront être utilisés en AMP par le(ou la) patient(e) après son consentement, et de son vivant. Si le(ou la) patient(e) demande à utiliser un centre d’AMP situé à l’étranger, une autorisation de l’Agence de la biomédecine est requise. En cas de décès, les gamètes conservés du (ou de la) patient(e) sont détruits. V
Références
1. Loi n° 2011-814 du 7 juillet 2011 relative à la bioéthique.
2. Arrêté du 30 juin 2017 modifiant l’arrêté du 11 avril 2008 modifié relatif aux règles de bonnes pratiques cliniques et biologiques d’assistance médicale à la procréation.
3. Plan cancer 2014-2019. www.e-cancer.fr
4. Chaput L, Grémeau AS, Vorilhon S, et al. Fertility preservation in oncology. Bull Cancer 2018 ; sous presse.
5. Benson JD, Woods EJ, Walters EM, Critser JK. The cryobiology of spermatozoa. Theriogenology 2012;78:1682-99.
6. Rienzi L, Gracia C, Maggiulli R, et al. Oocyte, embryo and blastocyst cryopreservation in ART: systematic review and meta-analysis comaring slow-freezing versus vitrification to produce evidence for the development of global guidance. Hum Reprod Update 2017;23:139-55.
7. Donnez J, Dolmans MM. Ovarian tissue freezing: current status. Curr Opin Obstet Gynecol 2015;27:222-30.
2. Arrêté du 30 juin 2017 modifiant l’arrêté du 11 avril 2008 modifié relatif aux règles de bonnes pratiques cliniques et biologiques d’assistance médicale à la procréation.
3. Plan cancer 2014-2019. www.e-cancer.fr
4. Chaput L, Grémeau AS, Vorilhon S, et al. Fertility preservation in oncology. Bull Cancer 2018 ; sous presse.
5. Benson JD, Woods EJ, Walters EM, Critser JK. The cryobiology of spermatozoa. Theriogenology 2012;78:1682-99.
6. Rienzi L, Gracia C, Maggiulli R, et al. Oocyte, embryo and blastocyst cryopreservation in ART: systematic review and meta-analysis comaring slow-freezing versus vitrification to produce evidence for the development of global guidance. Hum Reprod Update 2017;23:139-55.
7. Donnez J, Dolmans MM. Ovarian tissue freezing: current status. Curr Opin Obstet Gynecol 2015;27:222-30.