Pour toute patiente à haut risque d’infertilité ou nécessitant un traitement gonadotoxique.
Par Chloé Maignien,1 Mathilde Bourdon,1, 2 Justine Hugon-Rodin,3 Geneviève Plu-Bureau,3 Pietro Santulli,1, 2 Charles Chapron1, 2
Les lois de bioéthique prévoient que « toute personne dont la prise en charge médicale est susceptible d’altérer la fertilité, ou dont la fertilité risque d’être prématurément altérée, peut bénéficier du recueil de ses gamètes ou tissus germinaux […] en vue de la restauration de sa fertilité ». La congélation ovocytaire permet cela depuis plusieurs années. Initialement développée dans la prise en charge des cancers, elle est maintenant envisagée lors de toute pathologie bénigne susceptible d’entraîner une baisse du capital folliculaire (elle-même ou ses traitements) donc un risque d’insuffisance ovarienne prématurée (IOP).
Dans ces situations, il est licite d’informer les patientes au sujet des modes de conservation ovocytaire. Ils sont discutés au cas par cas selon le risque gonadotoxique, l’âge de la patiente, sa réserve ovarienne, son histoire personnelle et son souhait.
Les lois de bioéthique prévoient que « toute personne dont la prise en charge médicale est susceptible d’altérer la fertilité, ou dont la fertilité risque d’être prématurément altérée, peut bénéficier du recueil de ses gamètes ou tissus germinaux […] en vue de la restauration de sa fertilité ». La congélation ovocytaire permet cela depuis plusieurs années. Initialement développée dans la prise en charge des cancers, elle est maintenant envisagée lors de toute pathologie bénigne susceptible d’entraîner une baisse du capital folliculaire (elle-même ou ses traitements) donc un risque d’insuffisance ovarienne prématurée (IOP).
Dans ces situations, il est licite d’informer les patientes au sujet des modes de conservation ovocytaire. Ils sont discutés au cas par cas selon le risque gonadotoxique, l’âge de la patiente, sa réserve ovarienne, son histoire personnelle et son souhait.
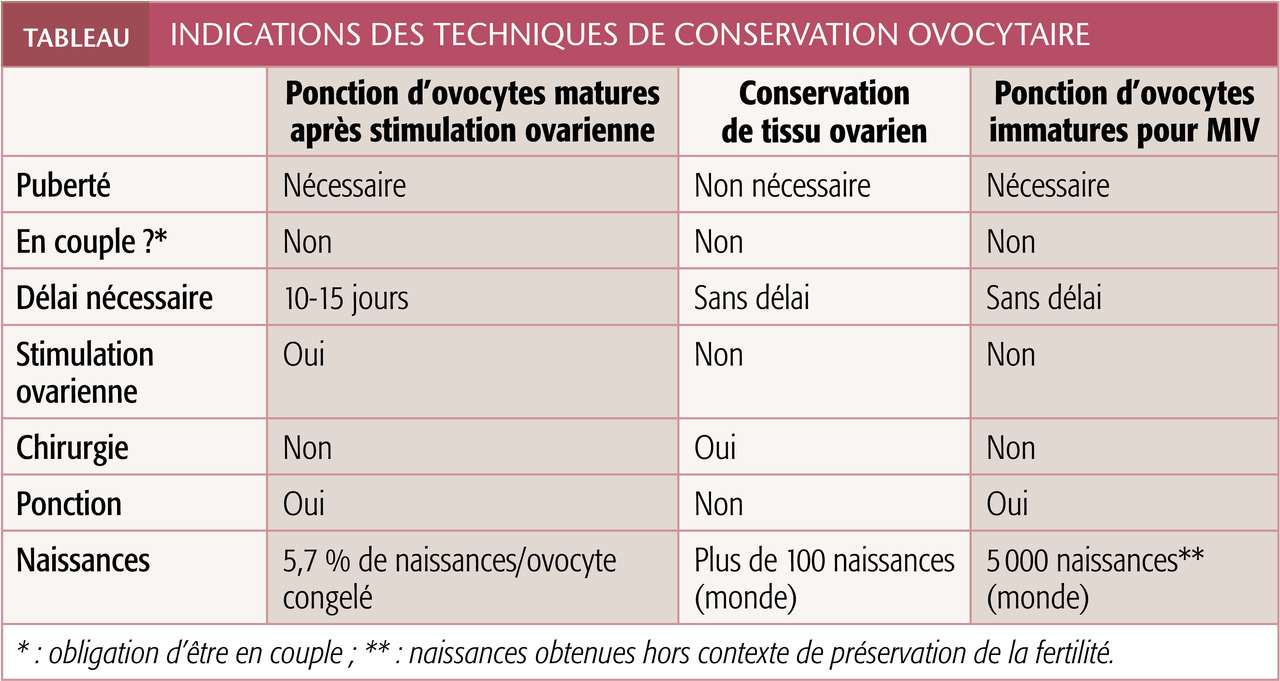
Techniques
Les principales : la congélation d’ovocytes recueillis après stimulation ovarienne ou à la suite d’une maturation in vitro (MIV) ; et celle du tissu ovarien lui-même. Les 2 dernières procédures sont encore expérimentales bien que pratiquées en routine par plusieurs équipes.
Ponction d’ovocytes matures après stimulation ovarienne
L’administration de gonadotrophines pendant 10 à 15 jours permet de récolter un maximum d’ovocytes matures : en métaphase II (de 2e division méiotique). Ils sont ensuite vitrifiés par refroidissement ultrarapide dans l’azote liquide en présence de cryoprotecteurs, ce qui réduit les dommages cellulaires en limitant la formation de cristaux.
Le protocole hormonal « antagoniste » est le plus utilisé : on déclenche l’ovulation avec un agoniste de la GnRH (hormone hypothalamique stimulant la sécrétion de gonadotrophines hypophysaires – FSH et LH), ce qui limite le risque d’hyperstimulation ovarienne, par rapport au protocole agoniste où le déclenchement de l’ovulation doit obligatoirement se faire par hCG, facteur de risque majeur d’hyperstimu-lation. Il peut être débuté en urgence, à n’importe quel moment du cycle menstruel.
Afin de maximiser le recueil, on peut procéder à deux stimulations successives. Toutefois, pour une patiente donnée, il est impossible de connaître le nombre minimal d’ovocytes nécessaire à une grossesse. Avant 35 ans, en vitrifier une dizaine permettrait d’atteindre un taux de 40 %.1
Le protocole hormonal « antagoniste » est le plus utilisé : on déclenche l’ovulation avec un agoniste de la GnRH (hormone hypothalamique stimulant la sécrétion de gonadotrophines hypophysaires – FSH et LH), ce qui limite le risque d’hyperstimulation ovarienne, par rapport au protocole agoniste où le déclenchement de l’ovulation doit obligatoirement se faire par hCG, facteur de risque majeur d’hyperstimu-lation. Il peut être débuté en urgence, à n’importe quel moment du cycle menstruel.
Afin de maximiser le recueil, on peut procéder à deux stimulations successives. Toutefois, pour une patiente donnée, il est impossible de connaître le nombre minimal d’ovocytes nécessaire à une grossesse. Avant 35 ans, en vitrifier une dizaine permettrait d’atteindre un taux de 40 %.1
Congélation de tissu ovarien
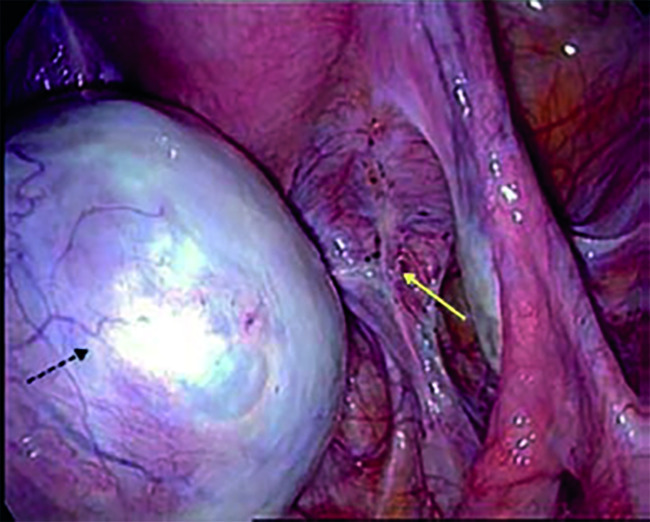
Celui-ci est prélevé par chirurgie cœlioscopique,2 puis fragmenté et congelé pour une réimplantation future. Cette technique a l’avantage d’être réalisable en urgence, sans stimulation ovarienne préalable. Seule modalité envisageable chez les filles prépubères, elle est réservée aux patientes dont le traitement est fortement gonadotoxique, puisque le prélèvement d’une large portion d’un ovaire (voire la gonade entière) peut engendrer, de fait, une diminution de fertilité spontanée à l’issue de la thérapie. La greffe des fragments récupérés peut être orthotopique (site naturel ovarien) ou hétérotopique (extrapéritonéal, notamment sous-cutané au niveau de l’abdomen ou du membre supérieur). Son objectif est de rétablir la fonction gonadique ou de permettre une fécondation in vitro (FIV). Près de 100 enfants sont déjà nés grâce à elle dans le monde (tableau ).
Ponction pour MIV
Elle consiste à prélever des ovocytes immatures par ponction transvaginale échoguidée des petits follicules antraux. Ils sont mis en culture au laboratoire pendant 24 à 48 heures afin d’évoluer jusqu’en métaphase II de 2e division méiotique, état vitrifiable. Comme la congélation de cortex ovarien, cette procédure peut être mise en œuvre sans délai, sans stimulation préalable, à n’importe quel moment du cycle menstruel, et peut être combinée à la technique précédente.
Le nombre d’ovocytes récupérés paraît corrélé à la réserve ovarienne : on peut la quantifier en dosant l’AMH (hormone anti-mullérienne) et en comptant les follicules antraux (CFA). Une AMH supérieure à 3,7 ng/mL ainsi qu’un CFA de plus de 20 semblent nécessaires pour obtenir au moins 10 ovocytes mûris in vitro destinés à être congelés.3
Le nombre d’ovocytes récupérés paraît corrélé à la réserve ovarienne : on peut la quantifier en dosant l’AMH (hormone anti-mullérienne) et en comptant les follicules antraux (CFA). Une AMH supérieure à 3,7 ng/mL ainsi qu’un CFA de plus de 20 semblent nécessaires pour obtenir au moins 10 ovocytes mûris in vitro destinés à être congelés.3
Indications gynécologiques
Endométriose
Pathologie bénigne, elle concerne 5 à 15 % des femmes en âge de procréer. Principales manifestations cliniques : l’infertilité ainsi que des douleurs d’intensité variable.
La réserve ovarienne diminue après chirurgie, risque majoré chez les patientes opérées d’endométriomes bilatéraux.4 En outre, elle pourrait être altérée par la maladie en elle-même, indépendamment de toute intervention.
Dans cette affection, les indications de préservation de la fertilité ne sont pas consensuelles. Cependant, les arguments sont nombreux pour une conservation ovocytaire lorsqu’il y a des endométriomes, surtout s’ils sont bilatéraux.
La réserve ovarienne diminue après chirurgie, risque majoré chez les patientes opérées d’endométriomes bilatéraux.4 En outre, elle pourrait être altérée par la maladie en elle-même, indépendamment de toute intervention.
Dans cette affection, les indications de préservation de la fertilité ne sont pas consensuelles. Cependant, les arguments sont nombreux pour une conservation ovocytaire lorsqu’il y a des endométriomes, surtout s’ils sont bilatéraux.
Tumeurs ovariennes présumées bénignes hors endométriome
Quelle que soit leur nature (kyste dermoïde ou uniloculaire simple), les TOPB ne semblent pas affecter la fertilité. C’est le traitement chirurgical qui expose à la destruction d’une portion de tissu ovarien sain adjacent. Il faut donc privilégier l’intervention la plus conservatrice (kystectomie).
Les situations très problématiques sont les kystes bilatéraux ou récidivants et la faiblesse préexistante de la réserve ovarienne, à évaluer en préopératoire en dosant l’AMH. S’il y a risque d’IOP iatrogène, une préservation de la fertilité peut être discutée, avant ou après la chirurgie, au cas par cas.
Les situations très problématiques sont les kystes bilatéraux ou récidivants et la faiblesse préexistante de la réserve ovarienne, à évaluer en préopératoire en dosant l’AMH. S’il y a risque d’IOP iatrogène, une préservation de la fertilité peut être discutée, avant ou après la chirurgie, au cas par cas.
IOP primaire
Elle est définie par une aménorrhée persistante associée à des gonadotrophines élevées avant l’âge de 40 ans. Parfois génétique (syndrome de Turner, prémutation FMR1) ou auto-immune, elle reste inexpliquée dans plus de 85 % des cas. Lorsqu’elle est avérée, le don d’ovocyte constitue la principale option pour obtenir une grossesse. Toutefois, la préservation de la fertilité se discute chez les patientes à risque après bilan étiologique complet et éventuel conseil génétique.
Avant la puberté, la congélation de cortex ovarien est la seule technique envisageable. Après, une stimulation pour congeler des ovocytes matures est possible si le volume ovarien est suffisant (nombre minimal requis de follicules antraux).
Avant la puberté, la congélation de cortex ovarien est la seule technique envisageable. Après, une stimulation pour congeler des ovocytes matures est possible si le volume ovarien est suffisant (nombre minimal requis de follicules antraux).
Pathologies non gynécologiques
Maladies de système
Qu’il s’agisse de lupus, vascularites, connectivites ou sarcoïdose, elles ne sont pas des indications en elles-mêmes ; aucune donnée n’a révélé d’altération de la réserve ovarienne liée à ces maladies. En revanche, lorsqu’un traitement gonadotoxique est nécessaire, la préservation doit être discutée.
Le méthotrexate, les corticoïdes ou les anti-inflammatoires ne semblent pas responsables d’IOP. Aucune donnée n’existe sur les biothérapies. Les traitements alkylants, dont le cyclophosphamide (le plus utilisé), ont une gonadotoxicité dépendant de la dose cumulée et de l’âge de la patiente.
Hors contre-indication d’une stimulation ovarienne (notamment thrombo-embolique), si le délai avant le début du traitement est suffisant, une congélation d’ovocytes matures est envisageable.5
Si celle-ci est impossible ou chez les patientes prépubères, une ponction d’ovocytes immatures en vue d’une MIV et/ou une congélation de cortex ovarien sont des alternatives.
Un agoniste de la GnRH peut être prescrit, concomitamment au traitement gonadotoxique, dans l’hypothèse d’un effet protecteur de l’agoniste qui reste cependant controversé (blocage de maturation des follicules primordiaux en l’absence de FSH/LH pour les soustraire à l’apoptose induite par le traitement).
Drépanocytose
La fertilité des patientes drépanocytaires ne paraît pas altérée. La seule situation justifiant un recours aux techniques de préservation est l’allogreffe de moelle osseuse, qui impose un conditionnement par des alkylants.
Des précautions doivent être prises en cas de stimulation ovarienne devant le surrisque de crises vaso-occlusives et d’accidents thrombo-emboliques chez ces femmes à haut risque vasculaire.
Le méthotrexate, les corticoïdes ou les anti-inflammatoires ne semblent pas responsables d’IOP. Aucune donnée n’existe sur les biothérapies. Les traitements alkylants, dont le cyclophosphamide (le plus utilisé), ont une gonadotoxicité dépendant de la dose cumulée et de l’âge de la patiente.
Hors contre-indication d’une stimulation ovarienne (notamment thrombo-embolique), si le délai avant le début du traitement est suffisant, une congélation d’ovocytes matures est envisageable.5
Si celle-ci est impossible ou chez les patientes prépubères, une ponction d’ovocytes immatures en vue d’une MIV et/ou une congélation de cortex ovarien sont des alternatives.
Un agoniste de la GnRH peut être prescrit, concomitamment au traitement gonadotoxique, dans l’hypothèse d’un effet protecteur de l’agoniste qui reste cependant controversé (blocage de maturation des follicules primordiaux en l’absence de FSH/LH pour les soustraire à l’apoptose induite par le traitement).
Drépanocytose
La fertilité des patientes drépanocytaires ne paraît pas altérée. La seule situation justifiant un recours aux techniques de préservation est l’allogreffe de moelle osseuse, qui impose un conditionnement par des alkylants.
Des précautions doivent être prises en cas de stimulation ovarienne devant le surrisque de crises vaso-occlusives et d’accidents thrombo-emboliques chez ces femmes à haut risque vasculaire.
références
1. Cobo A, García-Velasco JA, Coello A, Domingo J, Pellicer A, Remohí J. Oocyte vitrification as an efficient option for elective fertility preservation. Fertil Steril 2016;105:755-64.e8.
2. Ott J, Nouri K, Stögbauer L, et al. Ovarian tissue cryopreservation for non-malignant indications. Arch Gynecol Obstet 2010;281:735-9.
3. Sonigo C, Simon C, Boubaya M, et al. What threshold values of antral follicle count and serum AMH levels should be considered for oocyte cryopreservation after in vitro maturation? Hum Reprod 2016;31:1493-500.
4. Somigliana E, Vigano P, Filippi F, et al. Fertility preservation in women with endometriosis: for all, for some, for none? Hum Reprod 2015;30:1280-6.
5. Andreoli L, Bertsias GK, Agmon-Levin N, et al. EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017;76:476-85.
2. Ott J, Nouri K, Stögbauer L, et al. Ovarian tissue cryopreservation for non-malignant indications. Arch Gynecol Obstet 2010;281:735-9.
3. Sonigo C, Simon C, Boubaya M, et al. What threshold values of antral follicle count and serum AMH levels should be considered for oocyte cryopreservation after in vitro maturation? Hum Reprod 2016;31:1493-500.
4. Somigliana E, Vigano P, Filippi F, et al. Fertility preservation in women with endometriosis: for all, for some, for none? Hum Reprod 2015;30:1280-6.
5. Andreoli L, Bertsias GK, Agmon-Levin N, et al. EULAR recommendations for women’s health and the management of family planning, assisted reproduction, pregnancy and menopause in patients with systemic lupus erythematosus and/or antiphospholipid syndrome. Ann Rheum Dis 2017;76:476-85.