La perte brutale de l’odorat est fréquente en cas d’infection par le SARS-CoV-2. De nombreux arguments plaident en faveur d’une atteinte directe de la muqueuse olfactive. Corticothérapie par voie systémique, lavages de nez au sérum physiologique pendant la phase aiguë, et rééducation olfactive peuvent être envisagés, sans oublier une prise en charge psychologique pour certains patients.
La perte brutale de l’odorat liée à l’atteinte de la Covid-19 et son évolution naturelle
La perte brutale de l’odorat est un symptôme très fréquent chez les patients atteints de la coronavirus disease 2019 (Covid-19), avec une prévalence estimée à environ deux tiers des malades.1, 2 Cette perte peut être le seul symptôme de l’infection par le severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) ou être associée à d’autres signes cliniques.1, 2 De nombreux patients rapportent l’anosmie comme premier symptôme en l’absence de rhinorrhée ou de congestion/obstruction nasale. Notre étude a démontré que 80 % des patients atteints de la Covid-19 ont une perte brutale de l’odorat sans obstruction nasale.1 Cela suggère, dans l’hypothèse où la clé de la pathogenèse est inflammatoire, une atteinte très localisée au niveau de l’épithélium olfactif plutôt que générale. Une grande majorité des patients commencent à récupérer l’odorat 15 à 20 jours après sa perte.1, 3 Environ 60 % des patients récupèrent la totalité ou presque de leur odorat au 30e jour après le début de sa perte.1, 3 Autrement dit, 40 % des patients ont encore des troubles de l’odorat 1 mois après sa perte. Au 60e jour après, l’hyposmie modérée à sévère ne concerne plus que 6 % des patients.3
Physiopathologie de la perte de l’odorat dans la Covid-19
La perte brutale de l’odorat due au SARS-CoV-2 est principalement liée à la destruction massive de l’épithélium olfactif. On dénombre plusieurs arguments biologiques, cliniques et d’imagerie en faveur de cette hypothèse.
Le SARS-CoV-2 est nommé virus à couronne en raison de la présence de protéines (péplomères, spicules ou protéines Spike) comportant une frange de grandes projections bulbeuses qui décorent sa surface comme une couronne solaire.4 Ces protéines « S » interagissent avec des récepteurs cellulaires spécifiques pour se lier aux cellules hôtes. Le SARS-CoV-2 infecte les cellules par le biais d’interactions entre sa protéine S et le récepteur de l’enzyme de conversion de l’angiotensine II (ACE2) sur les cellules cibles.5 La liaison est suivie d’un clivage de la protéine S qui expose des domaines favorisant la fusion, permettant ainsi l’entrée du virus dans la cellule. Ce clivage semble majoritairement induit par la protéase transmembranaire à sérine 2 (TMPRSS2) de la cellule hôte, bien que d’autres protéases puissent également être impliquées.6 Ainsi, il semble nécessaire que la cellule hôte exprime le récepteur ACE2 pour que la fixation virale se fasse, et qu’elle active ses propres protéases pour que le SARS-CoV-2 puisse l’infecter.
Les cellules de l’épithélium respiratoire nasal présentent une expression plus importante des gènes impliqués dans l’entrée du SARS-CoV-2 que les cellules de l’épithélium respiratoire qui tapissent la trachée ou les poumons.7-9 Ces données suggèrent que l’épithélium nasal est le réservoir majeur du SARS-CoV-2. Ce réservoir est encore augmenté par la présence de la muqueuse olfactive : une équipe a, en effet, mis en évidence que l’expression immunohistochimique de l’ACE2 au niveau de l’épithélium olfactif humain est 200 à 700 fois plus élevée que celle des cellules épithéliales respiratoires nasales ou trachéales.9 Ce tropisme cellulaire particulier du SARS-CoV-2 pour l’épithélium olfactif pourrait expliquer son association avec la perte brutale de l’odorat chez une grande majorité des patients atteints de Covid-19.
L’épithélium olfactif est composé de plusieurs types de cellules : les neurones sensoriels olfactifs immatures et matures, les cellules non neuronales telles que les cellules de soutien (les cellules sustentaculaires), les cellules des glandes de Bowman, les cellules microvillaires, et les cellules souches comprenant des cellules basales globuleuses et horizontales. Les cellules sustentaculaires sont intimement associées aux neurones sensoriels olfactifs car elles « enveloppent » les cils dendritiques sensoriels qui se projettent dans l’espace aérien et permettent la capture des molécules odorantes. Plusieurs types de cellules non neuronales présentes dans l’épithélium olfactif expriment ACE2 et TMPRSS2, qui facilitent la liaison et la pénétration du SARS-CoV-2 nécessaire à sa réplication et à sa diffusion dans l’organisme.
Des travaux portant sur les types de cellules de l’épithélium olfactif exprimant ACE2 et d’autres gènes d’enzymes nécessaires à l’entrée virale chez les souris et chez l’homme10-12 concluent que les neurones sensoriels olfactifs n’expriment pas, quant à eux, les récepteurs ACE2. A contrario, la coexpression d’ACE2 et TMPRSS2 a été observée dans les cellules de soutien, les glandes de Bowman, les cellules microvillaires et les cellules souches qui sont à l’origine de la réparation de l’épithélium endommagé ou dégradé. Deux équipes10, 11 ont démontré une surexpression intense de la protéine ACE2 dans une large population de cellules sustentaculaires concentrées dans la région dorso-médiale de l’épithélium olfactif de souris. La coexpression d’ACE2 et TMPRSS2 dans les cellules de soutien de l’épithélium olfactif suggère qu’elles pourraient être la cible initiale de l’infection par le SARS-CoV-2.
Un article récemment publié a étudié l’aspect morphologique de l’épithélium olfactif sur un modèle animal (hamster) après l’instillation nasale du SARS-CoV-2.13 Ils ont observé une dégradation massive de l’épithélium olfactif à J2 post-infection par le SARS-CoV-2. Dans les zones histologiques les plus touchées, les faisceaux d’axones des neurones sensoriels olfactifs sous l’épithélium olfactif, étaient presque en contact direct avec l’environnement intranasal. La plus grande partie de l’épithélium olfactif avait disparu à J4 post-infection, après quoi il a commencé à se régénérer mais n’avait pas atteint, à J14, son épaisseur initiale. Avec une double coloration de la muqueuse olfactive par OMP et CK18, marqueurs spécifiques des neurones sensoriels olfactifs matures et cellules sustentaculaires respectivement, ils ont remarqué que le SARS-CoV-2 infecte seulement les cellules de soutien et non les neurones sensoriels olfactifs. En outre, il n’y avait pas de virus dans les bulbes olfactifs ni dans le cortex olfactif (cortex piriforme, tubercule olfactif), hypothalamus, hippocampe, et tronc cérébral.
Sur le plan fonctionnel, les neurones sensoriels olfactifs perdent la plupart de leurs cils nécessaires à la détection des odeurs dès J2 post-infection de SARS-CoV-2.13 Ces dommages sont associés à l’infection d’une grande proportion de cellules sustentaculaires mais pas des neurones olfactifs.13 Les auteurs de cet article ont également observé des infiltrations massives de cellules immunitaires, telles que les macrophages, dans l’épithélium olfactif et la lamina propria peu de temps après l’infection des cellules de soutien.13
L’infection des cellules de soutien et l’inflammation qui l’accompagne peuvent provoquer une augmentation locale des cytokines inflammatoires, dont il a été démontré qu’elles influaient sur la fonction des neurones sensoriels olfactifs sans qu’il y ait forcément une atteinte cellulaire. En effet, des taux particulièrement élevés de cytokine pro-inflammatoire TNF-α ont été observés dans l’épithélium olfactif de patients atteints de la Covid-19 par comparaison à des sujets contrôles. Cela suggère que l’atteinte directe de l’épithélium olfactif pourrait aussi jouer un rôle dans la perte olfactive aiguë décrite chez de nombreux patients Covid-19.14
Le SARS-CoV-2 est nommé virus à couronne en raison de la présence de protéines (péplomères, spicules ou protéines Spike) comportant une frange de grandes projections bulbeuses qui décorent sa surface comme une couronne solaire.4 Ces protéines « S » interagissent avec des récepteurs cellulaires spécifiques pour se lier aux cellules hôtes. Le SARS-CoV-2 infecte les cellules par le biais d’interactions entre sa protéine S et le récepteur de l’enzyme de conversion de l’angiotensine II (ACE2) sur les cellules cibles.5 La liaison est suivie d’un clivage de la protéine S qui expose des domaines favorisant la fusion, permettant ainsi l’entrée du virus dans la cellule. Ce clivage semble majoritairement induit par la protéase transmembranaire à sérine 2 (TMPRSS2) de la cellule hôte, bien que d’autres protéases puissent également être impliquées.6 Ainsi, il semble nécessaire que la cellule hôte exprime le récepteur ACE2 pour que la fixation virale se fasse, et qu’elle active ses propres protéases pour que le SARS-CoV-2 puisse l’infecter.
Les cellules de l’épithélium respiratoire nasal présentent une expression plus importante des gènes impliqués dans l’entrée du SARS-CoV-2 que les cellules de l’épithélium respiratoire qui tapissent la trachée ou les poumons.7-9 Ces données suggèrent que l’épithélium nasal est le réservoir majeur du SARS-CoV-2. Ce réservoir est encore augmenté par la présence de la muqueuse olfactive : une équipe a, en effet, mis en évidence que l’expression immunohistochimique de l’ACE2 au niveau de l’épithélium olfactif humain est 200 à 700 fois plus élevée que celle des cellules épithéliales respiratoires nasales ou trachéales.9 Ce tropisme cellulaire particulier du SARS-CoV-2 pour l’épithélium olfactif pourrait expliquer son association avec la perte brutale de l’odorat chez une grande majorité des patients atteints de Covid-19.
L’épithélium olfactif est composé de plusieurs types de cellules : les neurones sensoriels olfactifs immatures et matures, les cellules non neuronales telles que les cellules de soutien (les cellules sustentaculaires), les cellules des glandes de Bowman, les cellules microvillaires, et les cellules souches comprenant des cellules basales globuleuses et horizontales. Les cellules sustentaculaires sont intimement associées aux neurones sensoriels olfactifs car elles « enveloppent » les cils dendritiques sensoriels qui se projettent dans l’espace aérien et permettent la capture des molécules odorantes. Plusieurs types de cellules non neuronales présentes dans l’épithélium olfactif expriment ACE2 et TMPRSS2, qui facilitent la liaison et la pénétration du SARS-CoV-2 nécessaire à sa réplication et à sa diffusion dans l’organisme.
Des travaux portant sur les types de cellules de l’épithélium olfactif exprimant ACE2 et d’autres gènes d’enzymes nécessaires à l’entrée virale chez les souris et chez l’homme10-12 concluent que les neurones sensoriels olfactifs n’expriment pas, quant à eux, les récepteurs ACE2. A contrario, la coexpression d’ACE2 et TMPRSS2 a été observée dans les cellules de soutien, les glandes de Bowman, les cellules microvillaires et les cellules souches qui sont à l’origine de la réparation de l’épithélium endommagé ou dégradé. Deux équipes10, 11 ont démontré une surexpression intense de la protéine ACE2 dans une large population de cellules sustentaculaires concentrées dans la région dorso-médiale de l’épithélium olfactif de souris. La coexpression d’ACE2 et TMPRSS2 dans les cellules de soutien de l’épithélium olfactif suggère qu’elles pourraient être la cible initiale de l’infection par le SARS-CoV-2.
Un article récemment publié a étudié l’aspect morphologique de l’épithélium olfactif sur un modèle animal (hamster) après l’instillation nasale du SARS-CoV-2.13 Ils ont observé une dégradation massive de l’épithélium olfactif à J2 post-infection par le SARS-CoV-2. Dans les zones histologiques les plus touchées, les faisceaux d’axones des neurones sensoriels olfactifs sous l’épithélium olfactif, étaient presque en contact direct avec l’environnement intranasal. La plus grande partie de l’épithélium olfactif avait disparu à J4 post-infection, après quoi il a commencé à se régénérer mais n’avait pas atteint, à J14, son épaisseur initiale. Avec une double coloration de la muqueuse olfactive par OMP et CK18, marqueurs spécifiques des neurones sensoriels olfactifs matures et cellules sustentaculaires respectivement, ils ont remarqué que le SARS-CoV-2 infecte seulement les cellules de soutien et non les neurones sensoriels olfactifs. En outre, il n’y avait pas de virus dans les bulbes olfactifs ni dans le cortex olfactif (cortex piriforme, tubercule olfactif), hypothalamus, hippocampe, et tronc cérébral.
Sur le plan fonctionnel, les neurones sensoriels olfactifs perdent la plupart de leurs cils nécessaires à la détection des odeurs dès J2 post-infection de SARS-CoV-2.13 Ces dommages sont associés à l’infection d’une grande proportion de cellules sustentaculaires mais pas des neurones olfactifs.13 Les auteurs de cet article ont également observé des infiltrations massives de cellules immunitaires, telles que les macrophages, dans l’épithélium olfactif et la lamina propria peu de temps après l’infection des cellules de soutien.13
L’infection des cellules de soutien et l’inflammation qui l’accompagne peuvent provoquer une augmentation locale des cytokines inflammatoires, dont il a été démontré qu’elles influaient sur la fonction des neurones sensoriels olfactifs sans qu’il y ait forcément une atteinte cellulaire. En effet, des taux particulièrement élevés de cytokine pro-inflammatoire TNF-α ont été observés dans l’épithélium olfactif de patients atteints de la Covid-19 par comparaison à des sujets contrôles. Cela suggère que l’atteinte directe de l’épithélium olfactif pourrait aussi jouer un rôle dans la perte olfactive aiguë décrite chez de nombreux patients Covid-19.14
Pourquoi cette perte brutale de l’olfaction alors que le SARS-CoV-2 infecte seulement des cellules non neuronales ?
Cela est dû au fait que les cellules sustentaculaires sont fonctionnellement et anatomiquement étroitement liées aux neurones sensoriels olfactifs. Premièrement, les cellules sustentaculaires protègent les neurones olfactifs en détoxifiant les produits chimiques volatils et en exprimant des enzymes de la famille du cytochrome P450. De plus, les cellules sustentaculaires endocytent les complexes « protéines de liaison aux odeurs-molécules odorantes » après le début de la transduction du signal au niveau des cils des neurones, permettant ainsi leur découplage et donc leur recyclage pour un prochain cycle de liaison des odeurs au récepteur. Enfin, les cellules sustentaculaires fournissent aux neurones sensoriels olfactifs, où se trouvent les récepteurs olfactifs, du glucose supplémentaire. Ce processus est essentiel pour parer les exigences énergétiques élevées de la cascade de transduction olfactive. Compte tenu de tous ces faits, l’altération des cellules de soutien causée par une infection virale peut facilement inhiber la perception des molécules odorantes par les neurones sensoriels olfactifs adjacents. D’autre part, l’infection par le SARS-CoV-2 des cellules de soutien peut altérer le microenvironnement de l’épithélium olfactif, notamment en modifiant la qualité du mucus sécrété par les glandes de Bowman, essentiel à la capture normale des molécules odorantes
Par ailleurs, au fur et à mesure de la progression de l’infection associée à la surproduction de cytokines, ces modifications drastiques de l’homéostasie locale induisent la mort des neurones sensoriels olfactifs, ce qui entraîne les modifications histologiques du neuroépithélium.13
Cliniquement, la plupart des patients commencent à récupérer leur odorat 11,6 ± 2,6 jours après la perte brutale de l’odorat sans traitement.1 Curieusement, certains patients rapportent une récupération complète et totale du jour au lendemain. Parmi ceux qui commencent à récupérer leur odorat, environ 51 % des patients ont totalement récupéré leur olfaction au 14e jour de la perte brutale. Or ce délai de 14 jours semble trop court pour être lié à une régénération complète de l’épithélium olfactif, qui requiert normalement de 8 à 12 semaines. En effet, en cas de lésion, les neurones ne réapparaissent qu’après 3 à 4 jours et ne sont matures qu’après 8 à 10 jours.16 Ce délai répond, à l’inverse, beaucoup mieux à l’hypothèse d’une différenciation des cellules progénitrices en cellules de soutien car ces dernières se régénèrent plus rapidement que les neurones sensoriels olfactifs matures. Cela est un argument qui corrobore l’atteinte des cellules de soutien de l’épithélium olfactif par le SARS-CoV-2. Au niveau biologique, l’infiltration de cellules immunitaires est très importante jusqu’à J4.13 L’infiltration des cellules immunitaires diminue ensuite progressivement : à J10 dans l’épithélium olfactif et à J14 dans la lamina propria. À J14, l’épaisseur de l’épithélium olfactif est reconstituée de moitié, et certains cils fonctionnels réapparaissent. Une telle cinétique est compatible avec la récupération observée de l’anosmie chez les patients Covid-19.
Il est à noter que les cellules basales, normalement au repos, jouent un rôle particulièrement important dans la régénération de l’épithélium olfactif endommagé et expriment également l’ACE2.10, 17 L’infection de ces cellules peut donc ralentir la récupération fonctionnelle sur une longue durée.
Si la blessure atteint une large surface et jusqu’à la profondeur de l’épithélium olfactif (où se trouvent les cellules basales), les patients peuvent ne récupérer que partiellement ou pas du tout leur odorat. En effet, il a été montré qu’un grand pourcentage de cellules basales étaient alors endommagées, rendant le renouvellement de l’épithélium olfactif difficile.16
Par ailleurs, au fur et à mesure de la progression de l’infection associée à la surproduction de cytokines, ces modifications drastiques de l’homéostasie locale induisent la mort des neurones sensoriels olfactifs, ce qui entraîne les modifications histologiques du neuroépithélium.13
Cliniquement, la plupart des patients commencent à récupérer leur odorat 11,6 ± 2,6 jours après la perte brutale de l’odorat sans traitement.1 Curieusement, certains patients rapportent une récupération complète et totale du jour au lendemain. Parmi ceux qui commencent à récupérer leur odorat, environ 51 % des patients ont totalement récupéré leur olfaction au 14e jour de la perte brutale. Or ce délai de 14 jours semble trop court pour être lié à une régénération complète de l’épithélium olfactif, qui requiert normalement de 8 à 12 semaines. En effet, en cas de lésion, les neurones ne réapparaissent qu’après 3 à 4 jours et ne sont matures qu’après 8 à 10 jours.16 Ce délai répond, à l’inverse, beaucoup mieux à l’hypothèse d’une différenciation des cellules progénitrices en cellules de soutien car ces dernières se régénèrent plus rapidement que les neurones sensoriels olfactifs matures. Cela est un argument qui corrobore l’atteinte des cellules de soutien de l’épithélium olfactif par le SARS-CoV-2. Au niveau biologique, l’infiltration de cellules immunitaires est très importante jusqu’à J4.13 L’infiltration des cellules immunitaires diminue ensuite progressivement : à J10 dans l’épithélium olfactif et à J14 dans la lamina propria. À J14, l’épaisseur de l’épithélium olfactif est reconstituée de moitié, et certains cils fonctionnels réapparaissent. Une telle cinétique est compatible avec la récupération observée de l’anosmie chez les patients Covid-19.
Il est à noter que les cellules basales, normalement au repos, jouent un rôle particulièrement important dans la régénération de l’épithélium olfactif endommagé et expriment également l’ACE2.10, 17 L’infection de ces cellules peut donc ralentir la récupération fonctionnelle sur une longue durée.
Si la blessure atteint une large surface et jusqu’à la profondeur de l’épithélium olfactif (où se trouvent les cellules basales), les patients peuvent ne récupérer que partiellement ou pas du tout leur odorat. En effet, il a été montré qu’un grand pourcentage de cellules basales étaient alors endommagées, rendant le renouvellement de l’épithélium olfactif difficile.16
Comment expliquer la persistance de troubles olfactifs chez certains patients plusieurs mois après la « première vague » ?
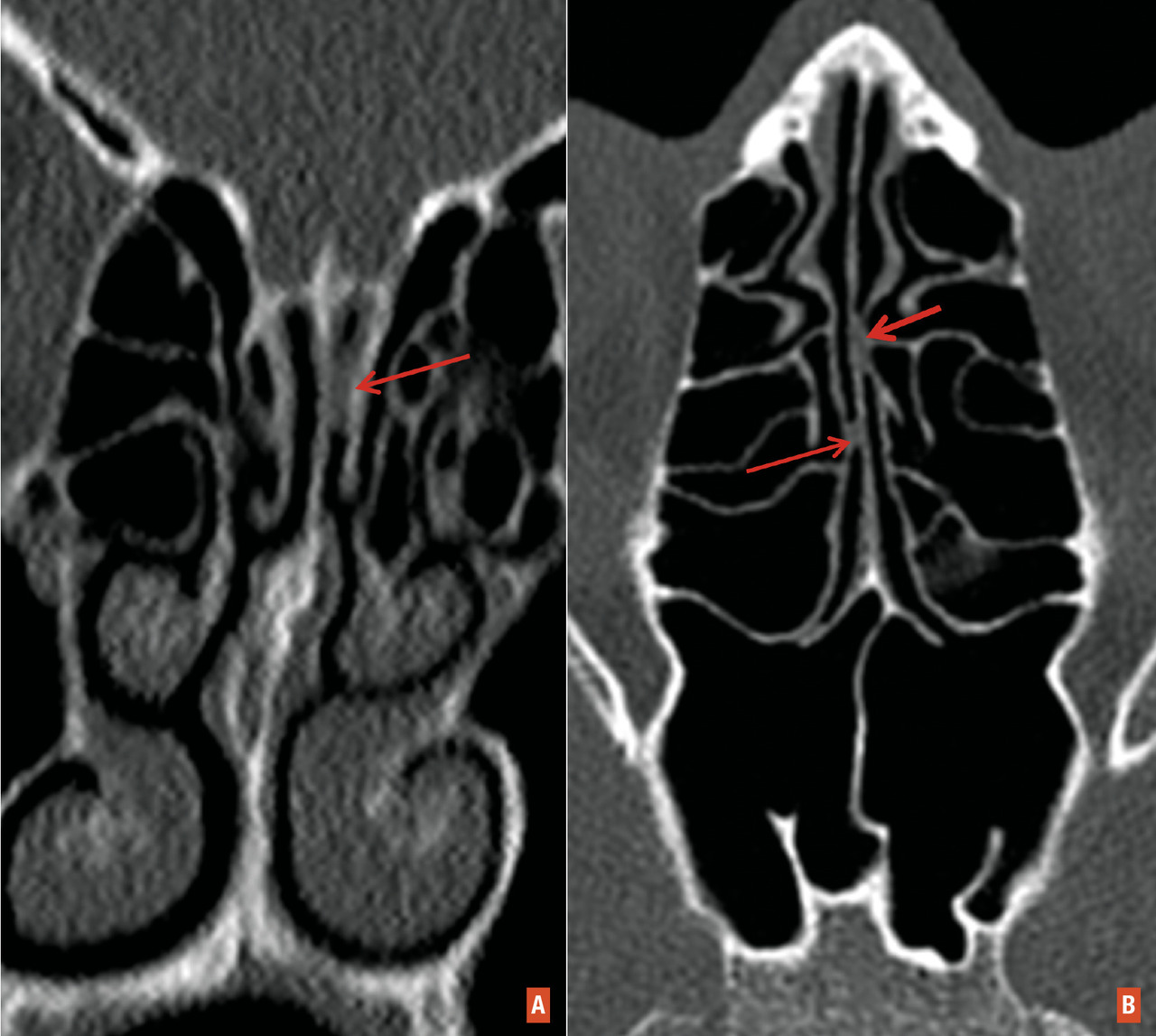
Nous avons pu observer plusieurs patients ayant des troubles de l’odorat persistant jusqu’à plusieurs mois après la première vague de Covid-19 en France. Ces troubles de type quantitatif (hyposmie ou anosmie) et qualitatif (parosmie et/ou phantosmie) ont des impacts particulièrement négatifs dans leur vie quotidienne. Chez ces patients, l’épithélium olfactif a probablement été touché de manière importante (diffuse et profonde), conduisant à une perte en nombre des cellules neuronales et une atteinte des cellules basales, ce qui impacte quantitativement et qualitativement la régénération de l’épithélium. D’autre part, la régénération des neurones sensoriels olfactifs peut être partiellement incomplète ou aberrante, à l’origine d’une parosmie ou phantosmie. Enfin, la cicatrisation de la muqueuse olfactive lésée peut entraîner des synéchies ou des lésions fibrose (ce qui pourrait correspondre à un phénomène similaire à celui décrit dans les pneumopathies Covid-19) [fig. 1 ].
Qu’en est-il à l’imagerie ?
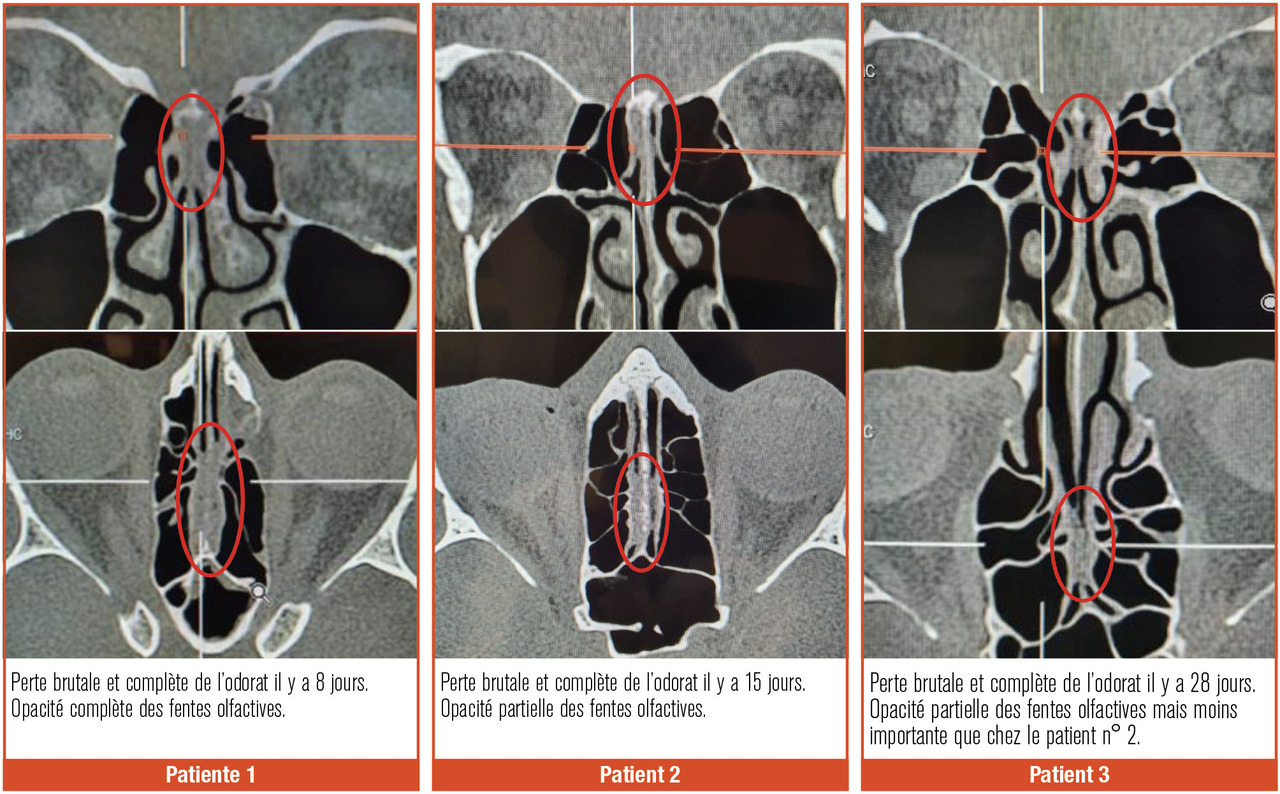
L’inflammation/destruction de la muqueuse olfactive est objectivée sur la tomodensitométrie et l’imagerie par résonance magnétique (IRM) nasosinusiennes. On observe, pendant la phase aiguë, des opacités complètes ou quasiment complètes des récessus olfactifs chez les patients Covid-19 ayant une perte brutale de l’odorat (fig. 2 ). Ces anomalies sont souvent isolées, sans atteinte des sinus paranasaux ni des cavités nasales. Ces opacités diminuent ou disparaissent au fil du temps lorsque les patients ont récupéré totalement leur odorat.
Un cas clinique publié dans Neurology a montré la présence d’un œdème transitoire des bulbes olfactifs sur une IRM à J7 chez un patient Covid-19, complètement résolutif 24 jours après les premiers symptômes.18 Cependant, dans une autre série de 20 patients Covid-19, il persistait un œdème de la muqueuse olfactive sur l’IRM réalisée le 15e jour après l’apparition de la perte de l’odorat, sans modification au niveau des bulbes olfactifs comparativement au groupe contrôle.19
Un cas clinique publié dans Neurology a montré la présence d’un œdème transitoire des bulbes olfactifs sur une IRM à J7 chez un patient Covid-19, complètement résolutif 24 jours après les premiers symptômes.18 Cependant, dans une autre série de 20 patients Covid-19, il persistait un œdème de la muqueuse olfactive sur l’IRM réalisée le 15e jour après l’apparition de la perte de l’odorat, sans modification au niveau des bulbes olfactifs comparativement au groupe contrôle.19
Et le système olfactif au niveau cérébral ?
De nombreux virus, y compris des coronavirus tels que le SARS-CoV-120 ou le HCoV-OC43,21 sont capables d’infecter le bulbe olfactif et les zones en aval telles que le cortex piriforme et le tronc cérébral par la voie épithéliale nasale. De plus, en 2005, a été rapportée la présence de SARS-CoV-1 dans des échantillons cérébraux prélevés lors d’autopsies chez huit patients atteints du syndrome de détresse respiratoire aiguë (SDRA).22 Cependant pour le SARS-CoV-2, cette possibilité d’atteinte cérébrale reste à confirmer ou à infirmer. Il apparaît d’après les études sur un modèle animal de souris que les neurones du bulbe olfactif n’expriment pas les récepteurs de l’ACE2.10 Le SARS-CoV-2 n’est pas identifié dans les cellules des bulbes olfactifs dans les études sur les hamsters infectés.13 L’analyse scSeq du cortex préfrontal humain et de l’hippocampe n’a pas réussi à identifier les cellules exprimant ACE2.23 Enfin, dans les cas cliniques rapportés de pseudo-encéphalites, l’ARN du SARS-CoV-2 n’a pas pu être isolé dans le liquide céphalorachidien des patients.26, 27 En revanche, de multiples études d’immunocoloration ont démontré l’expression de l’ACE2 dans le système vasculaire cérébral mais pas dans les neurones.10, 24, 25 C’est le cas des péricytes vasculaires dans les bulbes olfactifs qui ont une expression d’ACE2 intense,10 pouvant expliquer l’œdème transitoire des bulbes olfactifs rapporté chez un patient Covid-19.18
Quel traitement peut-on envisager ?
Place de la corticothérapie
Au début de la pandémie de Covid-19, les recommandations sur l’utilisation des corticoïdes étaient controversées. Selon la recommandation de la Surviving Sepsis Campaign (Campagne « survivre au sepsis ») publiée en mars 2020, l’utilisation des corticoïdes est faiblement recommandée chez les patients Covid-19 atteints de SDRA nécessitant une ventilation mécanique. Cependant, certains experts de ce panel n’ont pas voulu émettre de recommandations par manque de preuves.28 Un mois plus tard, la Société américaine des maladies infectieuses publiait une recommandation de grade faible de ne pas utiliser les corticostéroïdes, sauf pour les patients atteints de la forme sévère de Covid-19 associant un SDRA, traités dans le cadre d’essais cliniques.29
Une méta-analyse sur l’utilisation des corticoïdes dans les pneumopathies à coronavirus a démontré une réduction de mortalité chez les patients avec SDRA non-Covid et chez une petite cohorte de patients Covid-19.32 Chez les patients atteints de Covid-19 sévère mais sans SDRA, les preuves directes de deux études observationnelles ont fourni des preuves discutables d’une augmentation de la mortalité avec les cortico-stéroïdes (hazard ratio [HR] : 2,30 ; intervalle de confiance [IC] à 95 % : 1,00-5,29), tout comme les données dans les pneumopathies à influenzae.32
En effet, beaucoup craignaient, sans réelle preuve, que les corticostéroïdes puissent être à l’origine de formes graves d’infections par le SARS-CoV-2 bien qu’une équipe ait montré, au début de l’épidémie, que le traitement par méthylprednisolone réduisait le risque de mortalité chez les patients Covid-19 avec SDRA.33
En septembre 2020, une méta-analyse prospective réalisée sous l’égide de l’Organisation mondiale de la santé (OMS) a démontré que l’utilisation des corticoïdes systémiques réduisait la mortalité à 28 jours en comparaison avec une prise en charge habituelle chez les patients Covid-19 sévères (odds ratio [OR] : 0,66 ; IC à 95 % : 0,53-0,82).34 En termes de risques liés à ce traitement, en analysant six essais portant sur la survenue d’effets indésirables sévères, on rapporte 64 événements indésirables parmi 354 patients randomisés dans le bras corticoïdes contre 80 événements indésirables parmi 342 patients randomisés dans le bras soins habituels ou placebo.34 Il n’y avait pas de sur-risque de mortalité dans le groupe recevant des corticoïdes. Aujourd’hui, il est donc fortement recommandé d’utiliser des corticoïdes par voie systémique chez les patients atteints d’une forme sévère de Covid-19 nécessitant une ventilation mécanique.35 C’est un traitement efficace, peu coûteux, avec peu d’effets indésirables.34, 35
La prise de corticoïdes systémiques est un traitement largement utilisé dans la perte de l’odorat liée à l’œdème et l’inflammation de la voie olfactive périphérique. La corticothérapie est utilisée depuis longtemps en pratique courante par les oto-rhino-laryngologistes (ORL) et les médecins généralistes pour traiter les pertes post-infectieuses de l’odorat. Une revue récente a inclus six études portant sur la corticothérapie systémique (prednisolone ou bétaméthasone) pour la perte de l’odorat à la suite d’une infection virale des voies respiratoires supérieures.36 Ses auteurs rapportaient une amélioration de l’odorat objectivée par les tests psychophysiques. En particulier, les résultats étaient meilleurs en cas de traitement précoce.37 Les corticoïdes associent des effets anti-inflammatoires, antifibrotiques et vasoconstricteurs. Les corticostéroïdes inhibent l’œdème, le dépôt de fibrine, la dilatation capillaire, la migration des leucocytes, la prolifération capillaire, la prolifération des fibroblastes, le dépôt de collagène, et la formation de cicatrices inflammatoires. La corticothérapie a montré une efficacité dans l’amélioration de la fonction olfactive via des effets anti-inflammatoires, contrairement à l’entraînement olfactif, qui impliquerait la régénération cellulaire et le remodelage tissulaire.38
En ce qui concerne l’atteinte de l’épithélium olfactif par le SARS-CoV-2, il existe une surproduction de cytokines pro-inflammatoire, responsable de modifications drastiques de l’homéostasie locale causant la mort des neurones sensoriels olfactifs. Aussi, il est légitime de supposer que si la production de cytokines inflammatoires s’arrêtait, les cellules souches basales (dans l’épithélium) seraient capables de régénérer de nouveaux neurones olfactifs, permettant ainsi de restaurer la fonction olfactive.15 Par conséquent, la recherche de nouvelles stratégies pour l’élimination de certains médiateurs inflammatoires peut être utile afin de trouver un traitement efficace sur l’anosmie associée à la Covid-19. C’est pourquoi l’utilité du traitement par corticoïde systémique à cette phase semble intéressante mais reste à démontrer.
Jusqu’à maintenant, il n’y a pas de preuve publiée portant sur le traitement corticoïde par voie systémique pour l’anosmie due à la Covid-19 en phase aiguë. Une étude est en cours, menée par une équipe égyptienne en utilisant la dexaméthasone précoce versus tardive chez les patients ayant des formes légères à modérées de Covid-19 (clinicaltrials.gov : Anosmia and / or Ageusia and Early Corticosteroid Use).
Au vu des arguments biologiques, histologiques, d’imagerie et de la littérature, un traitement par corticoïdes per os en cure courte à partir de J7 après la perte brutale de l’odorat peut être discuté et envisagé pour les patients ayant, dans le cadre d’une Covid-19, une perte brutale de l’odorat en tenant compte des effets indésirables de ce traitement. Chez les patients ayant cliniquement une atteinte pneumologique (ou autre) associée, nous ne pouvons pas émettre de recommandations par manque d’arguments. Avant J7, il y a un phénomène inflammatoire très important au niveau de la muqueuse olfactive13, mais l’hypothèse d’un retard de la clairance virale rend la balance bénéfice-risque défavorable à la prise des corticoïdes par voie systémique. En effet, une équipe a montré une clairance virale retardée en comparant la concentration de l’ARN de SARS-CoV plasmatique chez 9 patients ayant reçu de l’hydrocortisone pendant la phase précoce de la maladie (< 7 jours de début des symptômes), par rapport à celle de 7 patients ayant reçu un placebo.30
Nous supposons que ce traitement permet de réduire l’inflammation de la muqueuse olfactive pour limiter la destruction des neurones sensoriels olfactifs et réduire le phénomène de sclérose de la muqueuse olfactive pendant la procédure de cicatrisation, limitant ainsi la sténose des fentes olfactives séquellaires. À partir de nos expériences, un traitement par corticoïdes à distance (au-delà de 6 semaines) chez les patients ayant eu une Covid-19 n’améliore pas leurs troubles de l’odorat malgré la présence d’opacités au niveau de la muqueuse olfactive sur le scanner nez-sinus. À ce niveau, ces opacités sont probablement dues à la sclérose. Le traitement par corticoïdes intranasaux est peu convaincant, car les molécules médicamenteuses n’atteignent que difficilement la muqueuse olfactive située dans une région très haute et étroite des cavités nasales. D’autre part, les lavages de nez à la seringue au sérum physiologique sont aussi à envisager, comme les soins des autres plaies cutanées ou de la muqueuse. Ces lavages permettent probablement de nettoyer les débris muqueux au niveau des fentes olfactives (dont la localisation est haute, nécessitant l’utilisation des seringues de 10 ou 20 mL), favorisant la cicatrisation et réduisant les synéchies à cet endroit. L’irrigation intranasale précoce par sérum physiologique versus celle à partir du 7e jour après la perte de l’odorat reste encore une question à résoudre. Théoriquement, plus les soins locaux sont faits tôt, mieux les plaies cicatrisent, avec une fibrose cicatricielle réduite. Des lavages précoces permettent-ils une accélération de la clairance virale locale ou au contraire facilitent-ils une dispersion du virus ? Ce sont des hypothèses à clarifier. Au-delà d’une semaine, le risque de disperser le virus est très faible, mais la cicatrisation de la muqueuse olfactive a déjà commencé.
Une méta-analyse sur l’utilisation des corticoïdes dans les pneumopathies à coronavirus a démontré une réduction de mortalité chez les patients avec SDRA non-Covid et chez une petite cohorte de patients Covid-19.32 Chez les patients atteints de Covid-19 sévère mais sans SDRA, les preuves directes de deux études observationnelles ont fourni des preuves discutables d’une augmentation de la mortalité avec les cortico-stéroïdes (hazard ratio [HR] : 2,30 ; intervalle de confiance [IC] à 95 % : 1,00-5,29), tout comme les données dans les pneumopathies à influenzae.32
En effet, beaucoup craignaient, sans réelle preuve, que les corticostéroïdes puissent être à l’origine de formes graves d’infections par le SARS-CoV-2 bien qu’une équipe ait montré, au début de l’épidémie, que le traitement par méthylprednisolone réduisait le risque de mortalité chez les patients Covid-19 avec SDRA.33
En septembre 2020, une méta-analyse prospective réalisée sous l’égide de l’Organisation mondiale de la santé (OMS) a démontré que l’utilisation des corticoïdes systémiques réduisait la mortalité à 28 jours en comparaison avec une prise en charge habituelle chez les patients Covid-19 sévères (odds ratio [OR] : 0,66 ; IC à 95 % : 0,53-0,82).34 En termes de risques liés à ce traitement, en analysant six essais portant sur la survenue d’effets indésirables sévères, on rapporte 64 événements indésirables parmi 354 patients randomisés dans le bras corticoïdes contre 80 événements indésirables parmi 342 patients randomisés dans le bras soins habituels ou placebo.34 Il n’y avait pas de sur-risque de mortalité dans le groupe recevant des corticoïdes. Aujourd’hui, il est donc fortement recommandé d’utiliser des corticoïdes par voie systémique chez les patients atteints d’une forme sévère de Covid-19 nécessitant une ventilation mécanique.35 C’est un traitement efficace, peu coûteux, avec peu d’effets indésirables.34, 35
La prise de corticoïdes systémiques est un traitement largement utilisé dans la perte de l’odorat liée à l’œdème et l’inflammation de la voie olfactive périphérique. La corticothérapie est utilisée depuis longtemps en pratique courante par les oto-rhino-laryngologistes (ORL) et les médecins généralistes pour traiter les pertes post-infectieuses de l’odorat. Une revue récente a inclus six études portant sur la corticothérapie systémique (prednisolone ou bétaméthasone) pour la perte de l’odorat à la suite d’une infection virale des voies respiratoires supérieures.36 Ses auteurs rapportaient une amélioration de l’odorat objectivée par les tests psychophysiques. En particulier, les résultats étaient meilleurs en cas de traitement précoce.37 Les corticoïdes associent des effets anti-inflammatoires, antifibrotiques et vasoconstricteurs. Les corticostéroïdes inhibent l’œdème, le dépôt de fibrine, la dilatation capillaire, la migration des leucocytes, la prolifération capillaire, la prolifération des fibroblastes, le dépôt de collagène, et la formation de cicatrices inflammatoires. La corticothérapie a montré une efficacité dans l’amélioration de la fonction olfactive via des effets anti-inflammatoires, contrairement à l’entraînement olfactif, qui impliquerait la régénération cellulaire et le remodelage tissulaire.38
En ce qui concerne l’atteinte de l’épithélium olfactif par le SARS-CoV-2, il existe une surproduction de cytokines pro-inflammatoire, responsable de modifications drastiques de l’homéostasie locale causant la mort des neurones sensoriels olfactifs. Aussi, il est légitime de supposer que si la production de cytokines inflammatoires s’arrêtait, les cellules souches basales (dans l’épithélium) seraient capables de régénérer de nouveaux neurones olfactifs, permettant ainsi de restaurer la fonction olfactive.15 Par conséquent, la recherche de nouvelles stratégies pour l’élimination de certains médiateurs inflammatoires peut être utile afin de trouver un traitement efficace sur l’anosmie associée à la Covid-19. C’est pourquoi l’utilité du traitement par corticoïde systémique à cette phase semble intéressante mais reste à démontrer.
Jusqu’à maintenant, il n’y a pas de preuve publiée portant sur le traitement corticoïde par voie systémique pour l’anosmie due à la Covid-19 en phase aiguë. Une étude est en cours, menée par une équipe égyptienne en utilisant la dexaméthasone précoce versus tardive chez les patients ayant des formes légères à modérées de Covid-19 (clinicaltrials.gov : Anosmia and / or Ageusia and Early Corticosteroid Use).
Au vu des arguments biologiques, histologiques, d’imagerie et de la littérature, un traitement par corticoïdes per os en cure courte à partir de J7 après la perte brutale de l’odorat peut être discuté et envisagé pour les patients ayant, dans le cadre d’une Covid-19, une perte brutale de l’odorat en tenant compte des effets indésirables de ce traitement. Chez les patients ayant cliniquement une atteinte pneumologique (ou autre) associée, nous ne pouvons pas émettre de recommandations par manque d’arguments. Avant J7, il y a un phénomène inflammatoire très important au niveau de la muqueuse olfactive13, mais l’hypothèse d’un retard de la clairance virale rend la balance bénéfice-risque défavorable à la prise des corticoïdes par voie systémique. En effet, une équipe a montré une clairance virale retardée en comparant la concentration de l’ARN de SARS-CoV plasmatique chez 9 patients ayant reçu de l’hydrocortisone pendant la phase précoce de la maladie (< 7 jours de début des symptômes), par rapport à celle de 7 patients ayant reçu un placebo.30
Nous supposons que ce traitement permet de réduire l’inflammation de la muqueuse olfactive pour limiter la destruction des neurones sensoriels olfactifs et réduire le phénomène de sclérose de la muqueuse olfactive pendant la procédure de cicatrisation, limitant ainsi la sténose des fentes olfactives séquellaires. À partir de nos expériences, un traitement par corticoïdes à distance (au-delà de 6 semaines) chez les patients ayant eu une Covid-19 n’améliore pas leurs troubles de l’odorat malgré la présence d’opacités au niveau de la muqueuse olfactive sur le scanner nez-sinus. À ce niveau, ces opacités sont probablement dues à la sclérose. Le traitement par corticoïdes intranasaux est peu convaincant, car les molécules médicamenteuses n’atteignent que difficilement la muqueuse olfactive située dans une région très haute et étroite des cavités nasales. D’autre part, les lavages de nez à la seringue au sérum physiologique sont aussi à envisager, comme les soins des autres plaies cutanées ou de la muqueuse. Ces lavages permettent probablement de nettoyer les débris muqueux au niveau des fentes olfactives (dont la localisation est haute, nécessitant l’utilisation des seringues de 10 ou 20 mL), favorisant la cicatrisation et réduisant les synéchies à cet endroit. L’irrigation intranasale précoce par sérum physiologique versus celle à partir du 7e jour après la perte de l’odorat reste encore une question à résoudre. Théoriquement, plus les soins locaux sont faits tôt, mieux les plaies cicatrisent, avec une fibrose cicatricielle réduite. Des lavages précoces permettent-ils une accélération de la clairance virale locale ou au contraire facilitent-ils une dispersion du virus ? Ce sont des hypothèses à clarifier. Au-delà d’une semaine, le risque de disperser le virus est très faible, mais la cicatrisation de la muqueuse olfactive a déjà commencé.
Rééducation olfactive : une voie prometteuse
Plusieurs hypothèses ont été suggérées : l’exposition répétitive des odeurs pourrait moduler la régénération de la muqueuse olfactive chez les patients ayant une anosmie post-infectieuse ; il y aurait également des modifications de la neurogenèse du bulbe olfactif secondaire à la stimulation olfactive ; enfin, la plasticité cérébrale accompagnant une réorganisation des réseaux neuronaux contribuerait à ces effets.39 Aussi, une autorééducation olfactive peut aider l’accélération de la régénération des neurones sensoriels olfactifs. Cependant, nous pensons que cet entraînement peut être moins efficace lorsqu’il existe un phénomène inflammatoire local, bloquant la captation et la reconnaissance des molécules olfactives. Par conséquent, la rééducation olfactive n’a réellement d’intérêt qu’au moment où les malades recommencent à sentir faiblement des odeurs ou à partir de deux semaines de la perte de l’odorat (délai pendant lequel l’épithélium olfactif reconstitue les couches cellulaires et où le phénomène inflammatoire a régressé).13
Pour les patients qui ont une perte de l’odorat persistante au-delà de 8 semaines, un bilan ORL complet associant endoscopie nasale, test de l’odorat, questionnaire évaluant l’impact des troubles de l’odorat dans la vie personnelle et professionnelle est nécessaire. Il s’agit aussi de chercher d’autres pathologies associées (rhinite allergique, polypose nasale…) qui sont également des causes de troubles de l’odorat. Un examen tomodensitométrique nez-sinus est également recommandé, à la recherche d’anomalies au niveau des récessus olfactifs, telles qu’une sténose, des opacités, des synéchies de la muqueuse… Une rééducation olfactive sur une longue durée (au minimum 16 semaines) est fortement conseillée, car cette méthode a prouvé son efficacité dans la perte de l’odorat post-infectieuse.39
La prise en charge psychologique et de soutien est aussi très importante dans ces situations. Enfin, s’il y a des sténoses des fentes olfactives confirmées, la place de la dilatation chirurgicale des fentes olfactives40 reste à démontrer, les données actuelles ne permettant pas clairement d’établir le rapport bénéfice-risque-résultats attendus.
Pour les patients qui ont une perte de l’odorat persistante au-delà de 8 semaines, un bilan ORL complet associant endoscopie nasale, test de l’odorat, questionnaire évaluant l’impact des troubles de l’odorat dans la vie personnelle et professionnelle est nécessaire. Il s’agit aussi de chercher d’autres pathologies associées (rhinite allergique, polypose nasale…) qui sont également des causes de troubles de l’odorat. Un examen tomodensitométrique nez-sinus est également recommandé, à la recherche d’anomalies au niveau des récessus olfactifs, telles qu’une sténose, des opacités, des synéchies de la muqueuse… Une rééducation olfactive sur une longue durée (au minimum 16 semaines) est fortement conseillée, car cette méthode a prouvé son efficacité dans la perte de l’odorat post-infectieuse.39
La prise en charge psychologique et de soutien est aussi très importante dans ces situations. Enfin, s’il y a des sténoses des fentes olfactives confirmées, la place de la dilatation chirurgicale des fentes olfactives40 reste à démontrer, les données actuelles ne permettant pas clairement d’établir le rapport bénéfice-risque-résultats attendus.
Une atteinte directe de la muqueuse
La perte brutale de l’odorat est fréquente dans le cadre d’une atteinte Covid-19. Des arguments biologiques, moléculaires, clinique et d’imagerie plaident en faveur de l’atteinte directe de la muqueuse olfactive, en particulier des cellules non neuronales, dites de soutien. L’efficacité d’une corticothérapie par voie systémique, associée à des lavages de nez au sérum physiologique pendant la phase aiguë, reste à étudier, mais semble prometteuse car elle pourrait réduire l’inflammation locale et ses conséquences néfastes sur l’épithélium olfactif. La rééducation olfactive est également à envisager quand l’inflammation de la muqueuse olfactive a régressé et que persistent des troubles de l’odorat. Enfin, la prise en charge psychologique doit être envisagée car les patients se sentent souvent démunis face une pathologie encore mal connue et dont le traitement n’est pas clairement codifié.
Références
1. Gorzkowski V, Bevilacqua S, Charmillon A, et al. Evolution of olfactory disorders in Covid-19 patients. Laryngoscope 2020;130:2667-73.
2. Lechien JR, Chiesa-Estomba CM, De Siati DR, et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild to moderate forms of the coronavirus disease (Covid-19): a multicenter European study. Eur Arch Otorhinolaryngol 2020;277:2251-61.
3. Vaira LA, Hopkins C, Petrocelli M, et al. Smell and taste recovery in coronavirus disease 2019 patients: a 60-day objective and prospective study. J. Laryngol Otol 2020;134:703-9.
4. Du L, He Y, Zhou Y, Liu S, Zheng BJ, Jiang S. The spike protein of SARS-CoV–– a target for vaccine and therapeutic development. Nat Rev Microbiol 2009;7:226-36.
5. Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, function, and antigenicity of the SARS-CoV-2 Spike glycoprotein. Cell 2020;181:281-92.e6.
6. Zang R, Gomez Castro MF, McCune BT, et al. TMPRSS2 and TMPRSS4 promote SARS-CoV-2 infection of human small intestinal enterocytes. Sci Immunol 2020;5:eabc3582.
7. Sungnak W, Huang N, Becavin C, et al, HCA Lung Biological network. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med 2020;26:681-7.
8. Hou YJ, Okuda K, Edwards CE, et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell 2020;182:429-46.e14.
9. Chen M, Shen W, Rowan NR, et al. Elevated ACE-2 expression in the olfactory neuroepithelium: implications for anosmia and upper respiratory SARS-CoV-2 entry and replication. Eur Respir J 2020;56:2001948.
10. Brann DH, Tsukahara T, Weinreb C, et al. Non-neuronal expression of SARS-CoV-2 entry genes in the olfactory system suggests mechanisms underlying Covid-19-associated anosmia. Sci Adv 2020;6:eabc5801.
11. Fodoulian L, Tuberosa J, Rossier D, Landis BN, Carleton A, Rodriguez I. SARS-CoV-2 receptor and entry genes are expressed by sustentacular cells in the human olfactory neuroepithelium. iScience 2020;23:101839.
12. Ziegler CGK, Allon SJ, Nyquist SK, et al. HCA Lung Biological network. SARS-CoV-2 Receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. Cell 2020;181:1016-35.e19.
13. Bryche B, St Albin A, Murri S, et al. Massive transient damage of the olfactory epithelium associated with infection of sustentacular cells by SARS-CoV-2 in golden Syrian hamsters. Brain Behav Immun 2020;89:579-86.
14. Torabi A, Mohammadbagheri E, Akbari Dilmaghani N, et al. Proinflammatory cytokines in the olfactory mucosa result in Covid-19 induced anosmia. ACS Chem Neurosci 2020;11:1909-13.
15. Lane A P, Turner J, May L, Reed R. A genetic model of chronic rhinosinusitis-associated olfactory inflammation reveals reversible functional impairment and dramatic neuroepithelial reorganization. J. Neurosci 2010:30:2324-9.
16. Schwob JE. Neural regeneration and the peripheral olfactory system. Anat Rec 2002;269:33‑49.
17. Schwob JE, Jang W, Holbrook EH, et al. Stem and progenitor cells of the mammalian olfactory epithelium: Taking poietic license. J Comp Neurol 2017;525:1034-54.
18. Laurendon T, Radulesco T, Mugnier J, et al. Bilateral transient olfactory bulb edema during Covid-19-related anosmia. Neurology 2020;95:224-5.
19. Eliezer M, Hamel AL, Houdart E, et al. Loss of smell in Covid-19 patients: MRI data reveals a transient edema of the olfactory clefts. Neurology 2020;95:e3145-52.
20. Netland J, Meyerholz DK, Moore S, Cassell M, Perlman S. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2. J Virol 2008;82:7264‑75.
21. Dubé M, Le Coupanec A, Wong AHM, Rini JM, Desforges M, Talbot PJ. Axonal transport enables neuron-to-neuron propagation of human coronavirus OC43. J Virol 2018:92;e00404-18.
22. Gu J, Gong E, Zhang B, et al. Multiple organ infection and the pathogenesis of SARS. J Exp Med 2005;202:415‑24.
23. Chen R, Wang K, Yu J, Chen Z, Wen C, Xu Z. The spatial and cell-type distribution of SARS-CoV-2 receptor ACE2 in human and mouse brain. bioRxiv 2020 https://doi.org/10.1101/2020.04.07.030650
24. Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203:631-7.
25. Kehoe PG, Wong S, Al Mulhim N, Palmer LE, Miners J.S. Angiotensin-converting enzyme 2 is reduced in Alzheimer’s disease in association with increasing amyloid-b and tau pathology. Alzheimers Res Ther 2016;8:50.
26. Schaller T, Hirschbuhl K, Burkhardt K, et al. Postmortem examination of patients with Covid-19. JAMA 2020;323:2518-20.
27. Farhadian S, Glick LR, Vogels CBF, et al. Acute encephalopathy with elevated CSF inflammatory markers as the initial presentation of Covid-19. BMC Neurol 2020;20:248.
28. Alhazzani W, Moller MH, Arabi YM, et al. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (Covid-19). Crit Care Med 2020;48:e440-9.
29. Bhimraj A, Morgan RL, Shumaker AH, et al. Infectious Diseases Society of America Guidelines on the treatment and management of patients with Covid-19. Clin Infect Dis 2020;ciaa478.
30. Lee N, Allen Chan KC, Hui DS, et al. Effects of early corticosteroid treatment on plasma SARS-associated coronavirus RNA concentrations in adult patients. J Clin Virol 2004;31:304-9.
31. Arabi YM, Mandourah Y, Al-Hameed F, et al; Saudi Critical Care trial group. Corticosteroid therapy for critically ill patients with Middle East Respiratory Syndrome. Am J Respir Crit Care Med 2018;197:757-67.
32. Ye Z, Wang Y, Colunga-Lozano LE, et al. Efficacy and safety of corticosteroids in Covid-19 based on evidence for Covid-19, other coronavirus infections, influenza, community-acquired pneumonia and acute respiratory distress syndrome: a systematic review and meta-analysis. CMAJ 2020;192:E756-67.
33. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia inWuhan, China. JAMA Intern Med 2020;180:934-43.
34. WHO Rapid Evidence Appraisal for Covid-19 Therapies (REACT) working group, Sterne JAC, Murthy S, Diaz JV, Slutsky AS, Villar J. Association between administration of systemic corticosteroids and mortality among critically ill patients with Covid-19: a meta-analysis. JAMA 2020;324:1330-41.
35. Prescott HC, Rice TW. Corticosteroids in Covid-19 ARDS: evidence and hope during the pandemic. JAMA 2020;324:1292-5.
36. Hura N, Xie DX, Choby GW, et al. Treatment of post viral olfactory dysfunction: an evidence-based review with recommendations. Int Forum Allergy Rhinol 2020;10:1065-86.
37. Kim DH, Kim SW, Hwang SH, et al. Prognosis of olfactory dysfunction according to etiology and timing of treatment. Otolaryngol Head Neck Surg 2017;156:371-7.
38. Kim BY, Park JY, Kim EJ. Differences in mechanisms of steroid therapy and olfactory training for olfactory loss in mice. Am J Rhinol Allergy 2020;34:810-21.
39. Nguyen DT, Jankowski R, Gallet P, Rumeau C. Rééducation olfactive dans l’anosmie post-infectieuse. Rev Prat 2020;70;703-8.
40. Jankowski R, Nguyen DT, Gallet P, Rumeau C. Olfactory cleft dilatation. Eur Ann Otorhinolaryngol Head Neck Dis 2018;135:437-41.
2. Lechien JR, Chiesa-Estomba CM, De Siati DR, et al. Olfactory and gustatory dysfunctions as a clinical presentation of mild to moderate forms of the coronavirus disease (Covid-19): a multicenter European study. Eur Arch Otorhinolaryngol 2020;277:2251-61.
3. Vaira LA, Hopkins C, Petrocelli M, et al. Smell and taste recovery in coronavirus disease 2019 patients: a 60-day objective and prospective study. J. Laryngol Otol 2020;134:703-9.
4. Du L, He Y, Zhou Y, Liu S, Zheng BJ, Jiang S. The spike protein of SARS-CoV–– a target for vaccine and therapeutic development. Nat Rev Microbiol 2009;7:226-36.
5. Walls AC, Park YJ, Tortorici MA, Wall A, McGuire AT, Veesler D. Structure, function, and antigenicity of the SARS-CoV-2 Spike glycoprotein. Cell 2020;181:281-92.e6.
6. Zang R, Gomez Castro MF, McCune BT, et al. TMPRSS2 and TMPRSS4 promote SARS-CoV-2 infection of human small intestinal enterocytes. Sci Immunol 2020;5:eabc3582.
7. Sungnak W, Huang N, Becavin C, et al, HCA Lung Biological network. SARS-CoV-2 entry factors are highly expressed in nasal epithelial cells together with innate immune genes. Nat Med 2020;26:681-7.
8. Hou YJ, Okuda K, Edwards CE, et al. SARS-CoV-2 reverse genetics reveals a variable infection gradient in the respiratory tract. Cell 2020;182:429-46.e14.
9. Chen M, Shen W, Rowan NR, et al. Elevated ACE-2 expression in the olfactory neuroepithelium: implications for anosmia and upper respiratory SARS-CoV-2 entry and replication. Eur Respir J 2020;56:2001948.
10. Brann DH, Tsukahara T, Weinreb C, et al. Non-neuronal expression of SARS-CoV-2 entry genes in the olfactory system suggests mechanisms underlying Covid-19-associated anosmia. Sci Adv 2020;6:eabc5801.
11. Fodoulian L, Tuberosa J, Rossier D, Landis BN, Carleton A, Rodriguez I. SARS-CoV-2 receptor and entry genes are expressed by sustentacular cells in the human olfactory neuroepithelium. iScience 2020;23:101839.
12. Ziegler CGK, Allon SJ, Nyquist SK, et al. HCA Lung Biological network. SARS-CoV-2 Receptor ACE2 is an interferon-stimulated gene in human airway epithelial cells and is detected in specific cell subsets across tissues. Cell 2020;181:1016-35.e19.
13. Bryche B, St Albin A, Murri S, et al. Massive transient damage of the olfactory epithelium associated with infection of sustentacular cells by SARS-CoV-2 in golden Syrian hamsters. Brain Behav Immun 2020;89:579-86.
14. Torabi A, Mohammadbagheri E, Akbari Dilmaghani N, et al. Proinflammatory cytokines in the olfactory mucosa result in Covid-19 induced anosmia. ACS Chem Neurosci 2020;11:1909-13.
15. Lane A P, Turner J, May L, Reed R. A genetic model of chronic rhinosinusitis-associated olfactory inflammation reveals reversible functional impairment and dramatic neuroepithelial reorganization. J. Neurosci 2010:30:2324-9.
16. Schwob JE. Neural regeneration and the peripheral olfactory system. Anat Rec 2002;269:33‑49.
17. Schwob JE, Jang W, Holbrook EH, et al. Stem and progenitor cells of the mammalian olfactory epithelium: Taking poietic license. J Comp Neurol 2017;525:1034-54.
18. Laurendon T, Radulesco T, Mugnier J, et al. Bilateral transient olfactory bulb edema during Covid-19-related anosmia. Neurology 2020;95:224-5.
19. Eliezer M, Hamel AL, Houdart E, et al. Loss of smell in Covid-19 patients: MRI data reveals a transient edema of the olfactory clefts. Neurology 2020;95:e3145-52.
20. Netland J, Meyerholz DK, Moore S, Cassell M, Perlman S. Severe acute respiratory syndrome coronavirus infection causes neuronal death in the absence of encephalitis in mice transgenic for human ACE2. J Virol 2008;82:7264‑75.
21. Dubé M, Le Coupanec A, Wong AHM, Rini JM, Desforges M, Talbot PJ. Axonal transport enables neuron-to-neuron propagation of human coronavirus OC43. J Virol 2018:92;e00404-18.
22. Gu J, Gong E, Zhang B, et al. Multiple organ infection and the pathogenesis of SARS. J Exp Med 2005;202:415‑24.
23. Chen R, Wang K, Yu J, Chen Z, Wen C, Xu Z. The spatial and cell-type distribution of SARS-CoV-2 receptor ACE2 in human and mouse brain. bioRxiv 2020 https://doi.org/10.1101/2020.04.07.030650
24. Hamming I, Timens W, Bulthuis MLC, Lely AT, Navis G, van Goor H. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol 2004;203:631-7.
25. Kehoe PG, Wong S, Al Mulhim N, Palmer LE, Miners J.S. Angiotensin-converting enzyme 2 is reduced in Alzheimer’s disease in association with increasing amyloid-b and tau pathology. Alzheimers Res Ther 2016;8:50.
26. Schaller T, Hirschbuhl K, Burkhardt K, et al. Postmortem examination of patients with Covid-19. JAMA 2020;323:2518-20.
27. Farhadian S, Glick LR, Vogels CBF, et al. Acute encephalopathy with elevated CSF inflammatory markers as the initial presentation of Covid-19. BMC Neurol 2020;20:248.
28. Alhazzani W, Moller MH, Arabi YM, et al. Surviving Sepsis Campaign: guidelines on the management of critically ill adults with coronavirus disease 2019 (Covid-19). Crit Care Med 2020;48:e440-9.
29. Bhimraj A, Morgan RL, Shumaker AH, et al. Infectious Diseases Society of America Guidelines on the treatment and management of patients with Covid-19. Clin Infect Dis 2020;ciaa478.
30. Lee N, Allen Chan KC, Hui DS, et al. Effects of early corticosteroid treatment on plasma SARS-associated coronavirus RNA concentrations in adult patients. J Clin Virol 2004;31:304-9.
31. Arabi YM, Mandourah Y, Al-Hameed F, et al; Saudi Critical Care trial group. Corticosteroid therapy for critically ill patients with Middle East Respiratory Syndrome. Am J Respir Crit Care Med 2018;197:757-67.
32. Ye Z, Wang Y, Colunga-Lozano LE, et al. Efficacy and safety of corticosteroids in Covid-19 based on evidence for Covid-19, other coronavirus infections, influenza, community-acquired pneumonia and acute respiratory distress syndrome: a systematic review and meta-analysis. CMAJ 2020;192:E756-67.
33. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia inWuhan, China. JAMA Intern Med 2020;180:934-43.
34. WHO Rapid Evidence Appraisal for Covid-19 Therapies (REACT) working group, Sterne JAC, Murthy S, Diaz JV, Slutsky AS, Villar J. Association between administration of systemic corticosteroids and mortality among critically ill patients with Covid-19: a meta-analysis. JAMA 2020;324:1330-41.
35. Prescott HC, Rice TW. Corticosteroids in Covid-19 ARDS: evidence and hope during the pandemic. JAMA 2020;324:1292-5.
36. Hura N, Xie DX, Choby GW, et al. Treatment of post viral olfactory dysfunction: an evidence-based review with recommendations. Int Forum Allergy Rhinol 2020;10:1065-86.
37. Kim DH, Kim SW, Hwang SH, et al. Prognosis of olfactory dysfunction according to etiology and timing of treatment. Otolaryngol Head Neck Surg 2017;156:371-7.
38. Kim BY, Park JY, Kim EJ. Differences in mechanisms of steroid therapy and olfactory training for olfactory loss in mice. Am J Rhinol Allergy 2020;34:810-21.
39. Nguyen DT, Jankowski R, Gallet P, Rumeau C. Rééducation olfactive dans l’anosmie post-infectieuse. Rev Prat 2020;70;703-8.
40. Jankowski R, Nguyen DT, Gallet P, Rumeau C. Olfactory cleft dilatation. Eur Ann Otorhinolaryngol Head Neck Dis 2018;135:437-41.
Dans cet article
- La perte brutale de l’odorat liée à l’atteinte de la Covid-19 et son évolution naturelle
- Physiopathologie de la perte de l’odorat dans la Covid-19
- Pourquoi cette perte brutale de l’olfaction alors que le SARS-CoV-2 infecte seulement des cellules non neuronales ?
- Comment expliquer la persistance de troubles olfactifs chez certains patients plusieurs mois après la « première vague » ?
- Qu’en est-il à l’imagerie ?
- Et le système olfactif au niveau cérébral ?
- Quel traitement peut-on envisager ?
- Une atteinte directe de la muqueuse