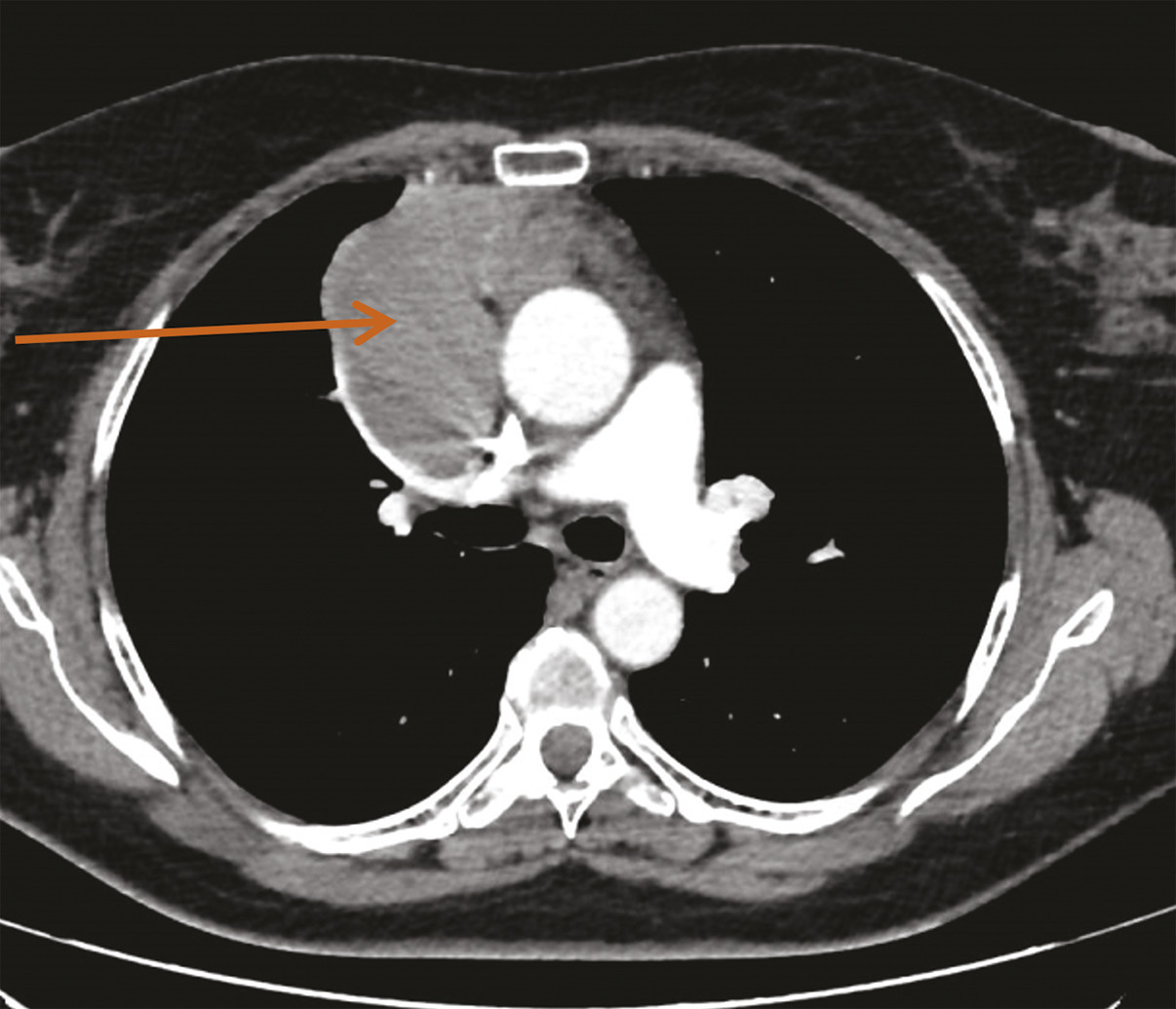
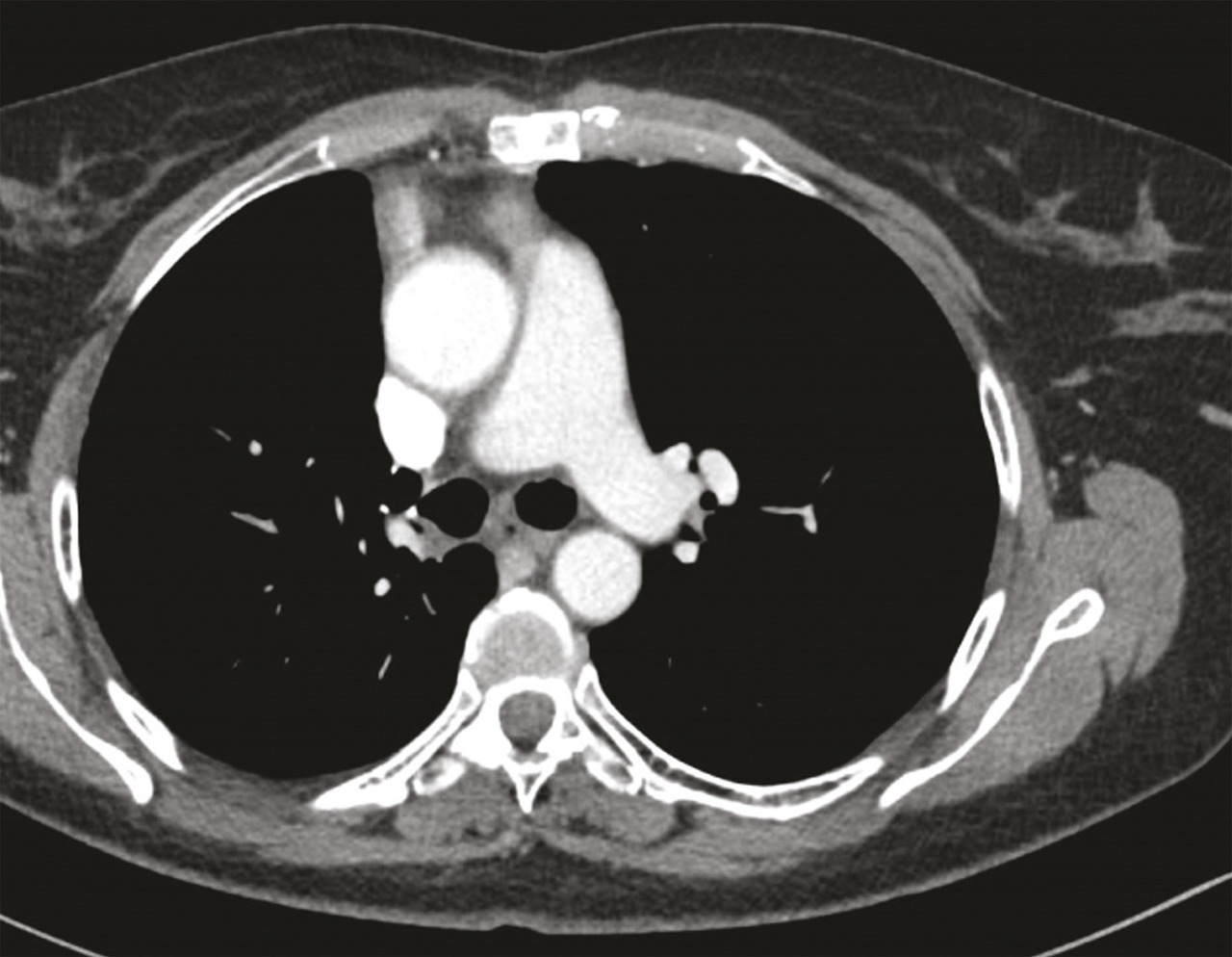
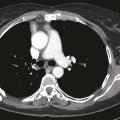
Une imagerie par résonance magnétique (IRM) du crâne réalisée 15 jours après le début des symptômes n’a pas montré d’anomalie. Toutefois, leur persistance et leur aggravation ont fait demander à son médecin traitant un dosage des anticorps antirécepteurs à l’acétylcholine, qui s’est révélé positif, conduisant au diagnostic de myasthénie. Des anticholinestérasiques ont alors été prescrits en première intention, permettant d’améliorer transitoirement les symptômes musculaires. Leur effet est de prolonger l’action de l’acétylcholine au niveau de la membrane post-synaptique par blocage réversible de l’acétylcholinestérase (deux médicaments sont disponibles : la pyridostigmine et l’ambénomium). Dans le cadre du bilan de cette myasthénie, une tomodensitométrie thoracique est pratiquée, qui met en évidence une masse médiastinale antérieure, volumineuse et polylobée évoquant une tumeur thymique (
Thymome ou hyperplasie thymique ?
Une thymectomie peut être indiquée en cas de myasthénie sans tumeur thymique. Elle a un effet bénéfique sur l’évolutivité de la maladie myasthénique sévère chez le sujet jeune de moins de 40 ans porteur d’une hyperplasie thymique.
En cas de diagnostic de myasthénie, une hyperplasie thymique est notée dans 65 % des cas, mais un thymome dans seulement 15 % des cas.
Une myasthénie existe chez près d’un tiers des patients atteints de thymome.2, 3 À l’inverse, seuls 15 % des patients ayant une myasthénie ont un thymome.
La myasthénie peut survenir de façon précessive, synchrone, ou métachrone au diagnostic de thymome. Elle doit faire rechercher une ou des maladie(s) auto-immune(s) associée(s) et nécessite, en cas de suspicion de tumeur thymique, le bilan biologique minimal suivant : hémogramme avec taux de réticulocytes ; électrophorèse des protéines sériques avec dosage pondéral des immunoglobulines ; dosage des créatines phosphokinases (CPK) ; dosage des anticorps antinucléaires et des anticorps antirécepteurs à l’acétylcholine (si positif, pas d’indication d’électromyogramme) ; dosage de la thyréostimuline (TSH).
Confirmation du diagnostic, chimiothérapie néoadjuvante
Il existe plusieurs sous-types histologiques des tumeurs thymiques :4
– le thymome A à prédominance de cellules épithéliales fusiformes ;
– le thymome AB, association de thymome A et de zones riches en lymphocytes ;
– le thymome B1, constitué de cellules épithéliales polygonales peu nombreuses ;
– le thymome B2, association de cellules épithéliales polygonales et tumeur riche en lymphocytes ;
– le thymome B3, constitué de cellules épithéliales polygonales avec atypies modérées ;
– le carcinome thymique, constitué de cellules épithéliales polygonales avec fortes atypies, et avec une expression de GLUT1+ fréquente.
On distingue aujourd’hui deux groupes de tumeurs thymiques dites de bas grade (thymome A, AB, B1) et de haut grade (thymome B2 et B3). Le carcinome thymique est de moins bon pronostic car plus agressif que le thymome.
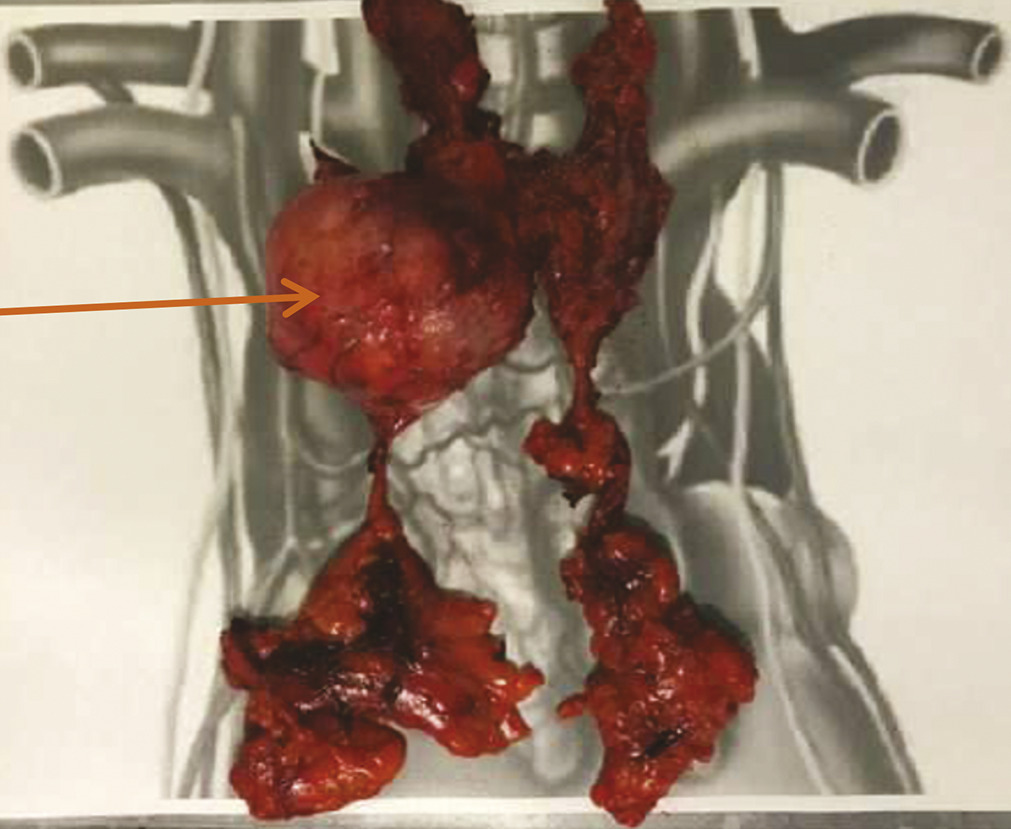
L’évaluation de la résécabilité, fondée sur l’expertise du chirurgien, est la première étape de la prise en charge d’une tumeur thymique. La possibilité d’une résection complète est en effet le facteur pronostique favorable le plus constant et le plus significatif sur la survie sans progression et la survie globale.5
En cas de tumeur localement avancée, la chimiothérapie d’induction a pour objectif l’obtention d’une réponse tumorale permettant une résection chirurgicale complète secondaire.
Chez cette patiente, on décide de prescrire une chimiothérapie néoadjuvante par CAP (cisplatine 50 mg/m², adriamycine 50 mg/m², cyclophosphamide 500 mg/m²). Trois cycles sont reçus, avec une bonne tolérance. L’évaluation RECIST 1.1 décrit une stabilité globale tumorale avec cependant une diminution de 10 % en taille de la lésion. La tumeur est résécable.
Prise en charge chirurgicale
La sternotomie médiane est la voie d’abord historique pour la résection des tumeurs thymiques. La thoracotomie antérieure bilatérale avec sternotomie transverse ou la sternotomie longitudinale partielle peuvent être préconisées pour de très volumineuses tumeurs, ou lorsqu’une exérèse pulmonaire semble prévisible.
Les approches à thorax fermé sont aujourd’hui souvent proposées en cas de tumeur de moins de 4 cm sans signes d’invasion.8
L’exérèse complète monobloc doit être le souci permanent, garantissant à elle seule un bon pronostic.
La thymectomie doit être associée à la thymomectomie.
Prise en charge postopératoire
La radiothérapie postopératoire doit être validée après discussion en RCP RYTHMIC. Elle est habituellement proposée dans les situations de tumeurs invasives, de carcinome thymique, ou en cas de résection incomplète.
Le suivi régulier est indispensable, car les tumeurs thymiques peuvent récidiver même après plusieurs années, et un traitement curatif doit être envisagé à la rechute.
Les modalités de suivi oncologique sont fondées sur un consensus d’experts. La proposition de suivi est la suivante :
– première tomodensitométrie thoracique à 3 mois après la résection chirurgicale ;
– en cas de thymome de stade I ou II, après résection complète : tomodensitométrie thoracique annuelle pendant 5 ans, puis bisannuelle ;
– en cas de thymome de stade III ou IV, de carcinome thymique, ou après résection R1 ou R2 : tomodensitométrie thoracique à 3 mois, puis tous les 6 mois pendant 3 à 5 ans, puis annuellement ;
– poursuite du suivi pendant 10 à 15 années.
La réapparition de signes d’un syndrome auto-immun, en particulier de myasthénie, doit conduire à une recherche précoce de récidive. Cependant, les manifestations auto-immunes métachrones peuvent apparaître, indépendamment d’une récidive tumorale.
Les tumeurs thymiques : à retenir
Près d’un tiers des patients atteints de tumeur épithéliale thymique sont asymptomatiques au diagnostic ; environ un tiers des patients ont des symptômes locaux liés à la compression médiastinale (douleurs thoraciques, toux, dyspnée) ; et le tiers restant a une maladie auto-immune associée.
Diagnostic
Les tumeurs épithéliales thymiques représentent la première cause de masse médiastinale antérieure (35 % des cas) ; les diagnostics différentiels les plus pertinents sont les lymphomes (25 % des cas) – maladie de Hodgkin et lymphomes malins non hodgkiniens – et les tumeurs germinales (20 % des cas) – tératomes, séminomes, tumeurs germinales malignes non séminomateuses.
Pronostic des tumeurs thymiques
Un élément à prendre en compte est le fait que jusqu’à 60 % des patients atteints de thymome ne décèdent pas de progression tumorale. Le décès est en effet rapporté à une autre cause pour plus d’un tiers des patients, et lié à l’évolution d’une affection auto-immune dans près de 25 % des cas.
Prise en charge initiale
La chimiothérapie néoadjuvante peut être discutée en fonction de la résécabilité initiale. Une radiothérapie postopératoire doit être validée en RCP RYTHMIC.
Prise en charge des récidives
Près de 75 % des récidives surviennent au niveau pleural. Une nouvelle résection complète des lésions récidivantes représente le facteur pronostique le plus significatif dans cette situation, et la chirurgie est ainsi recommandée en cas de lésion récidivante résécable.
En cas de récidive non résécable, plusieurs lignes consécutives de chimiothérapie peuvent être administrées.
Le réseau RYTHMIC (Réseau tumeurs thymiques et cancer)
À la suite d’un appel d’offres de l’Institut national du cancer (INCa) en 2010, un réseau de soins national de centres experts sur les thymomes et carcinomes thymiques a été mis en place en 2012 : le réseau RYTHMIC (Réseau tumeurs thymiques et cancer). Les cas de plus de 3 000 patients ont été discutés dans le cadre des réunions de concertation pluridisciplinaires (RCP) organisées par le réseau à ce jour.
Ce réseau s’articule sur 15 centres experts, dont un centre expert national bi-site (institut Gustave-Roussy, Villejuif, et institut Curie, Paris) et 13 centres régionaux ou inter-régionaux. Le coordonnateur en est le Pr Benjamin Besse. L’objectif du réseau est d’uniformiser la prise en charge des patients atteints de tumeur thymique, en particulier grâce à la rédaction du référentiel national et la mise en œuvre de RCP nationales RYTHMIC (par webconférence, deux fois par mois) et régionales.
La recommandation est de présenter tout nouveau dossier de tumeur thymique en réunion de recours régionale afin de valider l’attitude thérapeutique selon le référentiel national et d’enregistrer le dossier dans la base de données nationale. Si le dossier présente des difficultés diagnostiques ou thérapeutiques, il est alors discuté en réunion de concertation pluridisciplinaire de recours national.
Une relecture anatomopathologique nationale, coordonnée par le Pr Thierry Molina (hôpital Necker, Paris), est organisée pour tous les cas présentés en RCP de recours national. £Le réseau permet également la mise en œuvre d’essais thérapeutiques, de programmes de biologie moléculaire et la diffusion d’informations grâce à une formation médicale continue ainsi que grâce au site internet dédié.4
2. Evoli A, Lancaster E. Paraneoplastic disorders in thymoma patients. J Thorac Oncol 2014;9:S143-7.
3. Girard N, Mornex F, Van Houtte P, Cordier JF. Thymoma: a focus on current therapeutic management. J Thorac Oncol 2009;4:119-26.
4. www.rythmic.org
5. Girard N, Dansin E, Lena H, et al. MINI25.08 systemic treatment in advanced thymic epithelial tumors. Insights from a prospective cohort of 888 patients enrolled in RYTHMIC. J Thorac Oncol 2015;10:S353.
6. Detterbeck F, Nicholson AG, Kondo K, et al. The Masaoka-Koga stage classification for thymic malignancies: clarification and definition of terms. J Thoracic Oncol 2011;6:S1710-6.
7. Nicholson AG, Detterbeck FC, Marino M, et al. The IASLC/ITMIG thymic epithelial tumors staging project: proposals for the component for the forthcoming (8th) edition of teh TNM classification of malignant tumors. J Thor Oncol 2014;9(9 Suppl 2):S73-80.
8. Toker A, Sonett J, Zielinski M, et al. Standard terms, definitions and policies for minimally invasive resection of thymoma. J Thoracic Oncol 2011;6:S1739-42.

 Encadrés
Encadrés