Toujours pas de traitement pour la forme atrophique…
La dégénérescence maculaire liée à l’âge (DMLA) est la principale cause de malvoyance chez les personnes de plus de 50 ans dans les pays industrialisés. Pour autant, sa physiopathologie reste incomplètement élucidée. L’âge, le profil génétique et le tabac sont les 3 facteurs de risque principaux de la maladie. Les progrès thérapeutiques, surtout les injections intravitréennes d’anti-VEGF (Vascular Endothelial Growth Factor), ont considérablement modifié la prise en charge et amélioré le pronostic visuel.
Définition
La DMLA correspond à un ensemble de lésions dégénératives secondaires à une susceptibilité génétique et/ou des facteurs environnementaux, qui altèrent l’aire centrale de la rétine (macula) chez les sujets de plus de 50 ans.1 L’atteinte est généralement bilatérale, parfois asymétrique. On distingue les formes précoces, ou maculopathie liée à l’âge (MLA), des formes tardives comprenant les dégénérescences atrophiques (sèche) et exsudatives (humide), qui ont un retentissement sur la vision.
Épidémiologie
En l’absence de définition consensuelle, les données épidémiologiques sont hétérogènes. On peut retenir les résultats d’une grande étude européenne évaluant sa prévalence à 30 % de la population de plus de 75 ans, dont 25 % de formes précoces et 5 % de formes tardives.2
En France, les études POLA (2005) et ALIENOR (2010) ont montré l’augmentation de la prévalence avec l’âge et des chiffres superposables à ceux de la littérature. Dans la première, l’incidence de la maculopathie est de 0,49 % sur 3 ans mais de 3,41 % dans le même temps chez les 80 ans et plus. Dans la seconde, chez les 73 ans et plus, la prévalence de la MLA est de 28,4 % et celle de la DMLA de 5,6 %.
En France, les études POLA (2005) et ALIENOR (2010) ont montré l’augmentation de la prévalence avec l’âge et des chiffres superposables à ceux de la littérature. Dans la première, l’incidence de la maculopathie est de 0,49 % sur 3 ans mais de 3,41 % dans le même temps chez les 80 ans et plus. Dans la seconde, chez les 73 ans et plus, la prévalence de la MLA est de 28,4 % et celle de la DMLA de 5,6 %.
Facteurs de risque
La maladie est multifactorielle, avec trois déterminants principaux.
L’âge reste le plus important. Dans une étude récente, les formes tardives touchent 10 % de la population de plus de 85 ans et seulement 0,1 % des 55-59 ans.3
Une prédisposition génétique est suspectée depuis plusieurs décennies. Récemment, deux polymorphismes ont émergé : ceux du facteur H du complément et du gène ARMS2 (Age-Related Maculopathy Susceptibility 2). D’autres gènes codant pour des protéines du complément (C2, C3, facteur B) ont été mis en cause, mais l’association est plus faible.
Chez les tabagiques, un surrisque de 2 ou plus a été mis en évidence dans de nombreuses études ; il est probablement secondaire à une augmentation du stress oxydant au niveau de la rétine.
De nombreux autres facteurs ont été incriminés, mais leur association pathologique est moindre et diverge en fonction des études : hypertension artérielle, dyslipidémie, athérosclérose, exposition au soleil, iris clair, obésité.
L’âge reste le plus important. Dans une étude récente, les formes tardives touchent 10 % de la population de plus de 85 ans et seulement 0,1 % des 55-59 ans.3
Une prédisposition génétique est suspectée depuis plusieurs décennies. Récemment, deux polymorphismes ont émergé : ceux du facteur H du complément et du gène ARMS2 (Age-Related Maculopathy Susceptibility 2). D’autres gènes codant pour des protéines du complément (C2, C3, facteur B) ont été mis en cause, mais l’association est plus faible.
Chez les tabagiques, un surrisque de 2 ou plus a été mis en évidence dans de nombreuses études ; il est probablement secondaire à une augmentation du stress oxydant au niveau de la rétine.
De nombreux autres facteurs ont été incriminés, mais leur association pathologique est moindre et diverge en fonction des études : hypertension artérielle, dyslipidémie, athérosclérose, exposition au soleil, iris clair, obésité.
Évolution future de la prévalence
Une augmentation est prévisible, consécutive au vieillissement de la population. D’après certaines estimations, le nombre de cas doit doubler d’ici 30 ans, pour atteindre 1 million en France.4 Cependant, un article de décembre 2017 portant sur le suivi de la cohorte Beaver Dam (Wisconsin, États-Unis) laisse espérer un ralentissement de l’incidence (– 60 % entre la génération X et les baby boomers) à chaque nouvelle génération.5 L’explication en serait les progrès de l’hygiène, surtout alimentaire, qui retarderaient, avec une meilleure prise en charge, le vieillissement maculaire.
Plusieurs formes
Sénescence « physiologique »et pathologique
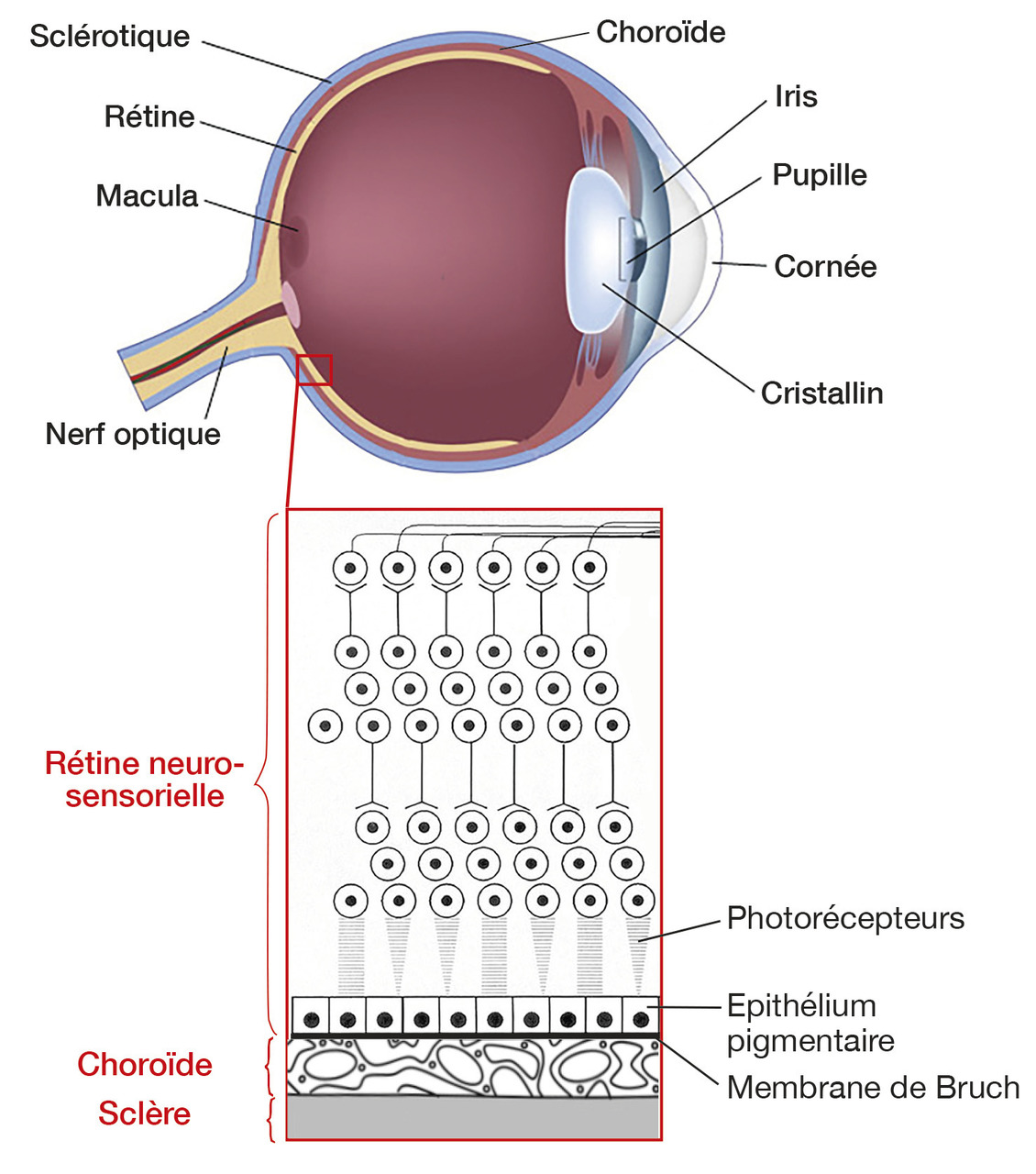
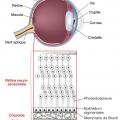
Le vieillissement rétinien se manifeste par un épaississement et des dépôts au niveau de la membrane de Bruch, située entre l’épithélium pigmentaire et la zone choriocapillaire (fig. 1 ). Ils précèdent l’apparition de drusen, résidus de la phagocytose des photorécepteurs par les cellules de l’épithélium pigmentaire, caractéristiques de la DMLA.
Cependant, la limite entre physiologique et pathologique reste floue. Historiquement, les drusen miliaires de petite taille (< 63 mm) sont une composante du vieillissement rétinien, contrairement aux drusen séreux (> 63 mm) signant la DMLA précoce. Des études récentes montrent néanmoins une évolution des premiers vers les seconds. Les drusen miliaires pourraient donc être considérés à l’avenir comme marqueur précoce de la MLA.
Cependant, la limite entre physiologique et pathologique reste floue. Historiquement, les drusen miliaires de petite taille (< 63 mm) sont une composante du vieillissement rétinien, contrairement aux drusen séreux (> 63 mm) signant la DMLA précoce. Des études récentes montrent néanmoins une évolution des premiers vers les seconds. Les drusen miliaires pourraient donc être considérés à l’avenir comme marqueur précoce de la MLA.
Classification
La plus répandue différencie la forme précoce de la maladie (caractérisée par des drusen et une fonction visuelle conservée) de l’entité tardive : atrophique ou exsudative, toujours avec une baisse de vision (tableau ).
Maculopathie liée à l’âge. Elle précède la DMLA proprement dite. Les patients sont dans la majorité des cas asymptomatiques. Le diagnostic est fait par l’ophtalmologiste à l’examen du fond d’œil, qui met en évidence des drusen et des migrations pigmentaires (cf. infra).
Les formes tardives sont des complications évolutives de la MLA. L’atrophie et des néovaisseaux sont alors associés aux drusen et migrations pigmentaires.
Dans la DMLA atrophique, la mort des cellules de l’épithélium pigmentaire rétinien et des photorécepteurs sus-jacents se traduit par des scotomes (zones de mauvaise vision) et une baisse progressive d’acuité visuelle.
La DMLA exsudative est définie par des néovaisseaux choroïdiens déployés sous l’épithélium pigmentaire (plus rarement entre celui-ci et la rétine). Leur paroi perméable est responsable d’une fuite du contenu plasmatique, dont la conséquence est une chute rapide de l’acuité visuelle.
Maculopathie liée à l’âge. Elle précède la DMLA proprement dite. Les patients sont dans la majorité des cas asymptomatiques. Le diagnostic est fait par l’ophtalmologiste à l’examen du fond d’œil, qui met en évidence des drusen et des migrations pigmentaires (cf. infra).
Les formes tardives sont des complications évolutives de la MLA. L’atrophie et des néovaisseaux sont alors associés aux drusen et migrations pigmentaires.
Dans la DMLA atrophique, la mort des cellules de l’épithélium pigmentaire rétinien et des photorécepteurs sus-jacents se traduit par des scotomes (zones de mauvaise vision) et une baisse progressive d’acuité visuelle.
La DMLA exsudative est définie par des néovaisseaux choroïdiens déployés sous l’épithélium pigmentaire (plus rarement entre celui-ci et la rétine). Leur paroi perméable est responsable d’une fuite du contenu plasmatique, dont la conséquence est une chute rapide de l’acuité visuelle.
Atteinte bilatérale obligatoire ?
La maladie est habituellement bilatérale, mais parfois asymétrique. Un œil peut être atteint par une complication tardive alors que l’autre souffre seulement de lésions précoces. Le risque d’aggravation de cet œil est alors estimé à 50 % à 5 ans.
Dépistage
Il est justifié par l’existence d’un traitement efficace de la forme exsudative surtout s’il est débuté tôt, idéalement dans la semaine qui suit la survenue de néovaisseaux. Il est organisé à plusieurs niveaux.
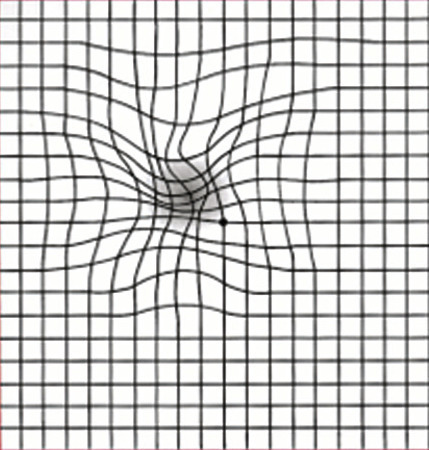
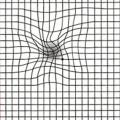
Dans la population générale, des campagnes visent à informer sur la maladie, les facteurs de risque, les signes fonctionnels et la nécessité de consulter en urgence en cas d’alerte : métamorphopsies (déformation des objets observés, comme l’ondulation des lignes droites au test d’Amsler ;fig. 2 ), scotomes, baisse d’acuité visuelle de près.
La consultation ophtalmologique régulière est conseillée à toutes les personnes de plus de 50 ans, pour qu’elles puissent bénéficier d’un fond d’œil, et d’autant plus fréquemment qu’il existe des risques (antécédents familiaux, tabac).
Pour les patients atteints de MLA, les recommandations sont de consulter leur ophtalmologiste tous les 6 mois (pour fond d’œil et OCT, Optical Coherence Tomography – cf. infra).
L’autosurveillance est fortement conseillée, avec la grille d’Amsler testée en vision monoculaire. Une consultation en urgence (dans les 7 jours) s’impose en cas d’aggravation des métamorphopsies, de scotomes centraux ou de baisse d’acuité visuelle de près.
Dans la population générale, des campagnes visent à informer sur la maladie, les facteurs de risque, les signes fonctionnels et la nécessité de consulter en urgence en cas d’alerte : métamorphopsies (déformation des objets observés, comme l’ondulation des lignes droites au test d’Amsler ;
La consultation ophtalmologique régulière est conseillée à toutes les personnes de plus de 50 ans, pour qu’elles puissent bénéficier d’un fond d’œil, et d’autant plus fréquemment qu’il existe des risques (antécédents familiaux, tabac).
Pour les patients atteints de MLA, les recommandations sont de consulter leur ophtalmologiste tous les 6 mois (pour fond d’œil et OCT, Optical Coherence Tomography – cf. infra).
L’autosurveillance est fortement conseillée, avec la grille d’Amsler testée en vision monoculaire. Une consultation en urgence (dans les 7 jours) s’impose en cas d’aggravation des métamorphopsies, de scotomes centraux ou de baisse d’acuité visuelle de près.
Diagnostic
Signes fonctionnels
Les patients atteints de MLA étant asymptomatiques dans la majorité des cas, leur apparition témoigne d’une maladie évoluée :
– baisse d’acuité visuelle de près, uni- ou bilatérale, entraînant des difficultés de lecture ;
– métamorphopsies : ondulation des lignes ou des images ;
– un ou plusieurs scotomes : zone du champ visuel floue plus ou moins opaque, tache sombre perçue par le patient ;
– autres signes plus discrets : diminution de la sensibilité aux contrastes, anomalie de la vision des couleurs, sensation d’éblouissement.
Leur survenue chez un sujet de plus de 50 ans doit alerter le médecin traitant et conduire à un examen ophtalmologique dans la semaine.
– baisse d’acuité visuelle de près, uni- ou bilatérale, entraînant des difficultés de lecture ;
– métamorphopsies : ondulation des lignes ou des images ;
– un ou plusieurs scotomes : zone du champ visuel floue plus ou moins opaque, tache sombre perçue par le patient ;
– autres signes plus discrets : diminution de la sensibilité aux contrastes, anomalie de la vision des couleurs, sensation d’éblouissement.
Leur survenue chez un sujet de plus de 50 ans doit alerter le médecin traitant et conduire à un examen ophtalmologique dans la semaine.
Bilan spécialisé
L’acuité visuelle est mesurée de loin et de près en monoculaire puis binoculaire, après correction d’une anomalie de la réfraction.
La grille d’Amsler met en évidence les scotomes et les métamorphopsies. Elle est toujours utilisée en monoculaire. Une grille peut être remise au patient pour une autoévaluation.
Le fond d’œil après dilatation pupillaire permet la recherche des signes suivants.
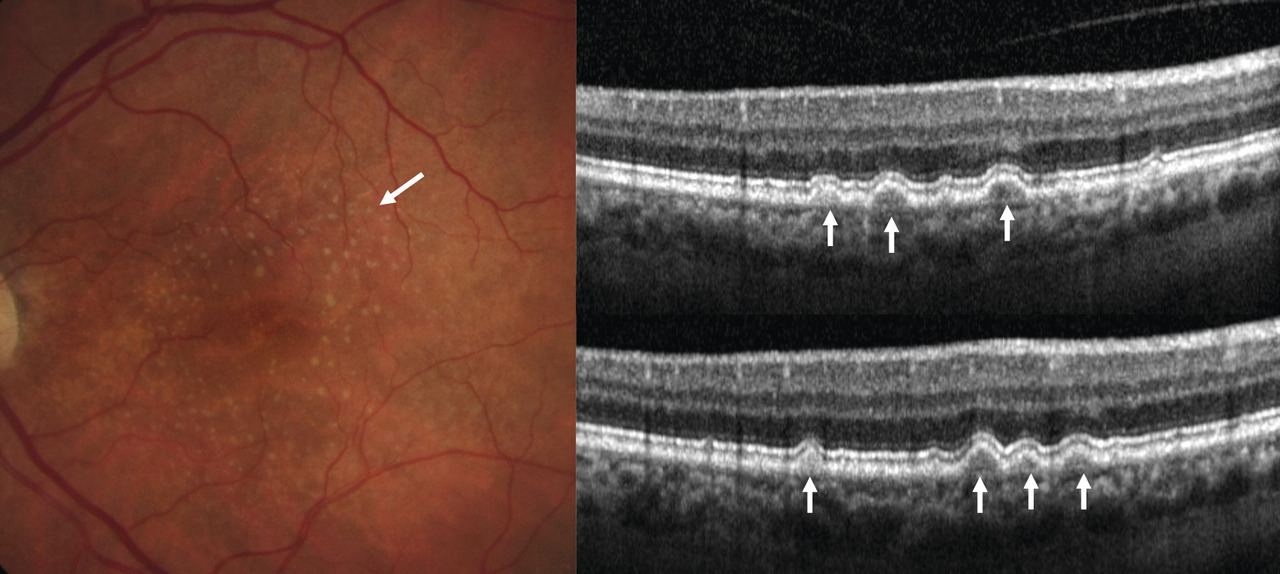
Certains témoignent de la maculopathie liée à l’âge (fig. 3 ) :
– drusen : dépôts jaunâtres sous l’épithélium pigmentaires, de taille variable, parfois coalescents ;
– migrations pigmentaires : taches brunes, ponctiformes, de contour irrégulier. Dues à la mort des cellules de l’épithélium pigmentaire, elles précèdent le plus souvent une DMLA atrophique.
Dans les formes tardives compliquant les lésions précoces, l’atrophie ou les néovaisseaux s’associent alors aux drusen et aux migrations pigmentaires pour aboutir aux 2 entités pathologiques :
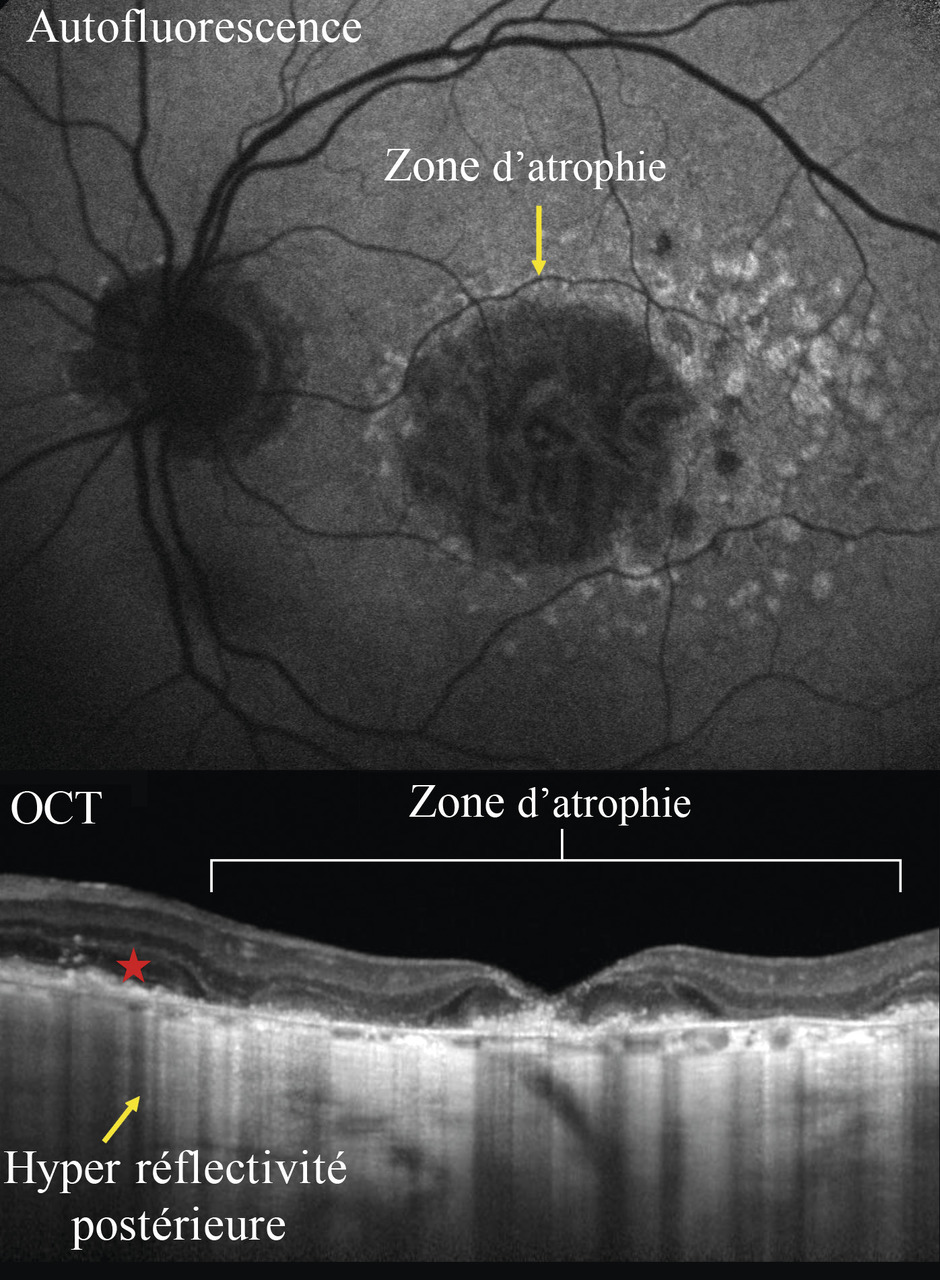
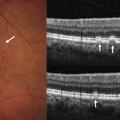
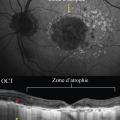
– DMLA atrophique (fig. 4 ) : zone de rétine plus claire et visualisation anormale des vaisseaux choroïdiens. Des néovaisseaux peuvent se développer aux bords de l’atrophie ;
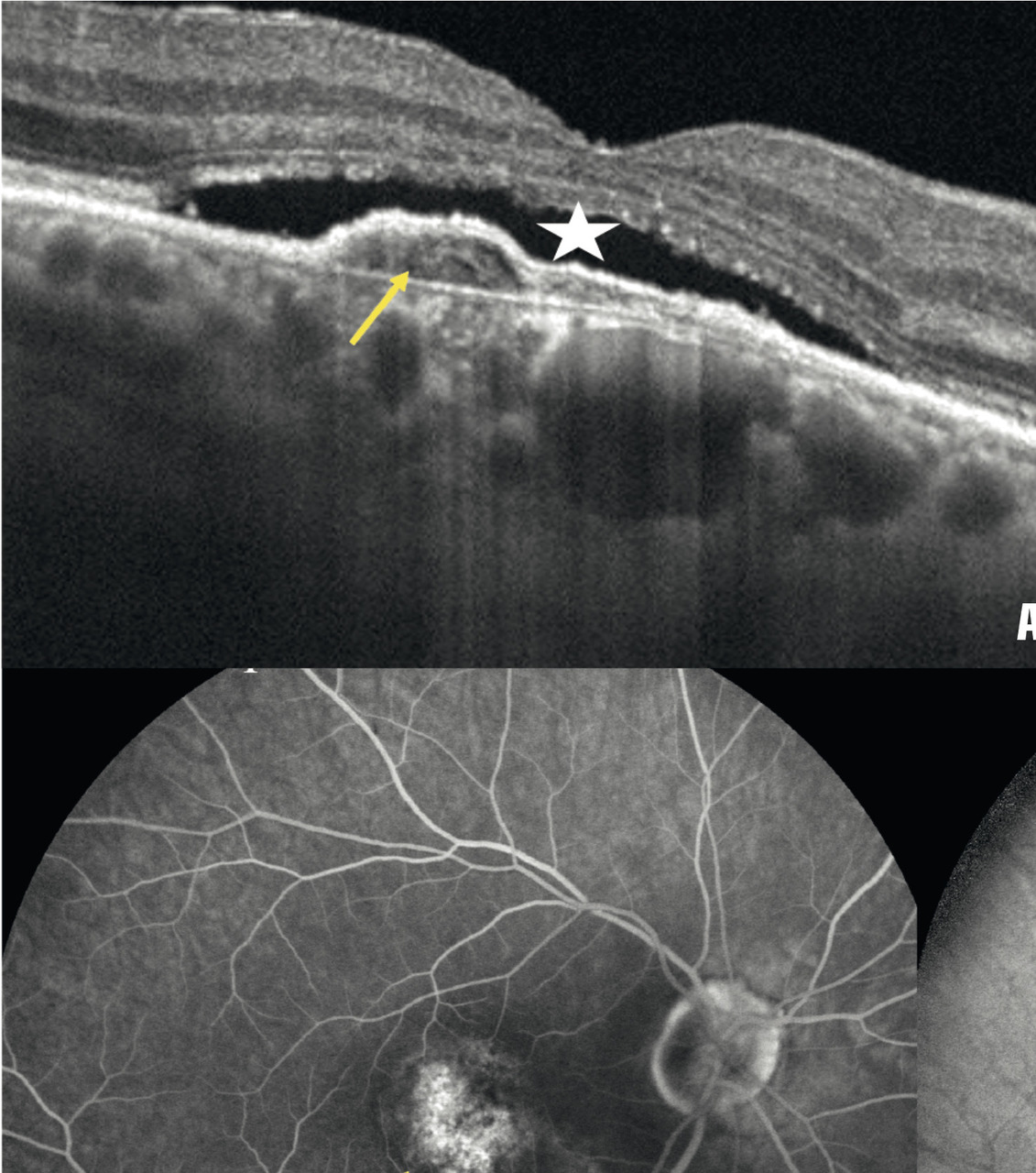
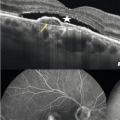
– DMLA exsudative (fig. 5 ) : hémorragies rétiniennes, exsudats (lésions jaunâtres correspondant à des dépôts lipidiques), liquide sous- rétinien (décollement séreux rétinien – DSR) ou intrarétinien.
La grille d’Amsler met en évidence les scotomes et les métamorphopsies. Elle est toujours utilisée en monoculaire. Une grille peut être remise au patient pour une autoévaluation.
Le fond d’œil après dilatation pupillaire permet la recherche des signes suivants.
Certains témoignent de la maculopathie liée à l’âge (
– drusen : dépôts jaunâtres sous l’épithélium pigmentaires, de taille variable, parfois coalescents ;
– migrations pigmentaires : taches brunes, ponctiformes, de contour irrégulier. Dues à la mort des cellules de l’épithélium pigmentaire, elles précèdent le plus souvent une DMLA atrophique.
Dans les formes tardives compliquant les lésions précoces, l’atrophie ou les néovaisseaux s’associent alors aux drusen et aux migrations pigmentaires pour aboutir aux 2 entités pathologiques :
– DMLA atrophique (
– DMLA exsudative (
OCT (Optical Coherence Tomography)
L’avènement de l’OCT dans les années 2000, l’accroissement progressif de la résolution et de la vitesse d’acquisition ont considérablement amélioré le diagnostic et le suivi des patients. Cet examen non invasif analyse la réflectivité des structures anatomiques ; il est couplé à l’interférométrie (mesure par les modifications de réflexion des ondes lumineuses sur des éléments anatomiques) pour donner des images de définition quasi histologique. Leur obtention en quelques secondes offre une résolution de 5 à 10 mm. Cet examen est utile dans toutes les formes de la maladie.
Dans la DMLA précoce, on visualise les drusen (lésions hyperréflectives sous l’épithélium pigmentaire). La rétine en regard est d’épaisseur normale, il n’y a pas de signes exsudatifs (DSR, œdème maculaire) [fig. 3 ].
Dans la DMLA atrophique, l’amincissement de l’épithélium pigmentaire et la perte des photo-récepteurs augmentent la réflectivité postérieure des zones touchées (fig. 4 ).
Dans la DMLA exsudative, les néovaisseaux sont visibles comme des lésions fusiformes hyper- réflectives, ainsi que leur activité : décollement séreux rétinien et logettes d’œdème intrarétiniennes (fig. 5 ).
Dans la DMLA précoce, on visualise les drusen (lésions hyperréflectives sous l’épithélium pigmentaire). La rétine en regard est d’épaisseur normale, il n’y a pas de signes exsudatifs (DSR, œdème maculaire) [
Dans la DMLA atrophique, l’amincissement de l’épithélium pigmentaire et la perte des photo-récepteurs augmentent la réflectivité postérieure des zones touchées (
Dans la DMLA exsudative, les néovaisseaux sont visibles comme des lésions fusiformes hyper- réflectives, ainsi que leur activité : décollement séreux rétinien et logettes d’œdème intrarétiniennes (
OCT-angiographie (angio-OCT)
Commercialisé en 2015, cet examen prend une place grandissante. L’appareil utilise une technique dérivée de l’OCT qui mesure la vitesse des hématies et donne des images non invasives du flux vasculaire. Il est particulièrement intéressant dans la forme exsudative, en montrant les néovaisseaux choroïdiens sans nécessiter l’injection de produits de contraste (fig. 5 ). L’association à l’OCT classique permet de visualiser leur activité (DSR, œdème). à l’avenir, il est possible que l’angio-OCT se substitue à l’angiographie à la fluorescéine pour le diagnostic de DMLA exsudative.
Angiographie à la fluorescéine et au vert d’indocyanine
Historiquement, l’angiographie à la fluorescéine est le gold standard du diagnostic et du suivi des DMLA exsudatives. Des photos du fond d’œil sont réalisées après injection d’un colorant fluorescent par voie intraveineuse. Il révèle les vaisseaux rétiniens et les signes indirects de perméabilité des néovaisseaux choroïdiens. On peut lui associer le vert d’indocyanine en cas de doute diagnostique ou de forme particulière de DMLA (fig. 5 ). Toutefois, des réactions d’hypersensibilité ont été rapportées avec la fluorescéine : chocs anaphylactiques qui ont parfois conduit au décès des patients. Ce risque impose un interrogatoire précis et une éventuelle prémédication anti-allergique. L’intérêt de l’examen est donc de plus en plus discuté. L’angio-OCT, indiqué en 2e intention en cas de doute diagnostique, pourrait le détrôner.
Images du fond d’œil
Les photographies en couleur sont utiles dans toutes les formes de la maladie, elles documentent les lésions et facilitent la surveillance (fig. 3 ).
Les clichés en autofluorescence permettent d’évaluer l’état de l’épithélium pigmentaire, grâce à la qualité de la distribution in situ d’un fluorophore (la lipofuscine). Ils sont particulièrement utiles dans la DMLA atrophique, car les zones touchées sont bien visibles en noir (mort des cellules épithéliales). On en suit aisément l’extension en comparant les images (fig. 4 ).
Les clichés en autofluorescence permettent d’évaluer l’état de l’épithélium pigmentaire, grâce à la qualité de la distribution in situ d’un fluorophore (la lipofuscine). Ils sont particulièrement utiles dans la DMLA atrophique, car les zones touchées sont bien visibles en noir (mort des cellules épithéliales). On en suit aisément l’extension en comparant les images (
Prise en charge
Supplémentation vitaminique ou pas ?
Même si la physiopathologie n’est pas totalement élucidée, de nombreuses études impliquent le stress oxydant dans la genèse des lésions. Toutefois, la supplémentation en anti-oxydants est vivement débattue depuis la publication, dans les années 2000, d’une grande étude prospective appelée AREDS (Age Related Eye Disease Study).
Réalisée aux États-Unis auprès de 3 557 personnes suivies pendant 6 ans, elle montre un ralentissement de 25 % de la progression de la maladie précoce vers la forme tardive, chez les patients supplémentés en bêtacarotène, vitamine C, E et zinc.6 Néanmoins, elle soulève de nombreuses critiques, relatives par exemple aux doses utilisées : 3 à 10 fois supérieures aux apports journaliers recommandés, donc potentiellement responsables d’effets secondaires. Ses résultats sont par ailleurs difficilement transposables à la France compte tenu des habitudes alimentaires très différentes entre les 2 pays. La formulation utilisée dans AREDS n’est d’ailleurs pas commercialisée dans notre pays.
Dans un second essai avec la même cohorte (AREDS 2), l’adjonction d’acides gras oméga 3 et/ou de lutéine et zéaxanthine (pigments maculaires) n’a pas freiné l’évolution maculaire. Ces résultats ont été contredits par d’autres études françaises (ALIENOR, POLA ET NAT2) qui montrent une diminution du risque avec ces deux types de suppléments.7
Réalisée aux États-Unis auprès de 3 557 personnes suivies pendant 6 ans, elle montre un ralentissement de 25 % de la progression de la maladie précoce vers la forme tardive, chez les patients supplémentés en bêtacarotène, vitamine C, E et zinc.6 Néanmoins, elle soulève de nombreuses critiques, relatives par exemple aux doses utilisées : 3 à 10 fois supérieures aux apports journaliers recommandés, donc potentiellement responsables d’effets secondaires. Ses résultats sont par ailleurs difficilement transposables à la France compte tenu des habitudes alimentaires très différentes entre les 2 pays. La formulation utilisée dans AREDS n’est d’ailleurs pas commercialisée dans notre pays.
Dans un second essai avec la même cohorte (AREDS 2), l’adjonction d’acides gras oméga 3 et/ou de lutéine et zéaxanthine (pigments maculaires) n’a pas freiné l’évolution maculaire. Ces résultats ont été contredits par d’autres études françaises (ALIENOR, POLA ET NAT2) qui montrent une diminution du risque avec ces deux types de suppléments.7
Règles hygiénodiététiques
L’arrêt du tabac est impératif, car c’est le troisième facteur de risque de la maladie.
Les conseils diététiques prônent la variété, avec beaucoup de fruits, de légumes et de poissons. à compléter avec des aliments riches en lutéine/zéaxanthine (chou vert, épinards, petits pois, brocolis, courge, maïs, œuf).
La supplémentation vitaminique (Nutrof Total, Preservision 3, Suveal Duo, Macula Z…) est préconisée par de nombreux ophtalmologistes. Il est important d’en informer les patients, sans la surestimer et en insistant sur son coût, non remboursé par la Sécurité sociale. En effet, il n’y a pas de preuves scientifiques formelles de son efficacité, même s’il existe un faisceau d’arguments laissant supposer qu’elle ralentit la maladie.
Les conseils diététiques prônent la variété, avec beaucoup de fruits, de légumes et de poissons. à compléter avec des aliments riches en lutéine/zéaxanthine (chou vert, épinards, petits pois, brocolis, courge, maïs, œuf).
La supplémentation vitaminique (Nutrof Total, Preservision 3, Suveal Duo, Macula Z…) est préconisée par de nombreux ophtalmologistes. Il est important d’en informer les patients, sans la surestimer et en insistant sur son coût, non remboursé par la Sécurité sociale. En effet, il n’y a pas de preuves scientifiques formelles de son efficacité, même s’il existe un faisceau d’arguments laissant supposer qu’elle ralentit la maladie.
Quelles indications du laser ?
Depuis l’avènement des anti-VEGF, la photocoagulation au laser des néovaisseaux est considérée comme obsolète. Au début des années 2000, la photothérapie dynamique (PDT) à la Visudyne était le traitement de choix. Actuellement, elle est réservée à certaines formes de DMLA (vasculopathie polypoïdale) ou au refus des injections intravitréennes par le patient.
Traitement médicamenteux
Il n’existe que pour la DMLA exsudative et repose presque exclusivement sur les injections intravitréennes d’anti-VEGF. On dispose de deux molécules : ranibizumab (Lucentis) et, plus récemment, aflibercept (Eylea). Leur efficacité a été démontrée par de grandes études randomisées et contrôlées. Elle est comparable.
À noter que le bévacizumab (Avastin), anticorps monoclonal anti-VEGF, est disponible depuis 2015 en RTU mais peu utilisé en raison de sa préparation et de sa prescription complexes.
Il n’y a actuellement aucun consensus sur le schéma thérapeutique à long terme et le rythme d’injection. En pratique, une phase d’induction est nécessaire : 1 injection intravitréenne (IVT) par mois pendant 3 mois, puis le rythme est laissé à l’appréciation de l’ophtalmologiste qui prendra en compte l’acuité visuelle et l’examen OCT. Il existe 2 protocoles principaux :
– PRN (pro re nata) : les patients sont examinés tous les mois et l’IVT n’est faite qu’en présence de signes exsudatifs à l’OCT. L’efficacité de ce schéma est démontrée, mais il impose un suivi mensuel, contraignant pour des sujets âgés ;
– inject and extend : 6 semaines après la phase d’induction, le patient est injecté. En l’absence de liquide, le suivi est espacé à 8 semaines. Dans le cas contraire, il est raccourci à 4 semaines. Ce protocole permet d’espacer les consultations chez les bons répondeurs, mais il implique des IVT systématiques chez des patients indemnes de signes exsudatifs.
Résultats : un tiers des patients ont un gain de 3 lignes d’acuité visuelle à 1 an dans les études pivots. Selon un essai récent, la vision est stable à 5 ans.
Comment réaliser une injection intravitréenne ? Le protocole est encadré par les bonnes pratiques professionnelles (HAS). Dans une salle dédiée, parfois au bloc opératoire, le traitement est administré après une double désinfection (cutanée et des culs-de-sac conjonctivaux) sous anesthésie topique (collyre). L’antibioprophylaxie locale n’est plus recommandée.
Les complications fréquentes sont :
– kératite ponctuée superficielle secondaire à l’instillation de Bétadine, provoquant une sensation de corps étranger intraoculaire. Le traitement par larmes artificielles est suffisant ;
– hémorragie sous-conjonctivale (au point de ponction) se résorbant en quelques jours ;
– corps flottant ;
– augmentation transitoire de la tension oculaire.
Les complications graves sont exceptionnelles (moins de 1 % des cas) : endophtalmie (infection de l’œil), décollement de rétine, hémorragie intravitréenne. Les patients sont informés de la nécessité de consulter en urgence en cas de baisse de la vision et de douleurs oculaires importantes.
À noter que le bévacizumab (Avastin), anticorps monoclonal anti-VEGF, est disponible depuis 2015 en RTU mais peu utilisé en raison de sa préparation et de sa prescription complexes.
Il n’y a actuellement aucun consensus sur le schéma thérapeutique à long terme et le rythme d’injection. En pratique, une phase d’induction est nécessaire : 1 injection intravitréenne (IVT) par mois pendant 3 mois, puis le rythme est laissé à l’appréciation de l’ophtalmologiste qui prendra en compte l’acuité visuelle et l’examen OCT. Il existe 2 protocoles principaux :
– PRN (pro re nata) : les patients sont examinés tous les mois et l’IVT n’est faite qu’en présence de signes exsudatifs à l’OCT. L’efficacité de ce schéma est démontrée, mais il impose un suivi mensuel, contraignant pour des sujets âgés ;
– inject and extend : 6 semaines après la phase d’induction, le patient est injecté. En l’absence de liquide, le suivi est espacé à 8 semaines. Dans le cas contraire, il est raccourci à 4 semaines. Ce protocole permet d’espacer les consultations chez les bons répondeurs, mais il implique des IVT systématiques chez des patients indemnes de signes exsudatifs.
Résultats : un tiers des patients ont un gain de 3 lignes d’acuité visuelle à 1 an dans les études pivots. Selon un essai récent, la vision est stable à 5 ans.
Comment réaliser une injection intravitréenne ? Le protocole est encadré par les bonnes pratiques professionnelles (HAS). Dans une salle dédiée, parfois au bloc opératoire, le traitement est administré après une double désinfection (cutanée et des culs-de-sac conjonctivaux) sous anesthésie topique (collyre). L’antibioprophylaxie locale n’est plus recommandée.
Les complications fréquentes sont :
– kératite ponctuée superficielle secondaire à l’instillation de Bétadine, provoquant une sensation de corps étranger intraoculaire. Le traitement par larmes artificielles est suffisant ;
– hémorragie sous-conjonctivale (au point de ponction) se résorbant en quelques jours ;
– corps flottant ;
– augmentation transitoire de la tension oculaire.
Les complications graves sont exceptionnelles (moins de 1 % des cas) : endophtalmie (infection de l’œil), décollement de rétine, hémorragie intravitréenne. Les patients sont informés de la nécessité de consulter en urgence en cas de baisse de la vision et de douleurs oculaires importantes.
Perspectives et suivi
Contre la DMLA exsudative, la combinaison anti-VEGF/anti-PDGF (Fovista) a montré en phase 2 sa supériorité sur l’anti-VEGF administré seul (espacement des IVT) Cependant, les essais de phase 3 ne retrouvent pas ce résultat.
Contre la DMLA atrophique, un anti-facteur D du complément en IVT (lampalizumab) a permis (phase 2) une baisse de 20 % de l’atrophie à 18 mois.8 Bénéfice non confirmé par les premières données de la phase 3.
Pour la DMLA précoce et atrophique, le suivi est biannuel par l’ophtalmologiste : acuité visuelle, fond d’œil, photos, autofluorescence et OCT ; mais aussi hebdomadaire par autosurveillance. Celle-ci comporte en particulier la détection des métamorphopsies en vision monoculaire : grille d’Amsler, mots croisés, observation d’un carrelage…
Dans la DMLA exsudative, la surveillance dépend du protocole adopté par l’ophtalmologiste : mensuelle, bimensuelle ou trimensuelle.
Contre la DMLA atrophique, un anti-facteur D du complément en IVT (lampalizumab) a permis (phase 2) une baisse de 20 % de l’atrophie à 18 mois.8 Bénéfice non confirmé par les premières données de la phase 3.
Pour la DMLA précoce et atrophique, le suivi est biannuel par l’ophtalmologiste : acuité visuelle, fond d’œil, photos, autofluorescence et OCT ; mais aussi hebdomadaire par autosurveillance. Celle-ci comporte en particulier la détection des métamorphopsies en vision monoculaire : grille d’Amsler, mots croisés, observation d’un carrelage…
Dans la DMLA exsudative, la surveillance dépend du protocole adopté par l’ophtalmologiste : mensuelle, bimensuelle ou trimensuelle.
Rééducation « basse vision »
La DMLA ne rend pas aveugle puisque la vision périphérique est conservée, mais elle entraîne une malvoyance, irréversible dans les formes évoluées.
La rééducation visuelle fait appel à diverses techniques utilisant la vision résiduelle. Elle apprend à se servir de la rétine périphérique pour les activités quotidiennes.
Fondée sur des exercices correspondant aux centres d’intérêt du patient, elle décale le point de fixation en périphérie, en dehors du scotome.
La rééducation visuelle fait appel à diverses techniques utilisant la vision résiduelle. Elle apprend à se servir de la rétine périphérique pour les activités quotidiennes.
Fondée sur des exercices correspondant aux centres d’intérêt du patient, elle décale le point de fixation en périphérie, en dehors du scotome.
Outils de réadaptation
La prise en charge doit être multidisciplinaire, par la collaboration étroite des « 3 O » : ophtalmologiste, opticien et orthoptiste. D’autres professionnels peuvent être sollicités : ergothérapeute et psychologue. Les intervenants travaillent en contact avec le médecin généraliste et les services sociaux si besoin (MDPH, assistante sociale).
Bilan orthoptique initial. L’orthoptiste évalue la situation visuelle sous ses aspects moteurs, sensoriels et cognitifs. En fonction de l’atteinte ophtalmologique, de ses répercussions quotidiennes et des besoins du patient, il établit un plan de rééducation, plus exactement de réadaptation.
Principes de la réadaptation :
– transfert du « point de fixation » dans une zone de rétine saine, ce que l’on appelle « excentrer » ;
– travail de poursuite oculaire et exercices de saccades pour apprendre à fixer un objet en mouvement ;
– encadrement de l’utilisation des corrections optiques (cf. infra).
Les aides visuelles sont des systèmes grossissants : surcorrections de verre de lunettes, loupes ; télé-agrandisseurs ou vidéoloupes et des aides non optiques : pupitres, éclairage adapté.
Bilan orthoptique initial. L’orthoptiste évalue la situation visuelle sous ses aspects moteurs, sensoriels et cognitifs. En fonction de l’atteinte ophtalmologique, de ses répercussions quotidiennes et des besoins du patient, il établit un plan de rééducation, plus exactement de réadaptation.
Principes de la réadaptation :
– transfert du « point de fixation » dans une zone de rétine saine, ce que l’on appelle « excentrer » ;
– travail de poursuite oculaire et exercices de saccades pour apprendre à fixer un objet en mouvement ;
– encadrement de l’utilisation des corrections optiques (cf. infra).
Les aides visuelles sont des systèmes grossissants : surcorrections de verre de lunettes, loupes ; télé-agrandisseurs ou vidéoloupes et des aides non optiques : pupitres, éclairage adapté.
Bénéfices attendus
Le but de la rééducation est d’accroître les capacités de lecture et d’écriture afin que les patients poursuivent leurs activités, autonomes, dans les meilleures conditions. Elle est proposée aux stades non évolués de DMLA exsudative et dans la DMLA atrophique pure.
Références
1. HAS. Dégénérescence maculaire liée à l’âge : prise en charge diagnostique et thérapeutique. Juin 2012.
2. Augood CA, Vingerling JR, de Jong PT, et al. Prevalence of age-related maculopathy in older Europeans: the European Eye Study (EUREYE). Arch Ophthalmol 2006; 124:529-35.
3. Colijn JM, Buitendijk GHS, Prokofyeva E, et al. Prevalence of Age-Related Macular Degeneration in Europe: The Past and the Future. Ophthalmology 2017;124:1753-63.
4. Soubrane G, Coscas G, Souied E. Les DMLAs. Rapport de la Société française d’ophtalmologie (SFO). Paris: Elsevier Masson; 2007.
5. Cruickshanks KJ, Nondahl DM, Johnson LJ, et al. Generational Differences in the 5-year incidence of Age Related Macular Degeneration. JAMA ophthalmol 2017; 135:1417-23.
6. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol 2001;119:1417-36.
7. Souied EH, Delcourt C, Querques G, et al. Oral docosahexaenoic acid in the prevention of exudative age-related macular degeneration: the Nutritional AMD Treatment 2 study. Ophthalmology 2013;120:1619-31.
8. Yaspan BL, Williams DF, Holz F, et al. Targeting factor D of the alternative complement pathway reduces geographic atrophy progression secondary to age-related macular degeneration. Sci Transl Med 2017;9: eaaf1443.
2. Augood CA, Vingerling JR, de Jong PT, et al. Prevalence of age-related maculopathy in older Europeans: the European Eye Study (EUREYE). Arch Ophthalmol 2006; 124:529-35.
3. Colijn JM, Buitendijk GHS, Prokofyeva E, et al. Prevalence of Age-Related Macular Degeneration in Europe: The Past and the Future. Ophthalmology 2017;124:1753-63.
4. Soubrane G, Coscas G, Souied E. Les DMLAs. Rapport de la Société française d’ophtalmologie (SFO). Paris: Elsevier Masson; 2007.
5. Cruickshanks KJ, Nondahl DM, Johnson LJ, et al. Generational Differences in the 5-year incidence of Age Related Macular Degeneration. JAMA ophthalmol 2017; 135:1417-23.
6. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol 2001;119:1417-36.
7. Souied EH, Delcourt C, Querques G, et al. Oral docosahexaenoic acid in the prevention of exudative age-related macular degeneration: the Nutritional AMD Treatment 2 study. Ophthalmology 2013;120:1619-31.
8. Yaspan BL, Williams DF, Holz F, et al. Targeting factor D of the alternative complement pathway reduces geographic atrophy progression secondary to age-related macular degeneration. Sci Transl Med 2017;9: eaaf1443.