La dégénérescence maculaire liée à l’âge (DMLA) est la troisième cause de cécité dans le monde et la première cause de baisse d’acuité visuelle sévère après 50 ans dans les pays développés. Sa prévalence augmente avec l’âge : les formes sévères touchent moins de 1 % des patients de plus de 55 ans et plus de 10 % des patients de plus de 85 ans, toujours dans les pays développés.1 Le vieillissement actuel de la population s’associe donc à une incidence croissante de cette pathologie.
Classification de la DMLA
On décrit classiquement quatre catégories de DMLA : la maculopathie liée à l’âge (MLA), la DMLA atrophique et la DMLA exsudative (tableau) ; une quatrième catégorie, la catégorie 1, est décrite pour les stades les plus précoces de MLA. Elle correspond au stade où l’on ne trouve aucun drusen ou seulement quelques petits drusen de diamètre inférieur à 63 µm.
Maculopathie liée à l’âge (MLA)
Il s’agit du stade précoce de la DMLA. Le diagnostic clinique de MLA est fait à l’examen du fond d’œil : on observe de petites taches jaunâtres – les « drusen » – et des zones pigmentées qui correspondent à des altérations de l’épithélium pigmentaire (AEP).
La MLA est asymptomatique, et les lésions sont souvent découvertes fortuitement lors d’un examen systématique.
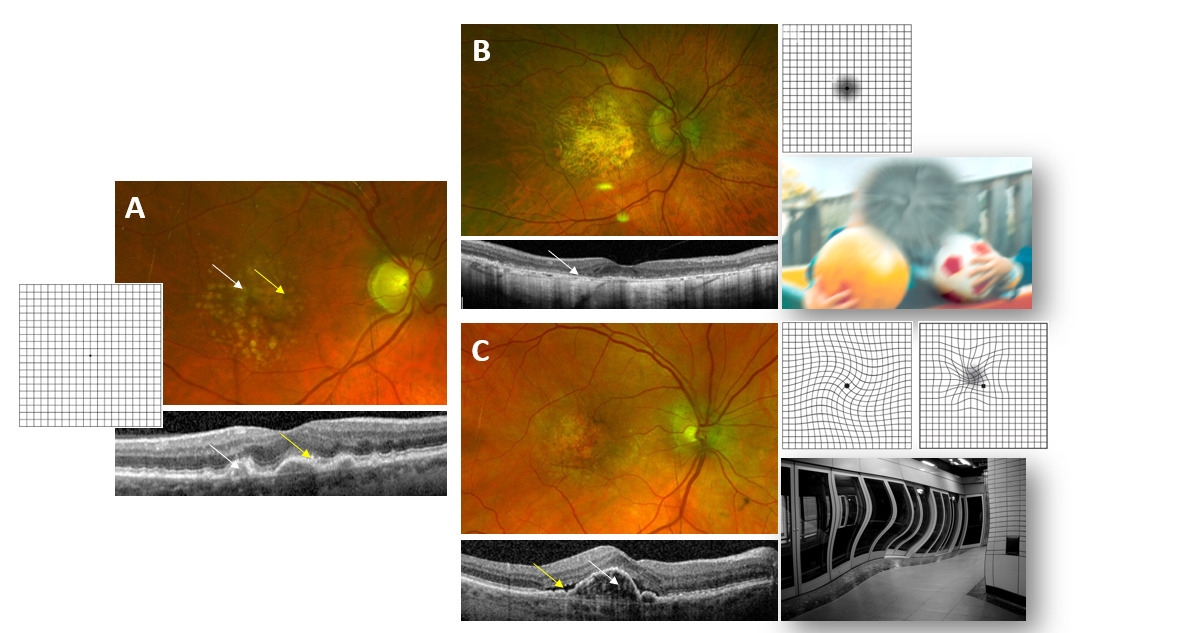
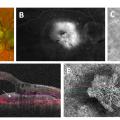
Certains examens permettent d’explorer la MLA. La tomographie par cohérence optique (optical coherence tomography [OCT]) montre que les drusen correspondent à des surélévations localisées de l’épithélium pigmentaire rétinien (EPR) dont le contenu est essentiellement cellulaire et lipidique. Les AEP sont liées à une désorganisation de la couche de l’EPR et jouent un rôle majeur dans le cycle visuel et le renouvellement des segments externes des photorécepteurs (fig. 1A). La présence d’AEP, la taille des drusen (> 125 µm) et l’atteinte bilatérale sont des facteurs de risque d’évolution vers une forme avancée de DMLA.
Au stade de MLA, une autosurveillance (apparition d’un scotome ou de métamorphopsies sur la grille d’Amsler), des règles hygiéno-diététiques et des compléments alimentaires peuvent être proposés (tableau).
DMLA atrophique
La DMLA atrophique correspond à la disparition progressive de l’EPR. Cette disparition est associée à une perte des photorécepteurs, voire de la choriocapillaire – réseau vasculaire nourricier de la rétine et de l’EPR –, notamment. L’atteinte est généralement bilatérale et symétrique. Initialement limitées à l’aire périfovéolaire, les zones d’atrophie s’étendent progressivement.
À ce stade, des scotomes paracentraux peuvent apparaître et empêchent les mouvements de saccade nécessaires à la lecture, entraînant une plainte. Lorsque l’atteinte devient centrale, la baisse de vision est plus marquée (fig. 1B), parfois associée à des métamorphopsies. Il existe des symptômes prodromaux : perte de la vision des contrastes, moins bonne adaptation à l’obscurité, ralentissement de la lecture, difficulté à reconnaître les visages.
Actuellement, il n’existe pas de traitement efficace de la DMLA atrophique ; des molécules visant à réduire l’étendue de l’atrophie centrale sont à l’essai (brimonidine, APL- 2).
Des règles hygiéno-diététiques doivent être appliquées, des compléments alimentaires peuvent être prescrits, et une prise en charge plus générale adaptée aux patients malvoyants est à proposer.
Le suivi ophtalmologique est initialement biannuel, puis annuel en cas de stabilité. Une autosurveillance (grille d’Amsler) permet de détecter précocement la survenue d’un néovaisseau choroïdien sur les berges de l’atrophie.
DMLA exsudative
La DMLA exsudative correspond à l’apparition de néovaisseaux choroïdiens. Ces derniers laissent diffuser du sang et du fluide dans les couches rétiniennes, provoquant une altération de la fonction visuelle. La gêne visuelle est brutale, associée à des métamorphopsies.
Le diagnostic peut être évoqué lors de la réalisation d’un fond d’œil devant la présence de drusen et d’AEP accompagnés d’un œdème ou d’un décollement séreux de la rétine. À ce stade, les explorations complémentaires sont essentielles :
- décollement et œdème sont mieux visualisés sur l’OCT (fig. 1C) ;
- grâce à l’angiographie à la fluorescéine, il est possible de visualiser la diffusion du colorant à travers la paroi du néovaisseau ;
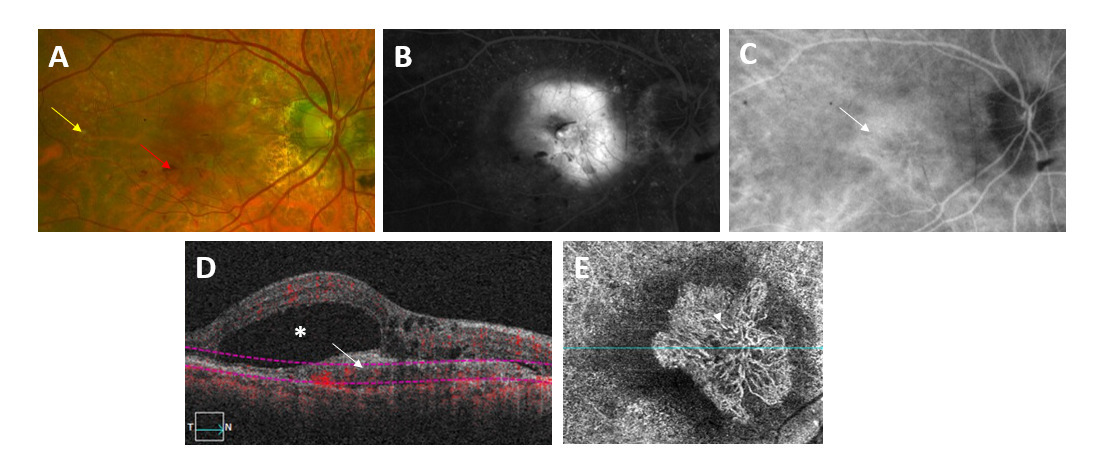
- le vert d’indocyanine est un autre colorant permettant d’individualiser directement la plaque néovasculaire (fig. 2A, B et C).
Le traitement repose exclusivement sur les injections intravitréennes (IVT) d’anti-VEGF (vascular endothelial growth factor). Malgré ces traitements, qui peuvent être répétés, la plaque néovasculaire peut évoluer vers une cicatrice fibrovasculaire disciforme, grevant le pronostic visuel lorsqu’elle est proche de la fovéa (la baisse de vision est alors définitive).
Par ailleurs, même si les anti-VEGF sont efficaces sur les néovaisseaux, la coexistence d’une atrophie peut aggraver la vision. D’autres complications peuvent survenir, comme la formation d’un hématome sous-rétinien, imposant un traitement chirurgical.
Progrès en imagerie ophtalmologique
L’OCT-angiographie détecte le mouvement des globules rouges et fournit une cartographie du flux des vaisseaux rétiniens et choroïdiens. Elle permet de repérer l’image d’un néovaisseau sans injection de produit de contraste et constitue une alternative à l’angiographie classique. Cependant, la technique demeure imparfaite : les images acquises en OCT-angiographie sont sujettes à de nombreux artefacts qui peuvent masquer la présence d’un néovaisseau, ce qui augmente le risque de faux négatifs. En pratique, l’absence de néovaisseau sur l’OCT-angiographie doit souvent être confirmée par une angiographie classique (fig. 2D et E).
L’optique adaptative est un examen d’imagerie en haute résolution qui permet d’explorer la composition des drusen et le comportement des cellules au niveau des zones d’atrophie.2 Cette technique d’imagerie est majoritairement utilisée au cours des recherches sur la physiopathologie de la DMLA.
Facteurs de risque et prévention
Génétique et facteurs constitutionnels
Deux gènes majeurs de susceptibilité ont été identifiés : les gènes du facteur H du complément (CFH) et ARMS2 (Age-Related Maculopathy Susceptibility 2). Les variants à risque sont fréquents dans la population générale et représentent des facteurs forts de prédisposition à la maladie.
Les seuls facteurs constitutionnels à risque élevé de DMLA sont l’âge et la présence d’une MLA.
Le sexe, l’origine ethnique et la couleur de l’iris sont des facteurs discutés.
Tabac et obésité augmentent le risque
La littérature a largement démontré l’association positive entre la consommation de tabac et les formes avancées de DMLA, en particulier la forme atrophique.1 Le risque augmente avec la durée et la quantité de tabac fumé. La pathologie surviendrait dix ans plus tôt chez les patients fumeurs. L’arrêt du tabac permettrait de réduire le risque.
Si le rôle de l’hypertension artérielle, des antécédents d’accidents cardiovasculaires et cérébraux et des lipides sanguins est controversé, l’obésité est, quant à elle, associée à une multiplication par 2 du risque de survenue d’une DMLA.3
Le rôle de l’exposition à la lumière dans la survenue de la DMLA demeure aujourd’hui incertain. L’exposition à la lumière bleue favoriserait le stress oxydatif dans les cellules rétiniennes in vivo et in vitro. Les filtres jaunes (bloquant la lumière bleue) pourraient atténuer ce phénomène. Néanmoins, les répercussions cliniques d’une telle exposition et l’effet protecteur des filtres restent controversés. La multiplication des sources de lumière bleue dans notre environnement (écrans, LEDs) doit faire porter une attention particulière sur ce facteur. D’autres études sont nécessaires pour préciser les répercussions ophtalmologiques.4, 5
Prise en charge
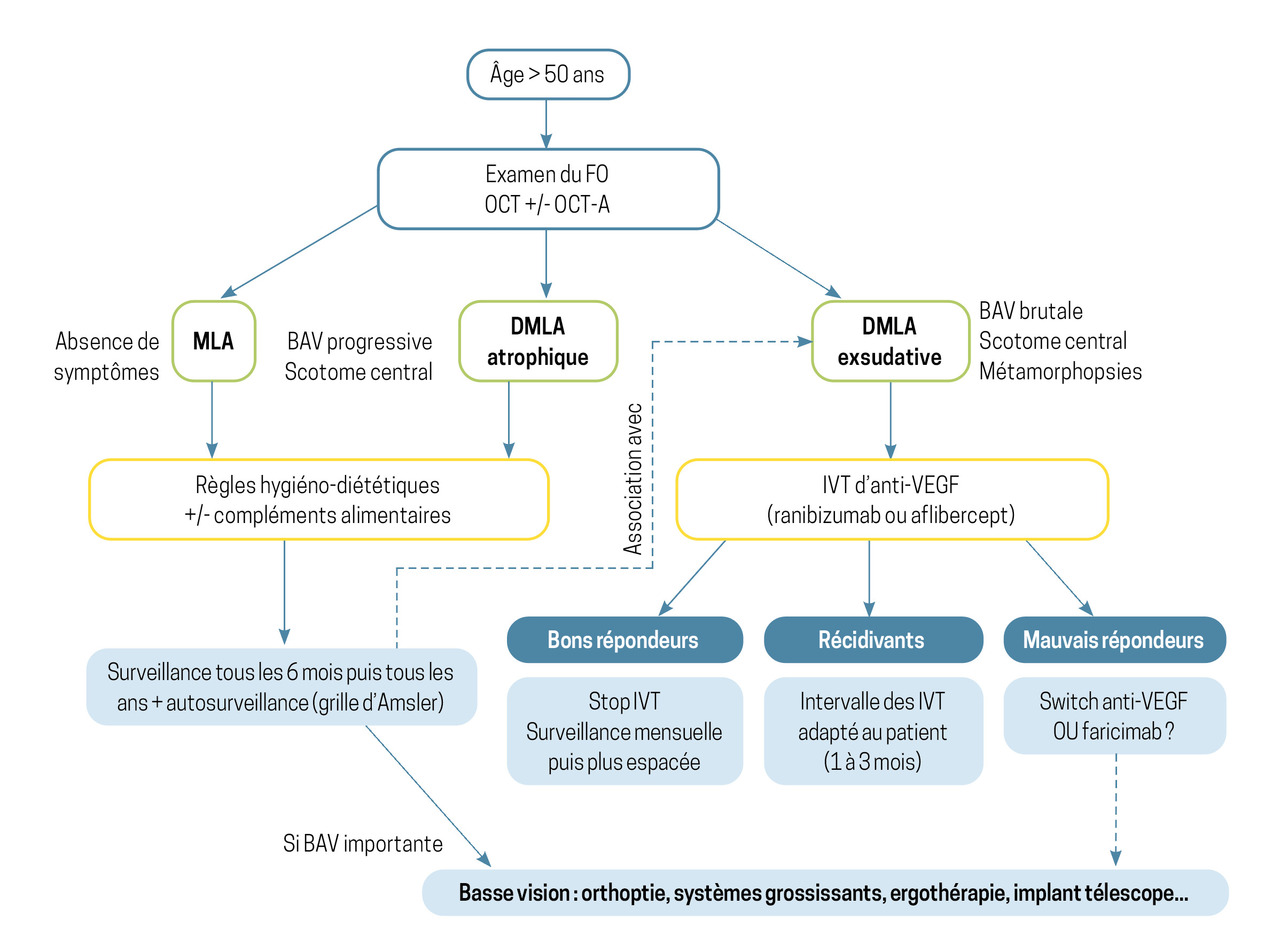
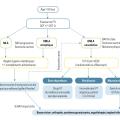
Mesures hygiéno-diététiques, IVT pour la forme exsudative, compensation de la baisse d’acuité visuelle et prise en compte du retentissement sur la qualité de vie constituent les piliers de la prise en charge (fig. 3).
Celle-ci ne doit pas être le fait de l’ophtalmologiste seul ; elle doit être globale et impliquer tous les intervenants entourant le patient. Le suivi psychologique et la bonne coordination des soins par et avec le médecin traitant sont indispensables.
Compléments alimentaires : mythe ou réalité ?
Outre le servage tabagique et la prise en charge d’une obésité, d’autres mesures nutritionnelles ont montré leur efficacité en prévention secondaire.
La consommation d’oméga 3 (acide gras présent dans les poissons gras, huile de colza, noix, soja… et dont les concentrations sont élevées dans les segments externes des photorécepteurs) est le principal facteur alimentaire protecteur de la DMLA, en particulier des formes avancées.
La lutéine et la zéaxanthine sont des caroténoïdes du pigment maculaire dont la consommation semble également protectrice. On en retrouve dans les légumes verts et dans les fruits et légumes de couleur orange.
L’étude AREDS (Age-Related Eye Disease Study) a montré que l’association de certains antioxydants (bêtacarotène, zinc, vitamines C et E) réduit le risque de progression de la maladie et de baisse d’acuité visuelle dans deux groupes de patients :
- ceux qui ont des drusen de taille intermédiaire ou grande ;
- ceux qui sont atteints d’une forme avancée de DMLA au niveau du « premier œil ».6
Sur la même population, l’étude AREDS2 a montré une efficacité similaire de l’association modifiée (ajout d’oméga 3, remplacement du bêtacarotène par la lutéine et la zéaxanthine et diminution des doses de zinc). L’élimination du bêtacarotène a été motivée par l’association de ce micronutriment à la survenue de cancers du poumon chez les patients fumeurs.7
Les compléments alimentaires, dont la composition repose sur les résultats de l’étude AREDS2, sont donc plutôt indiqués chez les patients à haut risque d’évolution vers une DMLA ou atteints de DMLA avancée au niveau d’un œil. Néanmoins, ils sont aussi souvent proposés aux patients atteints de MLA, même à faible risque d’évolution ; dans ce cas, leur efficacité reste difficile à démontrer puisque, chez ces patients, la transformation en DMLA est un événement rare (1 %). Des études longitudinales, avec un nombre important de patients, sont nécessaires pour confirmer les effets des compléments alimentaires.
Complications néovasculaires : un traitement au long cours
La prise en charge de la DMLA néovasculaire repose sur la réalisation d’IVT d’anti-VEGF. Deux molécules, d’efficacité équivalente, sont actuellement disponibles : le ranibizumab (Lucentis) et l’aflibercept (Eylea). En pratique, le traitement débute le plus précocement possible par une phase d’induction : trois IVT, espacées d’un mois, sont réalisées. Puis une phase d’observation mensuelle permet d’évaluer le profil de réponse et de récidive des patients : 15 %, « bons répondeurs », ne nécessiteront plus d’injection après cette première série ; d’autres récidiveront et devront subir de nouvelles injections à un intervalle adapté à leur profil de récidive (généralement, tous les 1 à 3 mois). Dans 90 % des cas, la répétition des injections permet de stabiliser la maladie. Malheureusement, certains patients « non répondeurs » auront toujours des signes d’exsudation associés à une baisse progressive de la vision malgré un traitement bien conduit. Il est important d’expliquer au patient que la DMLA est une maladie chronique pour laquelle il n’existe pas de traitement curatif. Les anti-VEGF permettent de suspendre l’activité des néovaisseaux afin de maintenir l’acuité visuelle, avec un risque de récidive à l’arrêt. Il s’agit donc d’un traitement au long cours.
Le faricimab (Vabysmo) est un anticorps dirigé contre le VEGF-A et l’angiopoïétine- 2. Il est également administré par voie intravitréenne, et sa durée d’action est légèrement supérieure à celle des anti-VEGF actuels (1 à 2 mois d’efficacité supplémentaires) pour un gain d’acuité visuelle similaire. Cette molécule a récemment obtenu l’autorisation de mise sur le marché et le remboursement en France.
Autres aspects de la prise en charge : qualité de vie et basse vision
Un retentissement majeur sur la qualité de vie
Lorsque la baisse d’acuité visuelle centrale est profonde, les activités nécessitant une vision précise sont affectées (lecture, écriture, bricolage, couture…). Le retentissement peut être important : au stade sévère, plus de 60 % des patients rapportent une altération de leur qualité de vie. La discordance entre les attentes du patient et les effets des traitements, notamment des IVT, est importante. Elle peut même être source d’anxiété, voire de dépression, et la perte fonctionnelle conduire à l’isolement.8
Sur le plan général, la DMLA, en particulier atrophique, est associée à un risque accru de maladie d’Alzheimer et de pathologies cardiovasculaires.9,10
Baisse de l’acuité visuelle : suppléer et s’adapter en attendant mieux
Lorsque l’acuité visuelle est basse, une rééducation orthoptique peut permettre de développer des mécanismes compensatoires du handicap visuel (fixation rétinienne de suppléance, systèmes grossissants, ergothérapie…).
À la différence du glaucome, le champ visuel périphérique est préservé, ce qui limite les difficultés de déplacement. Toutefois, la perte de la vision en relief peut rendre difficile le repérage d’un obstacle (trottoir, escalier).
D’un point de vue légal, la conduite automobile n’est possible que si l’acuité visuelle binoculaire est supérieure à 5/10e et que le champ visuel binoculaire ne montre pas d’atteinte centrale. Même en dehors de ces critères, la poursuite de la conduite peut être déconseillée chez les patients éprouvant une gêne visuelle. Une adaptation du poste des patients en activité, un dossier MDPH (maison départementale des personnes handicapées) pour l’obtention de droits sociaux et le maintien au travail ou la reconversion professionnelle doivent être proposés.
En cas de DMLA bilatérale avancée (atrophie centrale ou cicatrice néovasculaire disciforme), la pose unilatérale d’un implant télescope miniature peut être proposée lors de la chirurgie de la cataracte. Cet implant permet d’agrandir les images rétiniennes dans le champ visuel central, la réduction du champ visuel périphérique induite étant compensée par l’œil controlatéral non opéré. Une préparation préopératoire et une réhabilitation postopératoire sont nécessaires. Plusieurs études ont montré une amélioration visuelle et une meilleure qualité de vie chez les patients implantés, avec un faible taux de complication.11 Néanmoins, cette chirurgie ne concerne que peu de patients aujourd’hui.
D’autres thérapeutiques visant à compenser la perte des photorécepteurs (modulation de l’activité des cellules rétiniennes par thérapie génique ou optogénétique) ou à favoriser leur renouvellement (thérapie cellulaire) sont à l’essai.
Que dire à vos patients ?
- La DMLA est une maladie chronique pour laquelle il n’existe pas de traitement curatif.
- Seule la forme exsudative peut bénéficier d’injections intravitréennes. Les injections stabilisent l’acuité visuelle et doivent souvent être répétées au long cours.
- L’apparition de métamorphopsies, d’un scotome central ou d’une baisse d’acuité visuelle brutale doit faire consulter un ophtalmologue rapidement.
- Aux stades avancés, la baisse de vision est importante et les activités en vision de près (lecture, écriture, couture…) sont affectées. Le champ visuel est en revanche conservé, facilitant les déplacements.
- Une alimentation riche en oméga 3, lutéine et zéaxanthine et un arrêt de la consommation tabagique sont des facteurs protecteurs des formes sévères de DMLA.
2. Gocho K, Sarda V, Falah S, et al. Adaptive optics imaging of geographic atrophy. Invest Ophthalmol Vis Sci 2013;54(5):3673‑80.
3. Seddon JM, Cote J, Rosner B. Progression of age-related macular degeneration: Association with dietary fat, transunsaturated fat, nuts, and fish intake. Arch Ophthalmol 2003;121(12):1728‑37.
4. Vagge A, Ferro Desideri L, Del Noce C, Di Mola I, Sindaco D, Traverso CE. Blue light filtering ophthalmic lenses: A systematic review. Semin Ophthalmol. 3 oct 2021;36(7):541‑8.
5. Iqbal M, Elmassry A, Said O. Letter to the Editor Regarding “Blue Light Exposure: Ocular Hazards and Prevention—A Narrative Review”. Ophthalmol Ther. Oct 2023;12(5):2813‑6.
6. Age-Related Eye Disease Study Research Group. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol 2001;119(10):1417‑36.
7. Age-Related Eye Disease Study 2 Research Group. Lutein + zeaxanthin and omega-3 fatty acids for age-related macular degeneration: The Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA 2013;309(19):2005‑15.
8. Brody BL, Gamst AC, Williams RA, et al. Depression, visual acuity, comorbidity, and disability associated with age-related macular degeneration. Ophthalmology 2001;108(10):1893‑900; discussion 1900-1.
9. Woo SJ, Park KH, Ahn J, et al. Cognitive impairment in age-related macular degeneration and geographic atrophy. Ophthalmology 2012;119(10):2094‑101.
10. McGuinness MB, Karahalios A, Finger RP, et al. Age-Related Macular Degeneration and Mortality: A Systematic Review and Meta-Analysis. Ophthalmic Epidemiol 2017;24(3):141‑52.
11. Hudson HL, Lane SS, Heier JS, et al. Implantable Miniature Telescope for the Treatment of Visual Acuity Loss Resulting from End-Stage Age-Related Macular Degeneration: 1-Year Results. Ophthalmology 2006;113(11):1987‑2001.

 Encadrés
Encadrés