La dengue est une arbovirose tropicale transmise par la piqûre d’un moustique diurne du genre Aedes, infecté par le virus de la dengue. Il s’agit d’une maladie « émergente » caractérisée par son expansion géographique continue et l’augmentation croissante de son incidence.1-3 Cause croissante de morbidité chez le voyageur, la dengue fait également peser la menace d’une dissémination secondaire dans les régions tempérées où les vecteurs (Aedes albopictus) sont implantés.1-3 En France, il s’agit d’une maladie à déclaration obligatoire qui fait l’objet d’un plan de lutte antidissémination visant à identifier tout cas importé en période virémique ou tout cas autochtone sur le territoire.4-6 Les médecins de première ligne doivent connaître la stratégie diagnostique, les principes de la prise en charge et les mesures de prévention de la dengue.
Rappel épidémiologique
Les virus de la dengue sont des arbovirus (arthropod-borne virus) qui appartiennent à la famille des Flaviviridae, genre Flavivirus. Il s’agit de virus à ARN, enveloppés, dont on distingue quatre sérotypes différents : DEN-1, DEN-2, DEN-3, DEN-4. En effet, après l’infection par l’un de ces sérotypes, l’immunité conférée pour celui-ci est définitive, mais il n’y a pas d’immunité croisée durable avec les autres sérotypes. Un individu vivant en zone endémo-épidémique peut donc en théorie contracter quatre fois la dengue.1-4
L’homme est le principal réservoir. Il joue le rôle d’hôte amplificateur et de disséminateur du virus. En Asie et en Afrique, les primates non humains constituent des réservoirs possibles.1
Les virus de la dengue sont transmis d’homme à homme par des piqûres de femelles de moustiques infectées appartenant à la famille des Culicidae et au genre Aedes, ils sont caractérisés par leur forte préférence à piquer l’être humain (anthropophilie) et leur activité diurne.
A. aegypti est le principal vecteur de la dengue dans le monde. Ce moustique originaire d’Afrique est maintenant présent dans les zones intertropicales de tous les continents et il reste capable de recoloniser des zones d’où il a été éradiqué, comme l’Europe méditerranéenne.
A. albopictus est surnommé « moustique tigre ». Originaire des forêts du Sud-Est asiatique, cette espèce est capable de coloniser des pays tempérés car ses œufs peuvent entrer en diapause* si les conditions climatiques sont défavorables. Sa présence est avérée dans le sud-est de la France depuis environ 15 ans.
D’autres vecteurs comme Aedes polynesiensis peuvent également être mis en cause.
De rares cas de transmission materno-fœtale et des infections associées aux soins (accident d’exposition au sang, transfusion, transplantation d’organes) ont été décrits.1-4
L’homme est le principal réservoir. Il joue le rôle d’hôte amplificateur et de disséminateur du virus. En Asie et en Afrique, les primates non humains constituent des réservoirs possibles.1
Les virus de la dengue sont transmis d’homme à homme par des piqûres de femelles de moustiques infectées appartenant à la famille des Culicidae et au genre Aedes, ils sont caractérisés par leur forte préférence à piquer l’être humain (anthropophilie) et leur activité diurne.
A. aegypti est le principal vecteur de la dengue dans le monde. Ce moustique originaire d’Afrique est maintenant présent dans les zones intertropicales de tous les continents et il reste capable de recoloniser des zones d’où il a été éradiqué, comme l’Europe méditerranéenne.
A. albopictus est surnommé « moustique tigre ». Originaire des forêts du Sud-Est asiatique, cette espèce est capable de coloniser des pays tempérés car ses œufs peuvent entrer en diapause* si les conditions climatiques sont défavorables. Sa présence est avérée dans le sud-est de la France depuis environ 15 ans.
D’autres vecteurs comme Aedes polynesiensis peuvent également être mis en cause.
De rares cas de transmission materno-fœtale et des infections associées aux soins (accident d’exposition au sang, transfusion, transplantation d’organes) ont été décrits.1-4
Importance épidémiologique
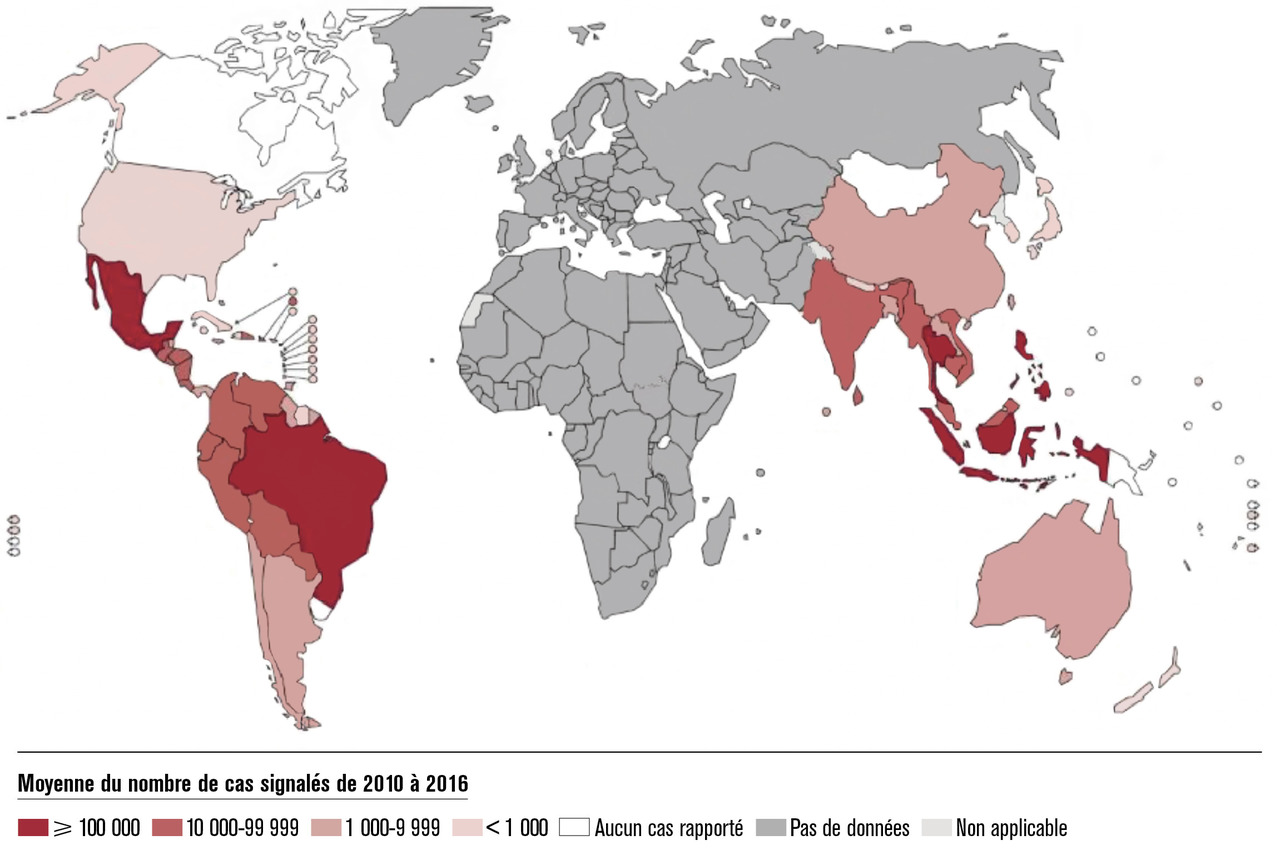
Dans le monde : 400 millions de cas annuels
La maladie est désormais endémique dans plus de 128 pays d’Afrique, des Amériques, de la Méditerranée orientale, de l’Asie du Sud-Est et du Pacifique occidental (L’arbovirose la plus fréquente chez les voyageurs
La dengue est l’arbovirose la plus fréquente chez les voyageurs.2, 8 Le risque d’acquisition de la dengue varie selon la destination visitée, la saison, et le niveau d’activité épidémique. Il s’agit de la deuxième cause d’hospitalisation pour fièvre au retour des tropiques, après le paludisme (première cause de fièvre au retour d’Asie du Sud-Est). Les cas importés font peser le risque d’introduction du virus et de dissémination locale secondaire (cas autochtones) dans des pays tempérés où le vecteur compétent, A. albopictus, est implanté, comme cela a été décrit en Europe (Italie, France, Croatie), aux États-Unis, en Chine et en Australie.2, 8 L’évolution clinique est généralement favorable, les formes graves étant exceptionnelles chez les voyageurs.8Et en France ?
L’infection par le virus de la dengue présente des profils épidémiologiques très divers selon le territoire français considéré.4, 5• Dans les Antilles françaises et en Guyane, la dengue est endémo-épidémique. La Martinique et la Guadeloupe connaissent des épidémies récurrentes (1997, 2001, 2005, 2007 et 2010, 2013 et 2014) liées chacune à la circulation d’un ou deux sérotypes prédominants. Ces épidémies durent en général 4 à 6 mois et peuvent toucher jusqu’à 10 % de la population (40 000 cas estimés en Martinique en 2010). La séroprévalence estimée en 2011 chez les personnes âgées de 18 ans et plus était de 90 % en Martinique et 96 % en Guadeloupe.
La Guyane est caractérisée par une circulation ancienne du virus de la dengue, avec des épidémies récurrentes depuis les années 1970, dont une épidémie majeure en 2006 puis 2009 et 2012-2013. La séroprévalence est légèrement plus faible qu’aux Antilles (autour de 70 %).
• Dans l’océan Indien, les virus de la dengue circulent de façon épisodique à Mayotte, avec des épidémies importantes en 2010 et 2014, en lien avec l’épidémiologie de la dengue aux Comores. La séroprévalence estimée en 2006 chez les personnes âgées de 2 ans et plus était de 23 %.
La Réunion était caractérisée jusqu’en 2016 par une circulation discontinue, avec de longues périodes interépidémiques mais, depuis 2017, on constate une transmission continue du virus, avec la survenue d’une épidémie modérée en 2018 qui se poursuit en 2019. À l’issue de l’épidémie de 2018, la séroprévalence était estimée à 5-10 % de la population.
• Dans le Pacifique, en Nouvelle-Calédonie et en Polynésie, la circulation de la dengue se fait sur un mode endémo-épidémique.
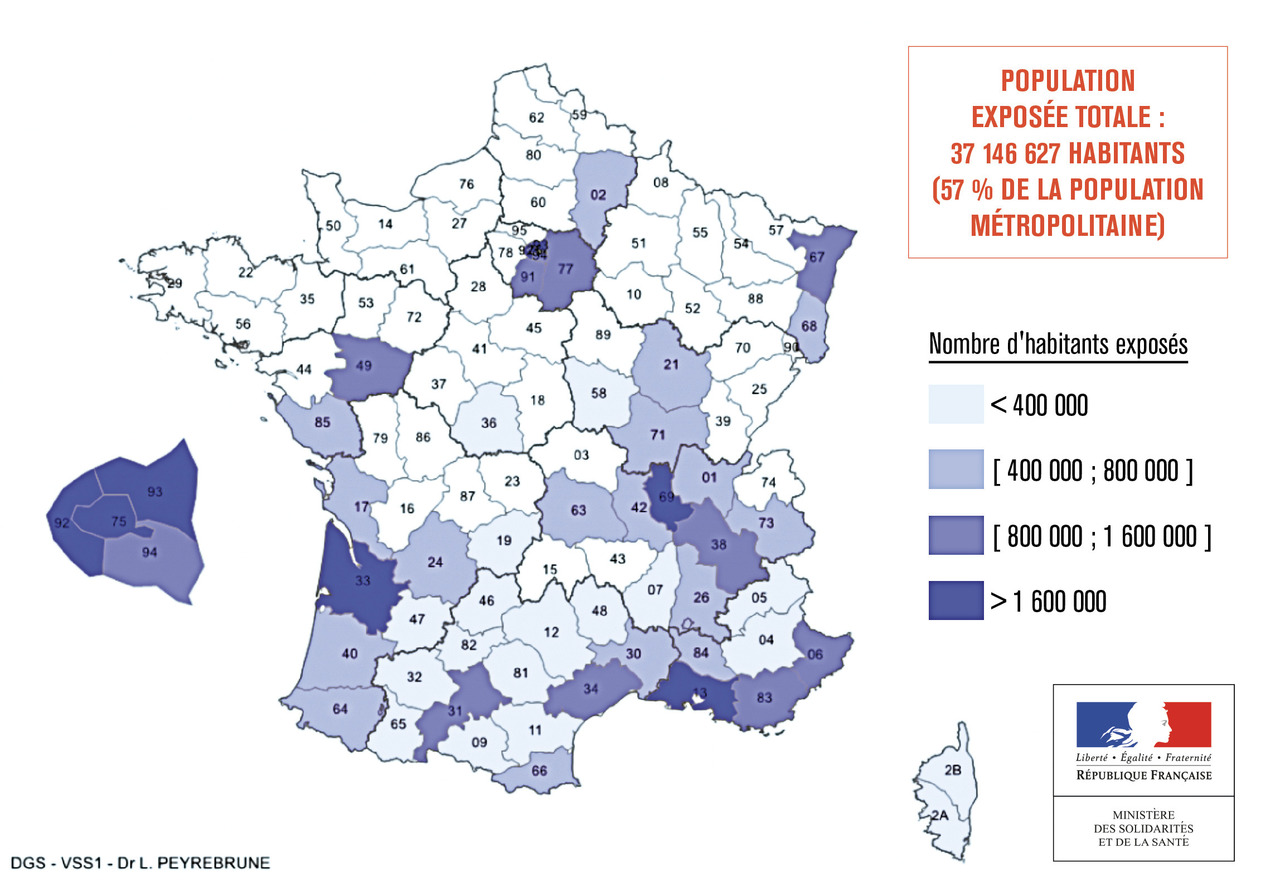
• En métropole, le nombre de cas annuels importés de dengue varie selon le contexte épidémiologique international et le flux des voyageurs de retour des zones endémiques. En 2018, 225 cas de dengue importés ont été notifiés. Depuis 2004, le moustique vecteur A. albopictus s’est implanté dans plusieurs départements méditerranéens, puis il a étendu son implantation vers le nord et l’ouest. En 2019, il était implanté dans 51 départements métropolitains, dont l’Île-de-France (
Polymorphisme clinique et évolution imprévisible
La dengue est caractérisée par son polymorphisme clinique et une évolution souvent imprévisible. Les formes asymptomatiques (apyrétiques) ou paucisymptomatiques sont majoritaires (75-90 % des cas), elles contrastent avec les rares formes graves, voire létales.2, 4, 7
Forme typique
Dans cette forme dite classique, après une période d’incubation de 4 à 7 jours (extrêmes : 2-14 jours) apparaît une fièvre brutale. Cette fièvre élevée dure de 2 à 6 jours et s’associe à une asthénie intense et une composante algique : céphalées rétro-orbitaires, myalgies, arthralgies, lombalgies. Un exanthème maculeux ou maculopapuleux, faciotronculaire, est présent dans la moitié des cas. Volontiers purpurique aux membres inférieurs, il peut être de localisation palmaire ou palmoplantaire et prurigineux. Des signes digestifs peuvent être observés : anorexie, nausées, vomissements, douleurs abdominales et diarrhées. Des signes hémorragiques mineurs dont la valeur pronostique est incertaine sont possibles : pétéchies (signe du tourniquet), purpura, épistaxis, gingivorragies. Le signe du tourniquet (apparition de pétéchies à la suite de l’application d’un brassard à tension gonflé autour du bras) pris en compte dans la classification de l’Organisation mondiale de la santé (OMS) témoigne d’une augmentation de la fragilité capillaire. Il n’est ni sensible ni spécifique.7 La présence d’une hépatosplénomégalie et d’adénopathies est décrite. Une dysgueusie et des paresthésies des membres sont possibles. Dans ces formes bénignes, l’évolution clinique est favorable en 7 à 8 jours, une asthénie résiduelle prolongée peut être observée.
Formes graves et classification de l’OMS
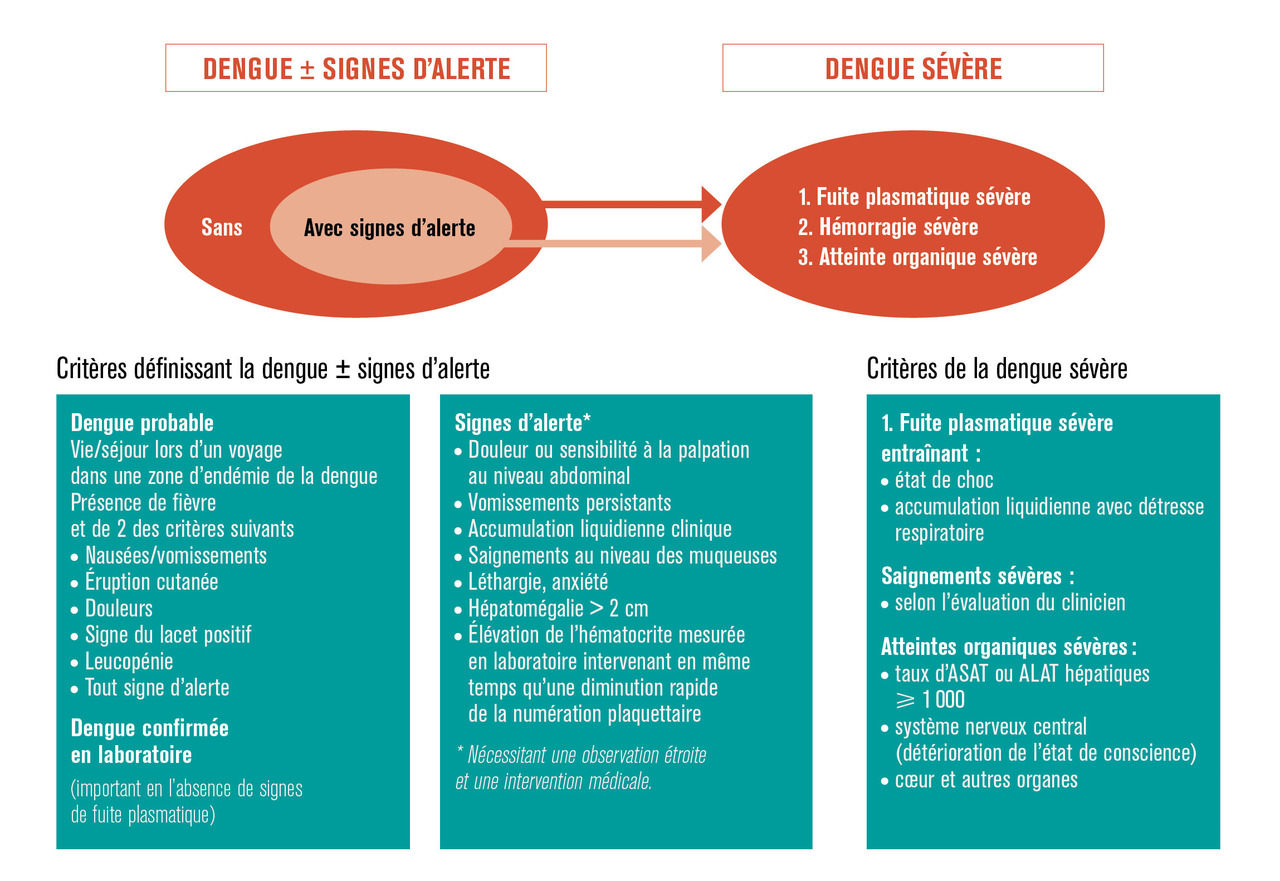
La nouvelle classification de l’OMS de 2009 distingue trois entités (fig. 3 ), la dengue probable, la dengue avec signes d’alerte et la dengue grave définie par l’existence d’au moins un des critères suivants :3, 7 un syndrome de fuite capillaire responsable de choc et/ou de détresse respiratoire ; une hémorragie grave selon le clinicien ; une atteinte viscérale, notamment hépatique (aspartate aminotransférase [ASAT]/alanine aminotransférase [ALAT] > 1 000 UI/L), neurologique (troubles de la vigilance) ou cardiaque.
En pratique, dans 2 à 4 % des cas, un syndrome de fuite plasmatique apparaît après 4 à 7 jours de dengue « classique », au moment de la défervescence thermique. Pendant cette phase critique (du 4e au 6e jour), la constatation de signes d’alerte dont la valeur pronostique est reconnue justifie une prise en charge hospitalière.
Le syndrome de fuite plasmatique de gravité variable se traduit par une hémoconcentration (élévation de l’hématocrite > 20 %, hypo-albuminémie). Il dure 2-3 jours et aboutit rarement à un état de choc (1 % des cas) de mauvais pronostic. L’échographie, qui peut déceler une fuite plasmatique infraclinique (épanchement des séreuses et/ou œdème de la paroi vésiculaire), facilite l’identification précoce des formes graves.7
Des manifestations hémorragiques peuvent compliquer cette situation. Elles sont le plus souvent secondaires à une défaillance multiviscérale, sans lien avec la thrombopénie. En l’absence de prise en charge précoce, la létalité des formes hémorragiques est élevée.
D’autres complications viscérales rares ont été décrites : hépatite, rhabdomyolyse, myocardite, encéphalite, myélite, syndrome de Guillain-Barré, syndrome d’activation macrophagique, rupture de rate.7
Certains patients à risque de formes graves justifient une prise en charge spécialisée : âges extrêmes, femmes enceintes au 3e trimestre, comorbidités associées (drépanocytose, diabète, immunodépression, troubles de coagulation…). Le risque de forme grave est accru chez les migrants et expatriés préalablement exposés à la dengue (infection secondaire par un sérotype hétérologue).8
En pratique, dans 2 à 4 % des cas, un syndrome de fuite plasmatique apparaît après 4 à 7 jours de dengue « classique », au moment de la défervescence thermique. Pendant cette phase critique (du 4e au 6e jour), la constatation de signes d’alerte dont la valeur pronostique est reconnue justifie une prise en charge hospitalière.
Le syndrome de fuite plasmatique de gravité variable se traduit par une hémoconcentration (élévation de l’hématocrite > 20 %, hypo-albuminémie). Il dure 2-3 jours et aboutit rarement à un état de choc (1 % des cas) de mauvais pronostic. L’échographie, qui peut déceler une fuite plasmatique infraclinique (épanchement des séreuses et/ou œdème de la paroi vésiculaire), facilite l’identification précoce des formes graves.7
Des manifestations hémorragiques peuvent compliquer cette situation. Elles sont le plus souvent secondaires à une défaillance multiviscérale, sans lien avec la thrombopénie. En l’absence de prise en charge précoce, la létalité des formes hémorragiques est élevée.
D’autres complications viscérales rares ont été décrites : hépatite, rhabdomyolyse, myocardite, encéphalite, myélite, syndrome de Guillain-Barré, syndrome d’activation macrophagique, rupture de rate.7
Certains patients à risque de formes graves justifient une prise en charge spécialisée : âges extrêmes, femmes enceintes au 3e trimestre, comorbidités associées (drépanocytose, diabète, immunodépression, troubles de coagulation…). Le risque de forme grave est accru chez les migrants et expatriés préalablement exposés à la dengue (infection secondaire par un sérotype hétérologue).8
Démarche diagnostique
Diagnostic de présomption
Arguments épidémiologiques
Les formes asymptomatiques ou pauci-symptomatiques, non spécifiques, sont fréquentes. En métropole, s’il est évident de suspecter une dengue après un séjour en région d’endémie (Asie du Sud-Est, Antilles, Guyane mais également Afrique subsaharienne), en l’absence de foyer autochtone établi, il faut y penser en cas de symptomatologie évocatrice car la transmission a pu se faire à partir de cas asymptomatiques.Arguments cliniques
En raison de la période d’incubation courte, le diagnostic de dengue est improbable en cas de fièvre évoluant depuis plus de 15 jours ou débutant plus de deux semaines après le retour d’une zone d’endémie. La présence d’un exanthème est évocatrice mais non spécifique.Arguments biologiques
L’hémogramme est le principal examen d’orientation et de suivi, il doit être réalisé le plus tôt possible. Il met classiquement en évidence :– une thrombopénie, qui a une valeur pronostique quand elle est précoce ou qu’elle s’aggrave brutalement ;
– une leucopénie avec lymphopénie et neutropénie souvent profonde et durable ;
– une hyperlymphocytose avec présence de lymphocytes « atypiques » d’apparition secondaire est possible, elle fait discuter les autres causes de syndrome mononucléosique, primo-infection par le virus de l’immunodéficience humaine (VIH) en particulier ;
– l ’augmentation de l’hématocrite est un marqueur d’hémoconcentration, qui peut traduire une fuite plasmatique qui survient entre le 3e et le 8e jour. Une augmentation de plus de 20 % en l’absence de déshydratation est un signe de gravité.7
La protéine C-réactive est le plus souvent normale ou basse, inférieure à 10 mg/L. Les anomalies du bilan hépatique sont constantes : cytolyse hépatique (ASAT > ALAT) qui est un signe de gravité si la cytolyse est importante (ASAT ou ALAT > 1 000 UI/L), plus rarement cholestase. L’élévation des enzymes musculaires (rhabdomyolyse) est classique. Une insuffisance rénale aiguë le plus souvent fonctionnelle et une hyponatrémie peuvent être observées. Des anomalies de la coagulation à type d’élévation isolée du temps de céphaline activée (anticoagulant circulant) sont fréquentes. Le taux de prothrombine est normal, sauf en cas de coagulation intravasculaire disséminée ou d’insuffisance hépatocellulaire. L’hypoalbuminémie et l’augmentation de la ferritine plasmatique vers J5-J6 traduisent l’augmentation de la perméabilité vasculaire.
Diagnostic différentiel
À la phase aiguë, selon la situation épidémiologique du lieu d’infection, on évoque un paludisme non compliqué, une primo-infection par le VIH, une virose exanthématique (rougeole, rubéole, mononucléose infectieuse), d’autres arboviroses (chikungunya…), ou une grippe.
À la phase critique, un paludisme grave, une leptospirose, une salmonellose, une rickettsiose, un sepsis bactérien, une pathologie chirurgicale abdominale (appendicite, cholécystite…), une méningo-encéphalite, une maladie de Kawasaki.3, 7 En phase épidémique, toute fièvre n’est pas une dengue et il faut toujours penser à éliminer un paludisme.
À la phase critique, un paludisme grave, une leptospirose, une salmonellose, une rickettsiose, un sepsis bactérien, une pathologie chirurgicale abdominale (appendicite, cholécystite…), une méningo-encéphalite, une maladie de Kawasaki.3, 7 En phase épidémique, toute fièvre n’est pas une dengue et il faut toujours penser à éliminer un paludisme.
Diagnostic de certitude
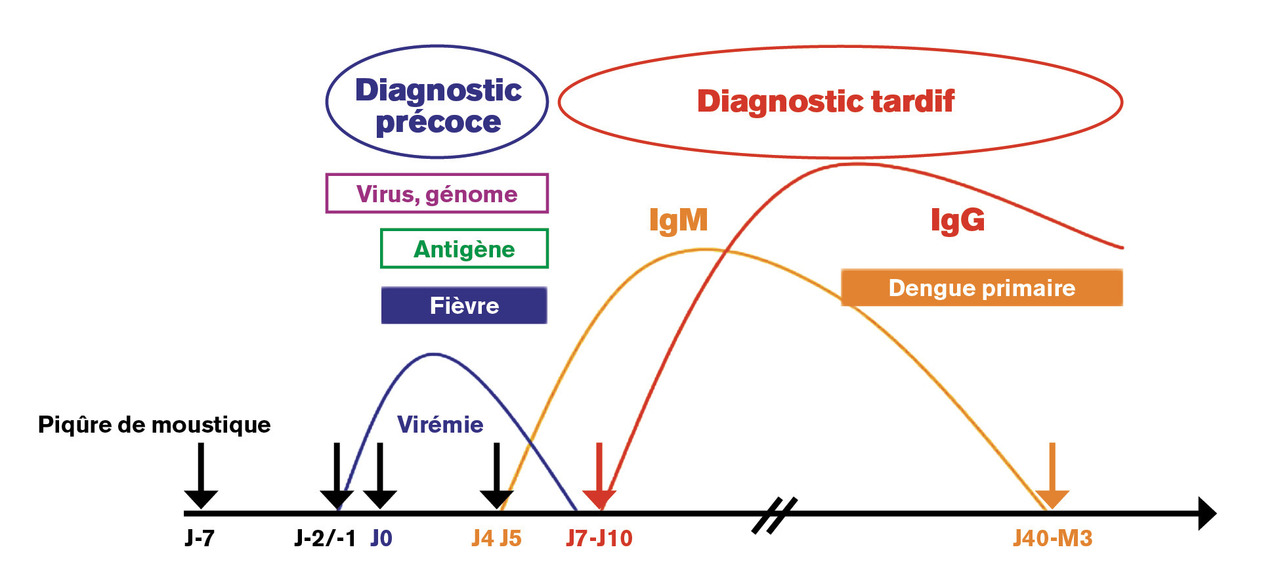
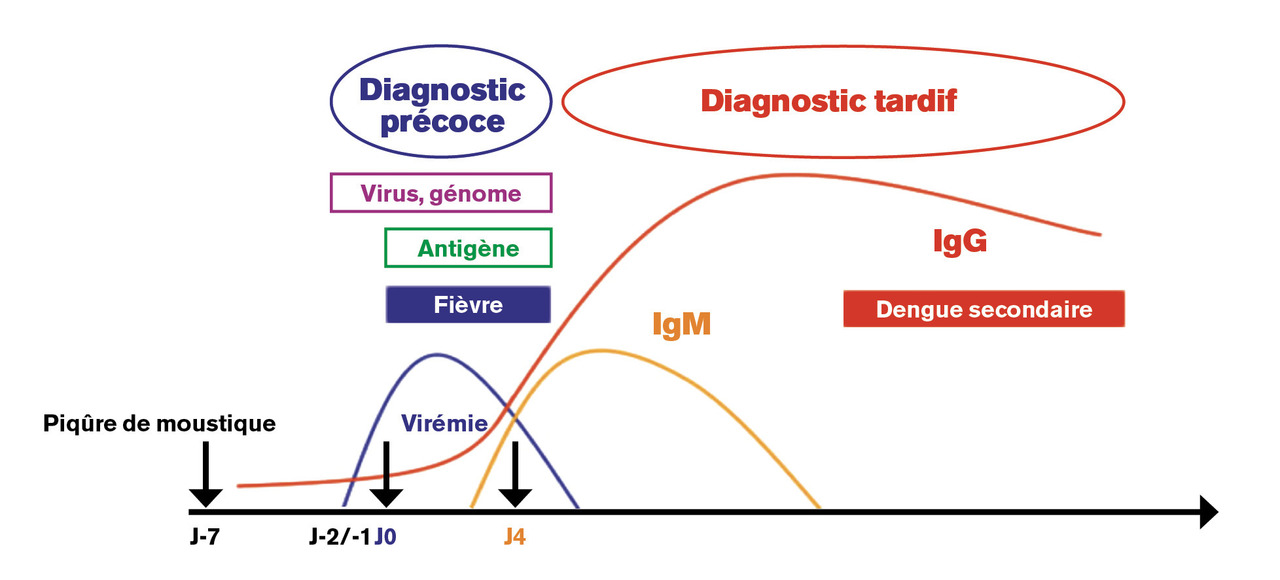
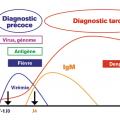
Le diagnostic de certitude de la maladie est primordial pour la prise en charge clinique et la mise en place des mesures de surveillance épidémiologique. Il s’appuie sur la compréhension du caractère bref de la virémie (5 jours en moyenne) qui est détectable entre le 2e jour précédant et jusqu’au 7e jour suivant le début des signes cliniques.2-4, 9
Outils diagnostiques
Diagnostic direct
Le diagnostic peut reposer sur un diagnostic direct par détection du virus dans le sang du malade (plus rarement dans le liquide céphalorachidien ou éventuellement dans des nécropsies). Trois techniques différentes, réservées au stade précoce (les 5 à 7 premiers jours) de la maladie, peuvent être utilisées :9– les techniques de biologie moléculaire sont les plus performantes et constituent désormais la référence. Elles détectent le génome viral par reverse-transcriptase polymerase chain reaction (RT-PCR) et RT-PCR en temps réel et identifient le sérotype en cause (intérêt épidémiologique) ;
– la détection d’antigènes viraux (antigène NS1). Cette protéine, spécifique des virus de la dengue, est présente à de fortes concentrations dans le sérum des personnes infectées entre le 1er et le 7e jour de maladie. On dispose à l’heure actuelle de tests ELISA, et de tests rapides immunochromatographiques, sous forme de bandelette ou de cassette. Ces tests spécifiques (de 86 à 100 % selon les études) ont une sensibilité variable selon le sérotype du virus en cause et en cas de dengue secondaire. De fait, l’utilisation de ces tests rapides n’est pas recommandée en zone endémique. Leur emploi doit être strictement limité à la phase précoce de la maladie, et tout résultat négatif doit être impérativement contrôlé par un test moléculaire ;
– l’isolement du virus par culture sur lignées cellulaires de moustiques, technique longue et complexe, est réservé aux laboratoires de sécurité biologique de niveau 3 (LSB3) comme le Centre national de référence des arbovirus.
Diagnostic indirect
La détection d’anticorps est à privilégier à partir du 5e jour de maladie. Il repose sur la détection d’immunoglobulines de type M (IgM) [ELISA de type capture] et d’IgG spécifiques (ELISA indirect) en fonction de leur cinétique d’apparition au cours du temps. Lors d’une infection primaire, les IgM apparaissent 5 à 6 jours et les IgG 7 à 10 jours après l’apparition des symptômes. Les IgM atteignent leur pic maximum en 2 à 3 semaines, et peuvent parfois persister jusqu’à 6 mois après le premier épisode infectieux (Lors d’une infection secondaire (
L’observation d’une ascension du titre des IgG (augmentation d’un facteur 4) est rarement constatée faute d’un second prélèvement effectué pendant la période de convalescence.
Stratégie du diagnostic biologique
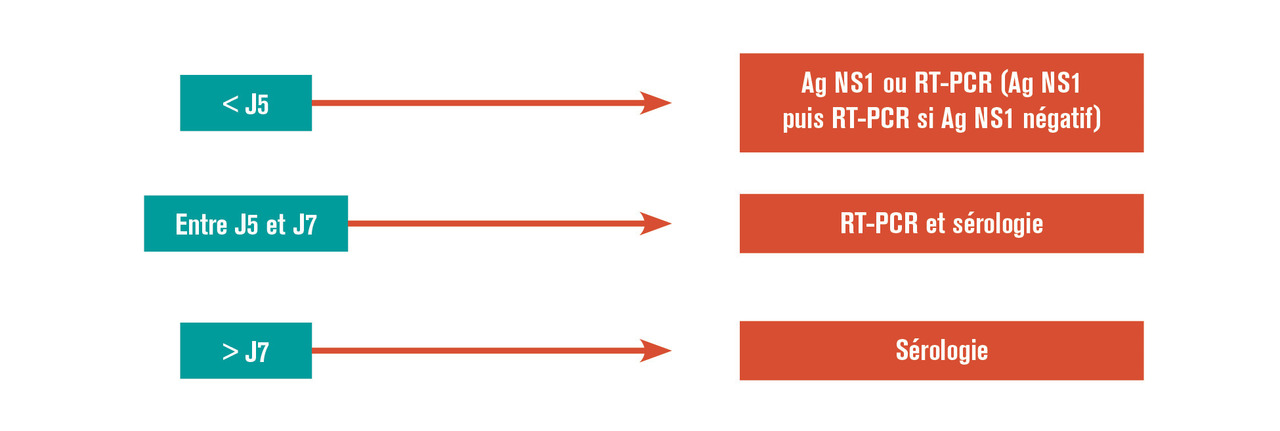
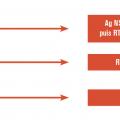
Le choix de la technique diagnostique à mettre en œuvre se fait en premier lieu selon la date de début des signes cliniques (fig. 6 ) : si le prélèvement est précoce (inférieur au 5e jour suivant l’apparition des symptômes), ce sont les méthodes directes, RT-PCR et détection de l’antigène NS1, qui sont indiquées. Entre J5 et J7, on utilise les méthodes directes et la sérologie. Après J7, seule la sérologie reste indiquée en insistant sur l’importance d’un second prélèvement à un minimum de 15 jours d’intervalle.9
Interviennent ensuite dans le choix du test diagnostique, la zone géographique dans laquelle la contamination a eu lieu et dans laquelle se trouve le patient (qui peuvent être différentes, par exemple les infections symptomatiques après un retour de voyage). Et, enfin, dans une zone géographique donnée sont prises en compte la situation épidémiologique, la disponibilité des tests et la situation clinique du patient. Le Haut Conseil de la santé publique a déterminé en 2011 les algorithmes de choix de la méthode diagnostique de dengue spécifiques à chacune des zones suivantes : métropole, Antilles-Guyane et océan Indien.9
Interviennent ensuite dans le choix du test diagnostique, la zone géographique dans laquelle la contamination a eu lieu et dans laquelle se trouve le patient (qui peuvent être différentes, par exemple les infections symptomatiques après un retour de voyage). Et, enfin, dans une zone géographique donnée sont prises en compte la situation épidémiologique, la disponibilité des tests et la situation clinique du patient. Le Haut Conseil de la santé publique a déterminé en 2011 les algorithmes de choix de la méthode diagnostique de dengue spécifiques à chacune des zones suivantes : métropole, Antilles-Guyane et océan Indien.9
Prise en charge et traitement
En l’absence de traitement antiviral spécifique, le traitement de la dengue est uniquement symptomatique. Il associe le repos, une hydratation et des antalgiques à base de paracétamol (risque d’hépatite). L’aspirine et les anti-inflammatoires sont contre-indiqués (risque hémorragique et rénal). Le patient et son entourage doivent connaître les signes d’alerte.3-7 En zone d’implantation de vecteurs, la mise en place d’une protection antivectorielle autour du patient (moustiquaire) est recommandée pendant la phase fébrile.3, 4, 7 Toute dengue survenant chez un sujet ayant un terrain à risque, une thrombopénie sévère (< 100 000/mm3) et a fortiori au moins un signe d’alerte justifient une hospitalisation dans un centre spécialisé doté d’un service de réanimation. Les états de choc sont traités par une expansion volémique précoce. Les cristalloïdes ou les colloïdes à la posologie initiale de 10 à 20 mL/kg par heure sont d’efficacité équivalente.2, 7 Un remplissage bref de 24 à 48 heures guidé par la clinique, l’hématocrite et l’échographie est le plus souvent suffisant (risque de surcharge par accumulation de solutés dans les espaces interstitiels). Les hémorragies sévères relèvent de transfusions de concentrés globulaires et plaquettaires.
Vaccin
Le vaccin vivant atténué tétravalent Dengvaxia, qui dispose d’une autorisation de mise sur le marché depuis décembre 2018, est indiqué chez les sujets âgés de 9 à 45 ans vivant en zone d’endémie et ayant un antécédent d’infection par le virus de la dengue. En France, selon les recommandations de la Haute Autorité de santé, il n’est recommandé ni chez les personnes qui résident dans les départements ultramarins ni chez les voyageurs se rendant dans des zones endémiques.10 Une efficacité limitée sur certains sérotypes et des effets indésirables parfois sévères réduisent son intérêt.
Mesures de prévention et lutte antivectorielle
La prévention de la dengue repose sur deux piliers complémentaires : l’application des mesures de protection personnelle antivectorielle : vêtements couvrants, voire imprégnés d’insecticides, moustiquaires imprégnées, répulsifs cutanés et insecticides adaptés à l’âge, au type et à la durée du séjour ; et lutte contre les gites larvaires dans les régions endémiques ou colonisées par des Aedes.4, 6, 11 L’activité diurne (début de matinée et surtout fin d’après-midi) du vecteur doit conduire à privilégier ces mesures de prévention à ces moments.
Références
1. Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue. Nature 2013;496:504-7.
2. Wilder-Smith A, Ooi EE, Horstick O, Wills B. Dengue. Lancet 2019;393:350-63.
3. Organisation mondiale de la santé. Dengue et dengue sévère. OMS, 2019. http://bit.ly/3bqplNB
4. Santé publique France. Dengue. Dossier thématique, SPF, octobre 2019. http://bit.ly/3bkvScu
5. Franke F, Giron S, Cochet A, et al. Émergences de dengue et de chikungunya en France métropolitaine, 2010-2018. Bull Epidemiol Hebd 2019;19-20:374-82. http://bit.ly/37eVHaL
6. Ministère de la Santé. Instruction n° DGS/RI1/2015/125 du 16 avril 2015 mettant à jour le guide relatif aux modalités de mise en œuvre du plan anti-dissémination du chikungunya et de la dengue en métropole. http://bit.ly/2SfFRZ3
7. Organisation mondiale de la santé. Guide pour la prise en charge clinique de la dengue. OMS, 2013. http://bit.ly/2uzmjWG
8. Halstead S, Wilder-Smith A. Severe dengue in travelers: pathogenesis, risk and clinical management. J. Travel Med 2019;26:taz062.
9. Haut Conseil de la santé publique. Stratégies de diagnostic biologique de la dengue. HSCP, Coll. Documents, janvier 2011. http://bit.ly/2vgV4jD
10. PPAV Working Group. Personal protection against biting insects and ticks. Parasite 2011;18:93-111.
11. Haut Conseil de la santé publique. Accès précoce avant l’AMM du vaccin contre la dengue dans les territoires français d’Amérique (TFA). Avis HCSP, 2016. http://bit.ly/2UHAwvw
2. Wilder-Smith A, Ooi EE, Horstick O, Wills B. Dengue. Lancet 2019;393:350-63.
3. Organisation mondiale de la santé. Dengue et dengue sévère. OMS, 2019. http://bit.ly/3bqplNB
4. Santé publique France. Dengue. Dossier thématique, SPF, octobre 2019. http://bit.ly/3bkvScu
5. Franke F, Giron S, Cochet A, et al. Émergences de dengue et de chikungunya en France métropolitaine, 2010-2018. Bull Epidemiol Hebd 2019;19-20:374-82. http://bit.ly/37eVHaL
6. Ministère de la Santé. Instruction n° DGS/RI1/2015/125 du 16 avril 2015 mettant à jour le guide relatif aux modalités de mise en œuvre du plan anti-dissémination du chikungunya et de la dengue en métropole. http://bit.ly/2SfFRZ3
7. Organisation mondiale de la santé. Guide pour la prise en charge clinique de la dengue. OMS, 2013. http://bit.ly/2uzmjWG
8. Halstead S, Wilder-Smith A. Severe dengue in travelers: pathogenesis, risk and clinical management. J. Travel Med 2019;26:taz062.
9. Haut Conseil de la santé publique. Stratégies de diagnostic biologique de la dengue. HSCP, Coll. Documents, janvier 2011. http://bit.ly/2vgV4jD
10. PPAV Working Group. Personal protection against biting insects and ticks. Parasite 2011;18:93-111.
11. Haut Conseil de la santé publique. Accès précoce avant l’AMM du vaccin contre la dengue dans les territoires français d’Amérique (TFA). Avis HCSP, 2016. http://bit.ly/2UHAwvw