Diagnostiquer une dénutrition dans les différentes populations de patients.
Identifier les sujets à risque de dénutrition.
Prescrire un soutien nutritionnel de premier recours
Introduction
Épidémiologie
Définitions
- la dénutrition et les carences/insuffisances ou excès en micronutriments ;
- le surpoids et l’obésité.
Différents modèles de dénutrition
Le marasme est dû à une carence prolongée mais équilibrée à la fois en protéines et en énergie. Il survient lors d’une situation de privation de nourriture. L’anorexie mentale restrictive est un modèle de marasme. Les sujets touchés par cette maladie présentent peu de signes cliniques et fonctionnels en dehors d'un amaigrissement important avec perte du pannicule adipeux. L’albuminémie est longtemps conservée.
Le kwashiorkor a été décrit initialement en Afrique dans les années 1930. Il est secondaire à un déficit pur en protéines. L’installation est subaiguë. Des œdèmes et une rétention hydrosodée sont présents. L’amaigrissement est généralement moins important que dans le marasme mais la perte de masse maigre est majeure. L’hypoalbuminémie est importante.
Sarcopénie
Critères diagnostiques de la dénutrition chez les sujets de moins de 70 ans
Situation clinique particulière
Population pédiatrique
Il n’existe pas de critères consensuels pour diagnostiquer une dénutrition chez l’enfant, les indices historiques tels que l’indice de Waterlow (rapport entre le poids de l’enfant et le poids attendu pour sa taille (P/PAT)) sont en train d’être supplantés par l’indice de masse corporelle (IMC) qui est plus simple d’utilisation et bien corrélé avec les autres indices. Les valeurs normales d’IMC varient en fonction de l’âge. Un IMC inférieur au troisième percentile pour l’âge et le sexe correspond à une insuffisance pondérale et doit faire rechercher une dénutrition. Il est également crucial d’interpréter les courbes de croissance, à la recherche d’une cassure de la courbe staturopondérale qui signe le diagnostic de dénutrition. Les signes cliniques de dénutrition qui doivent être recherchés sont similaires à ceux des adultesPopulation avec une obésité
Chez les sujets présentant une obésité, l’excès de masse grasse peut souvent masquer la dénutrition. En effet, malgré une perte de poids parfois importante, l’IMC peut rester élevé chez ces sujets et peut faussement rassurer le patient et le clinicien qui souvent se réjouissent d’une perte de poids. Néanmoins, en situation d’agression, il existe une perte de masse maigre importante y compris chez les sujets présentant une obésité. Si elle n’est pas jugulée par une prise en charge nutritionnelle adaptée, elle précipite le sujet vers l’obésité sarcopénique, qui a un pronostic très défavorable. Le développement, en pratique clinique, d’outils pour la mesure de la composition corporelle devrait permettre de mieux dépister ces patients. D’ici là, il convient d’appliquer les mêmes critères que ceux définis pour la population générale, en gardant à l’esprit que le critère fondé sur l’IMC est pris en défaut dans cette population.Repérer les patients à risque de dénutrition
La dénutrition peut avoir de multiples causes, qu’elles soient liées à une carence isolée d’apport, à une malabsorption ou à un hypercatabolisme.
Plusieurs situations favorisent la carence isolée d’apports : la diminution de la capacité masticatoire, les troubles de la déglutition, les déficits moteurs ou tremblements des membres supérieurs, les détériorations intellectuelles, la perte d’autonomie, les douleurs chroniques (physiques ou psychiques), les traitements et thérapies agressives (chimiothérapies, radiothérapie, immunosuppresseurs…) ou les régimes abusifs (sans sel strict…).
De même, plusieurs situations favorisent une malabsorption ou un hypercatabolisme : les pathologies malignes, les pathologies malabsorptives intestinales, les pathologies inflammatoires du tube digestif, les maladies infectieuses chroniques, les brûlures étendues, les chirurgies majeures (notamment carcinologiques ou digestives) et les insuffisances d’organe (rénales, hépatiques, cardiaque, respiratoire…).
L’hospitalisation est également une situation à risque de dénutrition. Dans la majorité des cas, la dénutrition du malade hospitalisé est la conséquence d’une maladie aiguë ou chronique et est un des témoins de la gravité de cette maladie. Le processus de dénutrition a bien souvent débuté longtemps avant l’hospitalisation et s’aggrave au cours du séjour hospitalier car elle est méconnue, par insuffisance d’apports à l’hôpital (période de jeûne), parce que sa prise en charge est insuffisante ou parce que l’hypercatabolisme est majeur et difficile à compenser par le support nutritionnel. La dénutrition hospitalière touche tous les services hospitaliers (chirurgie, médecine, réanimation…).
Évaluation clinique de l’état nutritionnel
L’examen clinique commence par un interrogatoire qui fera préciser les signes fonctionnels, conséquences de la dénutrition. L’examen clinique recherchera les signes cliniques de dénutrition.
Les principaux signes fonctionnels sont :
- un défaut de mémorisation ;
- une asthénie, une diminution des capacités physiques (et notamment une faiblesse musculaire) ;
- un désintérêt pour les activités courantes ;
- une perte des fonctions sexuelles chez l’homme et une aménorrhée secondaire chez la femme.
- une fonte du tissu adipeux sous-cutané, une fonte musculaire (des membres, des golfes temporaux, au niveau des arcades zygomatiques, des quadriceps et des deltoïdes) ;
- des œdèmes des membres inférieurs et des lombes (notamment chez les sujets alités) ;
- une altération des phanères (cheveux secs et cassants, ongles striés et cassants) ;
- une peau sèche, hyperpigmentée et desquamante, une hypertrichose lanugineuse du dos ;
- des troubles vasomoteurs (pétéchies, acrosyndrome ou allongement du temps de recoloration cutanée) ;
- des anomalies des muqueuses (glossite, stomatite, œsophagite) ;
- des signes spécifiques de carences vitaminiques, une hypotension artérielle orthostatique voire une bradycardie, et des troubles digestifs à type de constipation.
Parmi tous ces symptômes, le signe clinique principal de dénutrition est l’amaigrissement. Pour obtenir un poids fiable, le sujet doit être déshabillé en sous-vêtements, vessie vide, et si possible la mesure doit être faite le matin à jeun. Chez le patient ne pouvant être mis en position orthostatique ou chez qui la mesure de la taille peut être faussée (cyphose…), la mesure de la hauteur talon-genou permet son estimation. La distance talon-genou est en effet bien corrélée à la taille maximale atteinte. Elle est mesurée avec une toise pédiatrique, la cuisse et la jambe d’une part, la jambe et le pied d’autre part formant deux angles droits. Le poids doit être rapporté à la taille pour obtenir l’IMC, c’est-à-dire poids (kg)/taille (m)². L’IMC permet d’évaluer l’état nutritionnel (
Il est également crucial de calculer le déficit pondéral en pourcentage par rapport au poids de référence (ou poids de forme) du sujet, pour suspecter une dénutrition et en évaluer sa gravité.
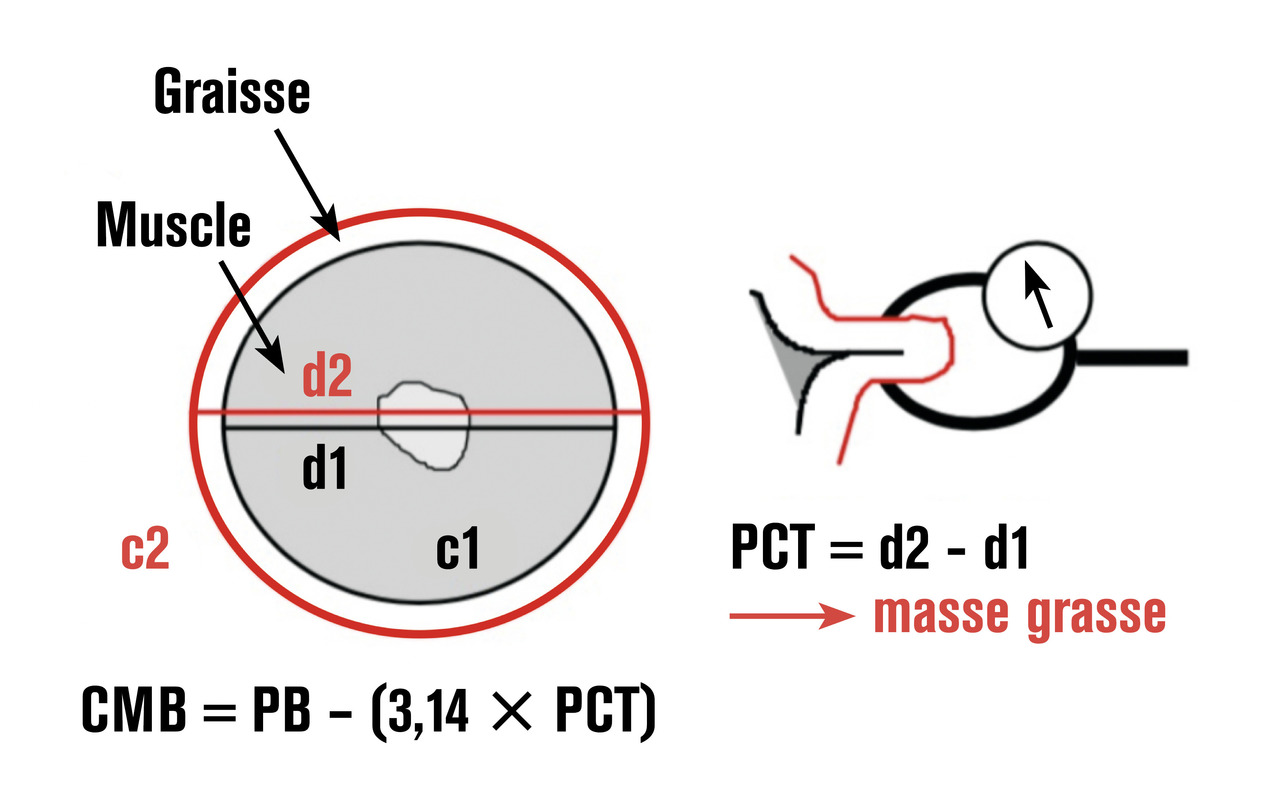
L’état des réserves adipeuses peut, quant à être évalué par la mesure du pli cutané tricipital, estimée en moyenne à 12 mm chez l’homme et 25 mm chez la femme d’après les tables de Heymsfield. La masse maigre peut également être estimée à partir de la mesure de la circonférence musculaire brachiale obtenue par la mesure du périmètre brachial et du pli cutané tricipital au niveau du même bras (fig.
Les tests de force musculaire sont des méthodes simples, non invasives, permettant d’évaluer l’état nutritionnel d’un individu par la mesure de la force musculaire. La masse protéique corporelle et la force musculaire étant liées, la mesure de la force musculaire est donc un reflet du capital protéique. Cette force peut être évaluée par dynamomètre hydraulique à main étalonné (appelé aussi Hand grip). La force musculaire est diminuée en cas de dénutrition, inférieure à 20 kg chez la femme, et à 30 kg chez l’homme. Sa mesure peut être un bon critère d’évaluation de la renutrition.
Évaluation biologique de l’état nutritionnel
L’albumine est le marqueur nutritionnel le plus anciennement utilisé, mais il s’avère être un marqueur plus pronostique que diagnostique. L’albumine représente la moitié des protéines synthétisées par le foie, et sa synthèse s’adapte en fonction des besoins. La concentration plasmatique normale est comprise entre 35 et 50 g/L chez l’adulte, soit environ la moitié du pool total d’albumine. Sa demi-vie est longue, entre 21 et 30 jours. En cas de dénutrition, la synthèse d’albumine diminue et la concentration plasmatique chute. Une albuminémie inférieure à 30 g/L signe une dénutrition protidique. Un syndrome inflammatoire (protéine C réactive > 15 mg/L), une insuffisance hépatocellulaire, une glomérulopathie ou une entéropathie exsudative peuvent entraîner une hypoalbuminémie.
La transthyrétine (ou pré-albumine) est également synthétisée par le foie mais aussi par le système nerveux central et par le pancréas. Sa concentration sérique normale se situe entre 250 et 350 mg/L, avec d’importantes variations physiologiques (âge, sexe…). Sa demi-vie est courte, entre 2 et 3 jours, ce qui fait de la pré-albumine un marqueur sensible et précoce de la dénutrition mais aussi et surtout un marqueur de suivi de la renutrition.
Évaluation de la composition corporelle
Les données anthropométriques, telles que les mesures des plis cutanés ou de la circonférence musculaire brachiale, constituent un moyen simple et peu coûteux d’évaluation. Le suivi longitudinal par des mesures répétées compense le manque de précision. À ce jour, la technique de référence en pratique clinique est l’absorptiométrie bi-énergétique (DEXA). Si elle n’est pas disponible, l’impédancemétrie bioélectrique est un second choix acceptable mais est pris en défaut chez les sujets de poids extrêmes et en présence d’œdèmes.
L’évaluation de la composition corporelle par scanographie ou imagerie par résonance magnétique tend à suppléer les techniques standard peu disponibles en routine, notamment en oncologie.
Ces examens, faits dans le cadre du suivi, permettent de déterminer et de suivre les modifications de composition corporelle. Il a ainsi été démontré que la perte de masse maigre est un facteur péjoratif.
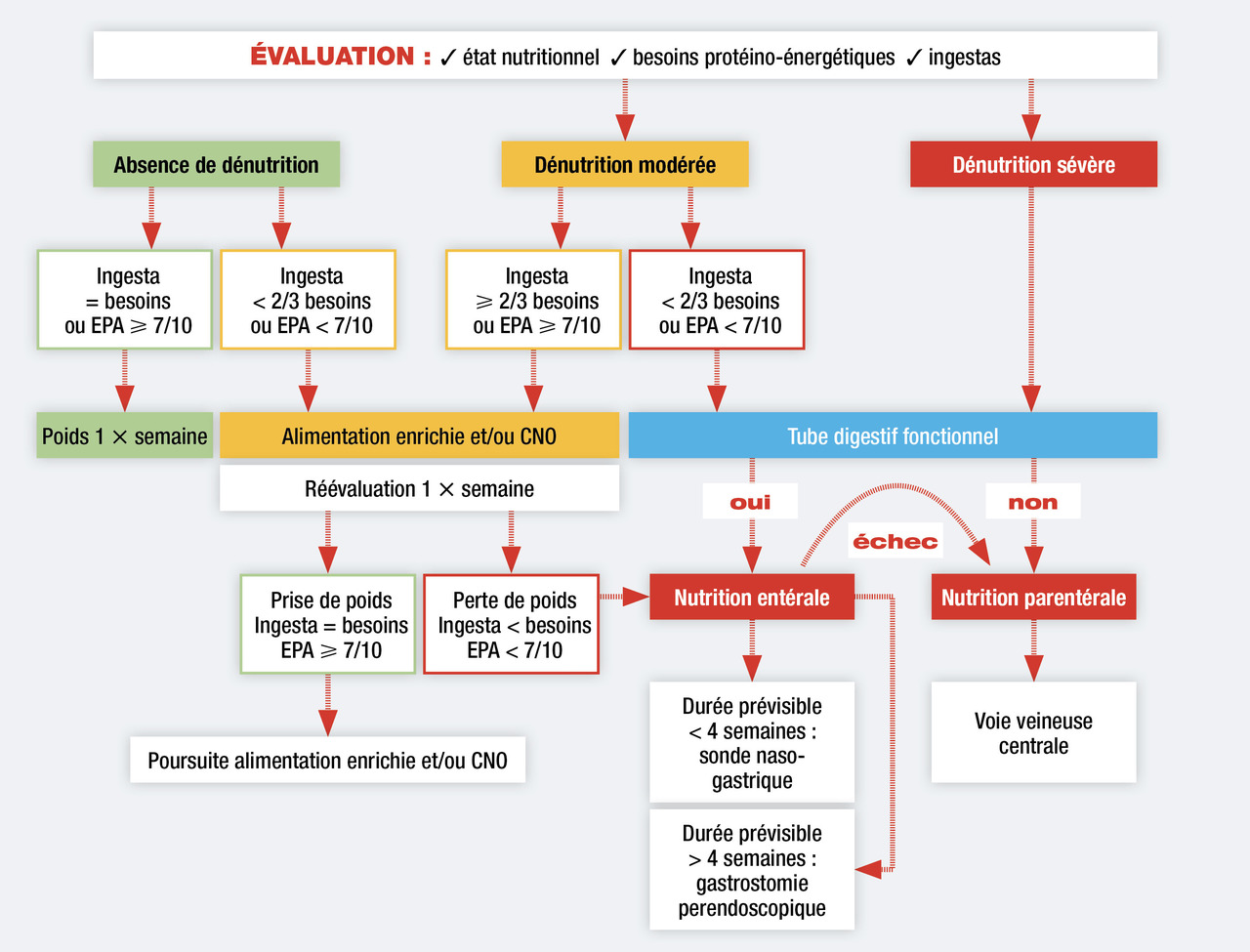
Prise en charge nutritionnelle de l’adulte
Le traitement de la dénutrition doit s’inscrire dans la prise en charge thérapeutique de la maladie causale et permettra d’en améliorer, bien souvent, le pronostic. La prise en charge nutritionnelle doit permettre un apport adéquat des différents nutriments, oligoéléments et vitamines pour permettre de restaurer les fonctions de la masse cellulaire active telles que les fonctions immunitaires, musculaires et de cicatrisation. Le but n’est pas d’obtenir une simple reprise de poids. Dans un premier temps, il convient de déterminer les besoins énergétiques du patient en fonction de ses paramètres anthropométriques et de sa situation clinique (hypermétabolisme, activité physique). Ceux-ci peuvent être mesurés (calorimétrie indirecte) ou estimés (équation de Harris et Benedict). D’une manière générale, les besoins énergétiques totaux sont compris entre 20 et 35 kcal/kg/j et peuvent être augmentés jusqu’à 40 kcal/kg/j en cas de dénutrition ou agression sévère. L’apport en protéines quant à lui est de l’ordre de 1 à 1,5 g/kg/j. Pour estimer les besoins d’un patient, on se référera toujours au poids à la prise en charge, excepté pour les patients obèses ou présentant une rétention hydrosodée, pour lesquels il faudra estimer respectivement le poids idéal ajusté (
Enrichissement et complémentation orale
Si malgré l’enrichissement, les besoins ne sont pas couverts, on pourra proposer la prise d'un complément nutritionnel oral. Cette complémentation permettra d’apporter sous un faible volume un apport en calories, nutriments, vitamines et minéraux. Les apports complémentaires sont iso- ou hypercaloriques, avec des teneurs en protéines allant de 6 à 29 g par portion. Certains sont enrichis en élément spécifique (oméga 3, arginine, zinc…). Les textures sont variées (jus, crème, soupe, gâteaux…) afin de satisfaire au mieux le goût des patients. Ils sont à consommer à distance des repas, plutôt frais. Certains peuvent être ajoutés aux préparations culinaires. La prise de plus de deux compléments nutritionnels oraux est souvent difficile à obtenir, et si les besoins ne sont pas atteints il faudra mettre en place un support nutritionnel entéral. Les patients présentant une dénutrition sévère doivent d’emblée recevoir une nutrition entérale.
Nutrition entérale
Nutrition parentérale
Surveillance clinico-biologique
Prise en charge nutritionnelle de l’enfant
Il faut mettre en route un support nutritionnel dès lors que :
- IMC < 3e percentile ;
- ou poids/taille < 80 % si dénutrition aiguë et < 85 % si dénutrition chronique.
Enrichissement oral
Nutrition entérale
Nutrition parentérale
Dénutrition chez l’adulte et l’enfant
L’évaluation de l’état nutritionnel, sa surveillance et sa correction doivent être intégrées dans la prise en charge globale des patients.
Tous les patients doivent être pesés et mesurés, le poids doit être régulièrement réévalué.
Une perte de poids involontaire de plus de 10 % en 6 mois est le témoin d’une dénutrition, jusqu’à preuve du contraire.
L’évaluation de l’état nutritionnel et le diagnostic de dénutrition reposent essentiellement sur des critères cliniques simples. L’interprétation des données biologiques de l’état nutritionnel doit tenir compte des pathologies associées.
Un support nutritionnel adapté doit être proposé à tout patient dénutri ou à risque de dénutrition.
Poids idéal ajusté (obèse)
➥ Poids idéal ajusté =
poids idéal théorique + ¼ (poids actuel – poids idéal théorique)
➥ Mesure du poids idéal théorique (PIT) =
PIT = X + 0,91 × (taille – 152,4)
avec X femme = 45,5 et X homme = 50 et taille en centimètres
Hankard R, Colomb V, Piloquet H, Bocquet A, Bresson JL, Briend A, Chouraqui JP, et al. 2012. Malnutrition screening in clinical practice. Archives de pédiatrie : organe officiel de la Société francaise de pédiatrie 19 (10): 1110-17. https://doi.org/10.1016/j.arcped.2012.07.024.
Collège des enseignants de nutrition. 2015. Nutrition : réussir les ECNi. 2e édition. Elsevier Masson.
Traité de nutrition clinique à tous les âges de la vie. Paris, K’Noë éditions, 2016.
Recommandations de la HAS : Stratégie de prise en charge en cas de dénutrition protéino-énergétique chez la personne âgée, 2008.
Évaluation diagnostique de la dénutrition protéino-énergétique des adultes hospitalisés, 2003.

 Encadrés
Encadrés