Le dépistage n’est pas une affaire idéologique, il faut examiner les données et les comprendre
Hors population à haut risque, le dépistage du cancer du sein par mammographie est recommandé aujourd’hui en France à toutes les femmes entre 50 et 74 ans. Dans le numéro de janvier 2024 de La Revue du Praticien,1 on peut lire, sous la plume de personnels de l’Institut national du cancer (INCa) et de l’Agence régionale de santé (ARS) : « Le principe de ce dépistage conserve des opposants en France. Bien que la mortalité par cancer du sein ait diminué entre 1990 et 2010, passant de 70 à 82 % de survie à 10 ans, ceux-ci s’appuient principalement sur la difficulté à évaluer les parts respectives dans ce progrès du dépistage et des innovations thérapeutiques ; sur le dépistage d’une frange de cancers peu ou pas évolutifs qui pourrait être comprise entre 10,7 et 19 %, considérée comme un surdiagnostic (terme consacré mais assez peu heureux sur le plan sémantique, s’agissant d’authentiques cancers) ; ou sur les risques d’une irradiation dont les doses cumulées sont néanmoins inférieures à celle d’un seul examen tomodensitométrique ». Ce texte laisse entendre que les risques associés au dépistage ne sont que des arguments fallacieux utilisés par les « opposants au dépistage ». Or, ils sont aussi réels que les bénéfices ! L’important est de les mesurer pour pouvoir choisir en connaissance de cause. Faisons le point.
Le dépistage expose à 3 types de risques
- Une mammographie positive peut entraîner des examens complémentaires non invasifs ou invasifs (biopsie) pour finalement conclure qu’il ne s’agit pas d’un cancer. Cette mammographie aura été un faux positif. C’est une épreuve pénible pour la patiente.
- Une mammographie expose à une dose de radiations ionisantes. Pour l’INCa :2 « Le nombre de décès évités avec le dépistage est largement supérieur au risque de décès par cancer radio-induit, qui est de l’ordre de 1 à 10 pour 100 000 femmes ayant réalisé une mammographie tous les 2 ans pendant 10 ans ». L’INCa précise aussi que :3 « si une femme suit strictement la recommandation de participation au programme de dépistage organisé de 50 à 74 ans, […] son exposition aux rayonnements ionisants représentera alors au total le quart de celle provoquée par un scanner abdominopelvien, acte très courant ».
- Enfin, on peut détecter (et traiter) un cancer qui ne serait jamais devenu symptomatique du vivant de la personne ; on parle alors de surdiagnostic. A priori, il peut sembler évident qu’il vaut mieux détecter un cancer précocement parce qu’il sera plus facile à traiter. Mais l’existence du surdiagnostic, bien démontré pour les cancers de la prostate, de la thyroïde et du neuroblastome de l’enfant,4 entame cette certitude. Le surdiagnostic expose une femme à un traitement. Or un cancer du sein, même s’il est limité à l’intérieur des canaux galactophores, peut être diffus, nécessitant une mastectomie, une reconstruction et souvent une symétrisation, l’ensemble du traitement pouvant s’étaler sur un an. Par ailleurs, recevoir un diagnostic de cancer est source d’angoisse. Le surdiagnostic entraîne automatiquement une amélioration de la survie après diagnostic puisqu’une partie des cancers trouvés n’auraient jamais contribué au décès. On ne peut donc pas attribuer au dépistage toute l’amélioration de la survie à 10 ans observée entre 1990 et 2010 puisqu’une partie pourrait être attribuable au surdiagnostic, et une autre – probablement plus importante – à l’amélioration des traitements.
Estimation du taux de surdiagnostic : environ 10 %
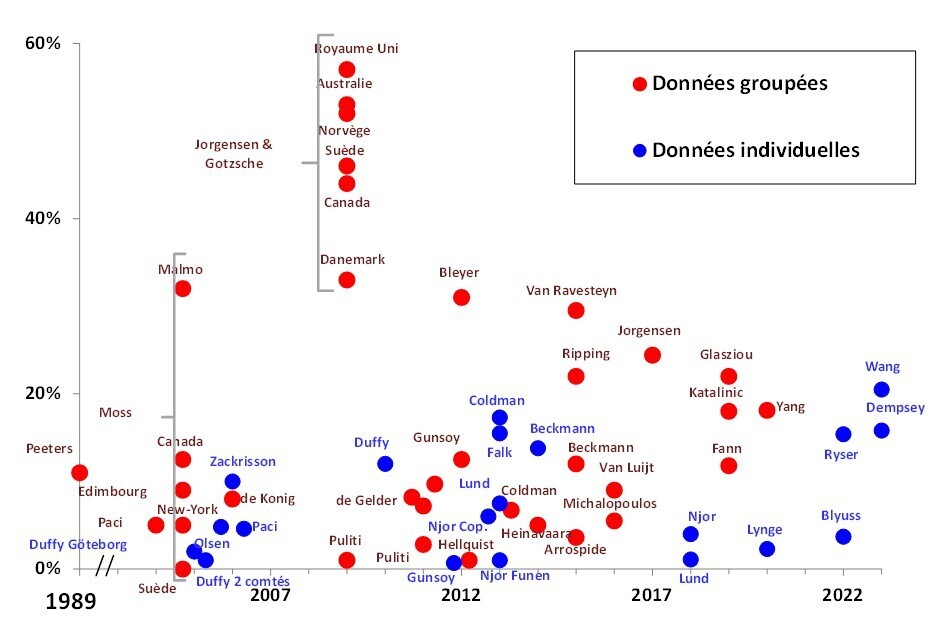
Le risque de surdiagnostic est un élément majeur de la controverse parce qu’il est difficile à estimer : on ne sait pas identifier, parmi les cancers du sein trouvés par le dépistage, ceux qui seraient restés latents. On ne peut le faire que sur la base d’arguments statistiques.
En théorie, le principe est simple : on compare deux populations, constituées par tirage au sort, l’une invitée au dépistage tous les deux ans entre 50 et 74 ans et l’autre sans dépistage. On trouvera plus de cancers dans le groupe dépisté que dans le groupe non dépisté ; en effet le dépistage avance la date du diagnostic : une partie des cancers trouvés chez les femmes de 50 à 74 ans seraient devenus symptomatiques quand elles auraient été plus âgées. En conséquence, on attend moins de cancers à partir de 75 ans dans la population dépistée, puisqu’une partie de ces cancers a été trouvée plus tôt. En l’absence de surdiagnostic, l’augmentation initiale du nombre de cancers dans les groupes d’âge soumis au dépistage serait entièrement compensée par une diminution similaire du nombre de cancers dans les groupes d’âge plus avancés, auxquels le dépistage n’est plus proposé. Le nombre de cancers surdiagnostiqués est simplement la différence entre les nombres de cancers détectés à partir de 50 ans dans chaque population (dépistée et non dépistée), idéalement suivies jusqu’à extinction des populations. Malheureusement, ces données idéales n’existent pas car, dans les essais réalisés, on a proposé le dépistage au groupe contrôle à la fin de l’essai.
Les estimations publiées, qui reposent sur des données bien moins parfaites, varient entre 0 % et un peu moins de 60 % (fig. 1). Les principales causes de ces variations5,6 sont la nature des données utilisées et la durée de suivi après le dépistage. Les estimations les plus élevées, sur lesquelles se fondent les détracteurs du dépistage (Cancer Rose, Bernard Duperray…)sont le résultat de nombreuses approximations (populations de différentes classes d’âge, pas de prise en compte de la participation individuelle au dépistage, suivi post-dépistage trop court...). Considérer que le surdiagnostic représente environ 10 % des cancers dans la population dépistée paraît une estimation raisonnable.
Un bénéfice surestimé
Pour évaluer le bénéfice, les données les plus fiables proviennent des essais cliniques randomisés, dans lesquels des femmes, divisées en deux groupes par tirage au sort – l’un invité au dépistage, l’autre non – ont été suivies pendant plusieurs années. Environ 600 000 femmes au total ont ainsi été incluses dans 9 essais conduits dans divers pays, le plus ancien ayant commencé en 1963.7
On dispose aussi d’études observationnelles, en principe plus discutables, par exemple des enquêtes cas-témoins dans lesquelles on compare les antécédents mammographiques de femmes décédées d’un cancer du sein aux antécédents de femmes témoins.8 - 10
La synthèse des résultats de ces études est le sujet d’un débat qui dure depuis plus de vingt ans. En 2001, deux experts danois, sous l’égide de la collaboration Cochrane,11 concluaient « qu’il n’existe aucune preuve fiable que le dépistage du cancer du sein réduit la mortalité ». Ce travail a entraîné de multiples réactions. Des synthèses ultérieures estiment que le dépistage réduit le risque de décès par cancer du sein de 20 % si l’on considère uniquement les essais cliniques,12 et de 25 % à 31 % si l’on considère uniquement les études observationnelles.10 La version actuelle de la collaboration Cochrane, qui date de 2013,13 admet une réduction du risque de décès de 15 %. Une étude plus récente, portant sur les données nationales danoises, a comparé la mortalité par cancer du sein dans une région où toutes les femmes de 50 à 67 ans ont été invitées au dépistage à partir de novembre 1993 à celle dans d’autres régions où il n’y avait pas de dépistage ; elle estime que le dépistage réduit de 20 % le risque de décèspar cancer du sein.14 Cette estimation semble relativement consensuelle aujourd’hui.
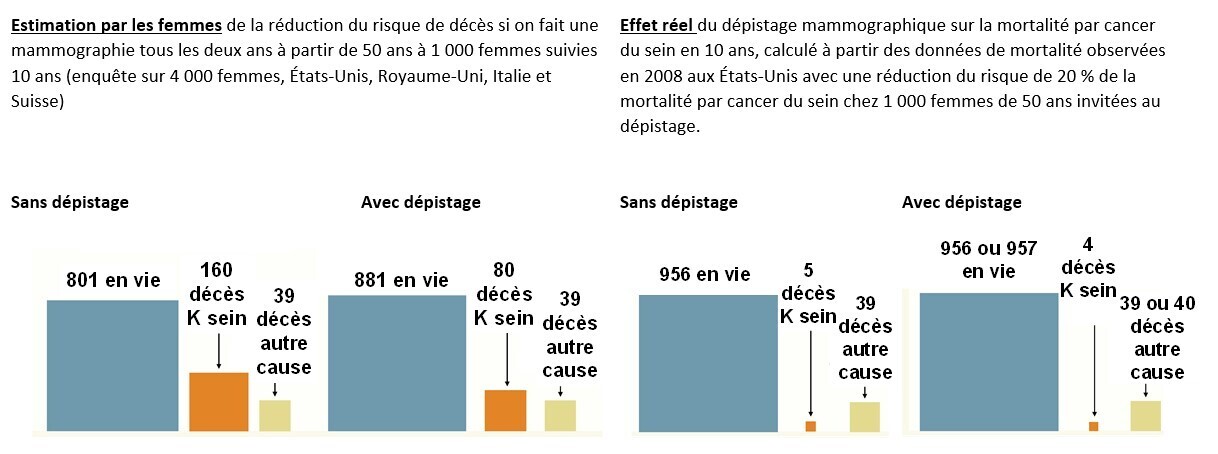
Or, le risque de décès par cancer du sein et l’efficacité du dépistage sont très surestimés par la population. En effet, des chercheurs ont demandé à 4 000 femmes résidant aux États-Unis, au Royaume-Uni, en Italie ou en Suisse d’estimer, dans une population de 1 000 femmes de 50 ans suivies 10 ans, les risques de décès par cancer du sein sans dépistage et avec un dépistage tous les deux ans.15 Elles ont estimé un risque de décès sans dépistage plus de 30 fois supérieur à la réalité, et une diminution de moitié du risque de décès grâce au dépistage (fig. 2).
Balance bénéfice/risque : pas de consensus !
La balance bénéfice/risque dépend de l’âge au premier dépistage, de la fréquence des dépistages et de la durée du suivi. Les désaccords sur cette balance bénéfice/risque sont très importants : 10 cas de surdiagnostic pour 1 décès évité parmi 1 000 femmes invitées au dépistage pendant 10 ans, d’après le groupe Cochrane nordique ;13 0,5 cas de surdiagnostic pour 1 décès évité parmi 100 femmes dépistées tous les deux ans de 50 à 69 ans et suivies jusqu’à 79 ans d’après un groupe d’experts européen.16 Exprimer la balance bénéfice/risque sous la forme d’un rapport entre le nombre de surdiagnostic et le nombre de décès évités n’est pas directement interprétable. Il manque la mesure de chacun de ces risques.
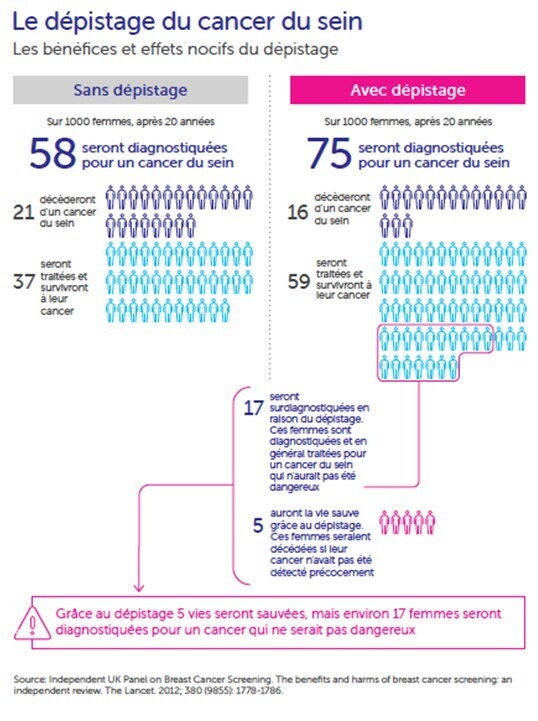
D’après Cancer Research UK :17 « avec le dépistage, sur 1 000 femmes dépistées régulièrement, au bout de 20 ans, 75 auront un cancer du sein diagnostiqué et traité, 16 en mourront et 59 seront traitées et survivront. Sur 1 000 femmes sans dépistage, au bout de 20 ans, 58 auront un cancer du sein diagnostiqué et traité, 21 en mourront et 37 seront traitées et survivront ». C’est-à-dire que, pour 1 000 femmes dépistées à partir de 50 ans, on a5 décès en moins et 17 femmes traitées pour un cancer qui ne se serait jamais manifesté. La figure 3 extraite d’un rapport de l’OMS18 illustre ces données.
Le risque de décès par cancer du sein augmente avec l’âge en l’absence de dépistage, donc le bénéfice du dépistage augmente aussi avec l’âge. Ainsi, pour un groupe d’experts canadiens,19pour éviter 1 décès (avec un suivi de 7 ans), il faut dépister tous les 2 ou 3 ans : 1 724 femmes entre 40 et 49 ans, 1 333 entre 50 et 59 ans, 1 087 entre 60 et 69 ans et 645 entre 70 et 74 ans.
Un dépistage qui commence à un âge dépendant d’une estimation du risque individuel est actuellement à l’étude en Europe 20 et aux États-Unis 21.
Proposition d’étendre le dépistage aux femmes de 40 à 49 ans
Tout récemment, une nouvelle publication de la US Preventive Services Task Force22 - 24 recommande d’étendre le dépistage du cancer du sein à toutes les femmes de 40 à 49 ans aux États-Unis.
Les conséquences de cette extension ont été étudiées en prenant le résultat médian des modélisations établies par six équipes différentes. L’extension du dépistage aux femmes de 40 à 49 ans pourrait éviter 1,3 ou 1,5 décès en plus pour 1 000 femmes. Mais cette extension entraînerait 2 cas de surdiagnostic (estimation très incertaine car elle varie entre 0 et 4 selon le modèle). La justification de cette recommandation semble être l’observation que les femmes noires ont un risque augmenté de 40 % de mourir d’un cancer du sein par rapport au risque chez les femmes blanches, et donc qu’elles vont tirer un bénéfice plus grand de l’extension du dépistage. Mais la santé des femmes issues de milieux défavorisés ne sera pas améliorée par un dépistage plus précoce si l’accès à une bonne prise en charge après le diagnostic n’est pas facilité. Cette publication, qui risque de faire couler beaucoup d’encre, est accompagnée d’un texte relativement critique.25
Une communication défaillante et contreproductive
Les informations disponibles sur l’efficacité du dépistage ne sont pas clairement communiquées et les estimations du risque de surdiagnostic reposent soit sur des analyses trop complexes pour être comprises par la plupart des lecteurs, soit sur des analyses trop simplistes pour arriver à un résultat correct.
Par exemple, la plaquette d’information diffusée par l’INCa (l’agence d’expertise sanitaire et scientifique en cancérologie de l’État) ne met en avant qu’un avantage qualitatif du dépistage (« plus les cancers du sein sont détectés tôt et plus les chances de guérison sont importantes ») et un chiffre difficile à interpréter : « La détection précoce permet à 99 femmes sur 100 d’être en vie 5 ans après le diagnostic ».
Ainsi, si les détracteurs du dépistage campent avec acharnement sur les estimations les plus fausses du surdiagnostic, les autorités françaises, en faisant la promotion de ce dépistage tout en niant ses inconvénients, ont une attitude infantilisante vis-à vis des femmes.
Cette communication défectueuse est, en plus, contreproductive : en 2022, seulement 45 % des femmes de 50 à 74 ans ont eu une mammographie dans les deux ans dans le cadre du dépistage organisé (même s’il il faut ajouter à ce pourcentage environ 10 % des femmes ayant eu une mammographie de dépistage en dehors de ce cadre).
Par ailleurs, le dépistage du cancer du sein est l’objet d’une couverture médiatique beaucoup plus importante que les dépistages du cancer du col de l’utérus et du cancer colorectal, alors que ces derniers sont beaucoup plus efficaces, car en partie préventifs. En trouvant et en traitant les dysplasies du col utérin et en vaccinant la population préadolescente contre les papillomavirus, on peut éradiquer le cancer du col de l’utérus. En trouvant et en traitant les gros polypes qui saignent dans le côlon, on peut prévenir une large proportion des cancers colorectaux.
Le dépistage du cancer du sein ne prévient pas l’apparition de ce cancer. Tout ce que peut faire une mammographie, c’est détecter un cancer plus précocement.
Il existe des moyens de prévenir ce cancer : il faut réduire sa consommation de boisson alcoolisée autant que possible (et le vin est de l’alcool !) car le risque augmente de 7 % par verre quotidien, éviter le surpoids et l’obésité,et n’avoir recours au traitement hormonal de la ménopause, pour une durée aussi courte que possible, que si les symptômes sont gênants – pour ne citer que les causes de cancer du sein les plus importantes en France à l’heure actuelle.26
Participer au programme national de dépistage du cancer du sein en continuant à fumer, à boire plus de 100 g d’alcool pur (soit 10 verres* de boisson alcoolisée) par semaine ou en étant en surpoids ou obèse, c’est avoir une stratégie inadaptée.
2. INCa. Les bénéfices et les limites du dépistage.
3. INCa. Le dépistage des cancers du sein. Mon livret d’informations pratiques. Septembre 2022.
4. Dunn BK, Woloshin S, Xie H, et al. Cancer overdiagnosis: a challenge in the era of screening. J Natl Cancer Cent 2022;2(4):235-242.
5. Chaltiel D, Hill C. Estimations of overdiagnosis in breast cancer screening vary between 0% and over 50%: why? BMJ Open 2021;11(6):e046353.
6. Njor SH, Paci E, Rebolj M. As you like it: How the same data can support manifold views of overdiagnosis in breast cancer screening. Int J Cancer 2018;143(6):1287-1294.
7. Jacklyn G, Glasziou P, Macaskill P, et al. Meta-analysis of breast cancer mortality benefit and overdiagnosis adjusted for adherence: improving information on the effects of attending screening mammography. Br J Cancer 2016;114(11):1269-76.
8. Blyuss O, Dibden A, Massat NJ, et al. A case-control study to evaluate the impact of the breast screening programme on breast cancer incidence in England. Cancer Med 2023;12:1878-1887.
9. Otto SJ, Fracheboud J, Verbeek AL, et al; National Evaluation Team for Breast Cancer Screening. Mammography screening and risk of breast cancer death: a population-based case-control study. Cancer Epidemiol Biomarkers Prev 2012;21(1):66-73.
10. Broeders M, Moss S, Nyström L, et al, for the EUROSCREEN Working Group. The impact of mammographic screening on breast cancer mortality in Europe: a review of observational studies. J Med Screen 2012;19(suppl 1):14-25.
11. Olsen O, Gøtzsche PC. Cochrane review on screening for breast cancer with mammography. Lancet 2001;358:1340-42.
12. Independent UK Panel on Breast Cancer Screening. The benefits and harms of breast cancer screening: an independent review. Lancet 2012;380(9855):1778-1786.
13. Gøtzsche PC, Jørgensen KJ. Screening for breast cancer with mammography. Cochrane Database Syst Rev 2013;2013(6):CD001877.
14. Lynge E, Beau AB, von Euler‑Chelpin M, et al. Breast cancer mortality and overdiagnosis after implementation of population-based screening in Denmark. Breast Cancer Res Treat 2020 Dec;184(3):891-899.
15. Biller-Andorno N, Jüni P. Abolishing mammography screening programs? A view from the Swiss Medical Board. N Engl J Med 2014;370(21):1965-7.
16. Paci E, for the EUROSCREEN Working Group. Summary of the evidence of breast cancer service screening outcomes in Europe and first estimate of the benefit and harm balance sheet. J Med Screen 2012;19(suppl 1):5-13.
17. Cancer Research UK. Breast screening. 26 mai 2023.
18. OMS. Programmes de dépistage. Guide succinct. Accroître leur efficacité et optimiser le rapport entre bénéfices et effets nocifs. 2020 ; Ryser MD, Lange J, Inoue LYT, et al. Estimation of Breast Cancer Overdiagnosis in a U.S. Breast Screening Cohort. Ann Intern Med 2022;175(4):471-478.
19. Canadian Task Force on Preventive Health Care. Breast cancer screening. Mars 2024.
20. My PeBS (Personalising Breast Screening) : https://www.mypebs.eu/
21. The Wisdom Study (Women Informed to Screen Depending On Measures of risk) : https://www.thewisdomstudy.org/
22. US Preventive Services Task Force. Screening for Breast Cancer. US Preventive Services Task Force Recommendation Statement. JAMA, published online April 30, 2024.
23. Henderson JT, Webber EM, Weyrich MS, et al. Screening for Breast Cancer. Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA, published online April 30, 2024.
24. Trentham-Dietz A, Chapman CH, Jayasekera J, et al. Collaborative modeling to compare different breast cancer screening strategies: a decision analysis for the US Preventive Services Task Force. JAMA, published online April 30, 2024.
25. Rubin R. Despite New Recommendations, the Debate Over Mammography Guidelines Continues. JAMA, published online May 3, 2024.
26. Soerjomataram I, Shield K, Marant-Micallef C, et al. Cancers related to lifestyle and environmental factors in France in 2015. Eur J Cancer 2018;105:103-113.
Dans cet article
- Le dépistage n’est pas une affaire idéologique, il faut examiner les données et les comprendre
- Le dépistage expose à 3 types de risques
- Estimation du taux de surdiagnostic : environ 10 %
- Un bénéfice surestimé
- Balance bénéfice/risque : pas de consensus !
- Proposition d’étendre le dépistage aux femmes de 40 à 49 ans
- Une communication défaillante et contreproductive