Le médecin généraliste est souvent confronté, lors de l’annonce d’un diabète, à une grande inquiétude du patient. Les premières consultations ont plusieurs objectifs : affirmer et préciser le diagnostic, discuter du pronostic et donc de la surveillance, débuter le traitement, en fixant des objectifs.
Le diagnostic repose sur la mise en évidence d’une glycémie à jeun supérieure à 1,26 g/L. à partir de ce seuil, le risque à long terme de complications microvasculaires spécifiques (rétinopathie) est significatif.1 La confirmation du diagnostic requiert soit 2 dosages témoignant d’une hyperglycémie (à 2 moments différents), soit une seule mesure supérieure à 2 g/L accompagnée de signes cliniques (syndrome polyuro-polydypsique, amaigrissement).
Pour l’Association américaine du diabète (ADA), on peut établir le diagnostic lorsque l’HbA1c est supérieure à 6,5 %. En France, la majorité des premiers dosages de ce marqueur est déjà indiquée à visée de dépistage.2
Pour l’Association américaine du diabète (ADA), on peut établir le diagnostic lorsque l’HbA1c est supérieure à 6,5 %. En France, la majorité des premiers dosages de ce marqueur est déjà indiquée à visée de dépistage.2
Chez qui doser la glycémie ?
Elle fait partie du bilan biologique que beaucoup de médecins prescrivent annuellement à leurs patients. Pour les sujets vus très ponctuellement, un repérage par glycémie digitale est possible au cabinet, mais il est moins précis et rarement effectué à jeun.
Il n’est cependant pas démontré qu’un dépistage systématique du diabète fait baisser l’incidence des complications. Il faut en fait un argument pour prescrire une glycémie. C’est impératif en cas de signes cliniques ou de complication vasculaire.
Le diabète de type 2 reste asymptomatique pendant plusieurs années, avant que l’hyperglycémie ne dépasse 2 g/L et entraîne une glycosurie.
Ainsi, il faut repérer les sujets à risque, c’est-à-dire ayant :
– une obésité ;
– des signes du syndrome métabolique (tour de taille élevé, dyslipidémie avec hypertriglycéridémie et HDL-cholestérol bas, HTA) ;
– des antécédents familiaux de diabète et obstétricaux (macrosomie néonatale ou diabète gestationnel).
Ils doivent motiver un dosage de glycémie à jeun (on parle de dépistage « opportuniste »).
Il n’est cependant pas démontré qu’un dépistage systématique du diabète fait baisser l’incidence des complications. Il faut en fait un argument pour prescrire une glycémie. C’est impératif en cas de signes cliniques ou de complication vasculaire.
Le diabète de type 2 reste asymptomatique pendant plusieurs années, avant que l’hyperglycémie ne dépasse 2 g/L et entraîne une glycosurie.
Ainsi, il faut repérer les sujets à risque, c’est-à-dire ayant :
– une obésité ;
– des signes du syndrome métabolique (tour de taille élevé, dyslipidémie avec hypertriglycéridémie et HDL-cholestérol bas, HTA) ;
– des antécédents familiaux de diabète et obstétricaux (macrosomie néonatale ou diabète gestationnel).
Ils doivent motiver un dosage de glycémie à jeun (on parle de dépistage « opportuniste »).
Identifier le type de diabète
Le plus fréquent est le diabète de type 2 (> 90 %). Sa définition physiopathologique – association d’une insulinorésistance et d’une carence insulinique relative – ne facilite pas la tâche du clinicien au quotidien, car les dosages d’insulinémie, d’interprétation délicate, ne sont pas recommandés.
Il faut donc s’appuyer sur des arguments, dont le recueil prend 1 à 2 minutes d’entretien pour éliminer un diabète de type 1 (tableau 1 ).
Classiquement, le diagnostic est fait sur une glycémie de dépistage chez un sujet âgé de plus de 40 ans, ayant un surpoids androïde (IMC > 25 au cours de sa vie), des signes du syndrome métabolique (tour de taille élevé, HTA, dyslipémie) et des antécédents familiaux et/ou obstétricaux pour les femmes. Lorsque ces éléments ne sont pas réunis, il faut évoquer d’autres types de diabète.
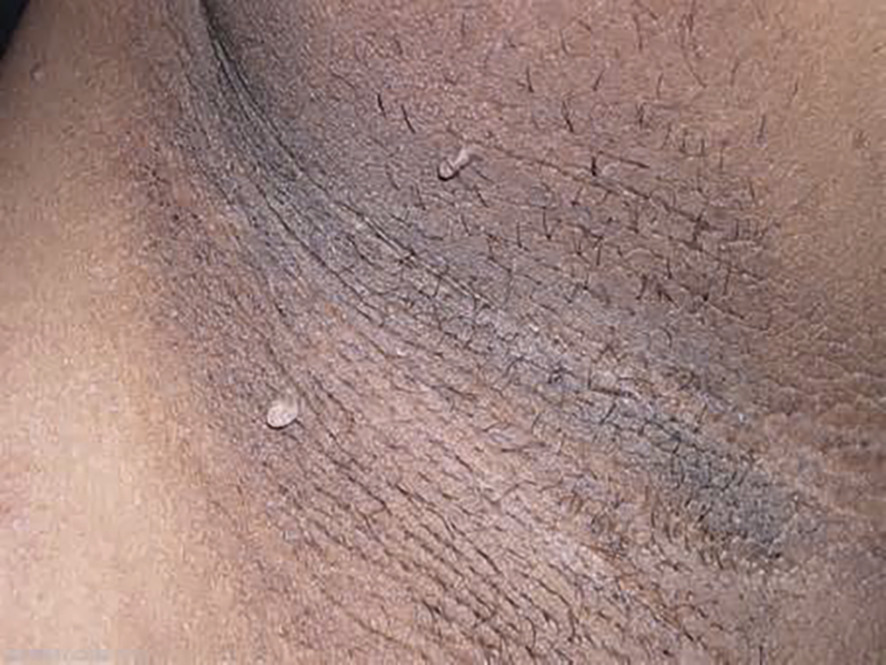
Chez les sujets jeunes, un acanthosis nigricans (fig. 1 ) est un argument majeur témoignant de l’insulinorésistance du diabète de type 2.
Il faut donc s’appuyer sur des arguments, dont le recueil prend 1 à 2 minutes d’entretien pour éliminer un diabète de type 1 (
Classiquement, le diagnostic est fait sur une glycémie de dépistage chez un sujet âgé de plus de 40 ans, ayant un surpoids androïde (IMC > 25 au cours de sa vie), des signes du syndrome métabolique (tour de taille élevé, HTA, dyslipémie) et des antécédents familiaux et/ou obstétricaux pour les femmes. Lorsque ces éléments ne sont pas réunis, il faut évoquer d’autres types de diabète.
Chez les sujets jeunes, un acanthosis nigricans (
Quels diagnostics différentiels ?
Pour mémoire, la survenue de signes cardinaux de diabète chez un sujet jeune, maigre, est en faveur d’un type 1 inaugural, pour lequel il faut sans tarder mettre en route une insulinothérapie, accompagnée de l’éducation thérapeutique.
L’analyse de l’histoire familiale est intéressante dans tous les types de diabète, et indispensable pour évoquer les rares formes monogéniques :
– diabète mitochondrial à transmission maternelle, ayant des complications spécifiques (surdité, rétinite pigmentaire, cardiomyopathies…) ;
– MODY (Maturity Onset Diabetes of the Young), familial, survenant avant l’âge de 25 ans, non insulino- dépendant, au moins initialement.
Un contexte particulier et l’examen clinique (tableau 2 ) font parfois évoquer :
– certains diabètes secondaires : pancréatite chronique de l’alcoolique dénutri, tableau systémique d’une hémochromatose ;
– des formes rares liées à des endocrinopathies (hypercorticisme surrénalien, phéochromocytome, acromégalie) et les diabètes lipoatrophiques (hyperglycémie, perte de tissu adipeux, grande insulinorésistance).
Deux diagnostics différentiels sont cruciaux :
– par sa gravité, le diabète secondaire à un cancer du pancréas. Cette tumeur a un risque de survenue multiplié par 5 dans l’année qui suit la découverte d’un diabète, et évalué à 0,85 % dans les 3 ans (après l’âge de 50 ans). Il n’y a pas lieu de demander un scanner à tous les sujets qui viennent d’être diagnostiqués, mais il faut y penser lorsque l’hyperglycémie accompagne un amaigrissement notable, après la cinquantaine ;
– par sa fréquence, le diabète de type 1 à marche lente, lié à l’expression très progressive de la carence insulinique chez les sujets mûrs. Environ 10 % des personnes considérées comme étant de type 2 ont en fait un diabète auto-immun avec auto-anticorps anti-GAD (anti-glutamate décarboxylase), qu’il faut rechercher en l’absence de syndrome métabolique. Logiquement, ils bénéficient plus rapidement d’une insulinothérapie.
L’analyse de l’histoire familiale est intéressante dans tous les types de diabète, et indispensable pour évoquer les rares formes monogéniques :
– diabète mitochondrial à transmission maternelle, ayant des complications spécifiques (surdité, rétinite pigmentaire, cardiomyopathies…) ;
– MODY (Maturity Onset Diabetes of the Young), familial, survenant avant l’âge de 25 ans, non insulino- dépendant, au moins initialement.
Un contexte particulier et l’examen clinique (
– certains diabètes secondaires : pancréatite chronique de l’alcoolique dénutri, tableau systémique d’une hémochromatose ;
– des formes rares liées à des endocrinopathies (hypercorticisme surrénalien, phéochromocytome, acromégalie) et les diabètes lipoatrophiques (hyperglycémie, perte de tissu adipeux, grande insulinorésistance).
Deux diagnostics différentiels sont cruciaux :
– par sa gravité, le diabète secondaire à un cancer du pancréas. Cette tumeur a un risque de survenue multiplié par 5 dans l’année qui suit la découverte d’un diabète, et évalué à 0,85 % dans les 3 ans (après l’âge de 50 ans). Il n’y a pas lieu de demander un scanner à tous les sujets qui viennent d’être diagnostiqués, mais il faut y penser lorsque l’hyperglycémie accompagne un amaigrissement notable, après la cinquantaine ;
– par sa fréquence, le diabète de type 1 à marche lente, lié à l’expression très progressive de la carence insulinique chez les sujets mûrs. Environ 10 % des personnes considérées comme étant de type 2 ont en fait un diabète auto-immun avec auto-anticorps anti-GAD (anti-glutamate décarboxylase), qu’il faut rechercher en l’absence de syndrome métabolique. Logiquement, ils bénéficient plus rapidement d’une insulinothérapie.
Quelle surveillance organiser ?
à la différence des états prédiabétiques, le diabète une fois installé n’est pas réversible, et le suivi au long cours est capital.
Cependant, lorsque cette pathologie complique une obésité massive, la chirurgie bariatrique, notamment par bypass, permet d’obtenir des rémissions fréquentes lorsqu’elle est réalisée tôt. Sans chirurgie, avec une modification du mode de vie comme celle de l’essai Look-AHEAD (coaching diététique et activité physique, induisant une perte de 8 kg en 1 an), on observe 11 % de rémission à 1 an et 7 % à 4 ans, versus 2 % dans le bras contrôle.3
La surveillance est fondée sur 3 axes : nutritionnel, métabolique (bilan trimestriel) et vasculaire (annuel).
Le poids est le paramètre qui permet le mieux d’évaluer la mise en pratique des conseils diététiques et d’activité physique. Au cours du diabète de type 2 typique, il est excessif et doit être contrôlé.
L’HbA1c est le marqueur de la qualité du contrôle glycémique, associé au risque de complications vasculaires à long terme, et qui indique si le diabète est équilibré ou pas. Lors de la première consultation d’un diabète de découverte récente, l’objectif thérapeutique est inférieur ou égal à 6,5 %, mais il doit être personnalisé (tableau 3 ).
Les atteintes microvasculaires doivent être dépistées, car elles sont insidieuses ; une prise en charge précoce peut être proposée avant l’installation de lésions évoluées irréversibles. L’ischémie rétinienne responsable d’une prolifération néovasculaire est évoquée à l’examen du fond d’œil par les clichés de rétinographie, et peut être traitée par l’ophtalmologiste (injections intravitréennes, laser).
La microalbuminurie pathologique (mesurée sur les urines du réveil) précédant une néphropathie diabétique établie peut régresser (un tiers des cas) ou au moins se stabiliser (un tiers) sous néphroprotecteur (IEC ou sartan) et prise en charge multifactorielle.
La baisse de sensibilité (monofilament, diapason), témoignant d’une neuropathie et qui expose fortement au « pied diabétique », impose un suivi podologique trimestriel lorsqu’elle est associée à des déformations des pieds ou à une artériopathie.
Il est aussi recommandé de consacrer une consultation annuelle à la recherche d’une complication macrovasculaire concernant les coronaires, les vaisseaux à visée cérébrale et les artères des membres inférieurs, avec au minimum un électrocardiogramme de repos. Bien sûr, la prévention des accidents cardiovasculaires requiert une surveillance de la pression artérielle et du bilan lipidique.
Point important : en raison de son insidiosité, au moment de sa découverte, le diabète de type 2 préexiste généralement depuis plusieurs années, ce qui oblige à débuter ces surveillances annuelles dans l’année du diagnostic.
En outre, les risques de certains cancers sont accrus (+ 20-25 % ; foie, côlon, poumons, pancréas…). Déficit cognitif (x 2) et maladies hépatiques (stéatohépatites métaboliques) sont aussi plus fréquents.
La prise en charge préventive des diabétiques étant fastidieuse et chronophage, pour la réaliser rigoureusement, une infirmière Asalée peut être une aide précieuse. Selon l’Irdes en 2008, ce protocole (délégation de l’éducation thérapeutique à l’infirmière) conduit à une prise en charge 2,8 fois plus efficace.
Cependant, lorsque cette pathologie complique une obésité massive, la chirurgie bariatrique, notamment par bypass, permet d’obtenir des rémissions fréquentes lorsqu’elle est réalisée tôt. Sans chirurgie, avec une modification du mode de vie comme celle de l’essai Look-AHEAD (coaching diététique et activité physique, induisant une perte de 8 kg en 1 an), on observe 11 % de rémission à 1 an et 7 % à 4 ans, versus 2 % dans le bras contrôle.3
La surveillance est fondée sur 3 axes : nutritionnel, métabolique (bilan trimestriel) et vasculaire (annuel).
Le poids est le paramètre qui permet le mieux d’évaluer la mise en pratique des conseils diététiques et d’activité physique. Au cours du diabète de type 2 typique, il est excessif et doit être contrôlé.
L’HbA1c est le marqueur de la qualité du contrôle glycémique, associé au risque de complications vasculaires à long terme, et qui indique si le diabète est équilibré ou pas. Lors de la première consultation d’un diabète de découverte récente, l’objectif thérapeutique est inférieur ou égal à 6,5 %, mais il doit être personnalisé (
Les atteintes microvasculaires doivent être dépistées, car elles sont insidieuses ; une prise en charge précoce peut être proposée avant l’installation de lésions évoluées irréversibles. L’ischémie rétinienne responsable d’une prolifération néovasculaire est évoquée à l’examen du fond d’œil par les clichés de rétinographie, et peut être traitée par l’ophtalmologiste (injections intravitréennes, laser).
La microalbuminurie pathologique (mesurée sur les urines du réveil) précédant une néphropathie diabétique établie peut régresser (un tiers des cas) ou au moins se stabiliser (un tiers) sous néphroprotecteur (IEC ou sartan) et prise en charge multifactorielle.
La baisse de sensibilité (monofilament, diapason), témoignant d’une neuropathie et qui expose fortement au « pied diabétique », impose un suivi podologique trimestriel lorsqu’elle est associée à des déformations des pieds ou à une artériopathie.
Il est aussi recommandé de consacrer une consultation annuelle à la recherche d’une complication macrovasculaire concernant les coronaires, les vaisseaux à visée cérébrale et les artères des membres inférieurs, avec au minimum un électrocardiogramme de repos. Bien sûr, la prévention des accidents cardiovasculaires requiert une surveillance de la pression artérielle et du bilan lipidique.
Point important : en raison de son insidiosité, au moment de sa découverte, le diabète de type 2 préexiste généralement depuis plusieurs années, ce qui oblige à débuter ces surveillances annuelles dans l’année du diagnostic.
En outre, les risques de certains cancers sont accrus (+ 20-25 % ; foie, côlon, poumons, pancréas…). Déficit cognitif (x 2) et maladies hépatiques (stéatohépatites métaboliques) sont aussi plus fréquents.
La prise en charge préventive des diabétiques étant fastidieuse et chronophage, pour la réaliser rigoureusement, une infirmière Asalée peut être une aide précieuse. Selon l’Irdes en 2008, ce protocole (délégation de l’éducation thérapeutique à l’infirmière) conduit à une prise en charge 2,8 fois plus efficace.
Modification du mode de vie
Cette priorité n’est pas un impératif économique : la metformine, premier médicament antidiabétique oral consensuel, est génériquée et peu coûteuse (3 à 13 euros par mois). C’est plutôt le choix du bon sens, et de l’efficacité. Dans l’essai UKPDS, les conseils diététiques et d’activité physique délivrés aux diabétiques de type 2 récents, leur ont permis de perdre 4 kg et ont baissé l’HbA1c de - 1,9 % dans les 3 premiers mois suivant l’inclusion. Aucun médicament antidiabétique oral n’a jamais montré autant d’efficacité !
Avant de donner un conseil diététique, une brève enquête fournit des indications précieuses sur les habitudes alimentaires du patient. Que mange-t-il au petit déjeuner, au déjeuner, au dîner, en dehors des repas, et que boit-il ? Pour contrôler le poids, l’objectif est de « négocier » une réduction des aliments riches en calories :
– lipidiques : matières grasses ;
– lipido-protéiques : charcuterie, viandes grasses, fromage (mais la consommation de poisson au moins 2 fois par semaine est encouragée) ;
– lipido-glucidiques : pâtisseries, viennoiseries, confiseries, frites, chips ;
– boissons alcoolisées ;
– glucidiques : sucreries.
Aucun aliment n’est interdit et, selon les dernières recommandations de l’American Diabetes Association, il n’y a pas une proportion idéale concernant la répartition des calories ingérées (glucidique/lipidique/protéique), qui vaille pour tous.4 Les boissons sucrées sont toutefois à éviter au cours d’une maladie qui peut donner soif. Un comptage précis des glucides alimentaire n’est pas indispensable, à ce stade précoce où le sujet n’est traité ni par insuline ni par médicaments insulinosécréteurs (sulfamides, glinides), susceptibles d’entraîner des hypoglycémies.
écouter le patient et lui donner des conseils diététiques personnalisés prend du temps. L’aide d’une diététicienne est très utile, mais sa consultation n’est pas remboursée en dehors des établissements de santé.
En ce qui concerne l’activité physique, on recommande au minimum 30 minutes de marche par jour,1 mais tout moyen de réduire la sédentarité est précieux, sport ou activités de la vie quotidienne. Les patients sont souvent plus réceptifs et motivés par ces conseils que par des régimes restrictifs. Les bénéfices en termes de perte de poids sont initialement minimes, s’il n’y a pas d’efforts associés concernant l’alimentation, mais un effet métabolique favorable peut quand même être obtenu.
L’activité physique peut être mesurée en comptabilisant le temps passé, ou simplement avec un podomètre, peu coûteux. L’objectif est ambitieux : 10 000 pas par jour. Le déploiement actuel des programmes du dispositif PEPS (prescription d’exercice physique pour la santé) ou d’APA (activité physique adaptée)peut aider à réduire la sédentarité.
Mais le patient va-t-il appliquer ces consignes ? Ce n’est pas certain. Les marges d’amélioration paraissent parfois limitées, chez des malades en surpoids qui tendent à sous-estimer leurs apports alimentaires et à surestimer leur activité physique. L’évolution du poids à la consultation suivante, 3 mois après, confirmera si le mode vie a été modifié : l’objectif est la perte de quelques kilos, dans l’idéal de 5 à 15 % du poids initial excessif.
Les diabétiques de type 2 ont plus de mal à maigrir et au cours d’interventions diététiques, on constate que la perte de poids est de moitié inférieure à celle des obèses non diabétiques, en moyenne. L’amélioration glycémique constatée lors de l’amaigrissement volontaire des patients très hyperglycémiques a une cause : la baisse de leur néoglucogenèse hépatique excessive, coûteuse en énergie. Elle a aussi une conséquence : la réduction de leur glycosurie qui est une fuite énergétique. Des résultats modestes ne doivent pas décourager. Une étude a montré que l’intention de perdre du poids, plus que l’amaigrissement lui-même, est associée à un meilleur pronostic !5
La découverte récente d’un diabète de type 2 est une période privilégiée pour analyser le mode de vie. On a de fortes chances de trouver alors des erreurs, et à ce stade aucun médicament n’est pourvoyeur d’hypoglycémies susceptibles d’entraver les efforts du sujet. C’est le bon moment pour construire une « alliance thérapeutique ».
Si on estime, d’un commun accord, qu’une modification comportementale ne suffit pas pour atteindre l’objectif d’HbA1c, la metformine peut être débutée. Si l’HbA1c > 9 %, on peut la prescrire d’emblée .
Avant de donner un conseil diététique, une brève enquête fournit des indications précieuses sur les habitudes alimentaires du patient. Que mange-t-il au petit déjeuner, au déjeuner, au dîner, en dehors des repas, et que boit-il ? Pour contrôler le poids, l’objectif est de « négocier » une réduction des aliments riches en calories :
– lipidiques : matières grasses ;
– lipido-protéiques : charcuterie, viandes grasses, fromage (mais la consommation de poisson au moins 2 fois par semaine est encouragée) ;
– lipido-glucidiques : pâtisseries, viennoiseries, confiseries, frites, chips ;
– boissons alcoolisées ;
– glucidiques : sucreries.
Aucun aliment n’est interdit et, selon les dernières recommandations de l’American Diabetes Association, il n’y a pas une proportion idéale concernant la répartition des calories ingérées (glucidique/lipidique/protéique), qui vaille pour tous.4 Les boissons sucrées sont toutefois à éviter au cours d’une maladie qui peut donner soif. Un comptage précis des glucides alimentaire n’est pas indispensable, à ce stade précoce où le sujet n’est traité ni par insuline ni par médicaments insulinosécréteurs (sulfamides, glinides), susceptibles d’entraîner des hypoglycémies.
écouter le patient et lui donner des conseils diététiques personnalisés prend du temps. L’aide d’une diététicienne est très utile, mais sa consultation n’est pas remboursée en dehors des établissements de santé.
En ce qui concerne l’activité physique, on recommande au minimum 30 minutes de marche par jour,1 mais tout moyen de réduire la sédentarité est précieux, sport ou activités de la vie quotidienne. Les patients sont souvent plus réceptifs et motivés par ces conseils que par des régimes restrictifs. Les bénéfices en termes de perte de poids sont initialement minimes, s’il n’y a pas d’efforts associés concernant l’alimentation, mais un effet métabolique favorable peut quand même être obtenu.
L’activité physique peut être mesurée en comptabilisant le temps passé, ou simplement avec un podomètre, peu coûteux. L’objectif est ambitieux : 10 000 pas par jour. Le déploiement actuel des programmes du dispositif PEPS (prescription d’exercice physique pour la santé) ou d’APA (activité physique adaptée)peut aider à réduire la sédentarité.
Mais le patient va-t-il appliquer ces consignes ? Ce n’est pas certain. Les marges d’amélioration paraissent parfois limitées, chez des malades en surpoids qui tendent à sous-estimer leurs apports alimentaires et à surestimer leur activité physique. L’évolution du poids à la consultation suivante, 3 mois après, confirmera si le mode vie a été modifié : l’objectif est la perte de quelques kilos, dans l’idéal de 5 à 15 % du poids initial excessif.
Les diabétiques de type 2 ont plus de mal à maigrir et au cours d’interventions diététiques, on constate que la perte de poids est de moitié inférieure à celle des obèses non diabétiques, en moyenne. L’amélioration glycémique constatée lors de l’amaigrissement volontaire des patients très hyperglycémiques a une cause : la baisse de leur néoglucogenèse hépatique excessive, coûteuse en énergie. Elle a aussi une conséquence : la réduction de leur glycosurie qui est une fuite énergétique. Des résultats modestes ne doivent pas décourager. Une étude a montré que l’intention de perdre du poids, plus que l’amaigrissement lui-même, est associée à un meilleur pronostic !5
La découverte récente d’un diabète de type 2 est une période privilégiée pour analyser le mode de vie. On a de fortes chances de trouver alors des erreurs, et à ce stade aucun médicament n’est pourvoyeur d’hypoglycémies susceptibles d’entraver les efforts du sujet. C’est le bon moment pour construire une « alliance thérapeutique ».
Si on estime, d’un commun accord, qu’une modification comportementale ne suffit pas pour atteindre l’objectif d’HbA1c, la metformine peut être débutée. Si l’HbA1c > 9 %, on peut la prescrire d’emblée .
Metformine : En première ligne
Cet antidiabétique oral est recommandé en première intention dans toutes les guidelines. Bien connu de longue date, peu coûteux, il est même utilisé aux états-Unis dans les états prédiabétiques, car il réduit le risque d’évolution vers le diabète de type 2, un peu moins efficacement toutefois que la modification «coachée» du mode de vie.
En France, la metformine est indiquée dès que l’HbA1c dépasse 6,5 %, malgré les efforts du patient. Au cours de l’essai UKPDS (diabétiques de type 2 repérés récemment), la mortalité était réduite chez les participants traités par metformine.
Ses trois principaux effets indésirables sont bien connus.
Les troubles digestifs sont fréquents, notamment la diarrhée, qui concerne 20 % des patients et oblige à l’arrêt dans 10 % des cas. Il faut augmenter les doses de façon progressive jusqu’à la posologie maximale tolérée (idéalement entre 2 et 3 g/j), prendre les comprimés pendant les repas, utiliser les formes moins dosées souvent mieux tolérées (Stagid). Avec ou sans diarrhée, les patients perdent quelques kilos, ce qui n’est pas gênant bien sûr.
Mais chez des personnes âgées, des amaigrissements inquiétants imposent parfois l’arrêt du médicament.
Les acidoses lactiques sont très rares, mais justifient le respect des contre-indications, notamment une insuffisance rénale sévère (DFG < 30 mL/min/ 1,73 m2) ; les doses doivent être divisées par 2 lorsqu’il est estimé entre 30 et 60 mL/min/1,73 m2.
Par ailleurs, on peut craindre une carence en vitamine B12, chez 10 % des patients, avec parfois une neuropathie diabétique aggravée. Selon l’American Diabetes Association : contrôler le taux sérique 1 fois par an pour introduire une supplémentation si nécessaire.4 La metformine n’entraîne pas d’hypoglycémie.
En France, la metformine est indiquée dès que l’HbA1c dépasse 6,5 %, malgré les efforts du patient. Au cours de l’essai UKPDS (diabétiques de type 2 repérés récemment), la mortalité était réduite chez les participants traités par metformine.
Ses trois principaux effets indésirables sont bien connus.
Les troubles digestifs sont fréquents, notamment la diarrhée, qui concerne 20 % des patients et oblige à l’arrêt dans 10 % des cas. Il faut augmenter les doses de façon progressive jusqu’à la posologie maximale tolérée (idéalement entre 2 et 3 g/j), prendre les comprimés pendant les repas, utiliser les formes moins dosées souvent mieux tolérées (Stagid). Avec ou sans diarrhée, les patients perdent quelques kilos, ce qui n’est pas gênant bien sûr.
Mais chez des personnes âgées, des amaigrissements inquiétants imposent parfois l’arrêt du médicament.
Les acidoses lactiques sont très rares, mais justifient le respect des contre-indications, notamment une insuffisance rénale sévère (DFG < 30 mL/min/ 1,73 m2) ; les doses doivent être divisées par 2 lorsqu’il est estimé entre 30 et 60 mL/min/1,73 m2.
Par ailleurs, on peut craindre une carence en vitamine B12, chez 10 % des patients, avec parfois une neuropathie diabétique aggravée. Selon l’American Diabetes Association : contrôler le taux sérique 1 fois par an pour introduire une supplémentation si nécessaire.4 La metformine n’entraîne pas d’hypoglycémie.
Et en deuxième intention ?
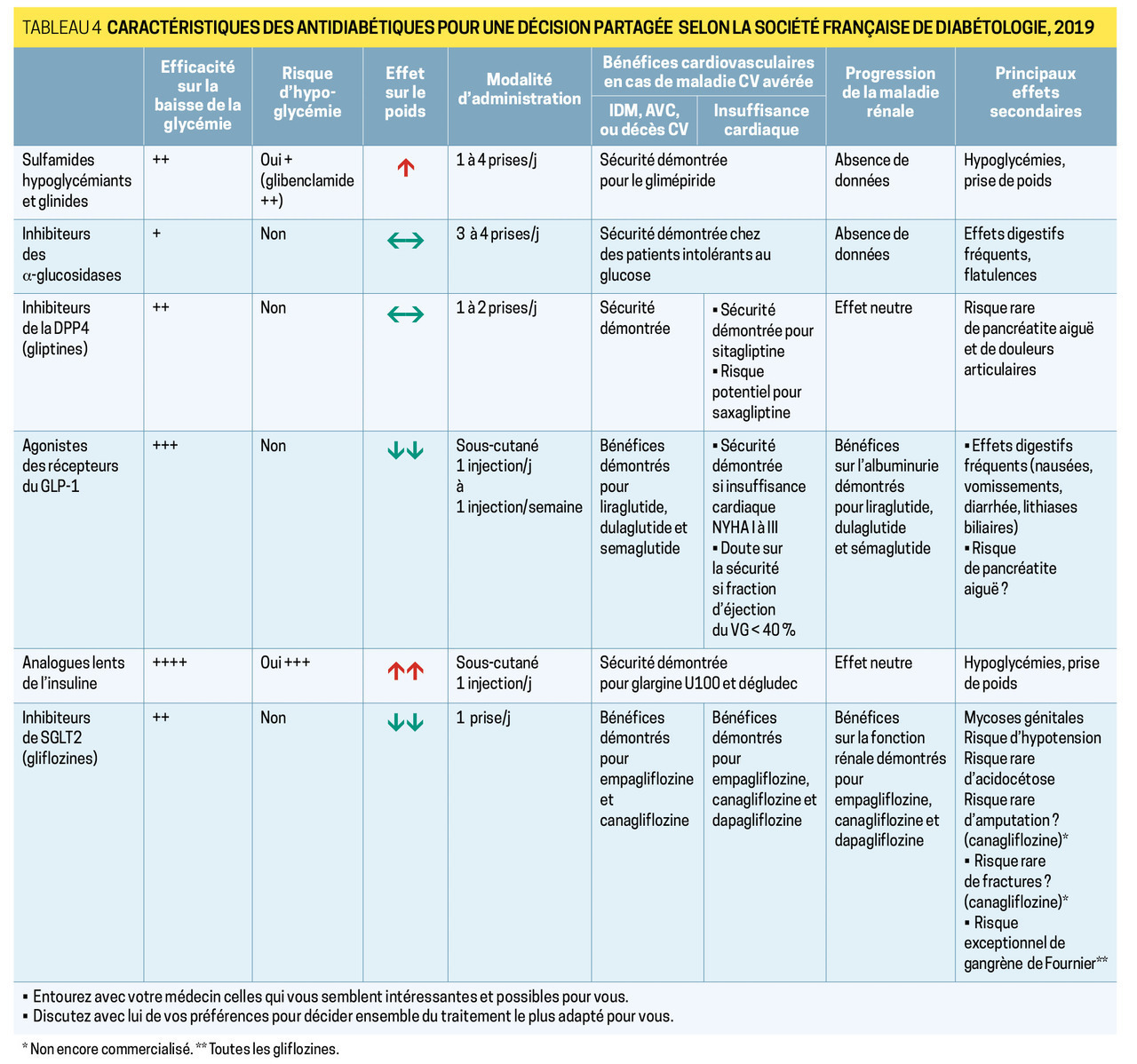
En cas de contre-indication à la metformine ou si l’objectif glycémique n’est pas atteint, on dispose de plusieurs options (tableau 4 ) :
– les inhibiteurs de DPP-4 (saxagliptine, Onglyza ; sitagliptine, Januvia ; linagliptine, Trajenta), per os, bien tolérés, sans risque d’hypoglycémie (la sitagliptine 50 mg est remboursée en monothérapie) ;
– les agonistes des récepteurs du GLP-1, injectables (exénatide, Bydureon, Byetta ; liraglutide, Victoza, Xultophy ; dulaglutide, Trulicity), surtout en cas de maladie cardiovasculaire avérée ;
– l’acarbose pour corriger l’hyperglycémie postprandiale, mais sa tolérance digestive est médiocre ;
– les sulfamides hypoglycémiants ou les glinides, mais ils doivent s’accompagner d’une éducation thérapeutique supplémentaire à cause du risque d’hypoglycémie : contrôle des apports glucidiques alimentaires, autosurveillance glycémique.
– les inhibiteurs de SGLT2 ou gliflozines (canagliflozine, Invokana ; dapagliflozine, Forxiga ; empagliflozine Jardiance), particulièrement intéressants en cas d’insuffisance cardiaque, mais ne sont toujours pas disponibles en France.
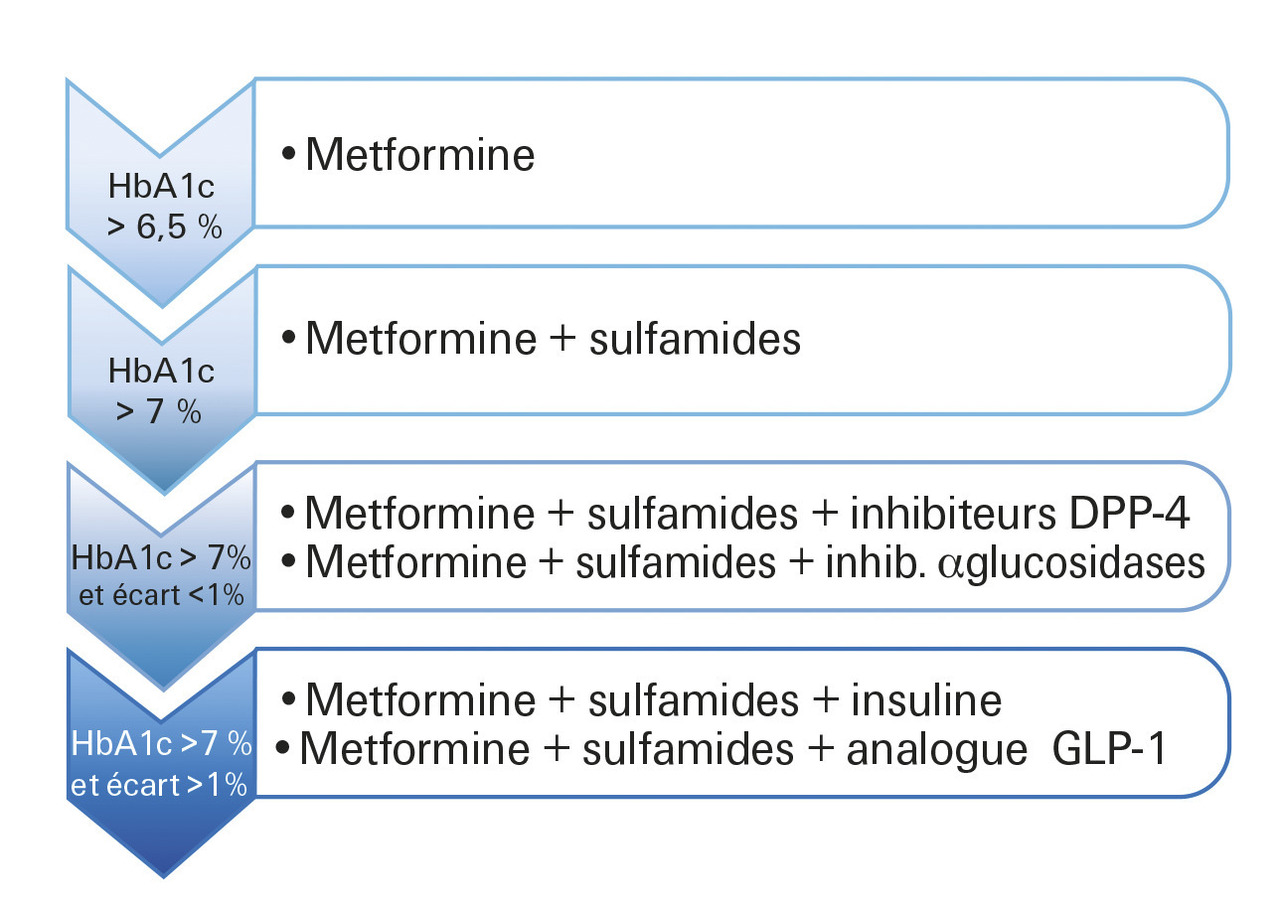
Contrairement aux recommandations de la HAS (fig. 2 ) qui préconisent de combiner metformine + sulfamide en 2e intention, la Société francophone du diabète (2019) préfère l’association à un inhibiteur de DPP-4. L’association metformine + GLP-1 RA peut être envisagée chez le patient obèse (IMC ≥ 30 kg/m2), ou en prévention cardiovasculaire secondaire (liraglutide).
Chez un malade amaigri, profondément hyperglycémique (HbA1c > 10 %), une insulinothérapie est à instaurer d’emblée.
– les inhibiteurs de DPP-4 (saxagliptine, Onglyza ; sitagliptine, Januvia ; linagliptine, Trajenta), per os, bien tolérés, sans risque d’hypoglycémie (la sitagliptine 50 mg est remboursée en monothérapie) ;
– les agonistes des récepteurs du GLP-1, injectables (exénatide, Bydureon, Byetta ; liraglutide, Victoza, Xultophy ; dulaglutide, Trulicity), surtout en cas de maladie cardiovasculaire avérée ;
– l’acarbose pour corriger l’hyperglycémie postprandiale, mais sa tolérance digestive est médiocre ;
– les sulfamides hypoglycémiants ou les glinides, mais ils doivent s’accompagner d’une éducation thérapeutique supplémentaire à cause du risque d’hypoglycémie : contrôle des apports glucidiques alimentaires, autosurveillance glycémique.
– les inhibiteurs de SGLT2 ou gliflozines (canagliflozine, Invokana ; dapagliflozine, Forxiga ; empagliflozine Jardiance), particulièrement intéressants en cas d’insuffisance cardiaque, mais ne sont toujours pas disponibles en France.
Contrairement aux recommandations de la HAS (
Chez un malade amaigri, profondément hyperglycémique (HbA1c > 10 %), une insulinothérapie est à instaurer d’emblée.
Encadre
Que faire chez un prédiabétique ?
Dépister le diabète de type 2 chez des sujets à risque permet le plus souvent de les rassurer (75 % des cas ; glycémie normale < 1 g/L), de les diagnostiquer précocement, puis de les prendre en charge dans 5 % des cas, d’identifier des états prédiabétiques dans 20 % des cas :2 glycémie à jeun > 1,10 g/L ou 1 g/L pour l’OMS.
Ces personnes doivent bénéficier de conseils d’hygiène de vie et d’une surveillance de la glycémie. Elles ne sont pas diabétiques, leur risque de complications microvasculaires n’est pas significatif, et la réversibilité vers une glycémie normale est fréquente si elles modifient leur mode de vie.
Dans le cas contraire, le risque de devenir diabétique est important, de l’ordre de 7 % par an.
Références
1. Darmon P, Bauduceau B, Bordier L, et al. Prise de position de la Société francophone du diabète (SFD) sur la prise en charge médicamenteuse de l’hyperglycémie du patient diabétique de type 2 – 2019. Médecine des Maladies Métaboliques 2019;13:711-32.
2. Stankevich L, Galhaud JP, Kuvshinov R, et al. Comment on Evron et al. Changes in Screening Practices for Prediabetes and Diabetes Since the Recommendation for Hemoglobin A1c Testing. Diabetes Care 2019;42:576-584. Diabetes Care 2019;42(6):e102.
3. Gregg EW, Chen H, Wagenknecht LE, et al. Association of an intensive lifestyle intervention with remission of type 2 diabetes. JAMA 2012;308:2489-96.
4. Evert AB, Dennison M, Gardner CD, et al. Nutrition therapy for adults with diabetes or prediabetes: a consensus report. Diabetes Care 2019;42:731-54.
5. Gregg EW, Gerzoff RB, Thompson TJ, Williamson DF. Trying to lose weight, losing weight, and 9-years mortality among overweight US adults with diabetes. Diabetes Care 2004;27:657-62.
2. Stankevich L, Galhaud JP, Kuvshinov R, et al. Comment on Evron et al. Changes in Screening Practices for Prediabetes and Diabetes Since the Recommendation for Hemoglobin A1c Testing. Diabetes Care 2019;42:576-584. Diabetes Care 2019;42(6):e102.
3. Gregg EW, Chen H, Wagenknecht LE, et al. Association of an intensive lifestyle intervention with remission of type 2 diabetes. JAMA 2012;308:2489-96.
4. Evert AB, Dennison M, Gardner CD, et al. Nutrition therapy for adults with diabetes or prediabetes: a consensus report. Diabetes Care 2019;42:731-54.
5. Gregg EW, Gerzoff RB, Thompson TJ, Williamson DF. Trying to lose weight, losing weight, and 9-years mortality among overweight US adults with diabetes. Diabetes Care 2004;27:657-62.

 Encadrés
Encadrés