Le diabète de type 2 (DT2) se définit par une hyperglycémie (≥ 1,26 g/L) chronique. Il est secondaire à une insulinorésistance et à un hyperinsulinisme réactionnel évoluant vers une insulinopénie relative (sécrétion insuffisante d’insuline par rapport à la glycémie). Avec une prévalence en augmentation et un risque de complications multiples, cette maladie fréquente est un problème majeur de santé publique.
Quels enjeux épidémiologiques ?
Prévalence en hausse
Le DT2 représente plus de 90 % des formes de diabète, et sa prévalence est en nette hausse. Le vieillissement de la population, les modifications du mode de vie et la progression endémique de l’obésité, notamment, sont en cause dans cette tendance. Il est classiquement diagnostiqué chez les sujets de plus de 40 ans, à un âge moyen de 65 ans. Si sa fréquence augmente avec l’âge, sa prévalence est aussi en hausse chez les sujets jeunes.1
En France, la prévalence du diabète traité pharmacologiquement était estimée à 4,6 % en 2012 et à 5,3 % en 2020, soit 3,5 millions de personnes (d’après Santé publique France). Par ailleurs, 2 % de la population souffrirait d’un diabète non dépisté, soit 500 000 à 900 000 Français.2 Ce retard diagnostique s’explique par une évolution longtemps asymptomatique de la maladie. Au total, le nombre de personnes ayant un DT2 a été évalué entre 4 et 4,5 millions en 2020 en France, et à 1 adulte sur 11 en Europe en 2021, avec une augmentation générale estimée à 13 % d’ici à 2045.1
En France, la prévalence du diabète traité pharmacologiquement était estimée à 4,6 % en 2012 et à 5,3 % en 2020, soit 3,5 millions de personnes (d’après Santé publique France). Par ailleurs, 2 % de la population souffrirait d’un diabète non dépisté, soit 500 000 à 900 000 Français.2 Ce retard diagnostique s’explique par une évolution longtemps asymptomatique de la maladie. Au total, le nombre de personnes ayant un DT2 a été évalué entre 4 et 4,5 millions en 2020 en France, et à 1 adulte sur 11 en Europe en 2021, avec une augmentation générale estimée à 13 % d’ici à 2045.1
Complications métaboliques et vasculaires
Le DT2 est responsable de complications métaboliques aiguës et vasculaires chroniques. L’hyperglycémie chronique est associée à une augmentation du risque de morbidités cardiovasculaire et non cardiovasculaire, responsable d’une mortalité précoce plus élevée que dans la population générale.
En effet, le diabète est la première cause d’insuffisance rénale terminale, de cécité avant l’âge de 55 ans (rétinopathie) et d’amputation de membre inférieur. Il multiplie par 2 le risque d’avoir un infarctus du myocarde, un accident vasculaire cérébral ou une artériopathie oblitérante des membres inférieurs (AOMI).3 Un patient diabétique sur 3 est hospitalisé au moins une fois par an.4 Le diabète est une cause majeure de handicap et d’altération de la qualité de vie, avec un retentissement sociétal et médico-économique majeur. En Europe, en 2021, son coût a été évalué à 189 000 millions de dollars par la Fédération internationale du diabète, et il y aurait été responsable – la même année – de 1,1 million de décès.1
Le diagnostiquer précocement et permettre aux patients d’atteindre un équilibre glycémique représentent donc des enjeux considérables de santé publique.
En effet, le diabète est la première cause d’insuffisance rénale terminale, de cécité avant l’âge de 55 ans (rétinopathie) et d’amputation de membre inférieur. Il multiplie par 2 le risque d’avoir un infarctus du myocarde, un accident vasculaire cérébral ou une artériopathie oblitérante des membres inférieurs (AOMI).3 Un patient diabétique sur 3 est hospitalisé au moins une fois par an.4 Le diabète est une cause majeure de handicap et d’altération de la qualité de vie, avec un retentissement sociétal et médico-économique majeur. En Europe, en 2021, son coût a été évalué à 189 000 millions de dollars par la Fédération internationale du diabète, et il y aurait été responsable – la même année – de 1,1 million de décès.1
Le diagnostiquer précocement et permettre aux patients d’atteindre un équilibre glycémique représentent donc des enjeux considérables de santé publique.
Facteurs de risque : qui dépister ?
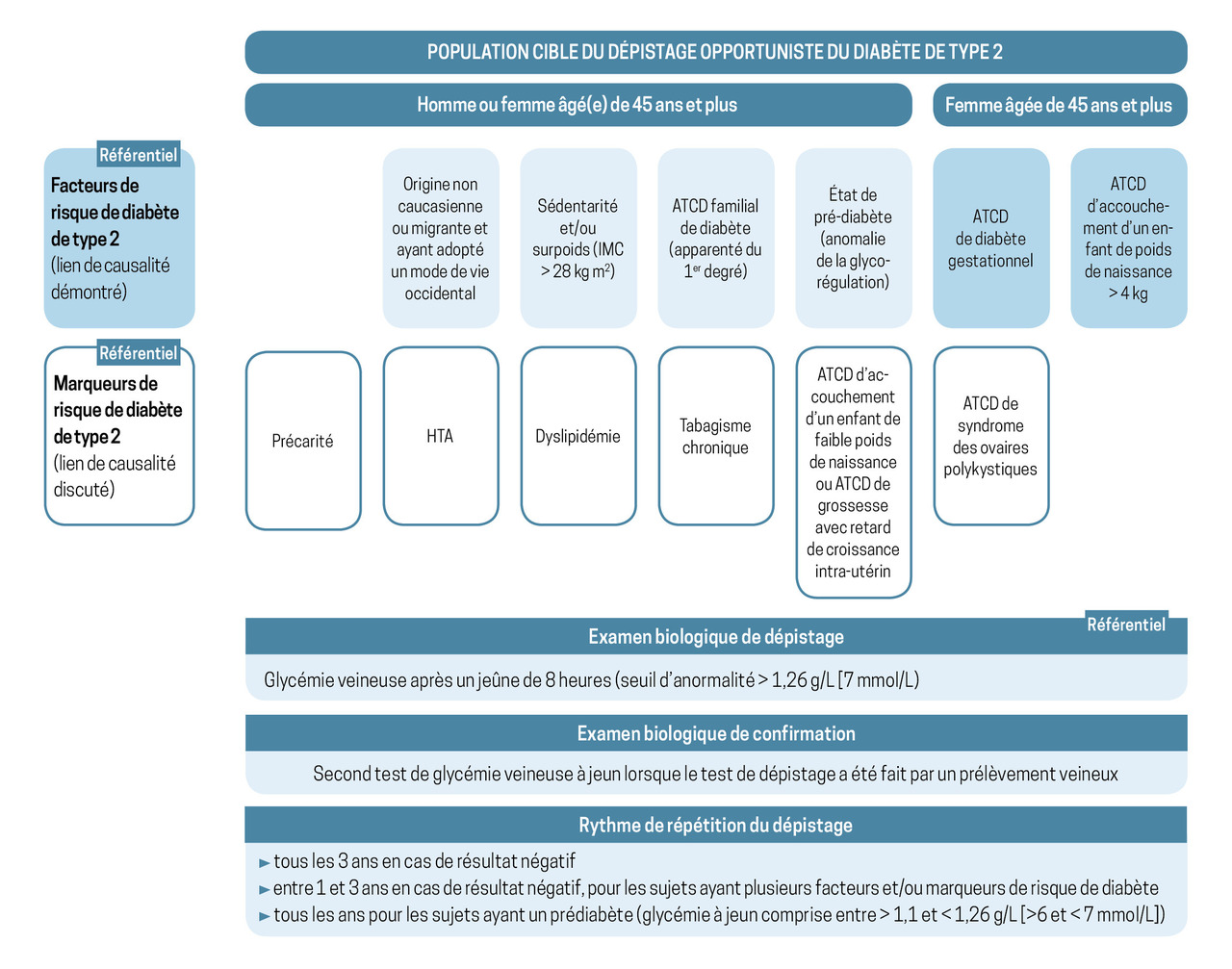
Le dépistage est réalisé systématiquement chez les sujets ayant au moins un facteur de risque de DT2, notamment : âge > 40 ans, indice de masse corporelle (IMC) > 25 kg/m², répartition androïde du tissu adipeux, syndrome métabolique, antécédent familial au premier degré de DT2, syndrome des ovaires polykystiques, antécédent personnel de diabète gestationnel ou d’enfant avec macrosomie fœtale. Certaines origines ethniques ont un risque élevé (Afrique, DROM-COM, Asie…) [fig. 1 ].
Poser le diagnostic
Le dosage de la glycémie permet de diagnostiquer un diabète :
– glycémie à jeun ≥ 1,26 g/L vérifiée une seconde fois (même en l’absence de symptômes) ;
– glycémie ≥ 2 g/L quel que soit le moment de la journée, en présence de signes cardinaux (syndrome polyuropolydipsique, asthénie, amaigrissement) ;
– glycémie ≥ 2 g/L deux heures après une charge orale de 75 g de glucides (épreuve d’hyperglycémie provoquée par voie orale [HGPO] réservée au dépistage du diabète gestationnel en pratique courante).
En cas de glycémie normale, il est raisonnable de répéter le dépistage tous les trois ans.5
– glycémie à jeun ≥ 1,26 g/L vérifiée une seconde fois (même en l’absence de symptômes) ;
– glycémie ≥ 2 g/L quel que soit le moment de la journée, en présence de signes cardinaux (syndrome polyuropolydipsique, asthénie, amaigrissement) ;
– glycémie ≥ 2 g/L deux heures après une charge orale de 75 g de glucides (épreuve d’hyperglycémie provoquée par voie orale [HGPO] réservée au dépistage du diabète gestationnel en pratique courante).
En cas de glycémie normale, il est raisonnable de répéter le dépistage tous les trois ans.5
Cas particuliers du prédiabète
Un diagnostic de prédiabète est retenu dans deux situations :
– détection d’une hyperglycémie modérée à jeun (entre 1,10 et 1,25 g/L) ;
– intolérance aux hydrates de carbone, avec une glycémie en HGPO entre 1,4 et 2 g/L à deux heures.
Chacune de ces deux situations augmenterait le risque de développer un DT2 d’environ 35 % (70 % si elles sont simultanées).
Les modifications du mode de vie permettent de prévenir l’installation d’un DT2 chez ces sujets en état de prédiabète.
– détection d’une hyperglycémie modérée à jeun (entre 1,10 et 1,25 g/L) ;
– intolérance aux hydrates de carbone, avec une glycémie en HGPO entre 1,4 et 2 g/L à deux heures.
Chacune de ces deux situations augmenterait le risque de développer un DT2 d’environ 35 % (70 % si elles sont simultanées).
Les modifications du mode de vie permettent de prévenir l’installation d’un DT2 chez ces sujets en état de prédiabète.
Quel type de diabète ?
En l’absence de tableau typique de DT2 précédemment cité (âge adulte, histoire familiale de DT2, surcharge pondérale…), il convient d’éliminer un autre type de diabète par des explorations complémentaires.
Ainsi, en présence d’un amaigrissement franc, d’une altération de l’état général, d’un antécédent ou de symptômes évoquant une pathologie du pancréas ou un mésusage de l’alcool, la réalisation d’un scanner, à la recherche d’un diabète secondaire à une atteinte pancréatique, est envisagée.
Devant un amaigrissement, une acidocétose, un âge inférieur à 35 ans ou un IMC inférieur à 25 kg/m², la présence d’anticorps anti-GAD (anti-acide glutamique décarboxylase), anti-IA2 (antiprotéine tyrosine phosphatase) ou anti-ZnT8 (antitransporteurs du zinc 8) est en faveur d’un diabète de type 1 auto-immun.
Enfin, en cas de découverte de diabète au cours d’une grossesse, un avis spécialisé est indispensable.
Ainsi, en présence d’un amaigrissement franc, d’une altération de l’état général, d’un antécédent ou de symptômes évoquant une pathologie du pancréas ou un mésusage de l’alcool, la réalisation d’un scanner, à la recherche d’un diabète secondaire à une atteinte pancréatique, est envisagée.
Devant un amaigrissement, une acidocétose, un âge inférieur à 35 ans ou un IMC inférieur à 25 kg/m², la présence d’anticorps anti-GAD (anti-acide glutamique décarboxylase), anti-IA2 (antiprotéine tyrosine phosphatase) ou anti-ZnT8 (antitransporteurs du zinc 8) est en faveur d’un diabète de type 1 auto-immun.
Enfin, en cas de découverte de diabète au cours d’une grossesse, un avis spécialisé est indispensable.
Prise en charge
Éducation thérapeutique
Individualisée et systématique, l’éducation thérapeutique inclut des conseils hygiénodiététiques (activité physique et alimentation) afin d’améliorer l’équilibre glycémique, diminuer l’insulinorésistance et contrôler les facteurs de risque cardiovasculaires.6 Une perte de poids, même modérée (5 %), apporte un bénéfice glycémique.
Alimentation non restrictive mais équilibrée
Une évaluation diététique quantitative et qualitative est réalisée afin d’adapter les repères de consommation à chaque patient (dimension économique, contraintes psychosociales, comorbidités, objectif pondéral, âge…).
Les repères nutritionnels donnés par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) en 2016 et par Santé publique France en 2019 orientent vers une alimentation composée de trois repas par jour, non restrictive, avec 35-40 % des apports énergétiques totaux composés de lipides, 10-20 % de protides (0,83 g/kg/j) et 40-55 % de glucides, et un apport en fibres supérieur à 30 g/j.
La consommation totale de sucres préconisée (fructose + saccharose), incluant les fruits, doit être inférieure à 100 g/j.
Il est conseillé de consommer plus de cinq fruits et légumes par jour, des féculents à chaque repas (en privilégiant les céréales complètes et les légumineuses), des protéines animales (viande, poisson, œufs) 1 ou 2 fois/j, des produits laitiers 2 fois par jour. Les boissons sucrées (dont jus de fruits, 1/j au maximum), la charcuterie (< 150 g/semaine), la viande rouge (< 500 g/semaine), l’alcool, le sel (< 6 g/j) et les produits ultratransformés doivent être consommés avec modération.7
L’American Diabetes Association (ADA) conseille de préserver le plaisir de s’alimenter en évitant les discours jugés moralisateurs et en privilégiant des outils pratiques tels que : la moitié de l’assiette en légumes, un quart en protéines et un quart en glucides.8
Les repères nutritionnels donnés par l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (Anses) en 2016 et par Santé publique France en 2019 orientent vers une alimentation composée de trois repas par jour, non restrictive, avec 35-40 % des apports énergétiques totaux composés de lipides, 10-20 % de protides (0,83 g/kg/j) et 40-55 % de glucides, et un apport en fibres supérieur à 30 g/j.
La consommation totale de sucres préconisée (fructose + saccharose), incluant les fruits, doit être inférieure à 100 g/j.
Il est conseillé de consommer plus de cinq fruits et légumes par jour, des féculents à chaque repas (en privilégiant les céréales complètes et les légumineuses), des protéines animales (viande, poisson, œufs) 1 ou 2 fois/j, des produits laitiers 2 fois par jour. Les boissons sucrées (dont jus de fruits, 1/j au maximum), la charcuterie (< 150 g/semaine), la viande rouge (< 500 g/semaine), l’alcool, le sel (< 6 g/j) et les produits ultratransformés doivent être consommés avec modération.7
L’American Diabetes Association (ADA) conseille de préserver le plaisir de s’alimenter en évitant les discours jugés moralisateurs et en privilégiant des outils pratiques tels que : la moitié de l’assiette en légumes, un quart en protéines et un quart en glucides.8
Activité physique régulière, modérée, adaptée
Il est conseillé aux patients de réduire la période quotidienne de sédentarité (< 7 heures/j) : se lever toutes les 30 minutes et augmenter l’activité physique quotidienne.8 Il est préconisé une activité modérée de type marche ou cyclisme de plus de 150 minutes par semaine en endurance non consécutive (répartie sur plusieurs jours), permettant une baisse de l’HbA1C moyenne de 0,7 %8, associée à deux séances par semaine de renforcement musculaire non consécutives.9
L’activité conseillée est adaptée individuellement et prend en considération les éventuelles complications (coronaropathie, rétinopathie, plaie de pied…).8 Lorsqu’un patient présentant une complication ou un facteur de risque cardiovasculaire reprend une activité modérée ou intense, une vigilance accrue est nécessaire, notamment vis-à-vis du risque coronarien. De plus, le patient doit être éduqué à la gestion de l’hypoglycémie et à l’adaptation des doses en cas de traitement comportant ce risque.
L’activité conseillée est adaptée individuellement et prend en considération les éventuelles complications (coronaropathie, rétinopathie, plaie de pied…).8 Lorsqu’un patient présentant une complication ou un facteur de risque cardiovasculaire reprend une activité modérée ou intense, une vigilance accrue est nécessaire, notamment vis-à-vis du risque coronarien. De plus, le patient doit être éduqué à la gestion de l’hypoglycémie et à l’adaptation des doses en cas de traitement comportant ce risque.
Traitements pharmacologiques : mono-, bi- voire trithérapie
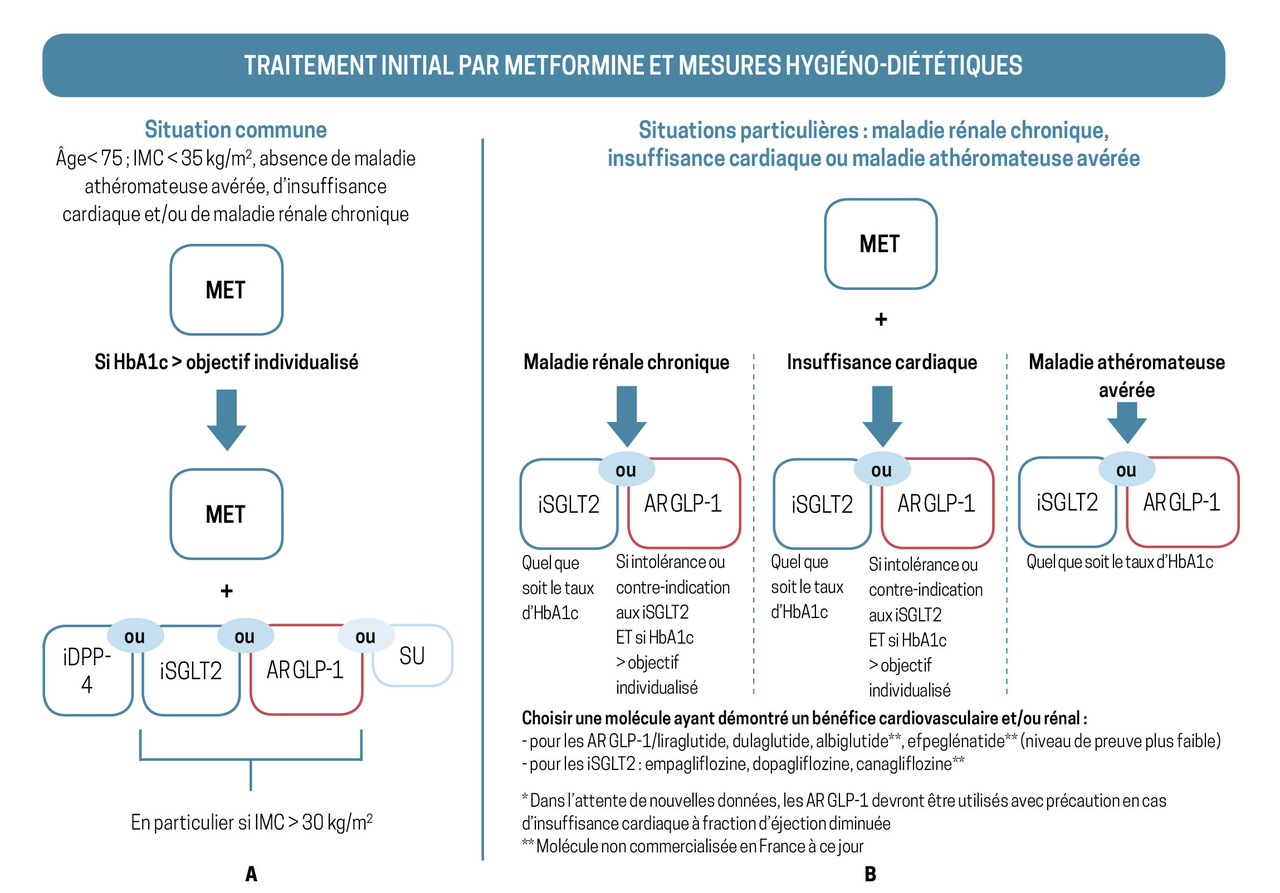
Un traitement pharmacologique est introduit en cas d’hyperglycémie majeure d’emblée ou si les modifications de mode de vie ne suffisent pas (tableau ).10
fig. 2 ). Elle doit être interrompue en cas d’intolérance digestive ou en cas d’insuffisance d’organe sévère : rénale (débit de filtration glomérulaire [DFG] < 30 mL/min/1,73 m²), hépatique, respiratoire ou cardiaque.
– les sulfamides hypoglycémiants (recommandations de la Haute Autorité de santé [HAS]) induisent un risque d’hypoglycémie et de prise de poids modérée ; ils sont suspendus en cas de jeûne, contre-indiqués en présence d’insuline rapide, d’insuffisance rénale ou hépatique sévère. Seuls les glinides sont utilisables en cas d’insuffisance rénale avec DFG compris entre 15 et 30 mL/min/1,73 m² ;
– les glinides, de même classe que les sulfamides hypoglycémiants, ont une durée d’action plus courte que celle des sulfamides hypoglycémiants. Attention, il n’est pas recommandé d’associer deux médicaments de même mécanisme d’action ;
– les incrétines (recommandations de la Société francophone du diabète [SFD]), sans risque d’hypoglycémie, sont contre-indiquées en cas d’insuffisances hépatique et rénale sévères ;
– les inhibiteurs des DPP-4 (dipeptidyl-peptidase-4, iDPP-4) (recommandations de la SFD) sont souvent bien tolérés et sans risque d’hypoglycémie. Ils peuvent être utilisés à des stades avancés d’insuffisance rénale avec une adaptation des doses variable d’une molécule à l’autre. Ils sont neutres sur le plan cardiovasculaire, hormis la saxagliptine pour laquelle une augmentation du risque d’hospitalisation pour insuffisance cardiaque a été observée ;
– les analogues du GLP-1 (glucagon-like peptide-1, aGLP-1) injectables peuvent être prescrits jusqu’à un DFG de 15 mL/min/1,73 m2. Ils favorisent la perte de poids et n’entraînent pas d’hypoglycémie (sauf association aux sulfamides hypoglycémiants ou à une insulinothérapie). Ils réduisent le risque d’événements cardiovasculaires majeurs d’origine athéroscléreuse. Ils doivent être privilégiés si l’IMC est supérieur à 30 kg/m² et/ou en cas de haut risque cardiovasculaire. Ils sont contre-indiqués en cas de maladie pancréatique. L’association iDPP-4-aGLP-1 est déconseillée ;
– les inhibiteurs du cotransporteur sodium-glucose 2 (SGLT2), sans risque d’hypoglycémie, ont un effet protecteur cardiaque et rénal. Ils sont privilégiés en cas d’insuffisance cardiaque à fraction d’éjection du ventricule gauche réduite et de maladie rénale chronique. Leur effet antihyperglycémiant est limité si le DFG est inférieur à 45 mL/min. Leur prescription à visée cardioprotectrice est cependant autorisée pour la dapagliflozine jusqu’à un DFG de 25 mL/min, même chez les patients non diabétiques. Le remboursement dans l’indication de néphroprotection est en cours d’évaluation ;
– l’insuline, à risque d’hypoglycémie et de prise de poids, peut être utilisée de manière temporaire ou définitive. En cas de déséquilibre majeur avec signes d’insulinopénie (parfois dès le diagnostic), de grossesse chez une femme diabétique de type 2, de pathologie intercurrente sévère ou de traitement insuffisant par antidiabétiques oraux, l’insulinothérapie doit être débutée, après avis du diabétologue. Une insuline lente est alors prescrite, seule (0,2 UI/kg/j, à titrer en fonction de la glycémie du réveil), ou associée à une insuline rapide avant les repas (fig. 2 ).
Metformine en première intention !
La metformine en monothérapie reste le traitement de premier recours. Souvent bien tolérée, sans risque d’hypoglycémie et très peu coûteuse, elle n’induit ni prise ni perte pondérale. Elle doit être maintenue à tous les stades du DT2 même en cas d’insulinothérapie (En deuxième intention, individualiser le traitement
En cas d’inefficacité, une deuxième, voire une troisième, molécule est associée à la metformine, en fonction du profil du patient :– les sulfamides hypoglycémiants (recommandations de la Haute Autorité de santé [HAS]) induisent un risque d’hypoglycémie et de prise de poids modérée ; ils sont suspendus en cas de jeûne, contre-indiqués en présence d’insuline rapide, d’insuffisance rénale ou hépatique sévère. Seuls les glinides sont utilisables en cas d’insuffisance rénale avec DFG compris entre 15 et 30 mL/min/1,73 m² ;
– les glinides, de même classe que les sulfamides hypoglycémiants, ont une durée d’action plus courte que celle des sulfamides hypoglycémiants. Attention, il n’est pas recommandé d’associer deux médicaments de même mécanisme d’action ;
– les incrétines (recommandations de la Société francophone du diabète [SFD]), sans risque d’hypoglycémie, sont contre-indiquées en cas d’insuffisances hépatique et rénale sévères ;
– les inhibiteurs des DPP-4 (dipeptidyl-peptidase-4, iDPP-4) (recommandations de la SFD) sont souvent bien tolérés et sans risque d’hypoglycémie. Ils peuvent être utilisés à des stades avancés d’insuffisance rénale avec une adaptation des doses variable d’une molécule à l’autre. Ils sont neutres sur le plan cardiovasculaire, hormis la saxagliptine pour laquelle une augmentation du risque d’hospitalisation pour insuffisance cardiaque a été observée ;
– les analogues du GLP-1 (glucagon-like peptide-1, aGLP-1) injectables peuvent être prescrits jusqu’à un DFG de 15 mL/min/1,73 m2. Ils favorisent la perte de poids et n’entraînent pas d’hypoglycémie (sauf association aux sulfamides hypoglycémiants ou à une insulinothérapie). Ils réduisent le risque d’événements cardiovasculaires majeurs d’origine athéroscléreuse. Ils doivent être privilégiés si l’IMC est supérieur à 30 kg/m² et/ou en cas de haut risque cardiovasculaire. Ils sont contre-indiqués en cas de maladie pancréatique. L’association iDPP-4-aGLP-1 est déconseillée ;
– les inhibiteurs du cotransporteur sodium-glucose 2 (SGLT2), sans risque d’hypoglycémie, ont un effet protecteur cardiaque et rénal. Ils sont privilégiés en cas d’insuffisance cardiaque à fraction d’éjection du ventricule gauche réduite et de maladie rénale chronique. Leur effet antihyperglycémiant est limité si le DFG est inférieur à 45 mL/min. Leur prescription à visée cardioprotectrice est cependant autorisée pour la dapagliflozine jusqu’à un DFG de 25 mL/min, même chez les patients non diabétiques. Le remboursement dans l’indication de néphroprotection est en cours d’évaluation ;
– l’insuline, à risque d’hypoglycémie et de prise de poids, peut être utilisée de manière temporaire ou définitive. En cas de déséquilibre majeur avec signes d’insulinopénie (parfois dès le diagnostic), de grossesse chez une femme diabétique de type 2, de pathologie intercurrente sévère ou de traitement insuffisant par antidiabétiques oraux, l’insulinothérapie doit être débutée, après avis du diabétologue. Une insuline lente est alors prescrite, seule (0,2 UI/kg/j, à titrer en fonction de la glycémie du réveil), ou associée à une insuline rapide avant les repas (
Des complications nombreuses nécessitant un suivi strict
Surveillance glycémique
Un bon équilibre glycémique permet de réduire le risque de complications (fig. 3 ).
L’autosurveillance glycémique n’est pas systématique en l’absence de traitement hypoglycémiant. Elle est néanmoins indispensable pour l’adaptation des doses et la surveillance des hypoglycémies, en cas d’utilisation des sulfamides hypoglycémiants, glinides et insuline.
Les objectifs thérapeutiques sont adaptés à l’âge et à la fragilité du patient. Les repères usuels, pour un patient nécessitant une HbA1C inférieure à 6,5 %, sont les suivants :
– glycémie entre 0,8 et 1,2 g/L à jeun (ou avant un repas) ;
– glycémie entre 1,2 et 1,60 g/L en postprandial (2 heures après un repas).
L’adaptation thérapeutique se fonde sur l’HbA1c, le nombre d’hypoglycémies, les effets indésirables et l’évolution des fonctions rénale, hépatique, respiratoire et cardiaque.
L’équilibre glycémique est évalué tous les trois mois par dosage de l’HbA1c. Sa valeur cible est adaptée à chaque contexte :
– inférieure à 6,5 % pour un diabète récent du patient jeune, en l’absence de complications ou en cas de grossesse ;
– inférieure à 7 % en cas de diabète non compliqué et sans comorbidité sévère (ou si les complications et/ou les comorbidités sont stables) ;
– inférieur à 8 % pour un diabète ancien ou associé à des complications et/ou comorbidités sévères et évolutives avec un risque élevé d’hypoglycémie ;
– inférieur à 9 % pour un patient âgé, polypathologique, dont l’espérance de vie est limitée.
Un bilan biologique hépatique est réalisé au moins une fois par an (dépistage d’une hépatopathie dysmétabolique).
L’autosurveillance glycémique n’est pas systématique en l’absence de traitement hypoglycémiant. Elle est néanmoins indispensable pour l’adaptation des doses et la surveillance des hypoglycémies, en cas d’utilisation des sulfamides hypoglycémiants, glinides et insuline.
Les objectifs thérapeutiques sont adaptés à l’âge et à la fragilité du patient. Les repères usuels, pour un patient nécessitant une HbA1C inférieure à 6,5 %, sont les suivants :
– glycémie entre 0,8 et 1,2 g/L à jeun (ou avant un repas) ;
– glycémie entre 1,2 et 1,60 g/L en postprandial (2 heures après un repas).
L’adaptation thérapeutique se fonde sur l’HbA1c, le nombre d’hypoglycémies, les effets indésirables et l’évolution des fonctions rénale, hépatique, respiratoire et cardiaque.
L’équilibre glycémique est évalué tous les trois mois par dosage de l’HbA1c. Sa valeur cible est adaptée à chaque contexte :
– inférieure à 6,5 % pour un diabète récent du patient jeune, en l’absence de complications ou en cas de grossesse ;
– inférieure à 7 % en cas de diabète non compliqué et sans comorbidité sévère (ou si les complications et/ou les comorbidités sont stables) ;
– inférieur à 8 % pour un diabète ancien ou associé à des complications et/ou comorbidités sévères et évolutives avec un risque élevé d’hypoglycémie ;
– inférieur à 9 % pour un patient âgé, polypathologique, dont l’espérance de vie est limitée.
Un bilan biologique hépatique est réalisé au moins une fois par an (dépistage d’une hépatopathie dysmétabolique).
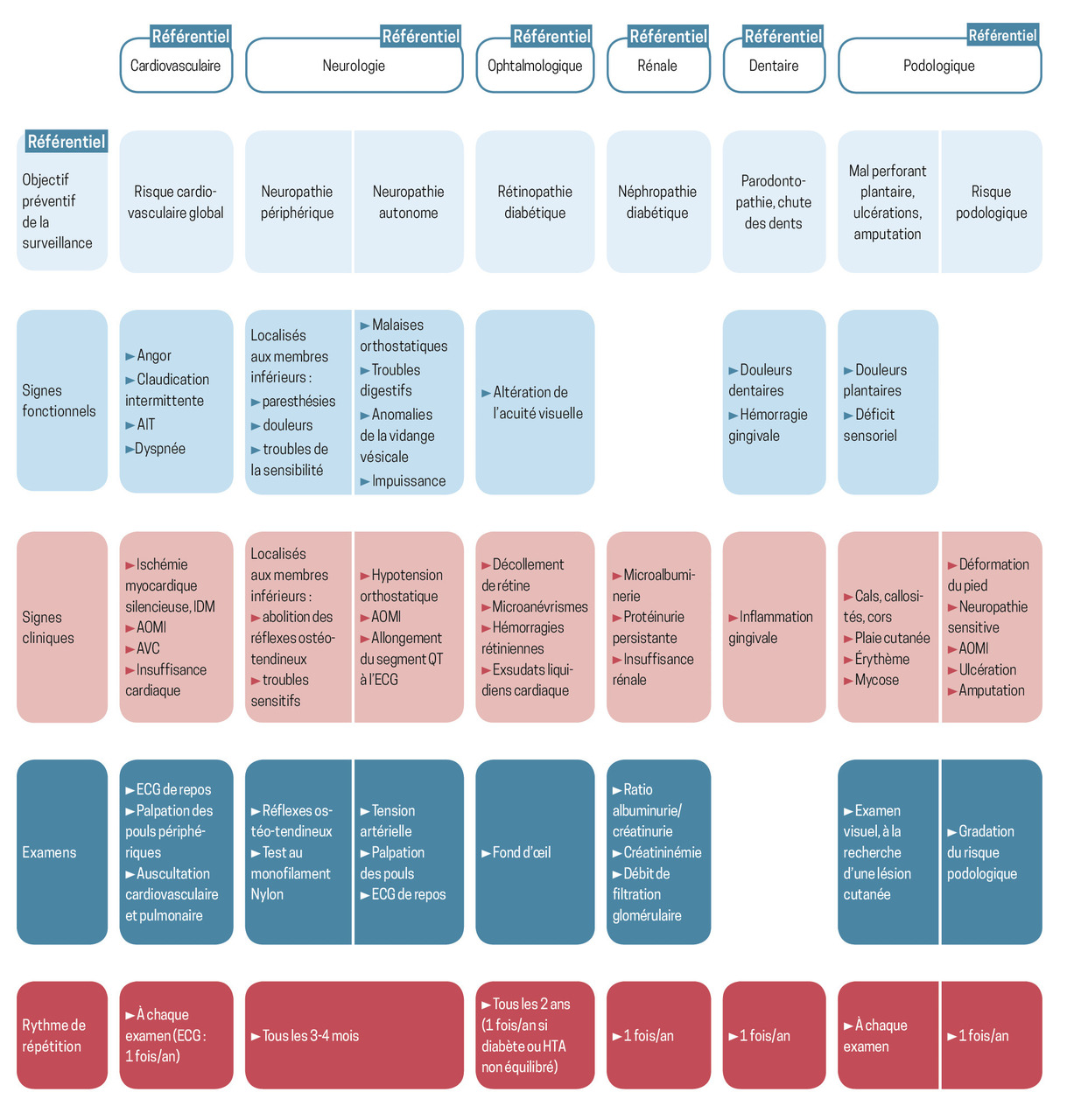
Dépistage des complications micro- et macrovasculaires
Les complications sont parfois présentes dès le diagnostic : elles doivent être recherchées sans attendre.
Un fond d’œil (ou rétinographie) est réalisé annuellement, pour dépister une rétinopathie diabétique.
La néphropathie diabétique est recherchée une fois par an par dosage de la créatinine sanguine, calcul du DFG, dosage de l’excrétion urinaire d’albumine et dosage de la créatininurie sur échantillon, avec calcul du rapport albumine/créatine urinaire (RAC). La découverte d’une albuminurie pathologique (> 30 mg/24 heures ou RAC > 30 mg/g ou 3 mg/mol) nécessite la confirmation par un deuxième prélèvement six mois après le premier, en l’absence d’infection urinaire, de menstruations ou de déséquilibre glycémique majeur. Le recours au néphrologue est conseillé en cas d’atteinte atypique (suspicion d’une autre cause que le diabète) ou de DFG compris entre 30 et 44 mL/min (insuffisance rénale chronique de stade 3B).
La neuropathie est dépistée en recherchant un déficit de sensibilité (hypopallesthésie, trouble proprioceptif, non-perception du monofilament), une aréflexie ostéotendineuse et des paresthésies.
Un dépistage de la maladie macrovasculaire s’effectue par interrogatoire et examen clinique minutieux : auscultation cardiaque et carotidienne, palpation des pouls périphériques, recherche de claudication intermittente, électrocardiogramme annuel. Le score calcique coronarien, calculé sur une imagerie par scanner thoracique, est désormais conseillé pour stratifier le risque cardiovasculaire.11
Le suivi est adapté au niveau de risque du patient et à sa symptomatologie.
Un bilan lipidique doit être réalisé au moins annuellement.
Un fond d’œil (ou rétinographie) est réalisé annuellement, pour dépister une rétinopathie diabétique.
La néphropathie diabétique est recherchée une fois par an par dosage de la créatinine sanguine, calcul du DFG, dosage de l’excrétion urinaire d’albumine et dosage de la créatininurie sur échantillon, avec calcul du rapport albumine/créatine urinaire (RAC). La découverte d’une albuminurie pathologique (> 30 mg/24 heures ou RAC > 30 mg/g ou 3 mg/mol) nécessite la confirmation par un deuxième prélèvement six mois après le premier, en l’absence d’infection urinaire, de menstruations ou de déséquilibre glycémique majeur. Le recours au néphrologue est conseillé en cas d’atteinte atypique (suspicion d’une autre cause que le diabète) ou de DFG compris entre 30 et 44 mL/min (insuffisance rénale chronique de stade 3B).
La neuropathie est dépistée en recherchant un déficit de sensibilité (hypopallesthésie, trouble proprioceptif, non-perception du monofilament), une aréflexie ostéotendineuse et des paresthésies.
Un dépistage de la maladie macrovasculaire s’effectue par interrogatoire et examen clinique minutieux : auscultation cardiaque et carotidienne, palpation des pouls périphériques, recherche de claudication intermittente, électrocardiogramme annuel. Le score calcique coronarien, calculé sur une imagerie par scanner thoracique, est désormais conseillé pour stratifier le risque cardiovasculaire.11
Le suivi est adapté au niveau de risque du patient et à sa symptomatologie.
Un bilan lipidique doit être réalisé au moins annuellement.
Ne pas oublier les pieds et la bouche !
L’examen minutieux des pieds recherche l’apparition d’une plaie. La découverte d’une lésion impose une mise en décharge jusqu’à cicatrisation.
Les soins podologiques sont remboursés en fonction de la classification suivante :
– grade 0 : absence de neuropathie, d’AOMI, de déformation ;
– grade 1 : neuropathie sensitive au monofilament isolée ;
– grade 2 : neuropathie sensitive et AOMI (absence d’un ou deux pouls pédieux ou indice de pression systolique < 0,9) ou neuropathie sensitive et déformation ;
– grade 3 : antécédent de plaie chronique (datant de plus de 1 mois) ou d’amputation.
Enfin, un suivi dentaire régulier est préconisé, à la recherche d’une parodontopathie.
Les soins podologiques sont remboursés en fonction de la classification suivante :
– grade 0 : absence de neuropathie, d’AOMI, de déformation ;
– grade 1 : neuropathie sensitive au monofilament isolée ;
– grade 2 : neuropathie sensitive et AOMI (absence d’un ou deux pouls pédieux ou indice de pression systolique < 0,9) ou neuropathie sensitive et déformation ;
– grade 3 : antécédent de plaie chronique (datant de plus de 1 mois) ou d’amputation.
Enfin, un suivi dentaire régulier est préconisé, à la recherche d’une parodontopathie.
Encadre
Que dire à vos patients
– Le diabète de type 2 est une maladie initialement asymptomatique mais responsable de complications nécessitant une bonne observance thérapeutique et un suivi régulier. Un bon équilibre glycémique permet de réduire le risque de complications.
– Les modifications du mode de vie (alimentation et activité physique) sont un pilier majeur du traitement.
– Des associations de patients peuvent être sollicitées :
• Fédération française des diabétiques : https://www.federationdesdiabetiques.org/
• Maisons du diabète (Ligue des diabétiques de France [LDF])
• Union Sports & diabète : www.unionsportsetdiabete.com
– Le site www.mangerbouger.fr est une source riche d’informations sur l’alimentation.
Références
1. International Diabetes Federation. IDF Diabetes Atlas. 10e édition. Bruxelles: International Diabetes Federation, 2021.
2. Lailler G, Piffaretti C, Fuentes S, et al. Prevalence of prediabetes and undiagnosed type 2 diabetes in France: Results from the national survey ESTEBAN, 2014-2016. Diabetes Res Clin Pract 2020;165:108252.
3. Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010;375(9733):2215-22.
4. Assogba FAG, Penfornis F, Detournay B, et al. Facteurs associés à l’hospitalisation des personnes diabétiques adultes en France. ENTRED 2007. Bull Epidémiol Hebd 2013;(37-38):454-63.
5. HAS. Prévention et dépistage du diabète de type 2 et des maladies liées au diabète [en ligne]. Octobre 2014 [consulté en février 2022]. Disponible sur : https://bit.ly/3Mb4ZtQ
6. He X, Li J, Wang B, et al. Diabetes self-management education reduces risk of all-cause mortality in type 2 diabetes patients: a systematic review and meta-analysis. Endocrine 2017;55:712-31.
7. Société francophone du diabète. Référentiel de bonnes pratiques – Nutrition & diététique. Diabète de type 2 de l’adulte. Med Mal Metab, hors-série 1, vol. 8, 2014.
8. American Diabetes Association. Prevention or Delay of Type 2 Diabetes and Associated Comorbidities: Standards of Medical Care in Diabetes–2022. Diabetes Care 2022;45(Supplement_1):S39-S45.
9. Boulé NG, Haddad E, Kenny GP, et al. Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus: a meta-analysis of controlled clinical trials. JAMA 2001;286(10):1218-27.
10.Darmon P, Bauduceau B, Bordier L, et al. Prise de position de la Société francophone du diabète (SFD) sur les stratégies d’utilisation des traitements anti-hyperglycémiants dans le diabète de type 2 – 2021. Med Mal Metab 2021;15(8):781-801.
11. Valensi P, Henry P, Boccara F, et al. Risk stratification and screening for coronary artery disease in asymptomatic patients with diabetes mellitus: Position paper of the French Society of Cardiology and the French-speaking Society of Diabetology. Diabetes Metab 2021;47(2):101185.
2. Lailler G, Piffaretti C, Fuentes S, et al. Prevalence of prediabetes and undiagnosed type 2 diabetes in France: Results from the national survey ESTEBAN, 2014-2016. Diabetes Res Clin Pract 2020;165:108252.
3. Sarwar N, Gao P, Seshasai SR, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet 2010;375(9733):2215-22.
4. Assogba FAG, Penfornis F, Detournay B, et al. Facteurs associés à l’hospitalisation des personnes diabétiques adultes en France. ENTRED 2007. Bull Epidémiol Hebd 2013;(37-38):454-63.
5. HAS. Prévention et dépistage du diabète de type 2 et des maladies liées au diabète [en ligne]. Octobre 2014 [consulté en février 2022]. Disponible sur : https://bit.ly/3Mb4ZtQ
6. He X, Li J, Wang B, et al. Diabetes self-management education reduces risk of all-cause mortality in type 2 diabetes patients: a systematic review and meta-analysis. Endocrine 2017;55:712-31.
7. Société francophone du diabète. Référentiel de bonnes pratiques – Nutrition & diététique. Diabète de type 2 de l’adulte. Med Mal Metab, hors-série 1, vol. 8, 2014.
8. American Diabetes Association. Prevention or Delay of Type 2 Diabetes and Associated Comorbidities: Standards of Medical Care in Diabetes–2022. Diabetes Care 2022;45(Supplement_1):S39-S45.
9. Boulé NG, Haddad E, Kenny GP, et al. Effects of exercise on glycemic control and body mass in type 2 diabetes mellitus: a meta-analysis of controlled clinical trials. JAMA 2001;286(10):1218-27.
10.Darmon P, Bauduceau B, Bordier L, et al. Prise de position de la Société francophone du diabète (SFD) sur les stratégies d’utilisation des traitements anti-hyperglycémiants dans le diabète de type 2 – 2021. Med Mal Metab 2021;15(8):781-801.
11. Valensi P, Henry P, Boccara F, et al. Risk stratification and screening for coronary artery disease in asymptomatic patients with diabetes mellitus: Position paper of the French Society of Cardiology and the French-speaking Society of Diabetology. Diabetes Metab 2021;47(2):101185.

 Encadrés
Encadrés