Rare mais grave s’il est méconnu, le diabète insipide central peut être bien toléré tant que l’accès à l’eau est possible. Savoir en évoquer le diagnostic devant un syndrome polyuropolydipsique est primordial.
Décrit pour la première fois en 1674 par Thomas Willis, le diabète insipide se caractérise par une incapacité du corps à concentrer les urines. Cliniquement, il se manifeste par une polyurie hypotonique associée à une polydipsie compensatrice.
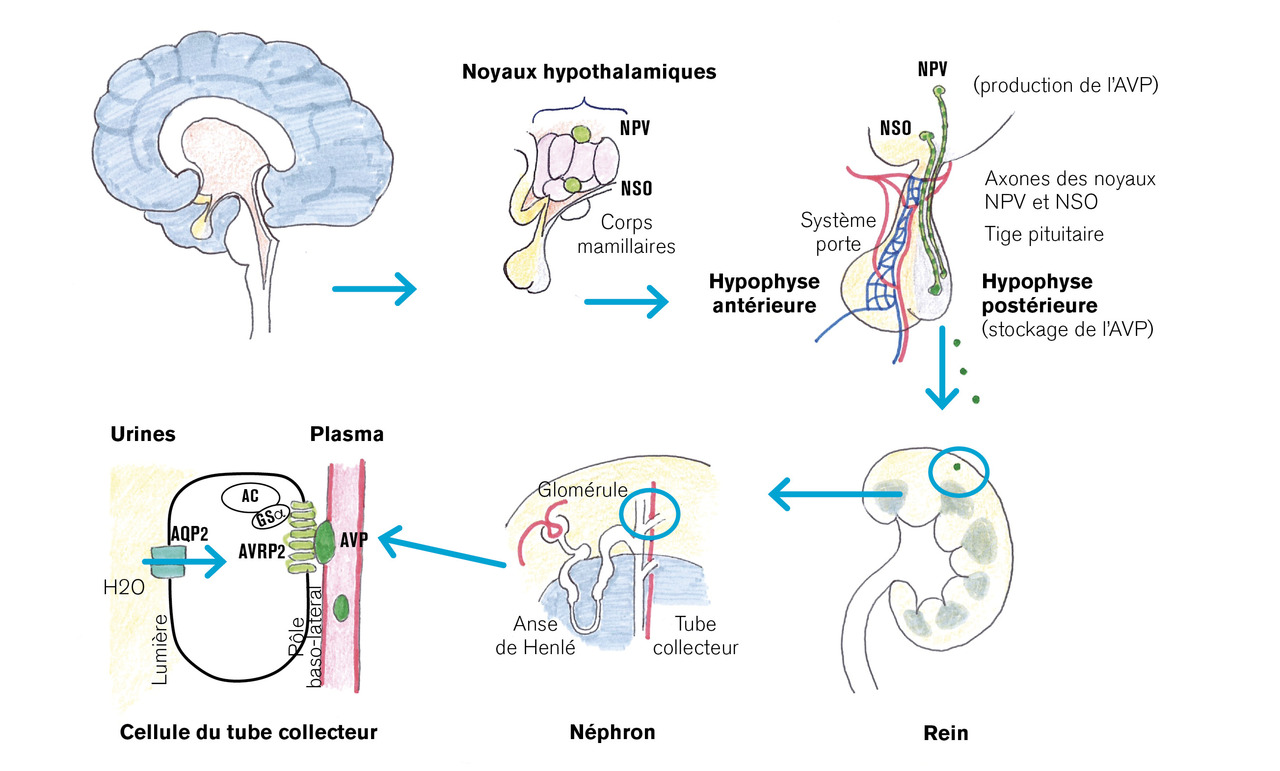
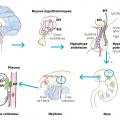
La capacité de concentration urinaire est dépendante de l’hormone antidiurétique (ADH), également appelée arginine vasopressine (AVP). Cette hormone peptidique, synthétisée par l’hypothalamus au niveau des noyaux supra-optiques et paraventriculaires, est ensuite stockée et libérée par la posthypophyse ; elle cible en particulier les récepteurs V2 du néphron distal dans le tubule collecteur (
Le diabète insipide peut être de deux types dont les causes et la prise en charge diffèrent :
– central lorsqu’il est dû à un déficit en production de l’AVP ; c’est le cas le plus fréquent ;
– néphrogénique en cas de sensibilité rénale à la vasopressine diminuée ou abolie.
Le diabète insipide central est une pathologie rare, avec une prévalence identique chez les hommes et chez les femmes, estimée à 1/25 000 cas. La Haute Autorité de santé a évalué à environ 10 000 le nombre de prescriptions réalisées dans le cadre d’un diabète insipide central, en 2003 et 2004.
Les diabètes insipides les plus fréquents sont idiopathiques ou acquis et peuvent se manifester à tout âge. Lorsqu’il est congénital, le diabète insipide se manifeste le plus souvent dès l’enfance.
Les causes du diabète insipide, qu’il soit acquis ou congénital, sont nombreuses (
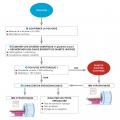
Quatre étapes pour poser le diagnostic
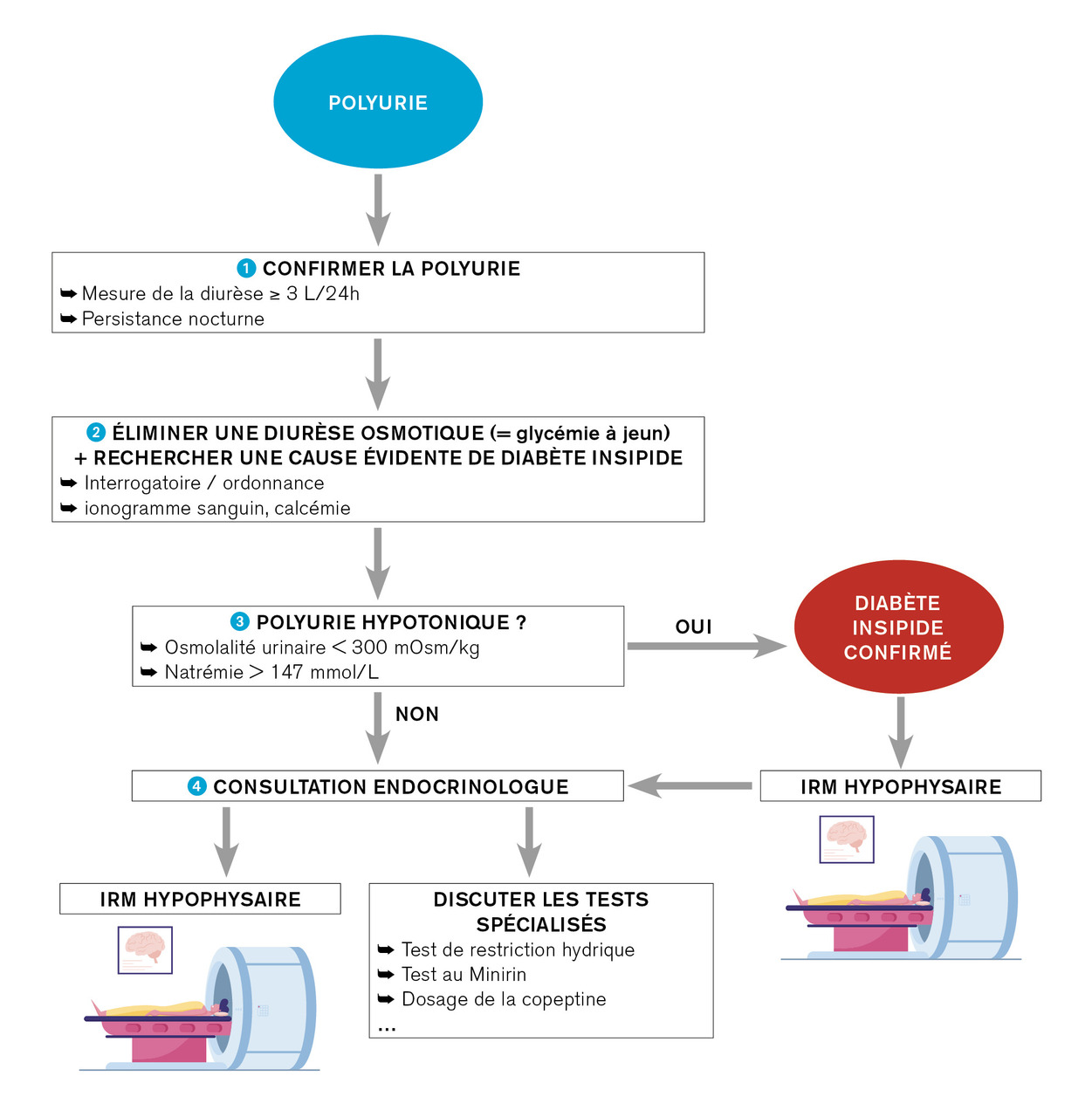
Le diagnostic de diabète insipide est basé sur l’observation d’une augmentation significative de la diurèse, persistante même dans les situations de privation en eau. La diurèse est considérée comme pathologique si elle est supérieure à 3 litres par 24 heures chez l’adulte (40 mL/kg/j), ou 6,6 mL/kg/h chez l’enfant. La démarche diagnostique initiale comporte alors plusieurs étapes simples (
Authentifier le syndrome polyurique
Il est nécessaire de bien quantifier la diurèse en incitant le patient à la mesurer (en nombre de bocaux ou bouteilles) sur un cycle d’au moins 24 heures. Cette mesure permet de différencier la polyurie de la pollakiurie (augmentation du nombre de mictions sans augmentation du volume urinaire).
Le patient doit décrire précisément les situations de soif et notamment le nombre de réveils nocturnes. La persistance nocturne du syndrome polyuro-polydipsique est un bon signe d’organicité ; son retentissement sur la qualité de vie et la fatigue qui en découlent sont à rechercher à l’interrogatoire. On précise enfin le début et la rapidité d’installation des symptômes.
Il est important de rappeler que la tolérance clinique reste bonne si les apports hydriques sont suffisants ; l’absence de signes de déshydratation (pas de perte de poids, pas d’hypotension) ne doit pas faire exclure le diagnostic.
Éliminer une polyurie osmotique
Une fois la polyurie authentifiée, un dosage de glycémie à jeun permet d’éliminer un diabète, principale cause de polyurie osmotique. Un interrogatoire minutieux sur les prises médicamenteuses récentes ou habituelles permet ensuite d’identifier un traitement potentiellement en cause dans la polyurie osmotique (intoxication au mannitol, notamment).
La polyurie osmotique est définie par une élimination osmotique urinaire supérieure à la charge osmotique standard (> 900 mOsm/L).
Il convient également d’écarter rapidement les troubles ioniques comme une hypokaliémie ou une hypercalcémie (causes de diabète insipide néphrogénique).
Confirmer le caractère hypotonique de la polyurie
Le bilan initial consiste en un simple ionogramme sanguin et une osmolalité plasmatique et urinaire. Dans des conditions d’accès libre à l’eau, les taux d’électrolytes sanguins sont normaux. Néanmoins, le taux de sodium à jeun le matin est souvent légèrement élevé. Si l’osmolalité urinaire est basse (inférieure à 300 mOsmol/kg), avec un taux de sodium sérique non adapté (supérieur à 147 mmol/L), le diabète insipide est confirmé.
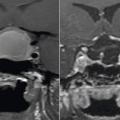
IRM centrée sur l’hypophyse : étape obligatoire
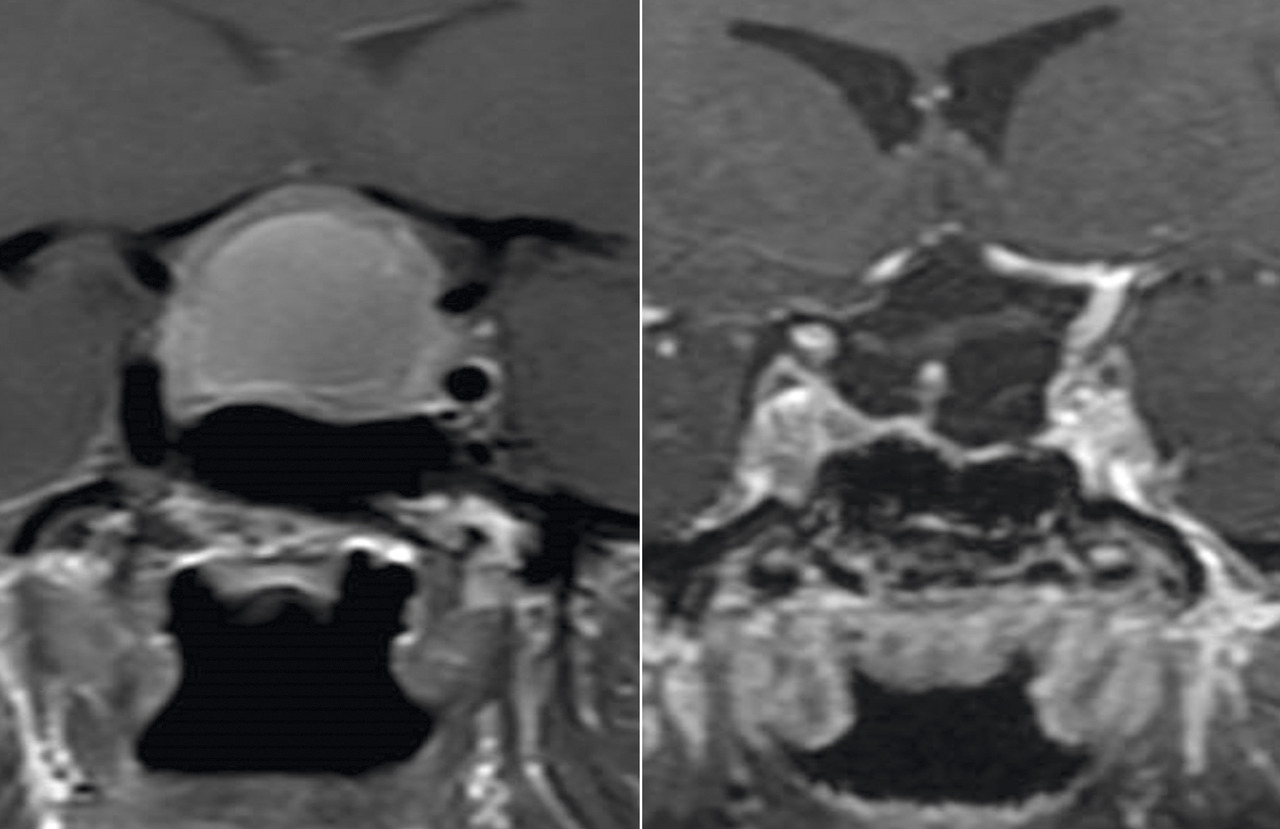
La réalisation d’une IRM centrée sur l’hypophyse est obligatoire devant toute suspicion de diabète insipide à partir des arguments diagnostiques évoqués. Elle permet d’affirmer la présence d’une tumeur de la région hypothalamo-hypophysaire ou de signes d’hypophysite (élargissement de la tige pituitaire notamment) en faveur d’une cause acquise de diabète insipide central.
L’IRM sans lésion peut révéler une perte de signal de la post-hypophyse (signant l’absence de vasopressine), en faveur du diagnostic de diabète insipide idiopathique.
L’adénome hypophysaire, même invasif, n’est classiquement pas pourvoyeur de diabète insipide, à l’exception de situations exceptionnelles de nécrose de l’adénome (apoplexie).
Incertitude diagnostique : prendre l’avis du spécialiste
Le plus souvent, le diagnostic repose sur des éléments simples : interrogatoire, courbes d’hydratation et de diurèse, osmolalités plasmatique et urinaire, IRM hypophysaire. Les tests et examens spécialisés ne sont indiqués qu’en cas de suspicion de formes partielles.
Test de restriction hydrique, sous surveillance clinique rapprochée
Le test de restriction hydrique consiste à mesurer la concentration maximale d’urine lors d’une privation prolongée en boissons.
En cas de suspicion de déficit partiel en vasopressine, sa réalisation peut être discutée pour confirmer le diagnostic.
En revanche, bien qu’étant l’examen de référence, il est inutile, voire dangereux, en cas de diabète insipide central complet : risque de déshydratation majeure avec hypernatrémie, pouvant mettre en jeu le pronostic vital du patient.
Il est donc réalisé dans un service spécialisé, sous surveillance horaire des paramètres cliniques (poids, pression artérielle, fréquence cardiaque, diurèse) et biologiques (ionogramme sanguin, osmolalités urinaire et plasmatique). Des signes de mauvaise tolérance (perte de poids > 3 %, hypotension orthostatique, tachycardie, diminution de la pression artérielle moyenne > 15 %, augmentation de la natrémie > 150 mmol/L) doivent faire interrompre le test.
Le diagnostic de diabète insipide central complet est retenu lorsque l’osmolalité urinaire maximale demeure inférieure à 300 mOsm/kg ; en cas d’osmolalité urinaire maximale de 300 à 800 mOsm/kg, il s’agit d’un diabète insipide partiel.5
Concentration urinaire après restriction hydrique
Cet examen correspond à la recherche de la réponse rénale à l’administration de desmopressine (2 µg par voie intraveineuse), à la fin ou à l’arrêt du test de restriction hydrique.
La concentration des urines est en faveur du diabète insipide central (augmentation de l’osmolalité urinaire de plus de 50 % dans le diabète insipide central complet et de 9 % à 50 % dans la forme partielle, 60 minutes après l’injection). L’absence de concentration affirme le diabète insipide néphrogénique.
Mesure de biomarqueurs : la copeptine, une révolution !
Un taux de vasopressine plasmatique non adapté permet d’orienter vers un diabète insipide central. Néanmoins, ce dosage nécessite des conditions de prélèvement très strictes (sur glace, avec centrifugation rapide et congélation immédiate) rendant sa réalisation et son interprétation délicates. Plus récemment, la copeptine a permis d’apporter des arguments supplémentaires en faveur d’un diabète insipide central.5 Cette molécule partage avec l’AVP le même précurseur ; elles sont toutes deux produites dans les mêmes proportions. La meilleure stabilité de la copeptine en fait désormais un biomarqueur de choix, plus facile à doser. Si la copeptine est supérieure à 21,4 pmol/L, le diagnostic de diabète insipide néphrogénique peut être posé d’emblée sans test complémentaire. Si elle est < 21,4 pmol/L, un test hypertonique doit être réalisé en milieu très spécialisé pour différencier un diabète insipide central d’une potomanie.
Forme idiopathique : un diagnostic d’élimination
Le diabète insipide central idiopathique est fréquent. Ce diagnostic ne peut cependant être retenu qu’après un bilan étiologique exhaustif et après répétition des examens d’imagerie.6
Prise en charge : substitution à vie
La prise en charge étiologique prime : chirurgie d’un craniopharyngiome, d’un germinome, etc. Puis, le diabète insipide central étant secondaire à une insuffisance de sécrétion en vasopressine, la thérapeutique repose sur un traitement substitutif.
En 1913, Farini et von den Velden ont traité avec succès des patients atteints de diabète insipide en utilisant des extraits de l’hypophyse postérieure, par injections hypodermiques.1
Plusieurs décennies après, en 1967, un analogue synthétique de l’AVP est créé : la dDAVP ou desmopressine. Il révolutionne le traitement du diabète insipide central par ses propriétés davantage antidiurétiques et moins vasopressives que la forme naturelle.
dDAVP orale, forme la plus utilisée
La demi-vie de la dDAV est de 3 heures et sa durée d’action de 8 heures. Elle existe sous plusieurs formes :
– injectable sous-cutanée (1 à 2 mg, une ou deux fois par jour), notamment pour les situations d’urgence ;
– endonasale (spray de 5 à 20 mg, deux à trois fois par jour, chaque spray apportant 10 mg). Cette forme n’est plus commercialisée en France depuis le 27 avril 2021 ;
– orale en lyophilisat (Minirinmelt 60, 120 ou 240 mg). Cette dernière est la plus utilisée, administrée à la dose de 60 à 120mg, 2 à 3 fois par jour. Elle est généralement débutée à la dose de 60 mg le soir, puis augmentée progressivement jusqu’à disparition des mictions nocturnes. Dans la journée, une prise de 60 mg le matin (voire aucune prise) peut suffire à contrôler la diurèse.
Éduquer le patient au risque de surdosage
L’adaptation des doses de dDAVP est réalisée par le patient, selon ses symptômes et la gêne ressentie. Une éducation thérapeutique est donc nécessaire. Le risque de surdosage doit notamment être bien connu : apparition de signes d’intoxication hydrique (maux de tête, nausées, confusion). Le patient doit alors savoir interrompre le traitement jusqu’à la réapparition de la polyurie.
Surveillance et modalités du traitement
La surveillance de la diurèse et de la natrémie doit être régulière en début du traitement par dDAVP. Par la suite, l’interrogatoire peut suffire. Les patients décrivent en effet très bien la récidive immédiate de la polyurie en cas d’oubli d’un comprimé, confirmant la persistance du diabète insipide, en particulier dans le cadre d’une séquelle de sarcoïdose hypothalamo-hypophysaire.3
La dDAVP est un traitement à vie, le diabète insipide étant permanent chez la plupart des patients. Une consultation annuelle en endocrinologie paraît justifiée pour la surveillance clinique et le renouvellement des conseils.
La dDAVP n’est pas contre-indiquée pendant la grossesse. Les quelques données de sécurité disponibles sont rassurantes pour la mère et l’enfant à naître. Une augmentation des doses habituelles peut parfois être nécessaire pour équilibrer la patiente.7
Deux diagnostics différentiels essentiels
Deux situations particulières méritent d’être évoquées : le diabète insipide néphrogénique et la potomanie (
Diabète insipide néphrogénique
Dans le diabète insipide néphrogénique, la sécrétion de vasopressine est normale. L’anomalie se situe cette fois au niveau rénal : il s’agit d’une insensibilité à l’action de cette hormone.
Le test de restriction hydrique confirme l’incapacité de concentration des urines, qui est ici persistante malgré l’administration de desmopressine. Cette insensibilité peut être secondaire à une pathologie rénale, à des perturbations métaboliques, à la prise de nombreux médicaments. Le lithium est ainsi la cause la plus fréquente de diabète insipide néphrogénique (30 % de diabète insipide chez les patients sous traitement au long cours). Il existe également des formes familiales, souvent plus sévères.8
Potomanie
La potomanie se caractérise par la prise quotidienne excessive de boissons ; elle relève de troubles psychologiques et/ou psychiatriques, le plus souvent niés.
La principale problématique est que toute potomanie peut induire un diabète insipide vrai, dit primaire, par désadaptation de la réponse à l’eau. Le diagnostic peut donc être difficile, le test de restriction pouvant être discordant.
Un syndrome polyuropolydipsique à début progressif, des antécédents de troubles psychiatriques et une osmolalité plasmatique souvent inférieure à celle d’un diabète insipide doivent faire évoquer ce diagnostic.
Il est important de noter que la soif est parfois aggravée par une sécheresse buccale iatrogène, notamment liée à l’utilisation de médicaments psychotropes.
Diabète insipide gestationnel, peu fréquent et transitoire
Rare, le diabète insipide gestationnel est transitoire, lié à une augmentation de la production de vasopressinases par le placenta, qui inactivent la vasopressine circulante. Il survient en fin de grossesse et disparaît classiquement quelques jours après l’accouchement.7
Rare mais grave
Le diabète insipide central peut être longtemps méconnu car sa tolérance est bonne tant que l’accès à l’eau est possible. Le rôle du médecin généraliste est de savoir évoquer ce diagnostic en insistant à l’interrogatoire sur le retentissement du syndrome polyuro-polydipsique (levers nocturnes et altération de la qualité de vie). Une IRM hypophysaire permet d’éliminer une cause tumorale potentiellement sévère de la région hypothalamo-hypophysaire ou d’en poser rapidement le diagnostic pour orienter le patient vers un service d’endocrinologie.
Le traitement est substitutif à vie (desmopressine orale). Il est adapté par le patient qu’il convient d’éduquer à sa pathologie.
Vers qui adresser les patients ?
Le diabète insipide central est une maladie très peu fréquente.
Depuis plusieurs années, les médecins spécialisés dans cette pathologie sont regroupés au sein du Centre de référence des maladies rares de l’hypophyse (CRMR HYPO) basé à l’Assistance publique-Hôpital de Marseille, de 3 sites constitutifs (services d’endocrinologie du Kremlin-Bicêtre, de Lyon et d’Angers) et de 29 centres de compétence.
Toutes les adresses sont disponibles sur le site de l’Association française du diabète insipide :
https://association-francaise-du-diabete-insipide.assoconnect.com
1. Qureshi S, Galiveeti S, Bichet DG, Roth J. Diabetes insipidus: celebrating a century of vasopressin therapy. Endocrinology. dec 2014;155(12):4605‑21.
2. Leroy C, Karrouz W, Douillard C, Do Cao C, Cortet C, Wémeau J-L, et al. Diabetes insipidus. Ann Endocrinol. déc 2013;74(5‑6):496‑507.
3. Langrand C, Bihan H, Raverot G, Varron L, Androdias G, Borson-Chazot F, et al. Hypothalamo-pituitary sarcoidosis: a multicenter study of 24 patients. QJM Mon J Assoc Physicians. oct 2012;105(10):981‑95.
4. Sagna Y, Courtillot C, Drabo JY, Tazi A, Donadieu J, Idbaih A, et al. Endocrine manifestations in a cohort of 63 adulthood and childhood onset patients with Langerhans cell histiocytosis. Eur J Endocrinol. sept 2019;181(3):275‑85.
5. Fenske W, Refardt J, Chifu I, Schnyder I, Winzeler B, Drummond J, et al. A Copeptin-Based Approach in the Diagnosis of Diabetes Insipidus. N Engl J Med. 2 août 2018;379(5):428‑39.
6. Maghnie M, Cosi G, Genovese E, Manca-Bitti ML, Cohen A, Zecca S, et al. Central diabetes insipidus in children and young adults. N Engl J Med. 5 oct 2000;343(14):998‑1007.
7. Chanson P, Salenave S. Diabetes insipidus and pregnancy. Ann Endocrinol. juin 2016;77(2):135‑8.
8. Bockenhauer D, Bichet DG. Pathophysiology, diagnosis and management of nephrogenic diabetes insipidus. Nat Rev Nephrol. oct 2015;11(10):576‑88.

 Encadrés
Encadrés