Diagnostiquer un diabète chez l’adulte.
Identifier les situations d’urgence et planifier leur prise en charge.
Argumenter l’attitude thérapeutique nutritionnelle et médicamenteuse (voir item 330).
Décrire les principes de la prise en charge au long cours.
Diagnostiquer un diabète chez l’adulte
Circonstances de découverte
En l’absence de symptômes : dépistage
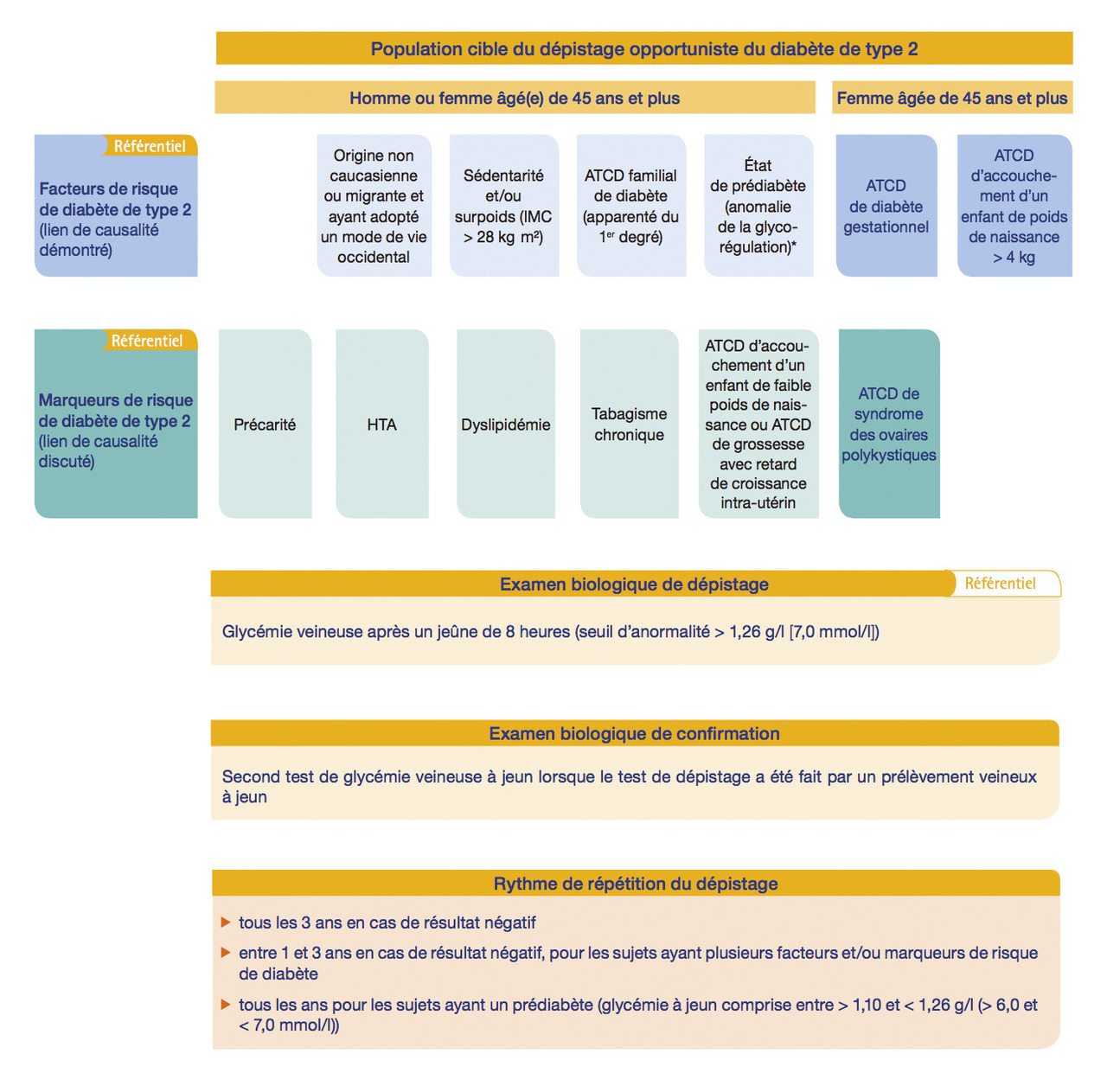
Le dépistage est indiqué chez des sujets de plus de 45 ans, en présence d’au moins un facteur de risque parmi les suivants : hyperglycémie modérée à jeun (entre 1,10 et 1,25 g/L), non Caucasiens, syndrome métabolique (indice de masse corporelle [IMC] > 28 kg/m², hypertension artérielle [HTA], HDL-cholestérol < 0,35 g/L et/ou triglycérides > 2 g/L et/ou dyslipidémie traitée), antécédents de diabète familial au premier degré, de diabète gestationnel, enfant né avec une macrosomie, signes d’insulinorésistance (acanthosis nigricans).Diagnostic biologique
Une glycémie à jeun ≥ 1,10 g/L et < 1,26 g/L définit une hyperglycémie modérée à jeun.
Diagnostic étiologique
Diabète de type 1 (DT1)
Physiopathologie
Les anticorps anti-GAD, anti-IA-2, anti-cellules d'îlots, anti-ZnT8, anti-insuline constituent des marqueurs d’auto-immunité, sans rôle pathogène.
Les prédispositions comportent : un antécédent personnel ou familial de maladie auto-immune (dysthyroïdie, vitiligo, maladie cœliaque, insuffisance surrénalienne, atrophie gastrique… pouvant s’intégrer dans une polyendocrinopathie auto-immune de type 2), avec, comme marqueurs génétiques, des haplotypes du complexe majeur d’histocompatibilité (HLA) de classe II DR3 et DR4.
Signes cliniques
Un syndrome cardinal est souvent observé : asthénie, syndrome polyuropolydipsique, déshydratation, amaigrissement à appétit conservé, parfois accompagné d’un tableau acidocétosique (dyspnée de Kussmaul, haleine acétonique, douleurs abdominales et vomissements).
Diagnostic biologique
- une bandelette urinaire, à la recherche de glycosurie et de cétonurie supérieures à une croix (> +) ;
- une glycémie et une cétonémie capillaires (augmentées) et/ou veineuses. Le diagnostic repose sur une glycémie veineuse ≥ 2 g/L, quelle que soit l’heure, en présence d’un syndrome cardinal ;
- un dosage des auto-anticorps pour confirmer l’origine auto-immune.
Traitement
L’insuline peut être administrée par :
- un stylo d’insuline lente (agit 24 heures) ou semi-lente (12 heures), à injecter à heure fixe et à maintenir même en cas de jeûne, et d’insuline rapide (3-4 heures) avant chaque repas, à suspendre en cas de jeûne ;
- une pompe à insuline, avec injection continue d’insuline rapide faisant fonction d’insuline basale.
Éducation thérapeutique
Le patient doit être éduqué à l’injection, à l’adaptation de l’insulinothérapie, à l’autosurveillance de la glycémie (capillaire ou interstitielle par capteur), aux causes des variations glycémiques (insuline, alimentation, alcool, activité, pathologie intercurrente…), aux signes faisant suspecter une situation urgente, à la reconnaissance et à la gestion des hypoglycémies.Complications métaboliques urgentes
Acidocétose diabétique
Elle reflète une carence sévère (voire absolue) en insuline et une sécrétion de glucagon. Elle peut survenir dès la découverte du DT1, en cas d’arrêt de l’insulinothérapie ou de pathologie intercurrente sévère. Elle comporte un tableau d’hyperglycémie majeure (syndrome cardinal avec déshydratation), de cétose (troubles digestifs), puis d’acidocétose avec polypnée. Tout syndrome abbdominal chez un diabétique doit faire penser à une acidocétose.Le diagnostic est retenu devant : une hyperglycémie > 2,5 g/L, une cétonémie > 3 mmol/L ou cétonurie ≥ ++, un trou ionique > 12 mEq/L et une acidose métabolique avec pH artériel < 7,30 et/ou bicarbonates plasmatiques < 15 mmol/L. Toute hyperglycémie > 2,5 g/L prolongée, sans cause évidente, nécessite la recherche de corps cétoniques sur bandelette urinaire ou sang capillaire.
Le traitement associe en urgence : réhydratation intraveineuse (IV), supplémentation potassique systématique (ou retardée si kaliémie initiale > 5 mmol/L) et insulinothérapie par voie intraveineuse à la seringue électrique (IVSE) [0,1 U/kg/h jusqu’à 7 U/h]. L’insuline est indispensable à la régulation glucido-lipidique : une solution glucosée sera administrée en cas de normoglycémie avec persistance de l’hypercétonémie. L’insulinothérapie IVSE ne sera relayée par voie sous-cutanée qu’après normalisation de l’acidose, de la cétonémie et du trou ionique.
Hypoglycémie
Le tableau clinique comporte des signes adrénergiques (pâleur, sueurs, tachycardie…) puis neuroglucopéniques (confusion, signes sensitifs ou moteurs, crise comitiale…). Des hypoglycémies à répétition ou une neuropathie végétative peuvent masquer les signes adrénergiques. Toute symptomatologie neurologique chez un patient diabétique doit faire rechercher une hypoglycémie.L’hypoglycémie se définit par une glycémie < 0,70 g/L. L’hypoglycémie sévère est définie par la nécessité de l’intervention d’un tiers. Les causes comprennent une dose d’insuline trop élevée, un apport insuffisant en glucides, une activité physique inhabituelle…
Le resucrage s’effectue per os (15 g de glucose) ou, en cas d’impossibilité, par injection intramusculaire (IM) de glucagon (une forme à administration nasale sera prochainement disponible) ou soluté glucosé intraveineux (IV).
Diabète de type 2 (DT2)
Ses facteurs de risque comportent le syndrome métabolique, un antécédent familial de DT2 au premier degré ou un antécédent personnel de diabète gestationnel ou de macrosomie. Certaines populations ont un risque plus élevé de développer un DT2 (Afrique, DOM-TOM, Asie…) [
Physiopathologie
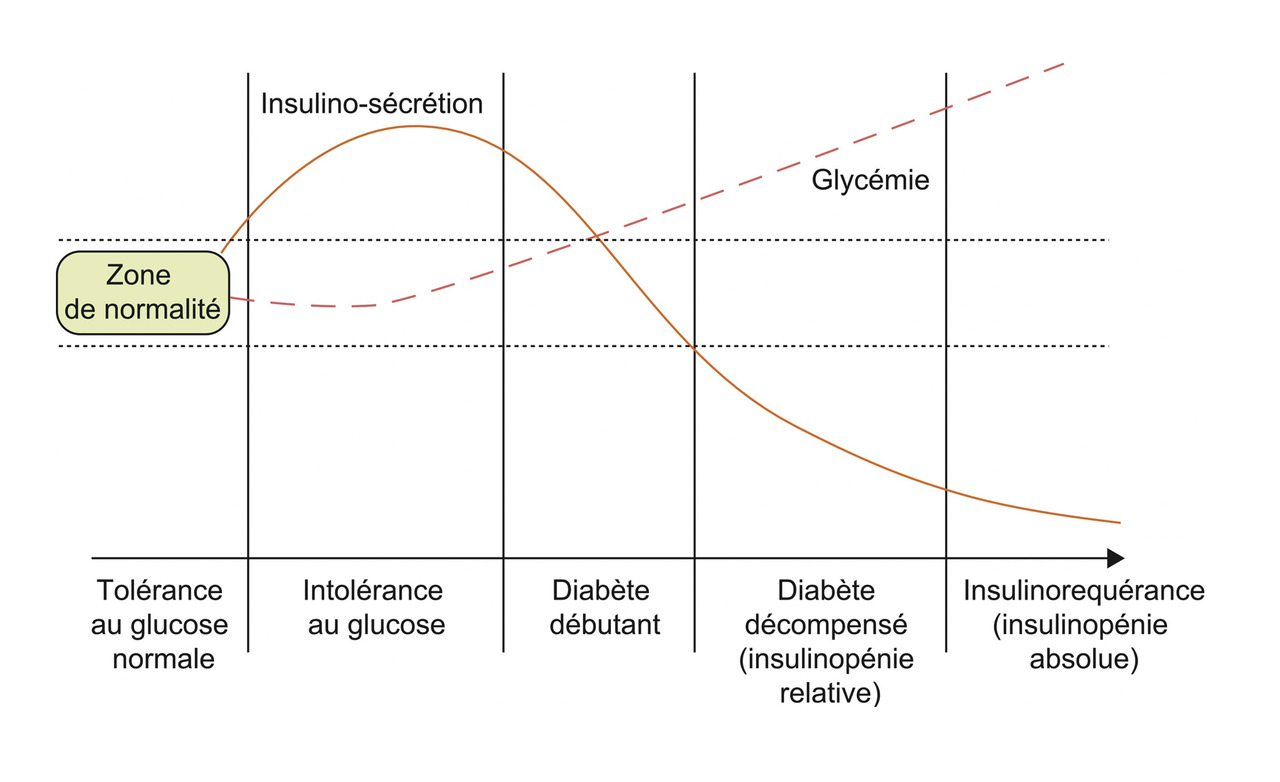
- une insulinorésistance hépatique, adipeuse et musculaire : responsable d’une glucolipotoxicité ;
- un hyperinsulinisme réactionnel initial évoluant vers une insulinopénie relative (sécrétion insuffisante par rapport à la glycémie), aggravée au cours du temps par glucolipotoxicité.
Diagnostic
- glycémie veineuse le matin à jeun ≥ 1,26 g/L, vérifiée une fois ;
- glycémie veineuse > 2 g/L quel que soit le moment de la journée, avec les signes cardinaux ;
- glycémie veineuse à 2 heures de l’épreuve d’hyperglycémie provoquée par voie orale (HGPO) ≥ 2 g/L (rarement effectuée en pratique, sauf dépistage et suivi de diabète gestationnel).
Traitement
Traitement de première intention
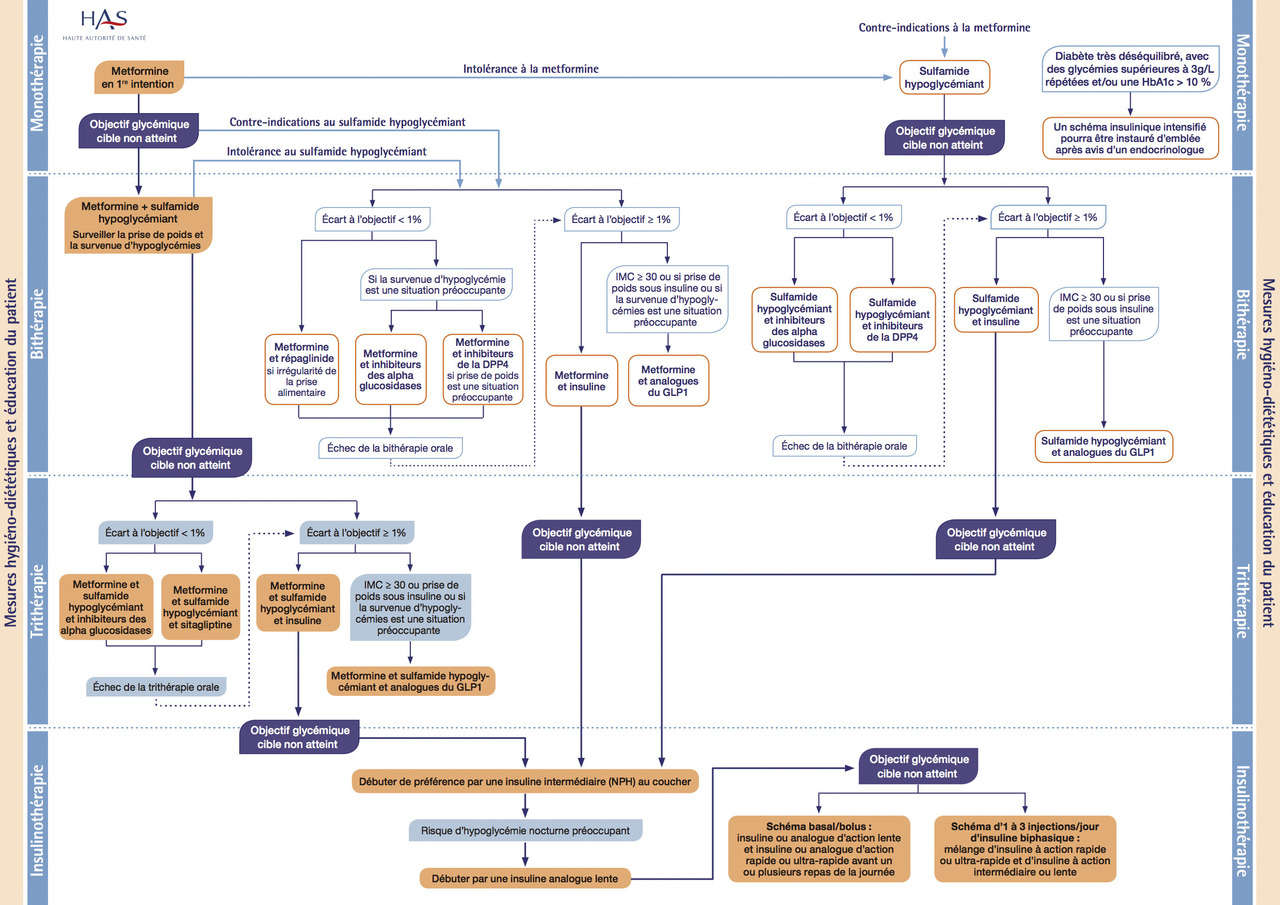
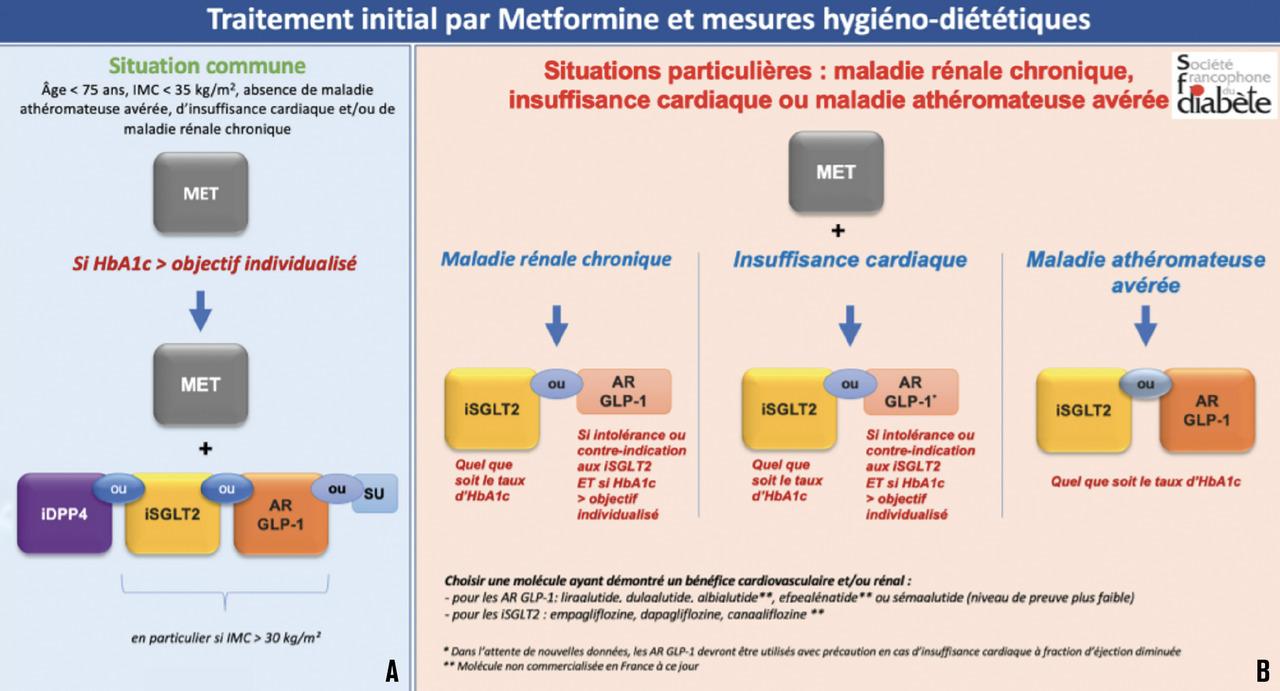
La metformine en monothérapie est recommandée en première intention (Traitements de deuxième intention
En deuxième intention (bithérapie puis trithérapie) seront ajoutés, en fonction du profil du patient :- les sulfamides hypoglycémiants ou glinides (recommandations de la Haute Autorité de santé [HAS] [
fig. 3 ]) : insulinosécréteurs à risque d’hypoglycémie et de prise de poids modérée, à stopper en cas de jeûne, contre-indiqués en présence d’insuline rapide, d’insuffisances rénale ou hépatique sévères ; seuls les glinides sont utilisables en cas d’insuffisance rénale avec DFG compris entre 15 et 30 mL/min/1,73 m2 ;
- les incrétines (Société francophone du diabète [SFD] [
fig. 4 ]) : insulinosécréteurs en fonction de la glycémie, sans risque d’hypoglycémie, contre-indiqués en cas d’insuffisances hépatique et rénale sévères ;
- les inhibiteurs des DPP4 (iDPP4) augmentent la biodisponibilité du glucagon-like peptide (GLP) 1 endogène. Les analogues du GLP1 (aGLP1) injectables (SFD 2021 [
fig. 4 ]), dont la prescription est possible jusqu’à un DFG > 15 ml/min/1,73 m2, ralentissent la vidange gastrique (effets indésirables digestifs), favorisent la perte de poids et réduisent le risque d’événements cardiovasculaires majeurs d’origine athéroscléreuse. Ils doivent être privilégiés si l’IMC dépasse 30 kg/m² et/ou en cas de haut risque cardiovasculaire. Ils sont contre-indiqués en cas de maladie pancréatique ou d’insuffisances cardiaque sévère ou rénale terminale. L’association iDPP4 et aGLP1 est déconseillée ;
- les inhibiteurs du glucose-sodium cotransporteur (SGLT2) [
fig. 4 ] entraînent une élimination urinaire de glucose, sans risque d’hypoglycémie, avec un effet protecteur cardiaque et rénal. Ils doivent être privilégiés en cas d’insuffisance cardiaque à fraction d’éjection du ventricule gauche réduite et de maladie rénale. Leur effet antihyperglycémiant est limité au-dessous du seuil de DFG de 45 mL/min, mais la prescription pour effet cardioprotecteur est autorisée (pour la dapagliflozine) jusqu’à un DFG de 25 mL/min. Le remboursement pour néphroprotection est en cours d’évaluation ;
- l’insulinothérapie, qui comporte un risque d’hypoglycémie et de prise de poids, peut être temporaire ou définitive. En cas de déséquilibre important, avec signes d’insulinopénie, de grossesse chez une femme DT2, de pathologie intercurrente sévère ou si le traitement par antidiabétiques oraux est insuffisant, l’insulinothérapie sera introduite après avis du diabétologue, par insuline lente seule (0,2 U/kg de poids par jour, à titrer en fonction de la glycémie du réveil) ou associée à une insuline rapide.
Complications métaboliques urgentes
Coma hyperosmolaire
Il s’agit d’une carence insulinique partielle sans lipolyse. Le tableau clinique comporte un syndrome cardinal avec déshydratation sévère et insuffisance rénale aiguë souvent fonctionnelle.Le diagnostic est retenu devant une hyperglycémie majeure > 6 g/L, une hypernatrémie > 150 mmol/L (corriger la natrémie avec la formule suivante : natrémie corrigée = natrémie mesurée + [glycémie en mmol - 5]/2), une osmolalité augmentée > 320 mOsmol/kg, sans cétose ni acidose. Des formes mixtes, associant acidocétose diabétique et décompensation hyperosmolaire, sont possibles.
Le traitement urgent associe réhydratation IV, correction des troubles hydroélectrolytiques, insulinothérapie IVSE, prise en charge du facteur déclenchant.
Acidocétose
Elle est possible en cas d’altération de l’insulinosécrétion du fait de l’ancienneté du DT2 ou d’une pathologie intercurrente sévère. Le tableau et la prise en charge sont identiques à ceux de l’acidocétose chez les DT1.Hypoglycémie
Cette complication iatrogène peut être due aux sulfamides hypoglycémiants ou à l’insulinothérapie. Le tableau est identique à celui de l’hypoglycémie du DT1. Le resucrage est effectué per os ou, en cas d'impossibilité, par soluté glucosé IV. Le glucagon est contre-indiqué en cas de traitement par sulfamides hypoglycémiants.Acidose lactique
Cette autre complication iatrogène rare peut être secondaire à l’accumulation de biguanides du fait d’une posologie inappropriée à la fonction rénale. Sa prévention passe par l’adaptation de la dose de metformine au DFG :- DFG > 60 mL/min/73 m2 : 2 à 3 g/j ;
- 60 > DFG > 30 mL/min : 1 à 1,5 g/j ;
- DFG < 30 ml/min/1,73 m2 : contre-indication.
Amaigrissement
Complications
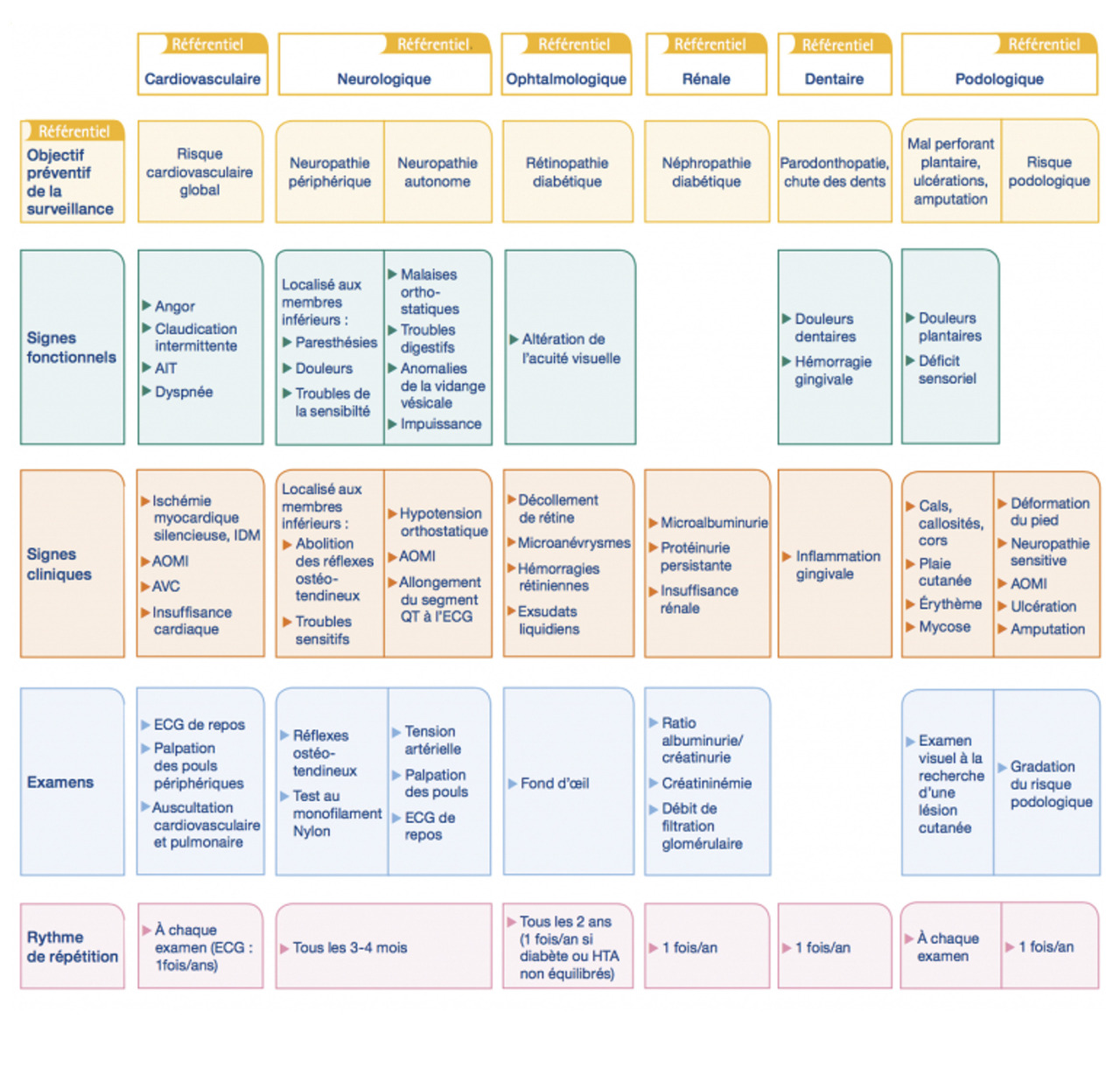
Suivi du diabète et de ses complications
Suivi de l’équilibre
- < 6,5 % pour un diabète récent chez un patient jeune et en l’absence de complications, ou en cas de grossesse ;
- < 7 % si les complications sont stables ;
- < 8 % pour un diabète ancien ou associé à des complications sévères, en cas de risque élevé d’hypoglycémie ;
- < 9 % pour un patient âgé, polypathologique, dont l’espérance de vie est limitée.
Complications chroniques
Complications microvasculaires : microangiopathie
Les principaux facteurs de risque sont le déséquilibre glycémique chronique et l’ancienneté du diabète. Il s’agit d’atteintes diffuses des microvaisseaux, dont l’évolution est simultanée. La microangiopathie diabétique atteint principalement la rétine, le néphron et le nerf périphérique.Rétinopathie diabétique : première cause de cécité chez les jeunes en Occident
En cas de rétinopathie sévère (préproliférante ou proliférante) évolutive non traitée anatomiquement, l’équilibre glycémique doit être restauré progressivement.
Physiopathologie
La rétinopathie diabétique est liée à une fragilité et à des anomalies atteignant principalement les capillaires, veinules et artérioles périphériques, avec des phénomènes ischémiques occlusifs et hémorragiques aboutissant à une prolifération anormale de néovaisseaux. Elle évolue en plusieurs stades :
- absence de rétinopathie ;
- rétinopathie non proliférante minime : microanévrismes et/ou microhémorragies ;
- rétinopathie non proliférante modérée : exsudats, hémorragies, nodules cotonneux ;
- rétinopathie non proliférante sévère ou préproliférante : anomalies rétiniennes précédentes avec hémorragies étendues et modifications veineuses ;
- rétinopathie proliférante : caractérisée par l’apparition de néovaisseaux, évoluant elle-même en trois stades : minime, modéré et sévère. La rétinopathie proliférante peut être responsable de complications graves (hémorragie du vitré, décollement rétinien ou glaucome néovasculaire), qui elles-mêmes exposent au risque de malvoyance ou de cécité.
La maculopathie et la rétinopathie périphérique évoluent souvent simultanément.
Examens complémentaires
L’angiographie à la fluorescéine ou numérique (utilisée le plus souvent) permet de mieux caractériser la rétinopathie diabétique et d’évaluer sa sévérité. La tomographie en cohérence optique (OCT) permet d’explorer la macula. En France, plusieurs centres disposent d’angio-OCT.
Traitement
Il repose sur :
- un équilibre glycémique strict (atteint progressivement en cas de déséquilibre important) ;
- un équilibre tensionnel strict ;
- la photocoagulation rétinienne au laser, débutée au stade de rétinopathie préproliférante sévère. Elle fait régresser les néovaisseaux et peut être associée à des injections intravitréennes d’anti-VEGF en cas d’atteinte très sévère ;
- des injections intravitréennes d’anti-VEGF en cas d’œdème maculaire, associées à la photocoagulation au laser en cas d’ischémie. Un implant intravitréen de corticoides (dexaméthasone) en cas de contre-indication ou de non-réponse à un traitement par anti-VEGF.
L’examen doit être complet et comporter le dépistage d’un glaucome chronique à angle ouvert (indépendant d’une rétinopathie), d’une cataracte et d’atteintes du nerf optique.
Néphropathie diabétique
Physiopathologie
L’hyperglycémie chronique est responsable de modifications hémodynamiques (hyperfiltration) et structurelles glomérulaires. Le filtre glomérulaire s’altère : une albuminurie pathologique puis une protéinurie sans hématurie apparaissent. La filtration glomérulaire diminue progressivement :
- stade 1 : hyperfiltration glomérulaire avec albuminurie physiologique (normoalbuminurie : < 30 mg/24 heures ou RAC < 30 mg/g ou < 3 mg/mol), protéinurie négative et fonction rénale conservée ;
- stade 2 : stade 1 et hypertrophie glomérulaire ;
- stade 3 : néphropathie diabétique incipiens (débutante), avec faible albuminurie (micro-albuminurie : 30-300 mg/24 heures ou RAC : 30-300 mg/g ou 3-30 mg/mol), fonction rénale conservée ou peu altérée ;
- stade 4 : néphropathie diabétique avérée avec albuminurie élevée (macroalbuminurie > 300 mg/24 heures ou RAC > 300 mg/g ou > 30 mg/mol), protéinurie positive et fonction rénale altérée. Une hypertension artérielle (HTA) est souvent associée ;
- stade 5 : insuffisance rénale chronique évoluée ou terminale (IRT) avec nécessité de suppléance ou de transplantation rénales.
Diagnostic
Il nécessite la confirmation de l’albuminurie pathologique sur un deuxième prélèvement, six mois après le premier, en l’absence d’infection urinaire, de menstruations, de déséquilibre glycémique majeur...
La ponction-biopsie rénale n’est pas indispensable au diagnostic, son indication est réservée à l’appréciation du néphrologue. Le recours au néphrologue est conseillé en cas d’atteinte atypique (suspicion d’une autre cause que le diabète) ou d’insuffisance rénale chronique stade 3B.
Traitement
Il associe :
- un équilibre strict du diabète. Les traitements antidiabétiques ne sont pas équivalents en termes de protection rénale. Certains aGLP-1 exercent un effet antiglomérulaire (antialbuminurique) favorable, mais sans effet protecteur sur le DFG. Les inhibiteurs du SGLT2 s’avèrent de puissants néphroprotecteurs, sur l’albuminurie et le DFG mais aussi vis-à-vis de l’insuffisance rénale chronique évoluée ou terminale, des décès de causes rénale et cardiovasculaire (autorisation de mise sur le marché [AMM] française dans l’indication néphroprotection avec amélioration du service médical rendu [ASMR] IV ; périmètre de remboursement par la Caisse d’assurance maladie en cours d’évaluation) ;
- un équilibre tensionnel strict, en privilégiant en première intention les inhibiteurs du système rénine-angiotensine (inhibiteurs de l’enzyme de conversion [IEC] ou antagonistes du récepteur AT1 de l’angiotensine 2 [ARA2]) à dose maximale tolérée. Ces traitements doivent être discutés, selon la tolérance du patient (hypotension), dès le stade de microalbuminurie, même en absence d’HTA ;
- la prise en charge des autres facteurs de risque cardiovasculaires, pharmacologiques (statines) ou non pharmacologiques (sevrage du tabac, perte de poids en cas de surcharge pondérale, alimentation restreinte en lipides, protides et sel).
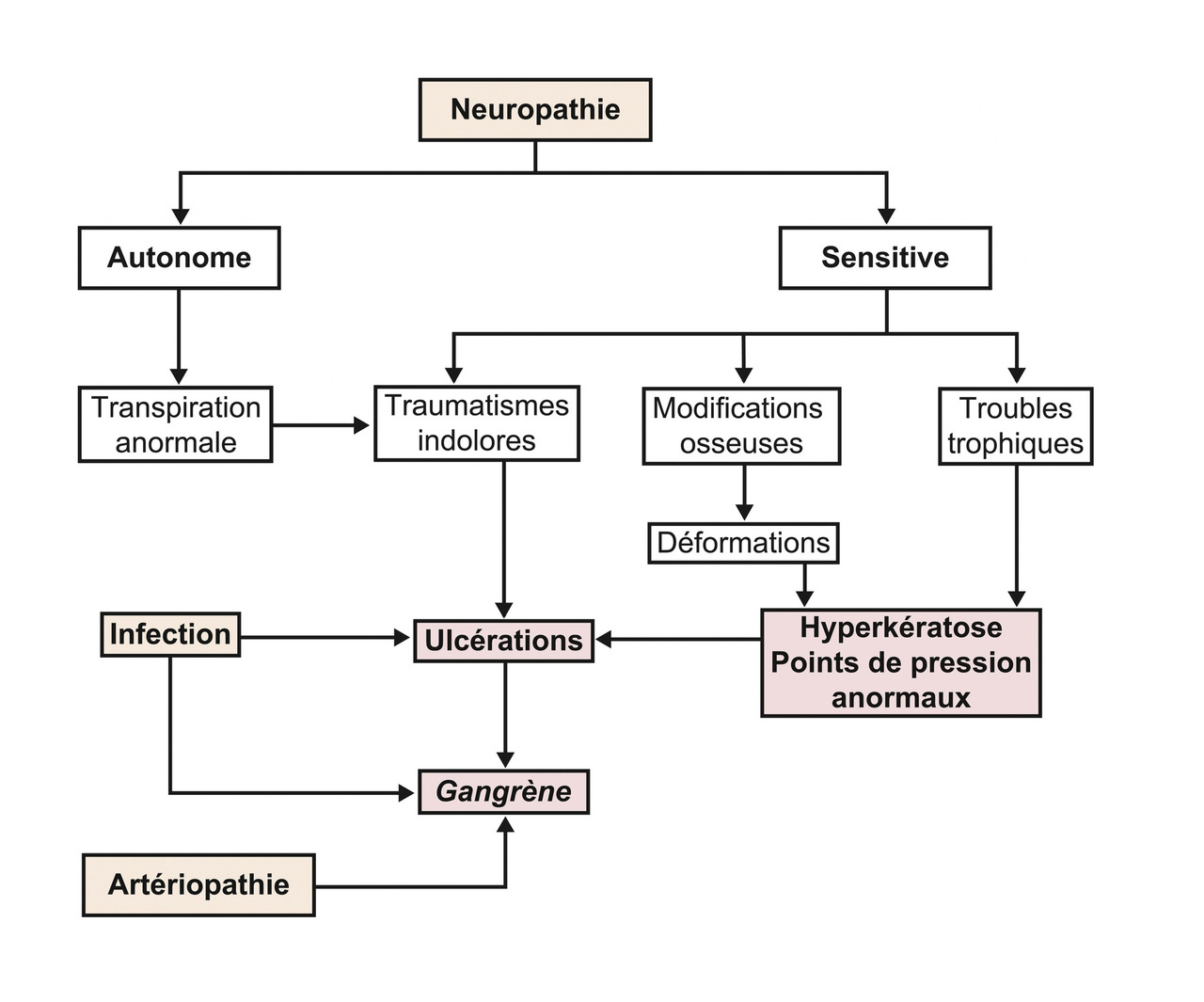
Neuropathie diabétique
Neuropathie périphérique
La polynévrite axonale ascendante est l’atteinte la plus fréquente. L’atteinte sensitive précède l’atteinte motrice. Elle touche, de façon bilatérale et symétrique, les extrémités des membres inférieurs (puis supérieurs) et évolue de façon ascendante, vers les racines. Souvent asymptomatique au début, un déficit de sensibilité doit être recherché (hypopallesthésie, trouble proprioceptif, non perception du monofilament), ainsi qu’une aréflexie ostéotendineuse et des paresthésies. Le déficit moteur est tardif. L’électromyogramme n’est pas indispensable, il n’est recommandé que si le tableau est atypique.
La polynévrite peut aboutir à des déformations de la voûte plantaire, des orteils en griffes, à une neuro-arthropathie diabétique sévère (pied de Charcot). Le pronostic de la neuropathie diabétique périphérique est dominé par le risque de mal perforant plantaire et d’amputation du membre inférieur.
Le traitement associe un équilibre glycémique strict et des mesures symptomatiques en cas de douleur neuropathique : antiépileptiques, ou antidépresseurs inhibiteurs sélectifs de la recapture de la sérotonine (ISRS).
Les atteintes monoradiculaires ou multinévrites, plus rares, sont plus brutales : cruralgie, paralysie oculomotrice ou faciale périphérique, syndrome du canal carpien…
Neuropathie autonome
Plus tardive, son dépistage est clinique :
- neuropathie digestive avec gastroparésie (entraînant une variabilité glycémique), dysphagie, troubles du transit ;
- neuropathie urogénitale avec atteinte vésicale (résidu post-mictionnel, incontinence urinaire), ou dysfonction érectile (mixte avec atteinte artérielle) ;
- neuropathie autonome cardiaque avec tachycardie sinusale sans variation à l’effort, allongement du QT, ischémie silencieuse, hypotension orthostatique sans accélération de la fréquence cardiaque ;
- troubles de la sudation.
Complications macrovasculaires : macroangiopathie
L’hyperglycémie est un facteur de risque d’athérosclérose qui est plus fréquente, plus précoce et rapidement évolutive chez les patients diabétiques, comparés aux sujets non diabétiques. Le diabète est caractérisé par une médiacalcose très marquée.Le risque cardiovasculaire est élevé en cas de :
- maladie cardiovasculaire (symptomatique ou silencieuse) ;
- DT2 ou DT1 évoluant depuis plus de dix à quinze ans ;
- facteurs de risque cardiovasculaires associés ;
- microangiopathie diabétique : néphropathie (micro-albuminurie, protéinurie ou insuffisance rénale chronique), rétinopathie sévère et neuropathie.
Le traitement, fondé sur le contrôle des facteurs de risque cardiovasculaires, comporte :
- en présence d’une maladie macrovasculaire athérosclérotique avérée (prévention secondaire) : antiagrégant plaquettaire, statine, IEC ou ARA2 et souvent un bêtabloquant ;
- en l’absence de maladie macrovasculaire athérosclérotique (prévention primaire), si le risque cardiovasculaire est élevé : statine, IEC ou ARA2 en cas d’HTA et/ou de néphropathie ;
- une prise en charge non pharmacologique, indispensable pour réduire le risque d’événements cardiovasculaires.
Coronaropathie
Le dépistage s’effectue sur la base de l’interrogatoire, de l’examen clinique et d’un électrocardiogramme. Le score calcique des coronaires est désormais conseillé pour stratifier le risque cardiovasculaire des patients diabétiques. Des examens complémentaires (épreuve d’effort, échographie cardiaque de stress, scintigraphie, coroscanner, IRM…) sont effectués en prévention primaire, si le patient est symptomatique ou à haut risque, notamment en cas de score calcique élevé.
En l’absence de coronaropathie, une insuffisance cardiaque définit une cardiomyopathie diabétique.
Atteinte carotidienne
Artériopathie oblitérante des membres inférieurs
- examen clinique : palpation des pouls, recherche de claudication intermittente (qui peut être absente en cas de neuropathie sensitive) ;
- mesure de l’indice de pression systolique (IPS) cheville/bras, parfois surestimé en cas de médiacalcose ;
- échodoppler artériel en cas de symptômes. En cas d’artériopathie symptomatique, il est recommandé de demander l’avis d’un chirurgien vasculaire.
Pied diabétique
Le « pied diabétique » (Physiopathologie
- neurogène : la microangiopathie entraîne des déficits sensitifs, proprioceptifs, sudoripares et moteurs, aboutissant à une déformation du pied et à une hyperkératose des points d’appui ;
- ischémique : la macroangiopathie induit des retards de cicatrisation.
Traitement d’une plaie
- une mise en décharge systématique, jusqu’à cicatrisation, avec soins locaux ;
- l’évaluation du statut vasculaire. En cas d’ischémie critique ou aiguë, l’avis d’un chirurgien vasculaire est recommandé ;
- l’évaluation du statut infectieux : local ou systémique, prélèvements pour adapter l’antibiothérapie, radiographie à la recherche d’ostéite, vérification du statut vaccinal antitétanique.
Autres complications
Il existe d’autres complications : dentaires, rhumatologiques, infections cutanées et urinaires.POINTS FORTS À RETENIR
Le diagnostic de diabète est affirmé sur 2 glycémies veineuses à jeun ≥ 1,26 g/L en l’absence de symptôme ou en présence d’un syndrome cardinal si elle est ≥ 2 g/L quel que soit le moment. Une glycémie à jeun ≥ 1,10 g/L et < 1,26 g/L définit une hyperglycémie modérée à jeun.
Le diabète de type 1 est secondaire à une carence absolue en insuline, le diabète de type 2 à une insulinorésistance et à une sécrétion d’insuline insuffisante. D’autres types de diabète, moins fréquents, existent.
L’équilibre du diabète est évalué tous les trois mois à partir de l’HbA1c, dont la valeur cible est adaptée à chaque patient.
Les complications microvasculaires atteignent principalement le rein, la rétine et le système nerveux périphérique. Leur dépistage s’effectue dès le diagnostic du diabète de type 2 et à partir de cinq ans pour le diabète de type 1 une fois par an.
L’hyperglycémie est un facteur de risque cardiovasculaire. Un dépistage par interrogatoire et examen clinique est systématique, les examens complémentaires à la recherche de complications macrovasculaires sont adaptés au niveau de risque du patient. Les autres facteurs de risque doivent être pris en charge.
Diabète sucré de type 1 et de type 2 de l’enfant et de l’adulte. Complications
Parmi les pièges qu’il est possible de rencontrer dans les QCM :
Diagnostic
En l’absence de symptôme, deux glycémies à jeun sont nécessaires pour poser le diagnostic.
L’HbA1c n’est pas utilisée pour le diagnostic en France.
La proportion de DT2 chez les jeunes tend à augmenter.
Physiopathologie
L’insuline fait entrer le potassium dans la cellule, une supplémentation potassique est nécessaire lors du traitement d’une acidocétose.
Il existe d’autres hormones hyperglycémiantes que le glucagon : notamment le cortisol et la GH.
Une pathologie intercurrente dans le DT2 peut nécessiter une insulinothérapie transitoire.
Un DT2 ancien peut justifier une insulinothérapie définitive.
Détecter une situation urgente
Tout syndrome abdominal chez un diabétique doit faire penser à une acidocétose.
Tout signe neurologique chez un diabétique doit faire penser à une hypoglycémie.
Des hypoglycémies à répétition ou une neuropathie végétative peuvent masquer les signes adrénergiques.
Thérapeutiques
Lors d’une acidocétose, l’insuline IVSE est relayée en sous-cutanée après normalisation de la cétonémie.
Chez le patient DT2, la metformine est maintenue lors de l’introduction d’une insulinothérapie.
Les sulfamides hypoglycémiants et glinides sont contre-indiqués en présence d’insuline rapide. L’association iDPP4 et aGLP1 est contre-indiquée.
En cas de jeûne, il faut interrompre l’insuline rapide du repas, les sulfamides hypoglycémiants, les glinides.
Examens complémentaires et suivi
Dans le DT2, des complications peuvent être présentes dès le diagnostic.
La rétinopathie diabétique est souvent longtemps asymptomatique, la baisse d’acuité visuelle est tardive, sauf en cas de maculopathie. Le dépistage de la macroangiopathie diabétique doit se fonder principalement sur l’interrogatoire et l’examen clinique.
Les examens fonctionnels de dépistage d’une cardiopathie ischémique silencieuse ne doivent pas être systématiques.
Le recours au néphrologue est conseillé en cas d’atteinte rénale atypique ou d’insuffisance rénale chronique de stade 3B.
HAS 2014. Guide parcours de soins Diabète de type 2 de l’adulte.
HAS 2014. Comment prévenir les réhospitalisations d’un patient diabétique avec plaie du pied ?
HAS 2013. Stratégie médicamenteuse du contrôle glycémique du diabète de type 2.
HAS 2012. Guide du parcours de soins – Maladie rénale chronique de l’adulte.
HAS 2011. Dépistage de la rétinopathie diabétique par lecture différée de photographies du fond d’œil.
HAS 2011. Évaluation du rapport albuminurie/créatininurie dans le diagnostic de la maladie rénale chronique chez l’adulte.
HAS 2007. ALD n° 8 - Diabète de type 2 Guide usagers.
HAS 2007. ALD n° 8 - Diabète de type 1 Guide patient.
HAS 2007. ALD n° 8 – Guide médecin sur le diabète de type 1 de l’adulte.
SFD 2021. Recommandations SFD-SFC sur le dépistage de l’ischémie myocardique.
SFD 2021. Prise de position de la Société francophone du diabète (SFD) sur les stratégies d'utilisation des traitements anti-hyperglycémiants dans le diabète de type 2.
SFD 2019. Prise de position de la Société francophone du diabète (SFD) : évaluation du rapport bénéfices-risques des inhibiteurs de SGLT2.
SFD 2016. Dépistage et surveillance des complications oculaires du patient diabétique SFD/SFO.
SFD 2013. Activité physique et diabète de type 2.
SFD 2012. Consensus sur la prise en charge du patient hyperglycémique et/ou diabétique au cours et au décours immédiat d’un syndrome coronaire aigu SFD/SFC.
SFD 2011. Neuropathie diabétique douloureuse. Diagnostic et traitement.
SFD 2011. Prise en charge des patients diabétiques présentant une atteinte de la fonction rénale.
SFD 2007. Microalbuminurie et excrétion urinaire d’albumine : recommandations françaises.

 Encadrés
Encadrés