Diagnostiquer un diabète chez l’enfant.
Identifier les situations d’urgence et planifier leur prise en charge.
Argumenter l’attitude thérapeutique nutritionnelle et médicamenteuse.
Décrire les principes de la prise en charge au long cours.
Diagnostic d’un diabète sucré
Définition
Mécanismes physiopathologiques
Diabète de type 1
Le diabète de type 1 est dû à une carence en insuline par destruction auto-immune des cellules bêta des îlots de Langerhans. Cette destruction progressive est liée à l’action de l’immunité cellulaire via les lymphocytes T. Le processus auto-immun est révélé par la présence d’auto-anticorps dirigés contre différents antigènes insulaires (insuline, GAD, IA2, ZnT8) que l’on peut doser. La maladie devient symptomatique lorsque plus de 85 % des îlots ont été détruits. Il existe alors une carence en insuline qui entraîne une hyperglycémie, une glycosurie et une production excessive de corps cétoniques.Il existe une susceptibilité génétique à la maladie, et de nombreux loci ont été identifiés. La principale région génétique impliquée concerne les gènes du complexe majeur d’histocompatibilité de classe 2 (HLA). Des facteurs environnementaux et épigénétiques induisent la réaction immunitaire, mais leurs identifications et rôles restent peu connus.
Diabète de type 2
Le diabète de type 2 est lié à l’installation progressive d’une insulinorésistance et secondairement à un défaut de sécrétion de l’insuline. L’hyperglycémie provient d’une baisse de sensibilité des cellules à l’insuline, en particulier celles du foie, du muscle et du tissu adipeux. Les cellules B produisent dans un premier temps plus d’insuline par effet de compensation, puis il existe une insuffisance de production d’insuline entraînant la survenue de l’hyperglycémie. Les déséquilibres nutritionnels, l’obésité, la sédentarité favorisent ce déséquilibre métabolique. Des facteurs génétiques et ethniques peuvent être impliqués.Épidémiologie du diabète
Le diabète de type 2 est retrouvé dans 5 à 10 % des cas de diabète sucré de l’enfant.
Diagnostic d’un diabète de type 1
Signes cliniques
Acidocétose inaugurale : elle est présente dans environ 40 à 50 % des cas. Elle est plus fréquente chez les enfants de moins de 5 ans. Les signes cliniques peuvent être digestifs (douleurs abdominales, vomissements) ou respiratoires (dyspnée).
Découverte fortuite d’une hyperglycémie ou d’une glycosurie.
Dosage de la glycémie
Les glycémies retrouvées lors de la prise en charge des enfants sont le plus souvent bien supérieures à 2 g/L. En cas de suspicion clinique de diabète de type 1, une glycémie capillaire et/ou une bandelette urinaire peuvent être réalisées au cabinet médical afin d’orienter rapidement l’enfant et sa famille dans un centre permettant une prise en charge rapide et adaptée. Il n’y a pas lieu d’attendre les résultats d’un bilan sanguin réalisé au laboratoire, qui pourrait entraîner un retard de prise en charge.
Bilan biologique initial
- dosage du peptide C : bas si diabète de type 1 ;
- dosage de l’HbA1c : permet d’évaluer l’équilibre glycémique des 3 derniers mois ;
- dosages des auto-anticorps retrouvés dans le diabète de type 1 : anticorps anti-GAD (glutamate décarboxylase), anti-IA2 (islet antigen 2), anti-insuline en 1re intention. Les auto-anticorps ZnT8 (transporteurs de zinc 8) seront demandés en 2e intention si les autres anticorps sont négatifs ;
- identification HLA : recherche des haplotypes associés au diabète HLA-DR3 et DR4 ou DQB1*0201 et DQB1*0302.
- hypothyroïdie : TSH, dosage des anticorps antithyroïdiens ;
- maladie cœliaque : dosage des anticorps antitransglutaminase et IgA totales ;
- en fonction du contexte clinique : recherche d’une insuffisance surrénale auto-immune (anticorps anti-21- hydroxylase).
Situations d’urgence dans le diabète de type 1
Acidocétose
Physiopathologie et facteurs favorisants (ou circonstances de survenue)
L’acidocétose est une urgence métabolique qui témoigne d’un déficit en insuline avec élévation des hormones de contre-régulation glycémique (glucagon, adrénaline, cortisol). L’acidocétose peut être inaugurale, c’est-à-dire présente à la découverte du diabète (40-50 % des cas). Elle peut également survenir au cours du suivi du patient du fait de facteurs favorisants : oublis d’injections d’insuline, sous-dosage en insuline, défaut technique de délivrance de l’insuline, infections intercurrentes.Il existe une augmentation de la production de glucose via la glycogénolyse et la néoglucogenèse ainsi qu’une diminution de l’utilisation périphérique de celui-ci. L’augmentation de la lipolyse et de la cétogenèse entraîne une cétonémie.
Le patient présente alors une hyperglycémie avec hyperosmolarité, une acidose métabolique et une déshydratation.
Il s’agit de la cause principale de mortalité chez l’enfant diabétique de type 1.
Diagnostic clinique
Les signes cliniques sont les suivants :- syndrome polyuropolydipsique, asthénie, amaigrissement ;
- signes de déshydratation : pli cutané, sécheresse des muqueuses, tachycardie, hypotension si hypovolémie ;
- signes digestifs : douleurs abdominales, nausées et vomissements ;
- signes respiratoires : dyspnée de Kussmaul, odeur acétonémique de l’haleine ;
- troubles neurologiques : obnubilation, somnolence, coma.
Diagnostic biologique
Il s’agit de :- glycémie veineuse > 2,5 g/L ;
- gaz du sang veineux avec pH < 7,30 (acidocétose sévère si pH < 7,10) et/ou bicarbonates < 15 mmol/L ;
- présence de corps cétoniques dans les urines (≥ 2 croix à la bandelette urinaire) ou présence d’une cétonémie capillaire > 3 mmol/L.
Autres examens paracliniques nécessaires
Ce sont :- ionogramme sanguin avec évaluation de la natrémie (fausse hyponatrémie le plus souvent) et de la kaliémie ;
- dosage de l’urée et de la créatinine (risque d’insuffisance rénale aiguë fonctionnelle) ;
- hémogramme et protéine C réactive (CRP) [recherche d’un contexte infectieux] ;
- électrocardiogramme (ECG) si dyskaliémie.
Prise en charge thérapeutique
Une hospitalisation dans un service de soins intensifs ou de réanimation est préconisée en cas d’acidocétose sévère (pH < 7,10 et/ou bicarbonates < 5 mmol/L), de déshydratation sévère ou si le patient est plus à risque d’œdème cérébral (enfant < 5 ans).Les objectifs de la prise en charge sont de :
- restaurer une volémie normale, avec équilibre des électrolytes ;
- baisser progressivement la glycémie (< 1 g/l/h) ;
- faire diminuer, puis disparaître les corps cétoniques afin de corriger l’acidose métabolique.
- mise en condition : monitoring cardiorespiratoire, pose de deux voies veineuses périphériques, mise à jeun ;
- si collapsus : remplissage vasculaire au NaCl 0,9 % (20 mL/kg) en bolus ;
- réhydratation hydroélectrolytique : débuter par du NaCl 0,9 % + KCl (si diurèse conservée et ECG normal), puis par soluté glucosé (G5 puis G10 %) + NaCl et KCl à adapter aux ionogrammes sanguins ;
- insulinothérapie (analogue rapide d’insuline) administrée par voie intraveineuse à la seringue électrique après au moins une heure de réhydratation. Le débit est à initier entre 0,05 et 0,1 UI/kg/h, puis à adapter aux glycémies capillaires ;
- surveillance clinique horaire (constantes, examen neurologique, diurèse, glycémie capillaire et cétonémie) ;
- surveillance paraclinique toutes les 4 heures (glycémie veineuse, gaz du sang, ionogramme sanguin avec fonction rénale, ECG si dyskaliémie).
Complications possibles
L’œdème cérébral survient dans 0,5 à 0,7 % des acidocétoses, avec un taux de décès de 25 %. Il s’agit de la cause principale de décès chez les enfants diabétiques de type 1.Il apparaît après quelques heures de prise en charge (entre 4 et 12 h). Les signes cliniques sont l’apparition de céphalées, de troubles de la conscience, de signes d’hypertension intracrânienne avec compression du tronc cérébral (pauses respiratoires, bradycardie, hypertension artérielle, atteintes des nerfs crâniens, mydriase), de convulsions.
Les facteurs de risque de survenue sont le jeune âge (< 5 ans), l’hydratation trop importante ou rapide, la diminution de la glycémie > 1 g/L/h, la sévérité de l’acidocétose inaugurale.
La prise en charge en réanimation consiste en la mise en position proclive, la diminution des débits de perfusion et la perfusion de mannitol 20 %. La tomodensitométrie (TDM) cérébrale sera réalisée une fois l’enfant stabilisé.
Les autres complications possibles de l’acidocétose sont les hypokaliémies, les pneumopathies d’inhalation, les sepsis et les complications vasculaires cérébrales (thrombose et hémorragie).
Hypoglycémie chez l’enfant diabétique traité
Physiopathologie
L’hypoglycémie chez l’enfant diabétique est une complication iatrogène secondaire à l’insulinothérapie. C’est la conséquence d’une inadéquation entre l’apport glucidique, la dose d’insuline réalisée et l’activité physique.Définition et signes cliniques
La glycémie est < 0,7 g/L (3,9 mmol/L).Les premiers signes cliniques sont secondaires à la réaction adrénergique : sueurs, tremblements, pâleur, tachycardie, sensation de faim.
Lorsque la glycémie continue de baisser < 0,5 g/L (3 mmol/L) surviennent les signes de neuroglucopénie : fatigue, céphalées, difficultés d’élocution, troubles visuels, troubles du comportement, confusion, convulsions et coma.
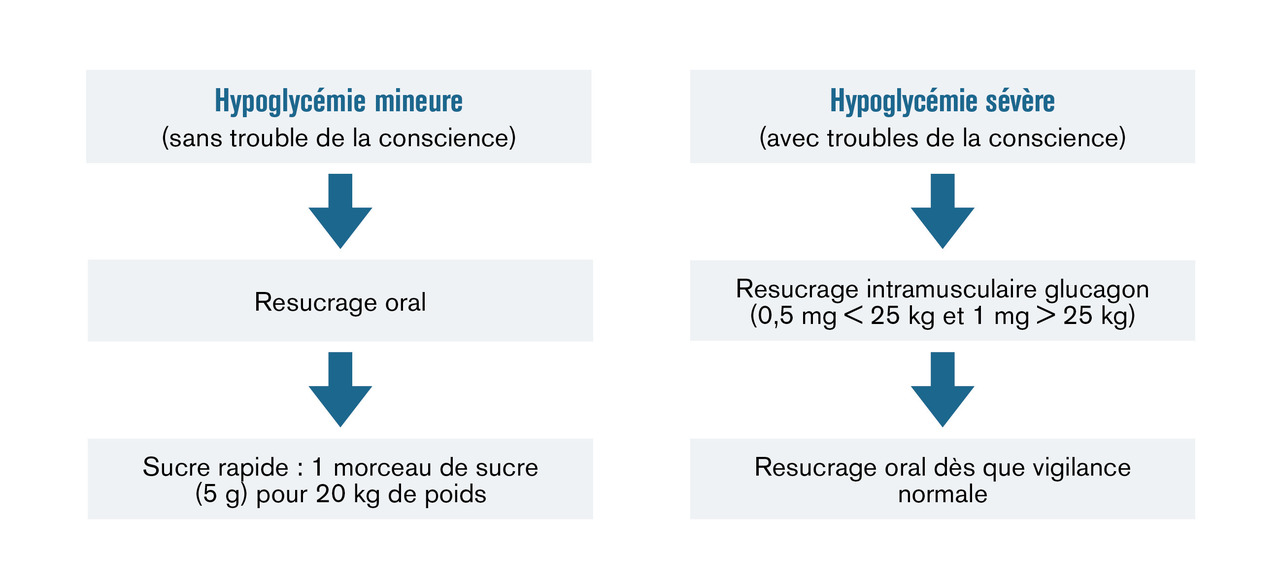
Les hypoglycémies mineures peuvent être corrigées par l’ingestion de glucose par l’enfant lui-même ou par les parents si l’enfant est très jeune. Ces hypoglycémies mineures surviennent en général plusieurs fois par semaine.
Les hypoglycémies sévères sont définies par la survenue de troubles de la conscience, de convulsions ou d’un coma nécessitant l’intervention d’une tierce personne pour les mesures correctives et l’injection de glucagon.
Les facteurs favorisant la survenue des hypoglycémies sont résumés dans le
Prise en charge
Mise au repos. Les modalités de resucrage sont synthétisées dans laLe resucrage est oral s’il n’existe pas de trouble de la conscience. L’ajout d’un sucre lent : pain, biscuit (15-30 g) dépend du contexte et du protocole habituel pour l’enfant.
En cas de troubles de la conscience, l’injection de glucagon (voie intramusculaire ou sous-cutanée) doit être réalisée. En deuxième intention ou en cas de prise en charge médicalisée, un bolus IV de sérum glucosé pourra être réalisé : G30 % 10 mL/20 kg de poids ou G10 % 30 mL/20 kg de poids. Lorsque le patient est réveillé et dans un second temps ,il convient de proposer un resucrage per os.
L’apprentissage par l’enfant et sa famille des symptômes d’hypoglycémie ainsi que la connaissance des facteurs favorisants permettent de réduire le nombre d’hypoglycémies et leur sévérité.
Prise en charge du diabète de type 1
Éducation thérapeutique du patient et de sa famille
Les objectifs de prise en charge en éducation thérapeutique sont de :
- comprendre la maladie et son évolution ;
- connaître et savoir faire son traitement, connaître l’équilibre alimentaire nécessaire ;
- connaître les objectifs glycémiques et d’HbA1c ;
- savoir reconnaître les situations à risque ou particulières nécessitant une adaptation thérapeutique ;
- planifier le suivi à moyen et long terme, identifier les personnes ressources.
Insulinothérapie
Le choix du traitement mis en place répond à des indications médicales et peut dépendre de l’âge du patient, de son mode de vie et de son choix. Le mode d’insulinothérapie est variable dans le temps et peut être rediscuté suivant l’évolution du patient et de sa maladie.
Traitement par stylos à insuline
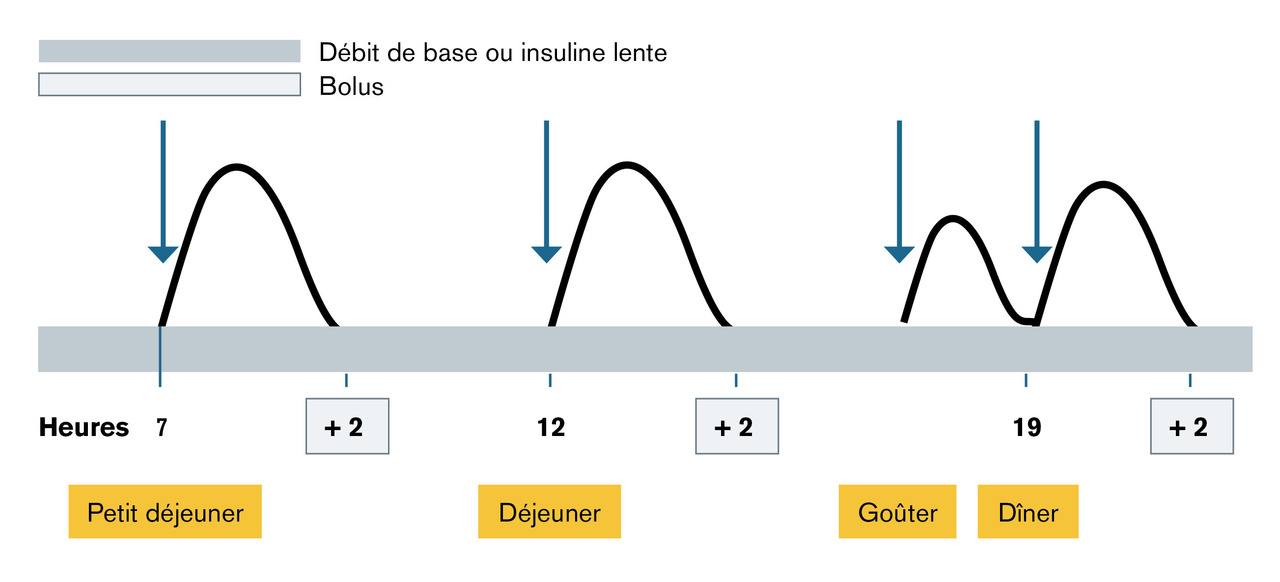
Les injections sous-cutanées d’un analogue de l’insuline d’action rapide sont réalisées avant chaque repas et sont associées à une injection unique journalière d’un analogue d’insuline d’action prolongée.Traitement par pompe à insuline
La pompe contient dans son réservoir uniquement un analogue de l’insuline d’action rapide. Elle délivre en sous-cutané de l’insuline en continu appelée débit de base suivant une programmation prédéfinie. Une prise en main de la pompe est nécessaire pour le choix de la dose à délivrer au moment du repas.Surveillance glycémique
Les objectifs glycémiques doivent être connus :
- à jeun : 0,70-1,30 g/L (3,9-7 mmol/L) ;
- en postprandial : 0,90-1,80 g/L (5-10 mmol/L).
Règles hygiénodiététiques
L’activité physique sera encouragée afin de lutter contre la sédentarité et l’obésité. La question du tabagisme est importante à aborder avec l’adolescent.
Prise en charge psychosociale
Un projet d’accueil individualisé (PAI) sera rédigé pour un retour organisé de l’enfant dans le milieu scolaire. Enfin, un suivi et un soutien psychologique peuvent être nécessaires en cours ou tout au long de la prise en charge.
Planification du suivi et prévention des complications
L’équilibre glycémique représente le principal objectif de la prise en charge. L’HbA1c témoigne de l’équilibre glycémique des trois derniers mois. L’objectif est une HbA1c autour de 7 % qui permettrait de prévenir les complications à long terme (micro-macroangiopathie).
Le bilan biologique est réalisé annuellement, il vérifie l’absence de dyslipidémie par le dosage du cholestérol et des triglycérides ainsi que l’absence de maladies auto-immunes associées par le dosage de la TSH et des anticorps antithyroglobuline et antithyroperoxydase (hypothyroïdie), ainsi que les anticorps antitransglutaminase (maladie cœliaque).
Le dépistage d’éventuelles complications microvasculaires chroniques est réalisé après l’âge de 11 ans et/ou si la puberté est démarrée, et/ou si le diabète évolue depuis au moins 5 ans. Dans ce cas, une surveillance annuelle de la fonction rénale avec recherche d’une microalbuminurie sera pratiquée ainsi que la réalisation d’un fond d’œil ou d’une rétinographie, à la recherche de signes de rétinopathie diabétique (signes identiques à l’adulte). L’examen neurologique recherchera l’installation d’une neuropathie.
Diagnostic et traitement du diabète de type 2 de l’enfant
Facteurs de risque du diabète de type 2
- obésité et surpoids ;
- âge pubertaire ;
- antécédents familiaux de diabète de type 2 ;
- groupes ethniques à risque (Afrique du Nord et subsaharienne, Asie, population hispanique aux États-Unis).
Signes cliniques
- syndrome polyuropolydipsique, perte de poids ;
- acidocétose possible au diagnostic ;
- signes cliniques d’insulinorésistance ; acanthosis nigricans, signes d’hyperandrogénie chez les jeunes filles ;
- infections traînantes ou récidivantes.
Diagnostic biologique
On vérifiera l’absence d’auto-anticorps anti-GAD, anti-IA-2, anti-insuline.
Prise en charge du diabète de type 2
Si l’état métabolique est stable (HbA1c < 8,5 % et absence de symptôme), la metformine est débutée à dose progressivement efficace.
Si le patient présente une cétonurie, une augmentation de l’acétonémie, une acidocétose et/ou une HbA1C > 8,5 %, une insulinothérapie est démarrée pour corriger rapidement les anomalies métaboliques, et la metformine est mise en place pour la suite de la prise en charge.
L’objectif du traitement est une HbA1c < 7 %.
L’autosurveillance glycémique est nécessaire au bon équilibre des glycémies et permet l’ajustement thérapeutique. Le rythme de l’autosurveillance est à personnaliser en fonction de l’équilibre glycémique obtenu.
Les règles hygiénodiététiques et le choix de mode de vie sont essentiels. Une alimentation équilibrée est mise en place, avec limitation des sucres rapides et des graisses. L’activité physique et sportive permet de lutter contre la sédentarité et l’obésité.
Un dépistage et une prise en charge des autres facteurs de risque cardiovasculaire et comorbidités sont nécessaires : HTA, dyslipidémie, tabagisme.
Le
POINTS FORTS À RETENIR
L’incidence du diabète de l’enfant et de l’adolescent est en augmentation.
L’acidocétose est une circonstance de découverte fréquente (40-50 % des cas).
La complication principale de l’acidocétose est la survenue d’un œdème cérébral.
La prise en charge de cette maladie chronique est pluridisciplinaire.
La prise en charge diététique et l’insulinothérapie sont les deux axes thérapeutiques essentiels.
Le diabète est équilibré si l’HbA1c obtenue est à 7 % avec peu d’hypoglycémies.
Les complications chroniques sont recherchées après 5 ans d’évolution du diabète ou à partir de la puberté.
L’éducation thérapeutique du patient et de sa famille est une approche essentielle en diabétologie.
Diabète sucré de types 1 et 2 de l’enfant et de l’adulte. Complications
Penser au diagnostic d’acidocétose inaugurale si l’enfant présente des signes digestifs tels que douleurs abdominales et vomissements et/ou des signes de détresse respiratoire.
Ne pas méconnaître les signes cliniques d’œdème cérébral survenant en cours de prise en charge de l’acidocétose.
La survenue d’un malaise chez un enfant diabétique connu doit orienter en premier lieu vers un malaise hypoglycémique bien souvent iatrogène.
Connaître les maladies auto-immunes associées et leurs signes cliniques.
Concernant la prise en charge, citer le rôle essentiel de l’accompagnement pluridisciplinaire et de l’éducation thérapeutique du patient et de sa famille.
Collège national des pédiatres universitaires (CNPU). Référentiel. Elsevier Masson, 8e éd, 2021.
Haute Autorité de santé (HAS). Diabète de type 1 de l’enfant et de l’adolescent, 2007.

 Encadrés
Encadrés