La sclérose en plaques (SEP) est une maladie inflammatoire et dégénérative du système nerveux central qui concerne environ 120 000 personnes en France. Elle débute habituellement chez l’adulte jeune, en moyenne vers 30 ans, mais peut apparaître à des âges plus extrêmes, rendant l’évocation du diagnostic plus difficile et, en conséquence, plus tardive. Ainsi, 5 % environ des cas débutent avant l’âge de 18 ans ; 6-7 % débutent après 50 ans, avec une installation des symptômes plus fréquemment progressive, chez des patients ayant des comorbidités, induisant parfois une errance diagnostique.1
À ce jour, il n’existe pas de biomarqueur permettant de faire simplement le diagnostic de SEP. Celui-ci reste donc probabiliste, reposant sur un faisceau d’arguments cliniques et d’imagerie. Affirmer le diagnostic n’est pas le seul enjeu, il s’agit surtout d’éviter les erreurs diagnostiques par excès.2 Tous les éléments recueillis doivent être analysés avec vigilance : manifestations cliniques, examens complémentaires, imagerie par résonance magnétique (IRM) et étude du liquide cérébrospinal (LCS) ; toute atypie doit faire évoquer la possibilité d’un diagnostic différentiel (
Les critères diagnostiques sont régulièrement révisés à la lumière des avancées de la science (IRM, biomarqueurs, nouvelles maladies…) ; ils doivent permettre un diagnostic sûr et de plus en plus précoce, pour une prise en charge la plus anticipée possible. C’est la version 2017 des critères diagnostiques de McDonald, révisés en 2001, 2005, 2010, qui est actuellement utilisée (
Place de l’IRM dans le diagnostic de la sclérose en plaques
Depuis son apparition dans les critères de McDonald 2001, l’IRM joue un rôle central dans la démarche diagnostique de la sclérose en plaques, dans son suivi et dans l’évaluation de la réponse thérapeutique : elle permet de confirmer la dissémination spatiale et temporelle de la maladie, souvent bien plus précocement que par la clinique. De nombreuses sociétés savantes recommandent d’utiliser des protocoles d’acquisition IRM standardisés. En France, cette standardisation a été proposée dès 2013 par un groupe d’experts cliniciens et en neuro-imagerie de l’Observatoire français de la sclérose en plaques (OFSEP), puis a été modifiée en 2020 pour limiter l’utilisation du gadolinium au cours du suivi.7-8
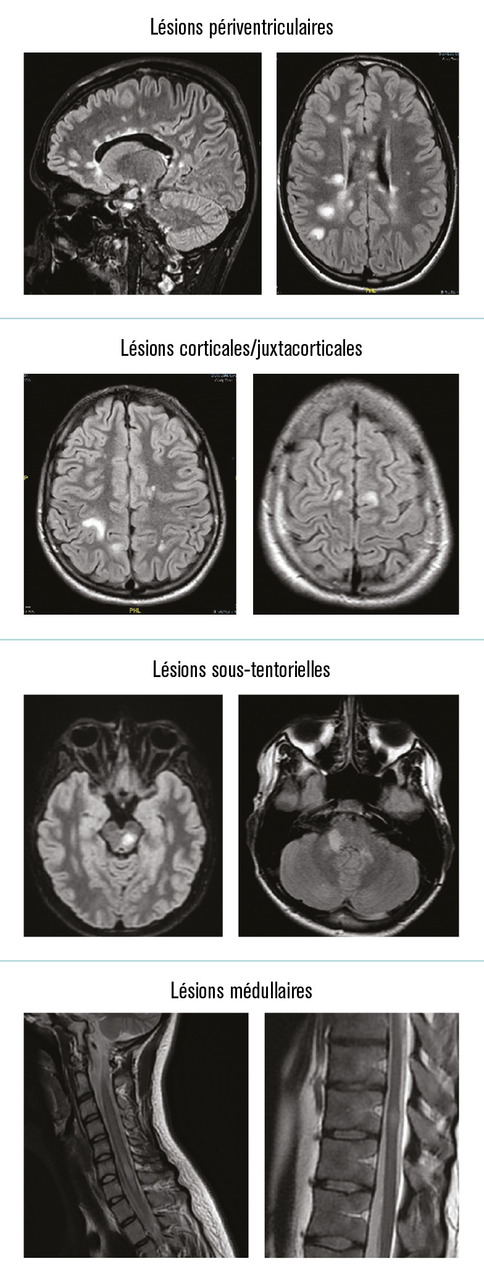
IRM cérébrale : des lésions typiques
Même si les critères de dissémination sont déjà remplis cliniquement, il est recommandé de réaliser une IRM cérébrale chez tout patient suspect de SEP.
Les lésions apparaissent sous la forme d’hypersignaux de la substance blanche sur les séquences pondérées en T2 ou en FLAIR (fluid-attenuated inversion recovery) ; elles peuvent également apparaître en hyposignal (« trous noirs ») sur les séquences pondérées en T1. Elles sont ovoïdes, mesurant habituellement plus de 5 mm, situées majoritairement dans la substance blanche périventriculaire, avec un grand axe perpendiculaire à celui des ventricules. Certaines localisations sont particulièrement évocatrices : autour du corps calleux (réalisant un aspect dit « en crête de coq » sur les coupes sagittales) ou au niveau du pédoncule cérébelleux moyen, par exemple (
L’IRM permet également d’identifier des diagnostics différentiels ; les présentations radiologiques sont alors atypiques : taille des lésions trop petite ou trop importante, localisations non habituelles, prise de contraste simultanée de toutes les lésions ou des méninges, prise de contraste prolongée (plus de 3 mois), présence de microbleeds (microsaignements) sur les séquences en T2* (
IRM médullaire à réaliser au cas par cas
L’IRM médullaire n’est pas réalisée systématiquement, mais elle doit être le premier examen à demander lorsque les symptômes sont évocateurs d’une atteinte médullaire. Elle est également fortement recommandée devant une présentation progressive d’emblée, dans les populations où la SEP est peu fréquente (patients plus âgés ou non caucasiens) ou quand des données supplémentaires sont utiles pour augmenter la certitude diagnostique.
L’aspect lésionnel typique médullaire est celui d’un hypersignal T2 ovalaire, étendu sur moins de trois segments vertébraux en coupes longitudinales (
Une association de critères cliniques et paracliniques pour un diagnostic probabiliste
Le diagnostic repose sur l’association de symptômes compatibles, d’une atteinte de la substance blanche du système nerveux central (SNC), d’éléments cliniques ou paracliniques faisant la démonstration d’une dissémination dans l’espace et dans le temps, et de la présence d’une inflammation du LCS, en l’absence de meilleure explication. Ce dernier élément souligne encore une fois la nécessité d’une analyse attentive de la situation, à la recherche de « drapeaux rouges » devant faire rechercher des diagnostics alternatifs (
Devant un premier épisode neurologique évocateur d’une affection inflammatoire du SNC, les éléments complémentaires à rechercher pour confirmer le diagnostic dépendent de la situation initiale (
Présentations cliniques typiques
La névrite optique unilatérale, les syndromes neurologiques focaux encéphaliques, les atteintes focales du tronc cérébral ou du cervelet et les myélopathies partielles sont les présentations cliniques typiques de la SEP (
Sont considérés comme atypiques (drapeaux rouges empêchant l’application des critères diagnostiques sans une analyse experte) : la survenue d’une névrite optique bilatérale ou donnant lieu à une baisse d’acuité visuelle sévère, une myélopathie complète, la présence de signes d’encéphalopathie (céphalées, troubles de conscience, méningisme…) ou une fatigue isolée (
Dissémination dans l’espace
Elle peut être affirmée cliniquement ou à l’imagerie. La démonstration de l’existence de deux localisations lésionnelles n’est pas toujours facile cliniquement, car la multiplicité des symptômes ne signe pas systématiquement la multiplicité des lésions. Rares, les situations simples correspondent à la présence d’une névrite optique et d’une atteinte médullaire ou du tronc cérébral.
De fait, l’IRM est le plus souvent révélatrice de cette dissémination spatiale, en mettant en évidence des lésions évocatrices dans au moins deux des quatre territoires typiques (périventriculaire, sous-tentorielle, juxtacortical/cortical ou médullaire) [
Dissémination dans le temps
Elle est définie cliniquement par la succession d’au moins deux épisodes neurologiques, espacés par définition d’au moins 30 jours. Il peut s’agir de deux poussées, ou d’une poussée suivie de l’installation d’une phase progressive.
L’IRM permet de devancer l’évolution clinique et de faire un diagnostic (et donc un traitement) plus précoce. La dissémination temporelle peut ainsi être mise en évidence dès la première IRM : présence simultanée des lésions évocatrices de SEP rehaussées et non rehaussées après injection de gadolinium prenant et ne prenant pas le contraste (la prise de contraste témoigne d’une lésion récente, en général de moins d’un mois).
Si ce n’est pas le cas, l’apparition de nouvelles lésions sur une IRM réalisée à n’importe quel moment après la première témoigne du fait que les lésions ne sont pas apparues de manière simultanée. Cette deuxième IRM est souvent réalisée trois à six mois après la précédente.
Inflammation du liquide cérébrospinal
L’inflammation du LCS est définie par la présence de bandes oligoclonales (au moins deux) en iso-électrofocalisation et/ou par une augmentation de l’index IgG (immunoglobulines G) au-delà de 0,7, témoignant d’une sécrétion intrathécale d’IgG. Cette inflammation n’est pas spécifique de la SEP ; elle peut exister dans d’autres maladies inflammatoires ou infectieuses du SNC. Elle est néanmoins présente chez plus de 90-95 % des patients atteints de SEP. Son absence constitue ainsi une alerte dans la démarche diagnostique et doit faire rechercher des diagnostics alternatifs ; de même, la présence d’une pléiocytose supérieure à 50 éléments/mm3 ou non lymphocytaire, d’une hyperprotéinorachie supérieure à 1 g/L ou, plus rarement, d’une hypoglycorachie sont autant de drapeaux rouges.
Les critères de McDonald 2017 ont remis l’analyse du LCS en avant. Si elle n’est pas indispensable au diagnostic de sclérose en plaques lorsque la présentation clinique est typique et les critères de dissémination spatiale et temporelle déjà remplis, elle reste recommandée pour éliminer des diagnostics différentiels. Par ailleurs, si le critère de dissémination dans le temps n’est pas rempli cliniquement ou radiologiquement, il peut être remplacé par la présence de bandes oligoclonales dans le LCS.
Absence de meilleure explication
Cet argument souligne la nécessité de toujours penser aux diagnostics différentiels devant les atypies cliniques, radiologiques et biologiques. (
Cas particulier des formes progressives d’emblée
Les critères de diagnostic ne s’appliquent pas de la même manière pour les présentations rémittentes récurrentes et progressives d’emblée.
Dans les formes progressives d’emblée (
importance de la consultation d’annonce
En 2022, le diagnostic de sclérose en plaques repose donc toujours sur des critères probabilistes qui permettent un diagnostic plus sûr et plus précoce. Il faut cependant souligner que ces critères ne doivent être utilisés que chez des patients ayant une présentation clinique subaiguë déjà très fortement suggestive de SEP. L’interprétation de l’histoire clinique, de l’examen neurologique ainsi que des résultats de l’IRM et de la biologie par un clinicien expérimenté est fondamentale, pour le diagnostic positif comme pour évoquer les diagnostics différentiels rares. Dans toutes les régions françaises existent désormais des centres spécialisés (centres de ressources et de compétences sur la sclérose en plaques, CRC-SEP) qui peuvent apporter, si besoin, cette expertise.
L’annonce d’un diagnostic de SEP à un patient est donc de plus en plus précoce, souvent possible dès son premier épisode neurologique. C’est une étape fondamentale qui conditionne l’alliance thérapeutique et la qualité du parcours de soins ultérieur. Elle doit être réalisée par un praticien formé aux techniques de l’annonce9 et adaptée à chaque patient. La proposition systématique d’une consultation post-annonce, différée de quelques semaines, l’inclusion dans un programme d’éducation thérapeutique, ou encore la mise en contact avec des pairs sont autant de dispositifs d’accompagnement importants.
Les drapeaux rouges : ces principaux signes cliniques, biologiques ou radiologiques qui doivent faire évoquer des diagnostics différentiels
La survenue d’une névrite optique bilatérale ou donnant lieu à une baisse d’acuité visuelle sévère, une myélopathie complète, la présence de signes d’encéphalopathie (céphalées, troubles de la conscience, méningisme…) ou une fatigue isolée sont autant de signes cliniques devant alerter et réorienter la démarche diagnostique.
L’absence d’inflammation du LCS, la présence d’une pléiocytose supérieure à 50 éléments/mm3 ou non lymphocytaire, d’une hyperprotéinorachie supérieure à 1 g/L ou, plus rarement, d’une hypoglycorachie doivent faire rechercher des diagnostics alternatifs.
À l’IRM, ce sont des lésions trop petites ou trop importantes, des localisations non habituelles, une prise de contraste simultanée de toutes les lésions ou des méninges, une prise de contraste prolongée (plus de 3 mois), la présence de microbleeds (microsaignements) sur les séquences en T2* qui font évoquer d’autres diagnostics que celui de la sclérose en plaques.
(Voir aussi : Marignier R. Diagnostics différentiels de la sclérose en plaques, pages 392).
1. http://www.ofsep.org/fr/la-cohorte-ofsep/descriptif-de-la-cohorte
2. Solomon AJ, Bourdette DN, Cross AH, Applebee A, Skidd PM, Howard DB, et al. The contemporary spectrum of multiple sclerosis misdiagnosis: a multicenter study. Neurology 2016;87:1393-9.
3. McDonald WI, Compston DA, Edan G, Goodkin D, Hartung HP, Lublin FD, et al. Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the Diagnosis of Multiple Sclerosis. Ann Neurol 2001;50:121-7.
4. Polman CH, Reingold SC, Edan G, Filippi M, Hartung HP, Kappos L, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the “McDonald Criteria”. Ann Neurol 2005;58:840-6.
5. Polman CH, Reingold SC, Banwell B, Clanet M, Cohen JA, Filippi M, et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald Criteria. Ann Neurol 2011;69:292-302.
6. Thompson AJ, Banwell BL, Barkhof F, Carroll WM, Coetzee T, Comi G, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018;17:162-73.
7. Cotton F, Kremer S, Hannoun S, Vukusic S, Dousset V; Imaging Working Group of the Observatoire français de la sclérose en plaques. OFSEP, a nationwide cohort of people with multiple sclerosis: consensus minimal MRI protocol. J Neuroradiol 2015;42:133-40.
8. Brisset JC, Kremer S, Hannoun S, Bonneville F, Durand-Dubief F, Tourdias T, et al. New OFSEP recommendations for MRI assessment of multiple sclerosis patients: Special consideration for gadolinium deposition and frequent acquisitions. J Neuroradiol 2020;47:250-8.
9. Haute Autorité de santé. Guide parcours de soins : annonce et accompagnement du diagnostic d’un patient ayant une maladie chronique – Février 2014. https://www.has-sante.fr/

 Encadrés
Encadrés