Hépatologie. En présence d’un adénome, biopsier pour connaitre le sous-type de la tumeur, car certains sont à risque de complications.
Les tumeurs bénignes hépatiques solides se développent le plus souvent sur un foie sain et incluent principalement les hémangiomes hépatiques, les hyperplasies nodulaires focales et les adénomes hépatocellulaires. Un diagnostic précis est nécessaire afin d’éliminer le diagnostic différentiel des tumeurs malignes primitives et secondaires, et pour identifier le sous-type de la tumeur, car les adénomes hépatocellulaires sont à risque de complications à l’inverse des angiomes hépatiques et des hyperplasies nodulaires focales. L’imagerie hépatique joue un rôle clé dans l’algorithme diagnostique.
Hémangiome hépatique
C’est la plus fréquente des tumeurs bénignes du foie, avec une prévalence estimée entre 0,4 et 20 % selon les études radiologiques ou autopsiques.1 L’hémangiome hépatique est une tumeur bénigne non épithéliale évoquant une malformation vasculaire locale. Il a une prédominance féminine, avec un sex-ratio autour de 3 pour 1, et l’âge de découverte est le plus souvent entre 30 et 50 ans.2 Il est en général unique et de taille inférieure à 4 cm mais peut être plus grand, voire « géant » lorsqu’il dépasse 10 cm.3
Comment en faire le diagnostic ?
Cette tumeur est le plus souvent découverte fortuitement, sur des imageries faites dans un autre contexte ou pour douleurs abdominales non liées à l’hémangiome. Les symptômes liés à l’angiome (douleurs) ainsi que les complications sont exceptionnels et ne sont quasiment retrouvés qu’en cas d’angiome géant.
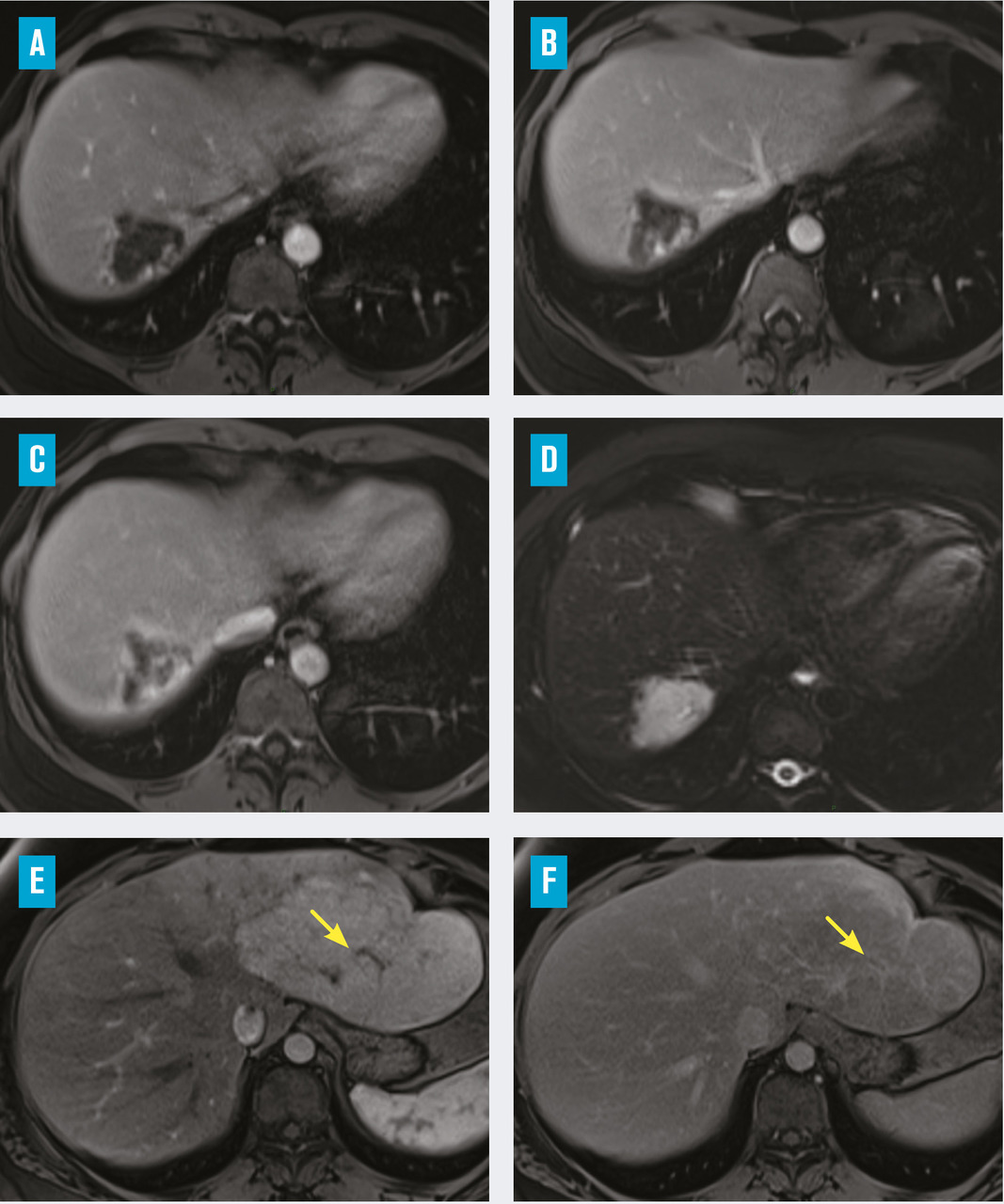
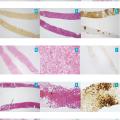
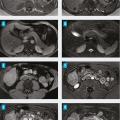
Le diagnostic est fondé sur l’imagerie hépatique. L’aspect typique à l’échographie est une lésion bien limitée, hyperéchogène, homogène avec un renforcement postérieur. L’échographie est le seul examen nécessaire au diagnostic lorsque tous les critères sont réunis pour une lésion de moins de 3 cm sur foie sain.4 En cas d’atypie, d’une taille supérieure, d’un antécédent de cancer solide ou en présence d’une hépatopathie sous-jacente, une imagerie en coupe avec injection de produit de contraste pourra être réalisée. L’imagerie par résonance magnétique (IRM) hépatique est l’examen de choix pour la caractérisation des tumeurs hépatiques bénignes : l’hémangiome a un aspect spontanément très hyperintense en séquence T2 caractéristique, hypodense en T1 sans injection puis prend le contraste en motte progressivement de la périphérie vers le centre (fig. 1A, 1B, 1C et 1D). Le diagnostic ne requiert pas d’analyse histologique, sauf dans de rares cas de présentation atypique liée par exemple au caractère sclérosant de l’hémangiome. Ce sont des tumeurs d’aspect spongieux, composées de cavités vasculaires anastomosées, associées parfois à des thromboses et à des remaniements scléreux (fig. 2A, 2B et 2C).5
Le diagnostic est fondé sur l’imagerie hépatique. L’aspect typique à l’échographie est une lésion bien limitée, hyperéchogène, homogène avec un renforcement postérieur. L’échographie est le seul examen nécessaire au diagnostic lorsque tous les critères sont réunis pour une lésion de moins de 3 cm sur foie sain.4 En cas d’atypie, d’une taille supérieure, d’un antécédent de cancer solide ou en présence d’une hépatopathie sous-jacente, une imagerie en coupe avec injection de produit de contraste pourra être réalisée. L’imagerie par résonance magnétique (IRM) hépatique est l’examen de choix pour la caractérisation des tumeurs hépatiques bénignes : l’hémangiome a un aspect spontanément très hyperintense en séquence T2 caractéristique, hypodense en T1 sans injection puis prend le contraste en motte progressivement de la périphérie vers le centre (fig. 1A, 1B, 1C et 1D). Le diagnostic ne requiert pas d’analyse histologique, sauf dans de rares cas de présentation atypique liée par exemple au caractère sclérosant de l’hémangiome. Ce sont des tumeurs d’aspect spongieux, composées de cavités vasculaires anastomosées, associées parfois à des thromboses et à des remaniements scléreux (fig. 2A, 2B et 2C).5
Quelle prise en charge ?
L’hémangiome ne présente aucun risque de transformation maligne ni de saignement. En dehors d’exceptionnels cas d’angiome géant symptomatique,3 il n’y a donc aucune indication de traitement ni de surveillance, et la contraception orale peut être poursuivie. Le diagnostic radiologique d’hémangiome chez un patient ayant une hépatopathie chronique et a fortiori une cirrhose doit être fait dans un centre spécialisé afin d’écarter le diagnostic de carcinome hépatocellulaire.
Hyperplasie nodulaire focale
L’hyperplasie nodulaire focale a une incidence de 0,03 à 3 %, avec une nette prédominance féminine.6, 7 L’âge au moment du diagnostic se situe entre 30 et 50 ans. L’hyperplasie est généralement unique, mais elle est multiple dans près de 30 % des cas. Les hormones ne jouent pas de rôle dans son développement. Il s’agit d’une tumeur hépatique résultant d’une prolifération hépatocytaire polyclonale réactionnelle à une malformation vasculaire artérielle locale.
Comment en faire le diagnostic ?
Comme l’hémangiome hépatique, l’hyperplasie nodulaire focale est souvent découverte de manière fortuite, car asymptomatique.
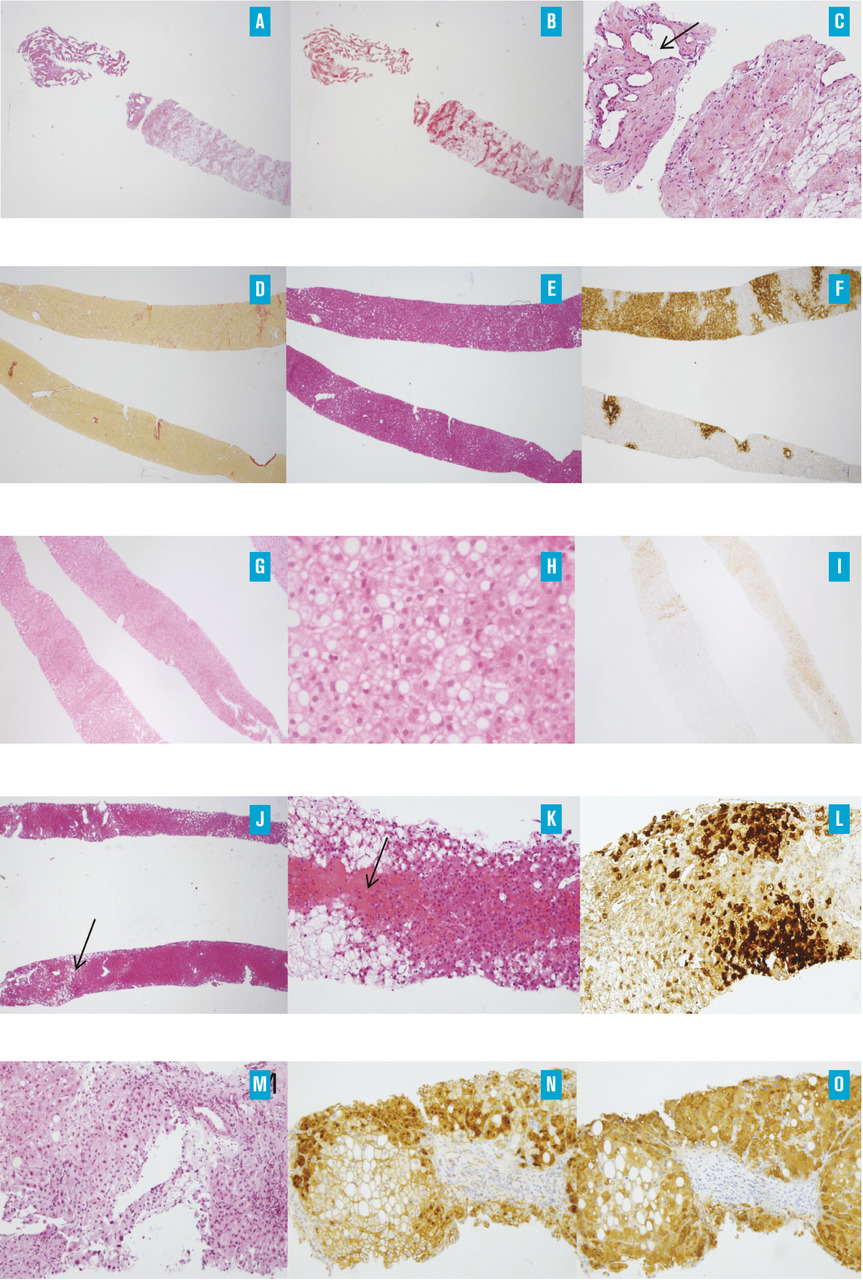
L’imagerie par résonance magnétique (IRM) hépatique avec injection est l’examen clé du diagnostic. Elle décrit classiquement une tumeur bien limitée, homogène en dehors d’une cicatrice fibreuse centrale, non encapsulée et hypo-intense en T1 sans injection de produit de contraste en dehors de la cicatrice qui est en hypersignal spontanée en T2. La tumeur se rehausse fortement au temps artériel, en dehors de la cicatrice centrale fibreuse, qui se rehausse plus tardivement (fig. 1E et 1F). Au temps portal et tardif, la lésion s’homogénéise par rapport au parenchyme adjacent et n’est en général quasiment plus visible. Pour les tumeurs de moins de 3 cm, la cicatrice centrale peut manquer.4 Une IRM avec produit de contraste hépatobiliaire spécifique (IRM Multihance) peut être nécessaire quand l’IRM classique au gadolinium est douteuse. Si les critères d’imagerie ne sont pas réunis, la biopsie en foie tumoral et non tumoral est nécessaire. L’examen histologique met en évidence une lésion ressemblant à un foyer de cirrhose développé dans un foie sain le plus souvent. Les travées régénératives qui constituent la lésion montrent des hépatocytes dépourvus d’atypies. Il existe des septums fibreux, souvent bordés par une réaction ductulaire, ainsi qu’une fibrose. Une stéatose peut également être présente. L’examen immunohistochimique avec la glutamine synthase permet de confirmer le diagnostic en montrant un marquage caractéristique en « carte de géographie » témoignant de l’alternance de plages fortement marquées et de plages négatives (fig. 2D, 2E et 2F).4
L’imagerie par résonance magnétique (IRM) hépatique avec injection est l’examen clé du diagnostic. Elle décrit classiquement une tumeur bien limitée, homogène en dehors d’une cicatrice fibreuse centrale, non encapsulée et hypo-intense en T1 sans injection de produit de contraste en dehors de la cicatrice qui est en hypersignal spontanée en T2. La tumeur se rehausse fortement au temps artériel, en dehors de la cicatrice centrale fibreuse, qui se rehausse plus tardivement (fig. 1E et 1F). Au temps portal et tardif, la lésion s’homogénéise par rapport au parenchyme adjacent et n’est en général quasiment plus visible. Pour les tumeurs de moins de 3 cm, la cicatrice centrale peut manquer.4 Une IRM avec produit de contraste hépatobiliaire spécifique (IRM Multihance) peut être nécessaire quand l’IRM classique au gadolinium est douteuse. Si les critères d’imagerie ne sont pas réunis, la biopsie en foie tumoral et non tumoral est nécessaire. L’examen histologique met en évidence une lésion ressemblant à un foyer de cirrhose développé dans un foie sain le plus souvent. Les travées régénératives qui constituent la lésion montrent des hépatocytes dépourvus d’atypies. Il existe des septums fibreux, souvent bordés par une réaction ductulaire, ainsi qu’une fibrose. Une stéatose peut également être présente. L’examen immunohistochimique avec la glutamine synthase permet de confirmer le diagnostic en montrant un marquage caractéristique en « carte de géographie » témoignant de l’alternance de plages fortement marquées et de plages négatives (fig. 2D, 2E et 2F).4
Quelle prise en charge ?
Du fait de l’absence de risque de transformation ou d’hémorragie, il n’y a pas d’indication de surveillance ou de traitement. Il n’y a pas lieu d’indiquer l’arrêt des estroprogrestatifs.3
Adénome hépatocellulaire
Les adénomes hépatocellulaires sont des tumeurs hépatocytaires bénignes rares, touchant la femme jeune dans plus de 85 % des cas. Elles sont directement associées à l’exposition hormonale (estrogènes et /ou androgènes) et sont développées principalement sur foie sain, le plus souvent uniques, parfois multiples. Le mode de révélation peut être fortuit, à l’occasion de douleurs abdominales ou lors de complications. Les deux principales complications sont l’hémorragie intratumorale (10 à 20 % des cas) et de rares cas de transformation maligne (< 5 % des cas). Il est décrit différents sous-types d’adénomes hépatocellulaires initialement identifiés en fonction de leurs caractéristiques pathomoléculaires.8
Différents sous-types
Adénome inactivé pour HNF1α
Ce sous-type d’adénome est défini par des mutations inactivatrices du facteur HNF1α et représente 35-40 % des adénomes hépatocellulaires. L’hepatic nuclear factor 1 alpha (HNF1α) est un facteur de transcription particulièrement exprimé dans le foie et impliqué dans plusieurs voies de régulation de la différenciation cellulaire ou du métabolisme. La mutation décrite est également responsable du diabète MODY-3 à transmission autosomique dominante. Il est décrit une association entre les familles atteintes de ce type de diabète et l’adénomatose familiale,9 définie par la présence d’au moins 10 adénomes.Adénome inflammatoire
Les adénomes inflammatoires sont liés à une activation de la voie de l’inflammation IL6/JAK/STAT3 et représente 35-40 % des adénomes. Sur le plan clinique, ils peuvent s’associer à un syndrome inflammatoire biologique, une cholestase biologique et de la fièvre. Ses facteurs de risque sont, en plus de l’exposition aux estrogènes, l’obésité et la consommation d’alcool. Certains adénomes inflammatoires sont également mutés pour la β-caténine sur l’exon 3 ou sur l’exon 7/8.Adénome muté β-caténine sur l’exon 3
La mutation de l’exon 3 de β-caténine est retrouvée dans 10-15 % des adénomes. Cette mutation entraîne une activation de la voie Wnt/β-caténine et ce sous-type est associé à un risque accru de transformation maligne.Adénome muté β-caténine sur l’exon 7/8
Les mutations portant sur les exons 7 ou 8 sont présentes dans 5 à 10 % des adénomes et sont mutuellement exclusives avec la mutation sur l’exon 3. Ces mutations entraînent une activation faible de la voie Wnt/β-caténine et ne sont pas associées à un sur-risque de transformation maligne.Adénome muté pour la voie sonic hedgehog
Près de 5 % des adénomes sont associés à une activation de la voie sonic hedgehog. La particularité de ce sous-groupe d’adénomes récemment décrit est le risque accru de saignement tumoral.Adénomes inclassés
Autour de 7 % des adénomes restent encore inclassés, sans anomalie caractéristique retrouvée en histologie ni en biologie moléculaire.Comment en faire le diagnostic ?
À l’imagerie
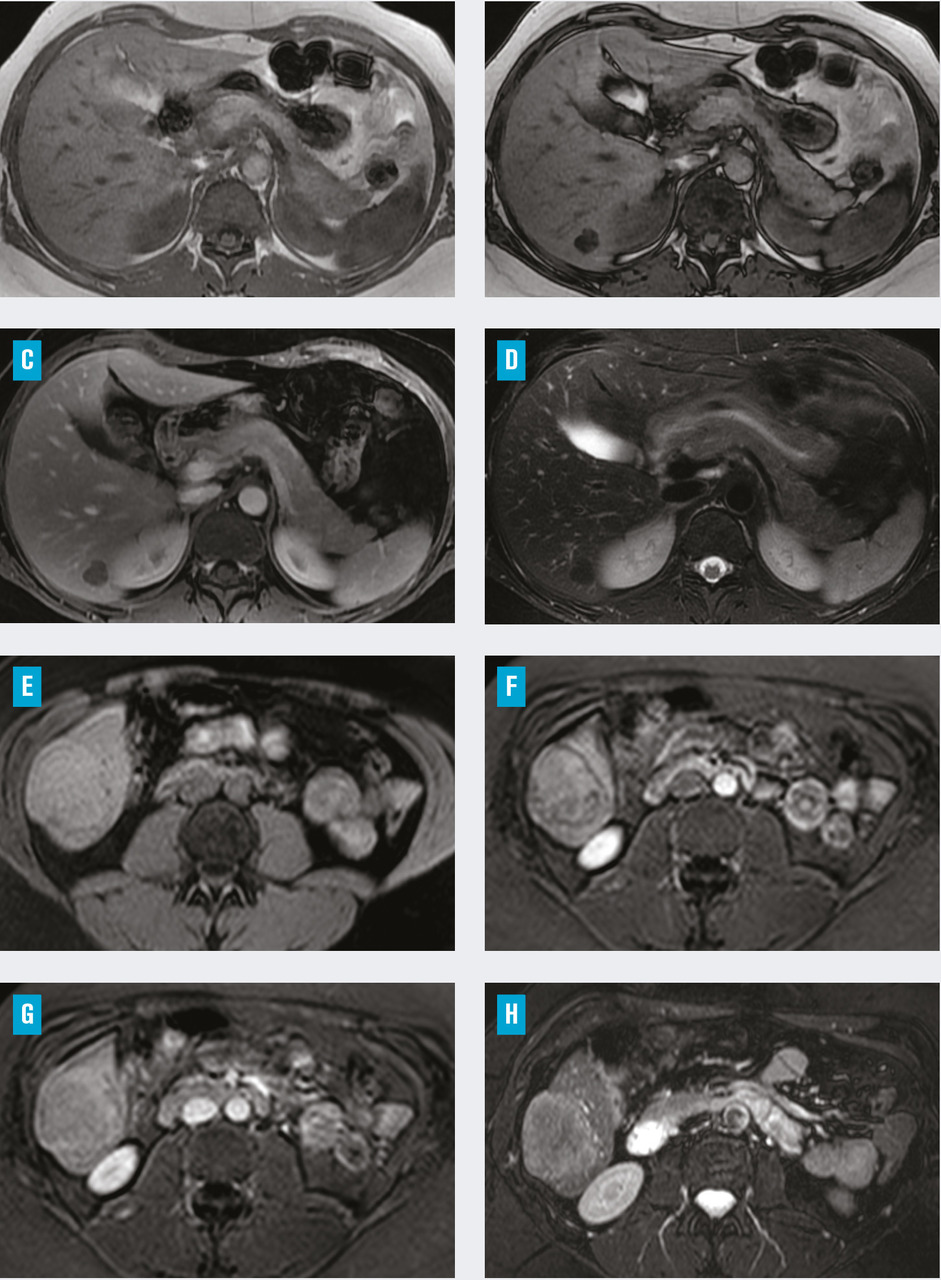
L’IRM permet de suggérer le diagnostic d’adénome hépatocellulaire, mais la biopsie et l’analyse histologique et immunohistochimique sont souvent nécessaires à la fois pour le diagnostic positif et pour la caractérisation des adénomes, dont le risque de complication diffère en fonction des sous-types moléculaires.10Du fait de sa composante graisseuse, l’adénome muté HNF1α est en hypersignal T1 et en hyposignal sur les séquences avec annulation du signal de la graisse (fig. 3A, 3B, 3C et 3D). L’adénome inflammatoire apparaît en hypersignal T2 et a une prise de contraste marquée et hétérogène au temps artériel en raison de son hypervascularisation avec un rehaussement persistant sur les temps tardifs (fig. 3E, 3F, 3G et 3H). Les autres sous-types mutés β-caténine, activés par la voie sonic hedgehog et inclassés, n’ont pas de caractéristiques particulières en imagerie.
À l’histologie
Les adénomes hépatocellulaires sont caractérisés par une prolifération hépatocytaire bénigne. L’analyse histologique et immunohistochimique permet d’identifier les principaux sous-groupes d’adénomes hépatocellulaires (fig. 2G à 2O). La combinaison des caractéristiques morphologiques (présence d’une fibrose, d’une stéatose, d’atypie) et immunohistochimiques, avec utilisation systématique des marqueurs d’inflammation sérum amyloïde A (SAA) et protéine C réactive (CRP), des marqueurs d’activation de la voie Wnt/β-caténine représentés par la glutamine synthase et la β-caténine et du marqueur d’une mutation de HNF1α, représenté par l’extinction du marquage par la liver-fatty acid binding protein (LFABP), permettent dans la majorité des cas de déterminer de manière très sensible et spécifique le sous-type de l’adénome.10Les adénomes mutés pour HNF1α montrent une stéatose marquée, sont dépourvus d’atypies, et il existe une extinction du marquage par la LFABP, présente dans le cytoplasme de 100 % des hépatocytes en dehors de la tumeur (fig. 2G, 2H et 2I). Dans les adénomes hépatocellulaires inflammatoires, on observe un infiltrat inflammatoire, des artères à paroi dystrophique et des dilatations sinusoïdales. Les hépatocytes qui composent la lésion expriment fortement les protéines de l’inflammation CRP et SAA (fig. 2J, 2K et 2L). Les adénomes hépatocellulaires mutés β-caténine sur l’exon 3 ont des foyers d’hépatocytes présentant des atypies nucléaires, un marquage diffus avec la glutamine synthase et une positivité nucléaire et/ou cytoplasmique avec la β-caténine (fig. 2M, 2N et 2O). En revanche, il n’y a aucun marquage β-caténine et le marquage glutamine synthase est soit négatif soit faible et/ou hétérogène dans le sous-groupe des adénomes hépatocellulaires mutés sur l’exon 7/8.10
Quelle prise en charge ?
La prise en charge de ces tumeurs doit être faite dans un service spécialisé, elle dépend du sous-type de l’adénome, de sa taille et du sexe du patient. Dans tous les cas, il faut arrêter la prise d’estroprogestatifs. Une biopsie hépatique en foie tumoral et non tumoral doit être discutée en réunion de concertation pluridisciplinaire afin de confirmer le diagnostic si celui-ci est incertain et/ou afin d’effectuer un sous-typage pour guider le traitement.
Une résection chirurgicale est à discuter en cas de :3
– taille de l’adénome supérieure à 5 cm ;
– sexe masculin quelle que soit la taille de l’adénome ;
– présence d’une mutation β-caténine sur l’exon 3.
Si l’option chirurgicale n’est pas retenue, une surveillance par imagerie est nécessaire afin de s’assurer de l’absence d’évolutivité.
Une résection chirurgicale est à discuter en cas de :3
– taille de l’adénome supérieure à 5 cm ;
– sexe masculin quelle que soit la taille de l’adénome ;
– présence d’une mutation β-caténine sur l’exon 3.
Si l’option chirurgicale n’est pas retenue, une surveillance par imagerie est nécessaire afin de s’assurer de l’absence d’évolutivité.
Conclusion
La prise en charge des tumeurs bénignes nécessite d’abord d’éliminer le diagnostic différentiel de tumeurs malignes primitives ou secondaires. Tout doute diagnostique doit faire référer le patient à un centre spécialisé dans la prise en charge des tumeurs hépatiques. Un diagnostic précis permet de différencier les tumeurs bénignes ne nécessitant ni traitement ni suivi (angiome hépatique et hyperplasie nodulaire focale) de celles pouvant se compliquer et devant faire discuter un éventuel traitement en réunion de concertation pluridisciplinaire (adénome hépatocellulaire).
Encadre
Quand faire une biopsie ?
Pour éliminer une tumeur maligne, en particulier devant : — une hépatopathie sous-jacente ; — un contexte évocateur de localisations secondaires.
En cas de doute diagnostique avec un angiome ou une hyperplasie nodulaire focale non typique après une imagerie en coupe injectée.
Devant un potentiel adénome, non typique d’adénome muté HNF1α, afin de caractériser le sous-type d’adénome si une chirurgie n’a pas été décidée d’emblée.
Références
1. Gandolfi L, Leo P, Solmi L, Vitelli E, Verros G, Colecchia A. Natural history of hepatic haemangiomas: clinical and ultrasound study. Gut 1991;32:677-80.
2. Bahirwani R, Reddy KR. Review article: the evaluation of solitary liver masses. Aliment Pharmacol Ther 2008;28:953-65.
3. European Association for the Study of the Liver (EASL). EASL clinical practice guidelines on the management of benign liver tumours. J Hepatol 2016;65:386-98.
4. Belghiti J, Cauchy F, Paradis V, Vilgrain V. Diagnosis and management of solid benign liver lesions. Nat Rev Gastroenterol Hepatol 2014;11:737-49.
5. Vilgrain V, Boulos L, Vullierme MP, Denys A, Terris B, Menu Y. Imaging of atypical hemangiomas of the liver with pathologic correlation. RadioGraphics 2000;20:379-97.
6. Marrero JA, Ahn J, Reddy KR. ACG clinical guideline: the diagnosis and management of focal liver lesions. Am J Gastroenterol 2014;109:1328-47.
7. Horta G, López M, Dotte A, et al. Benign focal liver lesions detected by computed tomography: Review of 1,184 examinations. Rev Med Chil 2015;143:197-202.
8. Nault JC, Couchy G, Balabaud C, et al. Molecular classification of hepatocellular adenoma associates with risk factors, bleeding, and malignant transformation. Gastroenterology 2017;152:880-94.
9. Bacq Y, Jacquemin E, Balabaud C, et al. Familial liver adenomatosis associated with hepatocyte nuclear factor 1alpha inactivation. Gastroenterology 2003;125:1470-5.
10. Nault JC, Paradis V, Cherqui D, Vilgrain V, Zucman-Rossi J. Molecular classification of hepatocellular adenoma in clinical practice. J Hepatol 2017;67:1074-83.
2. Bahirwani R, Reddy KR. Review article: the evaluation of solitary liver masses. Aliment Pharmacol Ther 2008;28:953-65.
3. European Association for the Study of the Liver (EASL). EASL clinical practice guidelines on the management of benign liver tumours. J Hepatol 2016;65:386-98.
4. Belghiti J, Cauchy F, Paradis V, Vilgrain V. Diagnosis and management of solid benign liver lesions. Nat Rev Gastroenterol Hepatol 2014;11:737-49.
5. Vilgrain V, Boulos L, Vullierme MP, Denys A, Terris B, Menu Y. Imaging of atypical hemangiomas of the liver with pathologic correlation. RadioGraphics 2000;20:379-97.
6. Marrero JA, Ahn J, Reddy KR. ACG clinical guideline: the diagnosis and management of focal liver lesions. Am J Gastroenterol 2014;109:1328-47.
7. Horta G, López M, Dotte A, et al. Benign focal liver lesions detected by computed tomography: Review of 1,184 examinations. Rev Med Chil 2015;143:197-202.
8. Nault JC, Couchy G, Balabaud C, et al. Molecular classification of hepatocellular adenoma associates with risk factors, bleeding, and malignant transformation. Gastroenterology 2017;152:880-94.
9. Bacq Y, Jacquemin E, Balabaud C, et al. Familial liver adenomatosis associated with hepatocyte nuclear factor 1alpha inactivation. Gastroenterology 2003;125:1470-5.
10. Nault JC, Paradis V, Cherqui D, Vilgrain V, Zucman-Rossi J. Molecular classification of hepatocellular adenoma in clinical practice. J Hepatol 2017;67:1074-83.

 Encadrés
Encadrés