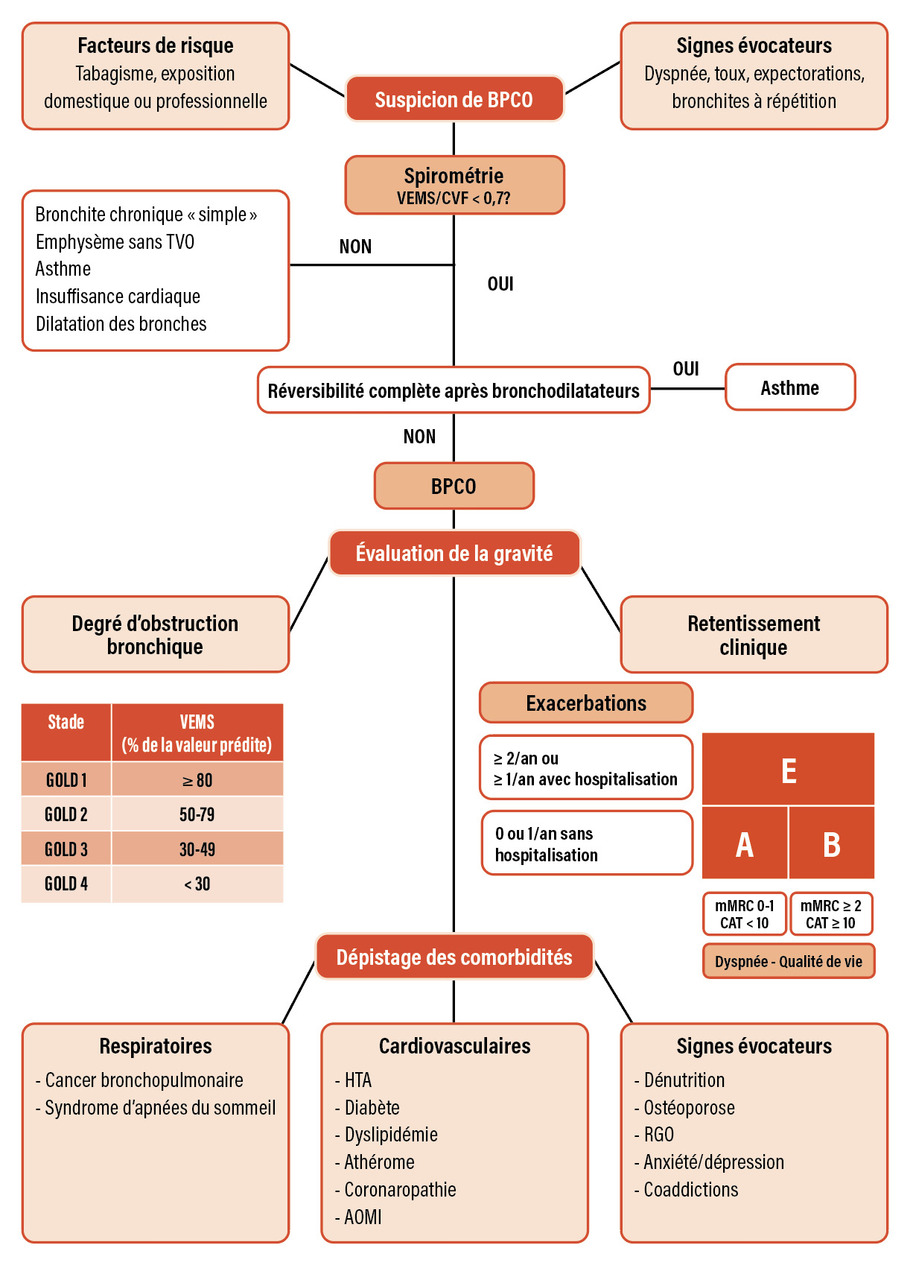
La bronchopneumopathie chronique obstructive, fréquente et sous-diagnostiquée, doit être suspectée chez les patients âgés de plus de 40 ans présentant des symptômes respiratoires chroniques associés à un terrain évocateur. Le diagnostic est confirmé grâce à la spirométrie. L’appréciation de la sévérité repose sur l’évaluation du degré d’obstruction bronchique, du retentissement clinique et des complications associées.
La bronchopneumopathie chronique obstructive (BPCO) est une maladie respiratoire fréquente liée à une exposition prolongée à des toxiques inhalés, au premier rang desquels le tabac. En France, sa prévalence est estimée entre 5 et 10 % de la population des plus de 45 ans, soit plus de 3,5 millions de personnes.1,2 Seule une fraction de ces patients est prise en charge, la BPCO étant notablement sous-diagnostiquée (signes cliniques peu spécifiques, évolution insidieuse, recours tardif aux soins). La BPCO est responsable d’une morbi-mortalité significative avec, en France, plus de 150 000 hospitalisations pour exacerbation et plus de 16 000 décès directement liés à la pathologie chaque année.3 Savoir rechercher, diagnostiquer et évaluer la gravité de la BPCO dans la population générale est donc un enjeu majeur de santé publique. Le diagnostic et la prise en charge thérapeutique de la BPCO font l’objet de propositions internationales publiées dans le document Global Initiative for Obstructive Lung Disease (GOLD)4 et d’un guide de parcours de soins mis à jour par la Haute Autorité de santé en 2020.5 L’aspect diagnostique et l’évaluation initiale sont des étapes cruciales pour la prise en charge. La démarche diagnostique globale est résumée dans la figure .
De quoi parle-t-on ?
Bronchopneumopathie chronique obstructive
La BPCO se définit par l’existence de symptômes respiratoires chroniques (dyspnée d’effort ou de repos, toux, expectoration, infections respiratoires récidivantes) associée à une obstruction bronchique permanente et progressive se traduisant par un trouble ventilatoire obstructif (TVO). Les symptômes et l’obstruction sont en rapport avec des anomalies bronchiques et/ou alvéolaires secondaires à l’inhalation d’aérocontaminants, au premier rang desquels le tabac, et influencés par des facteurs de l’hôte (anomalies de développement pulmonaire, génétique) [voir l’article « Histoire naturelle de la BPCO » dans le n° 2 de La Revue du Praticien de février 2024].
Bronchite chronique
Cette entité clinique est définie par l’association de toux et d’expectorations quotidiennes, durant au moins trois mois par an, et au cours d’au moins deux années consécutives. Elle peut s’associer à une BPCO et doit donc la faire rechercher systématiquement. Cependant, la bronchite chronique telle que définie ci-dessus n’est présente que chez une partie des patients atteints de BPCO ;6 l’absence de bronchite chronique ne doit donc jamais faire éliminer le diagnostic de BPCO. À l’inverse, une bronchite chronique n’évolue pas forcément vers une obstruction bronchique.
Emphysème
Il s’agit d’une entité anatomopathologique qui correspond à la destruction des parois alvéolaires. Au scanner thoracique, l’emphysème se traduit par la présence de zones hypodenses reflétant une raréfaction du parenchyme pulmonaire. C’est l’une des nombreuses anomalies parenchymateuses pulmonaires observées dans la BPCO, mais la présence d’emphysème n’est pas forcément synonyme de BPCO.
Exacerbation aiguë de BPCO
L’exacerbation est une situation clinique aiguë caractérisée par une aggravation des symptômes respiratoires habituels pendant plus d’une journée, et imposant des modifications thérapeutiques.
Repérer la BPCO chez les patients à risque
La BPCO doit être recherchée chez tout patient présentant au moins un facteur de risque et un symptôme évocateur.
Les facteurs de risque à rechercher à l’interrogatoire sont une intoxication tabagique ou une consommation de cannabis, une exposition professionnelle à des toxiques ou irritants (silice, charbon, moisissures, gaz, fumées) et des facteurs de l’environnement intérieur (chauffage au bois ou au charbon).
Les symptômes évocateurs de BPCO (inconstants) sont la dyspnée d’effort (symptôme le plus fréquent), la toux chronique s’accompagnant ou non d’expectorations et les bronchites à répétition. L’examen physique est, quant à lui, le plus souvent normal dans les stades précoces de la maladie. En cas de pathologie avancée, l’auscultation pulmonaire peut mettre en évidence des sibilants (témoins de l’obstruction), des ronchis (témoins de l’atteinte bronchique) ou une diminution du murmure vésiculaire (en cas d’emphysème). Les autres éléments à rechercher en état stable sont : des signes de distension thoracique (augmentation du diamètre antéro-postérieur du thorax, signe de Hoover), une respiration à lèvres pincées, l’utilisation des muscles respiratoires accessoires et, tardivement, une cyanose, voire des signes d’insuffisance cardiaque droite ou, plus rarement, de polyglobulie.
Les facteurs de risque à rechercher à l’interrogatoire sont une intoxication tabagique ou une consommation de cannabis, une exposition professionnelle à des toxiques ou irritants (silice, charbon, moisissures, gaz, fumées) et des facteurs de l’environnement intérieur (chauffage au bois ou au charbon).
Les symptômes évocateurs de BPCO (inconstants) sont la dyspnée d’effort (symptôme le plus fréquent), la toux chronique s’accompagnant ou non d’expectorations et les bronchites à répétition. L’examen physique est, quant à lui, le plus souvent normal dans les stades précoces de la maladie. En cas de pathologie avancée, l’auscultation pulmonaire peut mettre en évidence des sibilants (témoins de l’obstruction), des ronchis (témoins de l’atteinte bronchique) ou une diminution du murmure vésiculaire (en cas d’emphysème). Les autres éléments à rechercher en état stable sont : des signes de distension thoracique (augmentation du diamètre antéro-postérieur du thorax, signe de Hoover), une respiration à lèvres pincées, l’utilisation des muscles respiratoires accessoires et, tardivement, une cyanose, voire des signes d’insuffisance cardiaque droite ou, plus rarement, de polyglobulie.
Affirmer le diagnostic de BPCO grâce à la spirométrie
Lorsqu’il est suspecté cliniquement, le diagnostic de BPCO est établi sur la spirométrie, qui doit être réalisée par un professionnel formé et expérimenté et dont l’interprétation doit être rendue par un médecin.5 Cet examen permet la mesure du volume expiratoire maximal à la première seconde (VEMS) et de la capacité vitale forcée (CVF). En cas de BPCO, la spirométrie montre un trouble ventilatoire obstructif (TVO) défini par un rapport VEMS/CVF inférieur à 70 % qui persiste après l’administration de bronchodilatateurs par voie inhalée (par exemple, le salbutamol).4 Ce critère (seuil fixe du rapport VEMS/CVF) peut néanmoins conduire à un sous-diagnostic de l’obstruction bronchique chez les patients de moins de 50 ans et à un surdiagnostic chez les patients plus âgés, car le ratio VEMS/CVF diminue physiologiquement avec l’âge. L’alternative est une définition de l’obstruction bronchique fondée sur un rapport VEMS/CVF inférieur à la limite inférieure de la normale (LIN).5 Les tests de réversibilité doivent être interprétés avec prudence : une réversibilité dite « significative » (+12 % et 200 mL de VEMS) n’est pas synonyme d’asthme et peut tout à fait être observée dans la BPCO. De même, la réversibilité peut être totalement absente à un moment donné dans l’asthme. Finalement, la seule circonstance dans laquelle la réversibilité permet à elle seule de faire le diagnostic est lorsqu’elle est complète, ce qui est synonyme d’asthme. Lorsqu’elle est très importante (plus de 400 mL), elle est très évocatrice d’asthme. Dans les autres cas, elle n’est qu’un élément du faisceau d’arguments à prendre en compte pour le diagnostic différentiel. En cas de doute diagnostique, notamment sur l’existence ou non du TVO ou l’interprétation de son évolution après prise de bronchodilatateurs, la spirométrie devrait être répétée et le patient adressé à un pneumologue.
Le recours à l’imagerie thoracique n’est pas indispensable pour poser le diagnostic de BPCO. Quand elle est réalisée, la radiographie du thorax peut montrer des signes de distension thoracique (aplatissement des coupoles diaphragmatiques, horizontalisation des côtes) ou d’emphysème (hyperclarté des champs pulmonaires). Le scanner thoracique est utile dans l’évaluation des formes sévères, en cas de doute diagnostique ou encore pour dépister un cancer bronchopulmonaire.
Chez les patients peu ou pas tabagiques et atteints de BPCO, en particulier s’ils sont jeunes, on peut proposer un dosage de l’alpha-1 antitrypsine (prédisposition génétique).
Le recours à l’imagerie thoracique n’est pas indispensable pour poser le diagnostic de BPCO. Quand elle est réalisée, la radiographie du thorax peut montrer des signes de distension thoracique (aplatissement des coupoles diaphragmatiques, horizontalisation des côtes) ou d’emphysème (hyperclarté des champs pulmonaires). Le scanner thoracique est utile dans l’évaluation des formes sévères, en cas de doute diagnostique ou encore pour dépister un cancer bronchopulmonaire.
Chez les patients peu ou pas tabagiques et atteints de BPCO, en particulier s’ils sont jeunes, on peut proposer un dosage de l’alpha-1 antitrypsine (prédisposition génétique).
Ne pas méconnaître les diagnostics différentiels
Le principal diagnostic différentiel de la BPCO est l’asthme (tableau 1 ), dont certaines manifestations respiratoires sont communes à la BPCO (toux, sifflements, dyspnée, exacerbations aiguës). On évoque un asthme plutôt qu’une BPCO chez un patient jeune (premiers symptômes survenant avant l’âge de 40 ans) ayant un terrain atopique. Les patients asthmatiques ont des symptômes respiratoires variables dans le temps (périodes asymptomatiques) et survenant plus volontiers la nuit. Une atteinte rhinosinusienne associée à l’asthme est également fréquemment observée. Enfin, à l’état stable, la spirométrie d’un patient asthmatique est le plus souvent normale (le TVO, quand il existe, est presque toujours réversible), tout comme le scanner thoracique.7 Attention cependant, la BPCO et l’asthme peuvent être intriqués (patient asthmatique et fumeur, par exemple) dans le cadre d’un syndrome de chevauchement asthme-BPCO.
Les autres diagnostics différentiels de la BPCO sont la dilatation des bronches et l’insuffisance cardiaque.
Les autres diagnostics différentiels de la BPCO sont la dilatation des bronches et l’insuffisance cardiaque.
Évaluer la gravité de la BPCO selon une catégorisation multicritère
La sévérité de la BPCO est appréciée sur différents critères non complètement liés entre eux, ce qui a conduit au développement d’une catégorisation multicritère évaluant la sévérité fonctionnelle respiratoire, d’une part, et la sévérité clinique, d’autre part.
La sévérité fonctionnelle respiratoire est évaluée sur le degré d’obstruction bronchique, c’est-à-dire la mesure du VEMS après administration de bronchodilatateurs. Elle est classée en quatre stades (GOLD de 1 à 4) selon la valeur du pourcentage de VEMS par rapport à la valeur prédite (figure ). La sévérité clinique est appréciée sur l’intensité de la dyspnée, qui est cotée grâce à l’échelle de dyspnée modifiée du Medical Research Council (échelle mMRC) [tableau 2 ] ; le retentissement sur la qualité de vie est évalué grâce au score CAT (Chronic Obstructive Pulmonary Disease [COPD] Assessment Test)8 et à la fréquence et la gravité des exacerbations de BPCO. La combinaison de ces trois éléments permet d’établir une classification en trois catégories : A (peu symptomatique et peu à risque d’exacerbations) ; B (symptomatique et peu à risque d’exacerbations) ; E (à risque élevé d’exacerbations) [figure ]. Cette classification a pour objectif d’identifier des profils de patients et d’adapter en conséquence la prise en charge thérapeutique.
D’autres éléments de retentissement sont à identifier au moment de l’évaluation initiale. Compléter l’évaluation fonctionnelle du patient par des épreuves fonctionnelles respiratoires permet ainsi d’identifier une distension thoracique et/ou des troubles de la diffusion du monoxyde de carbone. On peut également rechercher l’existence d’une hypoxémie (cyanose, mesure de la saturation pulsée en oxygène) et/ou d’une hypercapnie (céphalées chroniques, astérixis) au repos, que l’on confirme par la réalisation de gaz du sang en air ambiant.
Chez les patients hypoxémiques, des signes cliniques d’insuffisance cardiaque droite sont recherchés et une échographie cardiaque réalisée, à la recherche d’une hypertension pulmonaire.
La sévérité fonctionnelle respiratoire est évaluée sur le degré d’obstruction bronchique, c’est-à-dire la mesure du VEMS après administration de bronchodilatateurs. Elle est classée en quatre stades (GOLD de 1 à 4) selon la valeur du pourcentage de VEMS par rapport à la valeur prédite (
D’autres éléments de retentissement sont à identifier au moment de l’évaluation initiale. Compléter l’évaluation fonctionnelle du patient par des épreuves fonctionnelles respiratoires permet ainsi d’identifier une distension thoracique et/ou des troubles de la diffusion du monoxyde de carbone. On peut également rechercher l’existence d’une hypoxémie (cyanose, mesure de la saturation pulsée en oxygène) et/ou d’une hypercapnie (céphalées chroniques, astérixis) au repos, que l’on confirme par la réalisation de gaz du sang en air ambiant.
Chez les patients hypoxémiques, des signes cliniques d’insuffisance cardiaque droite sont recherchés et une échographie cardiaque réalisée, à la recherche d’une hypertension pulmonaire.
Dépister et évaluer les comorbidités associées
La BPCO est associée à au moins une comorbidité pour 60 à 70 % des patients, du fait notamment de l’existence de facteurs de risque communs (tabac), d’une réduction fréquente de l’activité physique quotidienne et de l’inflammation chronique systémique observée chez certains patients atteints de BPCO.5 Ces comorbidités peuvent aggraver le pronostic de la maladie respiratoire si elles ne sont pas identifiées et prises en charge. On s’attache donc à rechercher systématiquement : un cancer bronchopulmonaire, des facteurs de risque et des pathologies cardiovasculaires (diabète, hypertension artérielle, coronaropathie), une anémie, une ostéoporose, une dénutrition, un syndrome anxiodépressif ou encore des coaddictions. Un syndrome d’apnées du sommeil ou un reflux gastro-œsophagien peut également aggraver le retentissement de la BPCO. Le tableau 3 résume les comorbidités associées à la BPCO.
Quand demander l’avis d’un pneumologue ?
Certaines situations cliniques doivent conduire à solliciter un avis spécialisé. Il est recommandé d’adresser le patient à un pneumologue en cas de doute diagnostique (diagnostic différentiel avec un asthme, difficultés d’interprétation de la spirométrie), de pathologie sévère (obstruction sévère, handicap dans la vie quotidienne, exacerbations fréquentes, hypoxémie, hypercapnie), de pathologie s’aggravant rapidement, ou en cas d’échec thérapeutique.
On sollicite également un avis pneumologique en cas de suspicion de syndrome d’apnées du sommeil ou de cancer bronchopulmonaire.
On sollicite également un avis pneumologique en cas de suspicion de syndrome d’apnées du sommeil ou de cancer bronchopulmonaire.
Références
1. Quach A, Giovannelli J, Cherot-Kornobis N, Ciuchete A, Clement G, Matran R, et al. Prevalence and underdiagnosis of airway obstruction among middle-aged adults in northern France: The ELISABET study 2011-2013. Respir Med 2015;109(12):1553-61.
2. Fuhrman C, Delmas MC, pour le groupe épidémiologie et recherche clinique de la SPLF. Epidemiology of chronic obstructive pulmonary disease in France. Rev Mal Respir 2010;27(2):160-8.
3. BPCO et insuffisance respiratoire chronique. Santé publique France 2019. https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-et-infections-respiratoires/bpco-et-insuffisance-respiratoire-chronique/donnees/#tabs
4. Agusti A, Celli BR, Criner GJ, Halpin D, Anzueto A, Barnes P, et al. Global initiative for chronic obstructive lung disease 2023 Report: GOLD Executive Summary. Arch Bronconeumol 2023;59(4):232-48.
5. Haute Autorité de santé. Guide du parcours de soins. Bronchopneumopathie chronique obstructive (BPCO). Guide maladie chronique. 2020. https://www.has-sante.fr/jcms/c_1242507/fr/guide-du-parcours-de-soins-bronchopneumopathie-chronique-obstructive-bpco
6. Allinson JP, Hardy R, Donaldson GC, Shaheen SO, Kuh D, Wedzicha JA. The presence of chronic mucus hypersecretion across adult life in relation to chronic obstructive pulmonary disease development. Am J Respir Crit Care Med 2016;193(6):662-72.
7. Louis R, Satia I, Ojanguren I, Schleich F, Bonini M, Tonia T, et al. European Respiratory Society guidelines for the diagnosis of asthma in adults. Eur Respir J 2022;2101585.
8. Jones PW, Harding G, Berry P, Wiklund I, Chen WH, Kline Leidy N. Development and first validation of the COPD Assessment Test. Eur Respir J 2009;34(3):648-54.
9. Bestall JC, Paul EA, Garrod R, Garnham R, Jones PW, Wedzicha JA. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax 1999;54(7):581-6.
2. Fuhrman C, Delmas MC, pour le groupe épidémiologie et recherche clinique de la SPLF. Epidemiology of chronic obstructive pulmonary disease in France. Rev Mal Respir 2010;27(2):160-8.
3. BPCO et insuffisance respiratoire chronique. Santé publique France 2019. https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-et-infections-respiratoires/bpco-et-insuffisance-respiratoire-chronique/donnees/#tabs
4. Agusti A, Celli BR, Criner GJ, Halpin D, Anzueto A, Barnes P, et al. Global initiative for chronic obstructive lung disease 2023 Report: GOLD Executive Summary. Arch Bronconeumol 2023;59(4):232-48.
5. Haute Autorité de santé. Guide du parcours de soins. Bronchopneumopathie chronique obstructive (BPCO). Guide maladie chronique. 2020. https://www.has-sante.fr/jcms/c_1242507/fr/guide-du-parcours-de-soins-bronchopneumopathie-chronique-obstructive-bpco
6. Allinson JP, Hardy R, Donaldson GC, Shaheen SO, Kuh D, Wedzicha JA. The presence of chronic mucus hypersecretion across adult life in relation to chronic obstructive pulmonary disease development. Am J Respir Crit Care Med 2016;193(6):662-72.
7. Louis R, Satia I, Ojanguren I, Schleich F, Bonini M, Tonia T, et al. European Respiratory Society guidelines for the diagnosis of asthma in adults. Eur Respir J 2022;2101585.
8. Jones PW, Harding G, Berry P, Wiklund I, Chen WH, Kline Leidy N. Development and first validation of the COPD Assessment Test. Eur Respir J 2009;34(3):648-54.
9. Bestall JC, Paul EA, Garrod R, Garnham R, Jones PW, Wedzicha JA. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax 1999;54(7):581-6.
Dans cet article
- De quoi parle-t-on ?
- Repérer la BPCO chez les patients à risque
- Affirmer le diagnostic de BPCO grâce à la spirométrie
- Ne pas méconnaître les diagnostics différentiels
- Évaluer la gravité de la BPCO selon une catégorisation multicritère
- Dépister et évaluer les comorbidités associées
- Quand demander l’avis d’un pneumologue ?