Àpartir des années 1990, la création des « cliniques de la mémoire » d’une part et les études épidémiologiques longitudinales d’autre part ont montré qu’il était possible d’identifier des sujets à risque de développer la maladie d’Alzheimer plusieurs années avant le diagnostic fondé sur la présence de troubles cognitifs légers, en particulier mnésiques.1 Plus récemment, des avancées technologiques ont été à l’origine de nouvelles méthodes visant à mettre en évidence du vivant du sujet les lésions cérébrales caractéristiques de la maladie d’Alzheimer ou leurs conséquences sur le cerveau.2 Ce sont les « biomarqueurs » issus de l’analyse du liquide céphalorachidien ou des méthodes d’imagerie cérébrale. Cette évolution a amené les professionnels à élaborer récemment de nouveaux critères de diagnostic clinique de la maladie d’Alzheimer, y compris au stade prodromal, préalable à la démence.2
Ces critères prennent en compte trois stades de la maladie, avec un premier stade « préclinique » lorsque le sujet est asymptomatique mais des examens approfondis mettent en évidence les lésions caractéristiques, un deuxième stade « prédémentiel » où le sujet a des troubles cognitifs légers avec des biomarqueurs positifs, et enfin le stade de « démence » où le fonctionnement du sujet au quotidien est altéré du fait de la présence des troubles cognitifs engendrés par les lésions caractéristiques de la maladie. Ces trois stades font un continuum, avec une très longue phase préclinique et prodromale précédant le diagnostic de démence, pouvant durer de 15 à 25 ans. Il s’agit d’une classification théorique, toutefois, car chaque patient est examiné à un moment précis de son parcours évolutif.
Ces critères prennent en compte trois stades de la maladie, avec un premier stade « préclinique » lorsque le sujet est asymptomatique mais des examens approfondis mettent en évidence les lésions caractéristiques, un deuxième stade « prédémentiel » où le sujet a des troubles cognitifs légers avec des biomarqueurs positifs, et enfin le stade de « démence » où le fonctionnement du sujet au quotidien est altéré du fait de la présence des troubles cognitifs engendrés par les lésions caractéristiques de la maladie. Ces trois stades font un continuum, avec une très longue phase préclinique et prodromale précédant le diagnostic de démence, pouvant durer de 15 à 25 ans. Il s’agit d’une classification théorique, toutefois, car chaque patient est examiné à un moment précis de son parcours évolutif.
Marqueurs de la maladie au stade prodromal (troubles cognitifs légers)
Marqueurs cognitifs
Lorsqu’on évoque les marqueurs de la maladie d’Alzheimer, on fait habituellement référence aux marqueurs biologiques (biomarqueurs), parfois également à l’imagerie cérébrale moléculaire (tomographie par émission de positons [TEP]). Toutefois, l’évaluation de la cognition à l’aide de tests neuropsychologiques est également révélatrice de la présence d’un dommage cérébral. Il s’agit même d’une information essentielle quant à l’impact des modifications biologiques sur le fonctionnement de l’individu. Les études longitudinales ont montré la présence de moins bonnes performances aux tests cognitifs chez des sujets qui, bien plus tard (plus de 10 ans après), ont développé une démence.3
La validité de la méthode n’est toutefois pas optimale à cause de la présence d’un nombre non négligeable de faux négatifs, à savoir des patients ayant des performances normales au départ mais qui sont néanmoins devenus déments par la suite, et, surtout, de faux positifs, à savoir des patients chez qui des déficits cognitifs ont été constatés mais qui n’ont pas évolué, même après de nombreuses années. La raison en est que, dans le but de dépister des déficits chez des patients ayant des troubles très légers, la limite normal-pathologique doit être moins restrictive, souvent à -1,5 déviation standard (DS) par rapport à la moyenne d’un groupe contrôle apparié pour l’âge, le sexe et l’éducation (en clinique, elle est usuellement établie à -2,0 DS). Par conséquent, des sujets ayant des performances cognitives plus basses pour des raisons variées peuvent être à tort considérés comme « à risque » de développer une maladie d’Alzheimer. À l’inverse, des sujets d’un niveau supérieur peuvent masquer leurs déficits plus longtemps et montrer des performances cognitives qui apparaissent encore comme normales.4
La validité de la méthode n’est toutefois pas optimale à cause de la présence d’un nombre non négligeable de faux négatifs, à savoir des patients ayant des performances normales au départ mais qui sont néanmoins devenus déments par la suite, et, surtout, de faux positifs, à savoir des patients chez qui des déficits cognitifs ont été constatés mais qui n’ont pas évolué, même après de nombreuses années. La raison en est que, dans le but de dépister des déficits chez des patients ayant des troubles très légers, la limite normal-pathologique doit être moins restrictive, souvent à -1,5 déviation standard (DS) par rapport à la moyenne d’un groupe contrôle apparié pour l’âge, le sexe et l’éducation (en clinique, elle est usuellement établie à -2,0 DS). Par conséquent, des sujets ayant des performances cognitives plus basses pour des raisons variées peuvent être à tort considérés comme « à risque » de développer une maladie d’Alzheimer. À l’inverse, des sujets d’un niveau supérieur peuvent masquer leurs déficits plus longtemps et montrer des performances cognitives qui apparaissent encore comme normales.4
Marqueurs biologiques
Quatre méthodes sont considérées suffisamment valides à l’heure actuelle pour être recommandées comme aide diagnostique pour le clinicien.2 Les biomarqueurs qui en résultent sont classés en deux catégories : ceux permettant de mettre en évidence des dépôts anormaux d’amyloïde et/ou de protéine tau dans le cerveau, et ceux témoignant d’un dommage neuronal et synaptique de type neurodégénératif (tableau 1 ). L’évaluation des biomarqueurs nécessite, selon le cas, soit une ponction lombaire avec analyse du liquide céphalorachidien, soit une imagerie cérébrale morphologique par résonance magnétique (IRM) ou fonctionnelle par TEP.
Utilisation des biomarqueurs en pratique pour le diagnostic prodromal
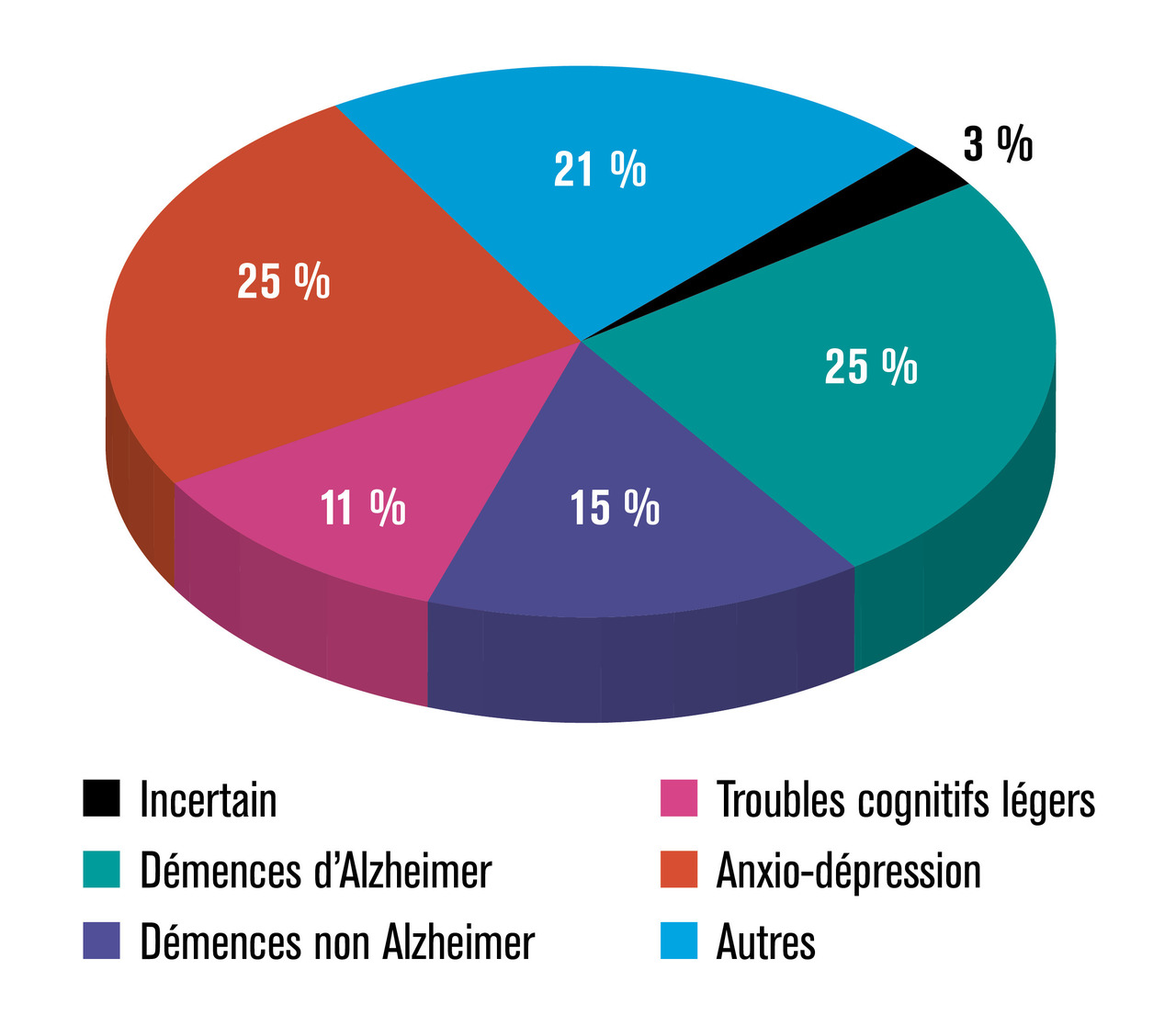
La meilleure façon de montrer l’utilisation de biomarqueurs pour un diagnostic précoce de la maladie d’Alzheimer est de prendre la position du clinicien face à un patient se plaignant de troubles de la mémoire. Dans notre expérience à la clinique de la mémoire, les patients ayant des troubles légers et chez qui le problème d’un diagnostic précoce se pose représentent approximativement 11 % du total des patients (fig. 1 ). Le diagnostic reste donc aujourd’hui majoritairement posé au stade de démence, comme en témoignent aussi les enquêtes internationales sur le sujet.*
Première étape
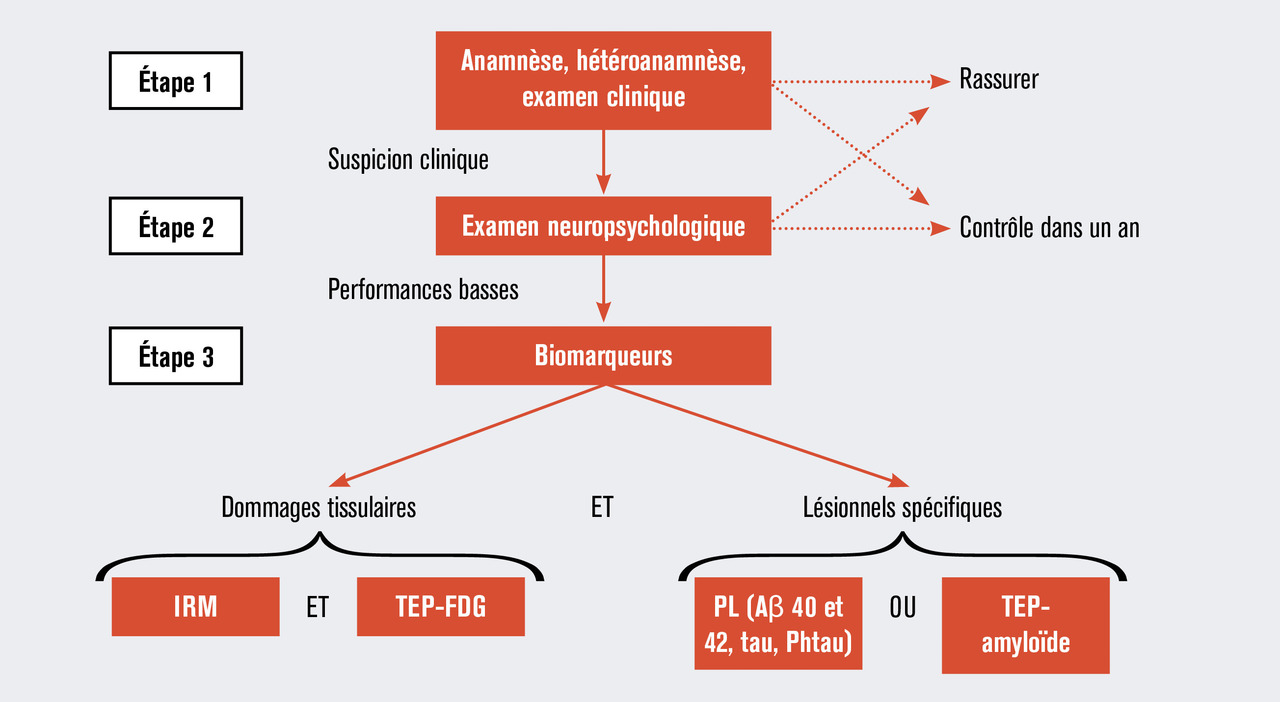
La démarche typique d’utilisation des biomarqueurs dans le diagnostic précoce de la maladie d’Alzheimer est schématisée dans la figure 2 v . p. 162 ). Une bonne anamnèse, incluant les médicaments en cours et les habitudes de consommation d’alcool, ainsi qu’un examen clinique complet sont des prérequis essentiels. L’hétéro-anamnèse n’est pas toujours possible aux stades précoces car le patient consulte souvent seul, mais elle est très précieuse car il est bien démontré que les patients atteints de maladie d’Alzheimer, même au stade prodromal, sont moins conscients de leurs troubles que ne l’est leur entourage, et ce dès les stades précoces.5 L’évaluation cognitive clinique par des outils standard comme le Mini-Mental State Examination (MMSE) ou le Montreal Cognitive Assessment (MoCA) est recommandée, mais un score normal à ces tests n’exclut pas une maladie d’Alzheimer prodromale. Après avoir raisonnablement exclu les causes non dégénératives à l’origine d’un déficit cognitif (tableau 2 ), le clinicien doit prendre une décision pour la suite : faut-il proposer au patient d’aller plus loin dans les investigations car il y a une suspicion légitime de maladie d’Alzheimer ou ne conviendrait-il pas plutôt de rassurer le patient ?
Aller plus loin ?
C’est une décision cruciale, et sur le plan éthique il convient de s’y appesantir car, selon les recommandations actuelles en matière de diagnostic précoce, il faut explorer avec le patient les tenants et les aboutissants d’un diagnostic éventuel de maladie d’Alzheimer avant même que les examens pouvant y conduire ne soient programmés.6 En effet, certains patients pourraient décider de ne pas vouloir « savoir », tandis que d’autres pourraient prendre l’attitude contraire. Les deux postures sont éthiquement défendables car, au stade prodromal, les troubles n’ont pas encore d’effet significatif sur la vie quotidienne des patients et, donc, en l’absence d’un traitement curatif, le diagnostic pourrait être différé. Toutefois, il est important que les patients ayant décidé, pour des raisons qui leur sont propres, d’avoir un diagnostic précis puissent trouver des réponses appropriées à leur demande.6
Au cas où le patient hésite à se lancer dans des investigations complémentaires et en l’absence de signes de détérioration significative de son fonctionnement, il convient de proposer un suivi avec, par exemple, une consultation de contrôle dans un an. Un examen neuropsychologique est toujours nécessaire à un stade précoce afin de caractériser et quantifier les troubles des principales fonctions cognitives pertinentes pour le diagnostic (mémoire, langage, fonctions exécutives et visuo-spatiales). Il peut constituer, dans certains cas, une étape intermédiaire avant de programmer des biomarqueurs. Le patient doit se sentir à l’aise avec la démarche et il doit pouvoir se prononcer, à chaque étape, sur la poursuite ou l’arrêt éventuel des examens.
Les biomarqueurs sont donc proposés aux patients chez qui une maladie d’Alzheimer prodromale est suspectée et qui ont été d’accord pour approfondir les examens. Les directives plus anciennes de diagnostic de la démence stipulaient un bilan complémentaire a minima (tomodensitométrie cérébrale et biologie « standard ») dans le seul but d’exclure les rares démences « curables » (2 % des patients au maximum). C’est à ce niveau que l’approche nouvelle des biomarqueurs diffère fondamentalement, car elle se propose de détecter dans le cerveau les lésions caractéristiques de la maladie d’Alzheimer.
Au cas où le patient hésite à se lancer dans des investigations complémentaires et en l’absence de signes de détérioration significative de son fonctionnement, il convient de proposer un suivi avec, par exemple, une consultation de contrôle dans un an. Un examen neuropsychologique est toujours nécessaire à un stade précoce afin de caractériser et quantifier les troubles des principales fonctions cognitives pertinentes pour le diagnostic (mémoire, langage, fonctions exécutives et visuo-spatiales). Il peut constituer, dans certains cas, une étape intermédiaire avant de programmer des biomarqueurs. Le patient doit se sentir à l’aise avec la démarche et il doit pouvoir se prononcer, à chaque étape, sur la poursuite ou l’arrêt éventuel des examens.
Les biomarqueurs sont donc proposés aux patients chez qui une maladie d’Alzheimer prodromale est suspectée et qui ont été d’accord pour approfondir les examens. Les directives plus anciennes de diagnostic de la démence stipulaient un bilan complémentaire a minima (tomodensitométrie cérébrale et biologie « standard ») dans le seul but d’exclure les rares démences « curables » (2 % des patients au maximum). C’est à ce niveau que l’approche nouvelle des biomarqueurs diffère fondamentalement, car elle se propose de détecter dans le cerveau les lésions caractéristiques de la maladie d’Alzheimer.
Biomarqueurs : quel usage ?
Plusieurs méthodes existent, et la question est de savoir comment utiliser ces outils. Premièrement, ce sont des examens à haut niveau de technicité, d’interprétation délicate, de disponibilité limitée, et d’un coût élevé pour l’imagerie. Mieux vaut donc réserver ces méthodes aux centres spécialisés. Le choix de ces examens par le spécialiste dépend de plusieurs facteurs. En les analysant, le clinicien doit répondre à deux questions :
– quelle est la probabilité de trouver une maladie d’Alzheimer versus une autre forme de maladie neurodégénérative ou une autre affection comme, par exemple, une dépression ?
– quelle est la pertinence clinique d’avoir un diagnostic précis ?
Marqueurs de dommage tissulaire. Il faut s’assurer que les défaillances cognitives sont bien en relation avec des atteintes cérébrales dans les régions attendues selon des corrélations anatomocliniques : l’hippocampe, les régions périsylviennes de l’hémisphère dominant et les régions postérieures pariéto-occipitales. Les deux méthodes sont souvent réalisées dans la pratique car elles se complètent : l’IRM est plus sensible pour déceler l’atrophie hippocampique, la TEP-FDG pour mettre en évidence l’atteinte des zones néocorticales.7 L’intérêt de ces examens réside également dans le diagnostic différentiel. Ainsi, la TEP-FDG peut mettre en évidence un hypométabolisme dans des régions plus rarement atteintes par la maladie d’Alzheimer mais typiques pour d’autres types de neurodégénérescence, comme le lobe frontal dans les démences frontotemporales ou le lobe occipital dans la démence à corps de Lewy. Pour ces affections, nous ne disposons pas de marqueurs spécifiques, dès lors l’analyse de la topographie cérébrale des lésions est une information essentielle pour un diagnostic correct. Enfin, l’IRM cérébrale permet d’apprécier l’importance et l’étendue des lésions cérébrovasculaires, dont la fréquence augmente avec l’âge et qui peuvent, par elles-mêmes, être à l’origine de troubles cognitifs ou contribuer à l’aggravation de celles-ci dans un contexte de maladie d’Alzheimer associée. Malgré la mise en évidence d’une atrophie hippocampique et/ou la détection d’un hypométabolisme typique pariétotemporal, il n’est jamais certain que les lésions sous-jacentes soient de type Alzheimer, car ces marqueurs sont seulement des mesures indirectes des effets de la pathologie.
Marqueur lésionnel spécifique. Un biomarqueur spécifique est donc nécessaire si l’on veut avoir un diagnostic précis. Parmi les marqueurs spécifiques, l’analyse du liquide céphalorachidien permet de déceler les substances résultant des lésions caractéristiques de la maladie, à savoir le peptide amyloïde, la protéine tau totale et sa variante phosphorylée, sans toutefois en dévoiler la topographie régionale. La TEP amyloïde est également recommandée en pratique clinique si elle est disponible car, au stade où le patient commence à avoir des troubles cognitifs, la protéine amyloïde doit être présente dans le cortex cérébral. L’examen est sans risques, facile à réaliser et à interpréter. La place de la TEP-TDM ou de l’IRM utilisant des traceurs pour la protéine tau est à l’étude, mais il faudra encore un certain temps avant de clarifier ses indications en pratique clinique. Des données préliminaires montrent qu’il s’agit sans doute d’un meilleur marqueur de l’évolution de la maladie d’Alzheimer que la TEP amyloïde.8
Le choix d’un biomarqueur plutôt qu’un autre dépend également de la présence de contre-indications médicales (par exemple certains stimulateurs cardiaques pour l’IRM) et du choix du patient qui, bien souvent, tend, dans la mesure du possible, à éviter les méthodes réputées « invasives » comme la ponction lombaire, même si les effets indésirables de celle-ci sont rares et mineurs.9 Par ailleurs, dans le cadre d’une procédure diagnostique, le nombre de TEP utilisant des isotopes radioactifs est limité, pour des raisons d’exposition, à quatre par an. Indépendamment des indications médicales stricto sensu, le choix des biomarqueurs reste encore largement déterminé par la disponibilité, les compétences techniques et le coût. Les traceurs amyloïdes ont été homologués par les autorités américaines (Food and Drug Administration) et européennes (European Medical Agency), mais ils sont encore peu utilisés en dehors des centres de recherche car ils sont chers et souvent à la charge du patient. Les mesures de l’atrophie cérébrale en IRM ou d’hypométabolisme en TEP sont plus précises si elles sont quantifiées (offrant alors l’avantage d’un contrôle possible de l’évolution dans le futur), mais les logiciels nécessaires pour obtenir ces mesures quantitatives ne sont pas encore à la portée de tous. Enfin, l’analyse du liquide céphalorachidien obtenu par ponction lombaire est à la portée de tout service de neurologie et elle est moins chère que l’imagerie moléculaire par TEP. En revanche, l’analyse des biomarqueurs dans le liquide céphalorachidien implique des conditions strictes de prélèvement (pas de contamination avec du sang, tubes de prélèvement adéquats) et elle nécessite des laboratoires de référence à même d’interpréter correctement les résultats.
– quelle est la probabilité de trouver une maladie d’Alzheimer versus une autre forme de maladie neurodégénérative ou une autre affection comme, par exemple, une dépression ?
– quelle est la pertinence clinique d’avoir un diagnostic précis ?
Quel niveau de certitude ?
La première question dépend des éléments de l’examen clinique et cognitif qui sont plus ou moins typiques. Par exemple, la prédominance des troubles de la mémoire sur d’autres atteintes cognitives et un déficit de mémorisation dû à une difficulté à encoder l’information dès le départ, souvent responsable d’un questionnement répétitif, sont suggestifs d’une maladie d’Alzheimer. La présence de symptômes anxieux et/ou dépressifs n’est pas discriminante car environ 30 % des patients souffrant de maladie d’Alzheimer débutante ont également des symptômes de ce type. L’âge est un facteur essentiel à prendre en compte, car la probabilité d’avoir une maladie d’Alzheimer, tous facteurs confondus, est proche de zéro à 40 ans (en dehors des très rares cas héréditaires) mais elle atteint 50 % à 85 ans. Toutefois, un diagnostic de certitude est souvent davantage requis chez les patients plus jeunes. Un niveau d’éducation bas et/ou une langue maternelle et un fond culturel différents, qui rendent l’interprétation des données cliniques et cognitives plus difficiles, sont également des facteurs qui augmentent la nécessité de recourir aux biomarqueurs. De manière générale, moins les données cliniques sont typiques et fiables, plus les biomarqueurs sont indiqués.Quel intérêt pour le patient ?
La deuxième question doit toujours être posée car, dans le contexte d’une maladie qui est incurable, le diagnostic ne se justifie que par les changements engendrés afin que la vie « en sachant » soit meilleure que celle menée dans l’ignorance. Parmi les réponses les plus fréquentes lorsqu’on interroge les patients sur leur désir de connaître un tel diagnostic, il y a la peur de devenir une charge pour l’entourage, le souhait d’organiser l’avenir en connaissance de cause et l’espoir qu’un remède existe ou, à tout le moins, qu’il sera trouvé à échéance utile. Dans les centres académiques, la participation aux essais cliniques est donc une motivation majeure pour la réalisation des biomarqueurs. Pour un patient très âgé, dont la durée de vie est éventuellement déjà limitée par une autre pathologie, qui est bien entouré et épaulé et dont le comportement reste calme et serein, la question d’un diagnostic précoce de la maladie d’Alzheimer se pose avec moins d’acuité.Quels examens ?
Finalement, si le clinicien a acquis la conviction qu’il est possible et souhaitable de connaître le diagnostic précis de maladie d’Alzheimer en utilisant les biomarqueurs, et si le patient est d’accord pour entreprendre cette démarche, il reste à choisir les examens les plus appropriés. En général, le spécialiste choisit au moins un marqueur de dommage tissulaire, cherchant à mettre en évidence une atrophie à l’IRM ou un hypométabolisme à la tomographie par émission de positons-tomodensitométrie (TEP-TDM) ou à l’IRM au fluorodésoxyglucose (FDG), et un marqueur spécifique des lésions de la maladie d’Alzheimer (analyse du liquide céphalorachidien ou TEP-TDM avec traceur spécifique pour l’amyloïde).Marqueurs de dommage tissulaire. Il faut s’assurer que les défaillances cognitives sont bien en relation avec des atteintes cérébrales dans les régions attendues selon des corrélations anatomocliniques : l’hippocampe, les régions périsylviennes de l’hémisphère dominant et les régions postérieures pariéto-occipitales. Les deux méthodes sont souvent réalisées dans la pratique car elles se complètent : l’IRM est plus sensible pour déceler l’atrophie hippocampique, la TEP-FDG pour mettre en évidence l’atteinte des zones néocorticales.7 L’intérêt de ces examens réside également dans le diagnostic différentiel. Ainsi, la TEP-FDG peut mettre en évidence un hypométabolisme dans des régions plus rarement atteintes par la maladie d’Alzheimer mais typiques pour d’autres types de neurodégénérescence, comme le lobe frontal dans les démences frontotemporales ou le lobe occipital dans la démence à corps de Lewy. Pour ces affections, nous ne disposons pas de marqueurs spécifiques, dès lors l’analyse de la topographie cérébrale des lésions est une information essentielle pour un diagnostic correct. Enfin, l’IRM cérébrale permet d’apprécier l’importance et l’étendue des lésions cérébrovasculaires, dont la fréquence augmente avec l’âge et qui peuvent, par elles-mêmes, être à l’origine de troubles cognitifs ou contribuer à l’aggravation de celles-ci dans un contexte de maladie d’Alzheimer associée. Malgré la mise en évidence d’une atrophie hippocampique et/ou la détection d’un hypométabolisme typique pariétotemporal, il n’est jamais certain que les lésions sous-jacentes soient de type Alzheimer, car ces marqueurs sont seulement des mesures indirectes des effets de la pathologie.
Marqueur lésionnel spécifique. Un biomarqueur spécifique est donc nécessaire si l’on veut avoir un diagnostic précis. Parmi les marqueurs spécifiques, l’analyse du liquide céphalorachidien permet de déceler les substances résultant des lésions caractéristiques de la maladie, à savoir le peptide amyloïde, la protéine tau totale et sa variante phosphorylée, sans toutefois en dévoiler la topographie régionale. La TEP amyloïde est également recommandée en pratique clinique si elle est disponible car, au stade où le patient commence à avoir des troubles cognitifs, la protéine amyloïde doit être présente dans le cortex cérébral. L’examen est sans risques, facile à réaliser et à interpréter. La place de la TEP-TDM ou de l’IRM utilisant des traceurs pour la protéine tau est à l’étude, mais il faudra encore un certain temps avant de clarifier ses indications en pratique clinique. Des données préliminaires montrent qu’il s’agit sans doute d’un meilleur marqueur de l’évolution de la maladie d’Alzheimer que la TEP amyloïde.8
Le choix d’un biomarqueur plutôt qu’un autre dépend également de la présence de contre-indications médicales (par exemple certains stimulateurs cardiaques pour l’IRM) et du choix du patient qui, bien souvent, tend, dans la mesure du possible, à éviter les méthodes réputées « invasives » comme la ponction lombaire, même si les effets indésirables de celle-ci sont rares et mineurs.9 Par ailleurs, dans le cadre d’une procédure diagnostique, le nombre de TEP utilisant des isotopes radioactifs est limité, pour des raisons d’exposition, à quatre par an. Indépendamment des indications médicales stricto sensu, le choix des biomarqueurs reste encore largement déterminé par la disponibilité, les compétences techniques et le coût. Les traceurs amyloïdes ont été homologués par les autorités américaines (Food and Drug Administration) et européennes (European Medical Agency), mais ils sont encore peu utilisés en dehors des centres de recherche car ils sont chers et souvent à la charge du patient. Les mesures de l’atrophie cérébrale en IRM ou d’hypométabolisme en TEP sont plus précises si elles sont quantifiées (offrant alors l’avantage d’un contrôle possible de l’évolution dans le futur), mais les logiciels nécessaires pour obtenir ces mesures quantitatives ne sont pas encore à la portée de tous. Enfin, l’analyse du liquide céphalorachidien obtenu par ponction lombaire est à la portée de tout service de neurologie et elle est moins chère que l’imagerie moléculaire par TEP. En revanche, l’analyse des biomarqueurs dans le liquide céphalorachidien implique des conditions strictes de prélèvement (pas de contamination avec du sang, tubes de prélèvement adéquats) et elle nécessite des laboratoires de référence à même d’interpréter correctement les résultats.
Annonce du diagnostic de maladie d’Alzheimer prodromale
Une étape très importante dans ce parcours est l’annonce du diagnostic de maladie d’Alzheimer, après avoir pris connaissance des résultats des biomarqueurs. Beaucoup craignent que la connaissance d’un tel diagnostic ne soit pas souhaitable pour des raisons à la fois pratiques et éthiques. Sur le plan pratique, d’aucuns ont invoqué l’impossibilité d’être certain de l’évolution et la futilité d’un tel diagnostic car de toute façon « il n’y a rien à faire ». En ce qui concerne le premier point, la prédiction de l’évolution sur une période de 5 ans chez les patients ayant des troubles cognitifs légers est suffisamment précise si l’on utilise les biomarqueurs pour avoir des conséquences concrètes sur l’organisation de la vie du patient. Quant à la futilité supposée du diagnostic, s’il faut reconnaître qu’il n’y a pas de « pilule magique », il est inexact qu’aucune mesure n’est utile. Des études récentes montrent que des changements des habitudes de vie (plus d’activité physique, cognitive et une diète plus adéquate) ont un impact significatif sur le déclin cognitif.10 Qui plus est, cette attitude défaitiste fait fi de la demande légitime du patient de connaître son état de santé. Les questions éthiques évoquées incluent les effets psychologiques potentiellement dévastateurs et la possibilité qu’un tel diagnostic mène à la stigmatisation.
Bien que l’on puisse penser que l’annonce d’une maladie d’Alzheimer constitue un choc sérieux, menaçant d’entraîner un effondrement psychologique et pouvant éventuellement pousser la personne à des actions extrêmes comme le suicide, de tels cas sont très rares. Souvent, les patients qui fréquentent une clinique de la mémoire à la recherche d’une explication de leurs défaillances cognitives sont déjà déprimés et, paradoxalement, se sentent libérés de savoir qu’il existe une cause spécifique à leur souffrance, même s’il n’existe aucun traitement curatif. Enfin, comme dans le cas d’autres pathologies sérieuses, les gens mettent en place des stratégies pour « faire face » à la maladie, et c’est exactement ce qu’il se passe chez les patients ayant reçu un diagnostic de maladie d’Alzheimer. Dans une étude réalisée en Belgique, les patients ayant reçu un diagnostic de maladie d’Alzheimer et leurs proches déclaraient avoir une meilleure qualité de vie 6 mois après le diagnostic, lorsqu’un suivi et des mesures de soutien avaient été mises en place.11
Il faut toutefois être vigilant pour ne pas lier automatiquement le diagnostic de maladie d’Alzheimer à un état d’incompétence juridique dans divers domaines, tels que conduire un véhicule ou signer des actes notariés. La divulgation du diagnostic de la maladie d’Alzheimer à la personne qui n’est pas encore atteinte de démence est un sujet sensible. Il est préférable de confier cette tâche délicate à des professionnels expérimentés, bénéficiant du travail d’équipe dans les cliniques de la mémoire. Des programmes de suivi et de conseils appropriés doivent être mis en place pour tous les patients ayant des troubles cognitifs légers et des biomarqueurs positifs de la maladie d’Alzheimer. La possibilité de participer à des essais cliniques avec de nouveaux médicaments pouvant avoir un impact sur l’évolution de la maladie devrait être offerte à tous ceux qui le veulent. Des conseils sur les changements de mode de vie, susceptibles d’avoir un impact positif sur le risque de développer une démence, devraient être fournis. Dans l’idéal, le médecin devrait amener le patient à accepter d’impliquer un membre de sa famille ou un ami proche, afin d’avoir un soutien essentiel pour l’avenir.
Bien que l’on puisse penser que l’annonce d’une maladie d’Alzheimer constitue un choc sérieux, menaçant d’entraîner un effondrement psychologique et pouvant éventuellement pousser la personne à des actions extrêmes comme le suicide, de tels cas sont très rares. Souvent, les patients qui fréquentent une clinique de la mémoire à la recherche d’une explication de leurs défaillances cognitives sont déjà déprimés et, paradoxalement, se sentent libérés de savoir qu’il existe une cause spécifique à leur souffrance, même s’il n’existe aucun traitement curatif. Enfin, comme dans le cas d’autres pathologies sérieuses, les gens mettent en place des stratégies pour « faire face » à la maladie, et c’est exactement ce qu’il se passe chez les patients ayant reçu un diagnostic de maladie d’Alzheimer. Dans une étude réalisée en Belgique, les patients ayant reçu un diagnostic de maladie d’Alzheimer et leurs proches déclaraient avoir une meilleure qualité de vie 6 mois après le diagnostic, lorsqu’un suivi et des mesures de soutien avaient été mises en place.11
Il faut toutefois être vigilant pour ne pas lier automatiquement le diagnostic de maladie d’Alzheimer à un état d’incompétence juridique dans divers domaines, tels que conduire un véhicule ou signer des actes notariés. La divulgation du diagnostic de la maladie d’Alzheimer à la personne qui n’est pas encore atteinte de démence est un sujet sensible. Il est préférable de confier cette tâche délicate à des professionnels expérimentés, bénéficiant du travail d’équipe dans les cliniques de la mémoire. Des programmes de suivi et de conseils appropriés doivent être mis en place pour tous les patients ayant des troubles cognitifs légers et des biomarqueurs positifs de la maladie d’Alzheimer. La possibilité de participer à des essais cliniques avec de nouveaux médicaments pouvant avoir un impact sur l’évolution de la maladie devrait être offerte à tous ceux qui le veulent. Des conseils sur les changements de mode de vie, susceptibles d’avoir un impact positif sur le risque de développer une démence, devraient être fournis. Dans l’idéal, le médecin devrait amener le patient à accepter d’impliquer un membre de sa famille ou un ami proche, afin d’avoir un soutien essentiel pour l’avenir.
Recourir à des centres spécialisés
Les marqueurs biologiques de la maladie d’Alzheimer commencent à être utilisés en pratique clinique par des centres spécialisés dits « cliniques de la mémoire » afin de poser un diagnostic au stade prodromal. Les nouveaux critères de diagnostic de la maladie d’Alzheimer recommandent une utilisation clinique, même si plusieurs obstacles subsistent à un usage courant (disponibilité, standardisation, remboursement). Malgré la recommandation d’utiliser les biomarqueurs chez les patients avec troubles cognitifs légers consultant pour ce motif, il apparaît pertinent de restreindre l’utilisation de ces méthodes aux centres spécialisés. En dehors du diagnostic précoce, les marqueurs biologiques sont utiles dans le diagnostic différentiel entre la maladie d’Alzheimer et d’autres affections.
Références
1. Petersen RC, Smith GE, Waring SC, Ivnik RJ, Tangalos EG, Kokmen E. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999;56:303-8.
2. Albert MS, DeKosky ST, Dickson D, et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011;7:270-9.
3. Dartigues JF, Helmer C, Letenneur L, et al. Paquid 2012: illustration and overview. Geriatr Psychol Neuropsychiatr Vieil 2012;10:325-31.
4. Amieva H, Mokri H, Le Goff M, et al. Compensatory mechanisms in higher- educated subjects with Alzheimer’s disease: a study of 20 years of cognitive decline. Brain 2014;137:1167-75.
5. Vannini P, Amariglio R, Hanseeuw B, et al. Memory self-awareness in the preclinical and prodromal stages of Alzheimer’s disease. Neuropsychologia 2017;99:343-9.
6. Porteri C, Albanese E, Scerri C, et al.; Geneva Task Force for the Roadmap of Alzheimer’s Biomarkers. The biomarker-based diagnosis of Alzheimer’s disease. 1-ethical and societal issues. Neurobiol Aging 2017;52:132-40.
7. Hanseeuw B, Dricot L, Lhommel R, Quenon L, Ivanoiu A. Patients with amyloid-negative mild cognitive impairment have cortical hypometabolism but the hippocampus is preserved. J Alzheimers Dis 2016;53:651-60.
8. Hanseeuw BJ, Betensky RA, Jacobs HIL, et al. Association of amyloid and tau with cognition in preclinical alzheimer disease: a longitudinal study. JAMA Neurol 2019. doi: 10.1001/jamaneurol.2019.1424.
9. Engelborghs S, Niemantsverdriet E, Struyfs H, et al. Consensus guidelines for lumbar puncture in patients with neurological diseases. Alzheimers Dement (Amst) 2017;8:111-26.
10. Ngandu T, Lehtisalo J, Solomon A, et al. A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial. Lancet 2015;385:2255-63.
11. Mets T, De Deyn PP, Pals P, et al.; COGNOS group. COGNOS: care for people with cognitive dysfunction: a national observational study. Alzheimer Dis Assoc Disord 2013;27:123-32.
2. Albert MS, DeKosky ST, Dickson D, et al. The diagnosis of mild cognitive impairment due to Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. Alzheimers Dement 2011;7:270-9.
3. Dartigues JF, Helmer C, Letenneur L, et al. Paquid 2012: illustration and overview. Geriatr Psychol Neuropsychiatr Vieil 2012;10:325-31.
4. Amieva H, Mokri H, Le Goff M, et al. Compensatory mechanisms in higher- educated subjects with Alzheimer’s disease: a study of 20 years of cognitive decline. Brain 2014;137:1167-75.
5. Vannini P, Amariglio R, Hanseeuw B, et al. Memory self-awareness in the preclinical and prodromal stages of Alzheimer’s disease. Neuropsychologia 2017;99:343-9.
6. Porteri C, Albanese E, Scerri C, et al.; Geneva Task Force for the Roadmap of Alzheimer’s Biomarkers. The biomarker-based diagnosis of Alzheimer’s disease. 1-ethical and societal issues. Neurobiol Aging 2017;52:132-40.
7. Hanseeuw B, Dricot L, Lhommel R, Quenon L, Ivanoiu A. Patients with amyloid-negative mild cognitive impairment have cortical hypometabolism but the hippocampus is preserved. J Alzheimers Dis 2016;53:651-60.
8. Hanseeuw BJ, Betensky RA, Jacobs HIL, et al. Association of amyloid and tau with cognition in preclinical alzheimer disease: a longitudinal study. JAMA Neurol 2019. doi: 10.1001/jamaneurol.2019.1424.
9. Engelborghs S, Niemantsverdriet E, Struyfs H, et al. Consensus guidelines for lumbar puncture in patients with neurological diseases. Alzheimers Dement (Amst) 2017;8:111-26.
10. Ngandu T, Lehtisalo J, Solomon A, et al. A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER): a randomised controlled trial. Lancet 2015;385:2255-63.
11. Mets T, De Deyn PP, Pals P, et al.; COGNOS group. COGNOS: care for people with cognitive dysfunction: a national observational study. Alzheimer Dis Assoc Disord 2013;27:123-32.