Il s’agit d’une maladie sporadique, mais il existe environ 5 % de formes génétiques, suspectées lorsque la maladie débute avant 40 ans ou avant 50 ans en présence d’antécédents familiaux. La transmission peut être autosomique dominante, mais plus fréquemment elle est autosomique récessive. Il s’agit en règle générale de formes qui débutent plus jeune et pouvant être plus sévères.
Il est aujourd’hui reconnu que des facteurs environnementaux tels que les pesticides représentent un facteur de risque de développer la maladie. Depuis 2012, la maladie de Parkinson peut être déclarée maladie professionnelle, au titre du tableau 58 du régime agricole.
Tous les patients ne tremblent pas
Classiquement, on décrit une triade motrice, parfois incomplète, qui associe :
– le tremblement de repos, unilatéral ou asymétrique, pouvant toucher les quatre membres, les lèvres ou le menton mais épargnant le chef, s’aggravant avec les émotions et disparaissant à l’action. Il est particulièrement visible au niveau de la main du patient lorsqu’il marche, avec un mouvement d’émiettement entre le pouce et l’index. Il est quasi pathognomonique mais pas systématiquement présent : il est même absent chez près d’un tiers des patients, notamment en début de maladie ;3
– l’akinésie, qui correspond à la difficulté à initier le mouvement, se caractérise par une lenteur (bradykinésie) et une perte d’amplitude (hypokinésie) dans l’exécution des mouvements. Elle se traduit par une pauvreté des mouvements spontanés, une perturbation des mouvements fins, comme l’écriture qui devient micrographique. Elle entraîne également une altération de la qualité de la marche, avec une difficulté au démarrage, une diminution de l’amplitude des pas réalisant une marche à petits pas avec un demi-tour décomposé. Enfin, le visage prend un aspect de faciès figé (amimie) : raréfaction du clignement et bouche entrouverte ;
– la rigidité de type plastique, avec une raideur des membres ou du cou, cédant par à-coups en roue dentée, renforcée par la manœuvre de Froment (mouvement actif avec le membre controlatéral). Une attitude antéfléchie du tronc et, à la marche, une perte du ballant des bras sont observées.
Ces symptômes moteurs répondent bien aux traitements ; cette caractéristique a même été intégrée dans les derniers critères diagnostiques de la maladie.4
Ne pas négliger les symptômes non moteurs
- troubles de l’olfaction (baisse ou perte de l’odorat) ;
- troubles gastro-intestinaux (constipation réfractaire, dysgueusie, hypersalivation) ;
- troubles du sommeil (sommeil agité avec mouvements et cris qui surviennent pendant le sommeil paradoxal, lié à une perte de l’atonie musculaire. Les patients ont des comportements moteurs complexes et « vivent leurs rêves » de manière parfois très violente, ce qui peut être source de mise en danger pour eux-mêmes et pour leurs partenaires. Il existe aussi fréquemment une somnolence diurne favorisée par un sommeil de mauvaise qualité en raison d’éveils et/ou de troubles de l’endormissement, de troubles respiratoires à type d’apnées, d’une nycturie ou d’un syndrome des jambes sans repos) ;
- douleurs pouvant être musculo-squelettiques (souvent secondaires au syndrome akinéto-rigide) ou douleurs dystoniques, neuropathiques... La douleur à l’épaule est parmi les plus fréquentes et est parfois un signe révélateur ;
- symptômes neuropsychiatriques (troubles anxiodépressifs, apathie, hallucinations, troubles obsessionnels et troubles cognitifs).
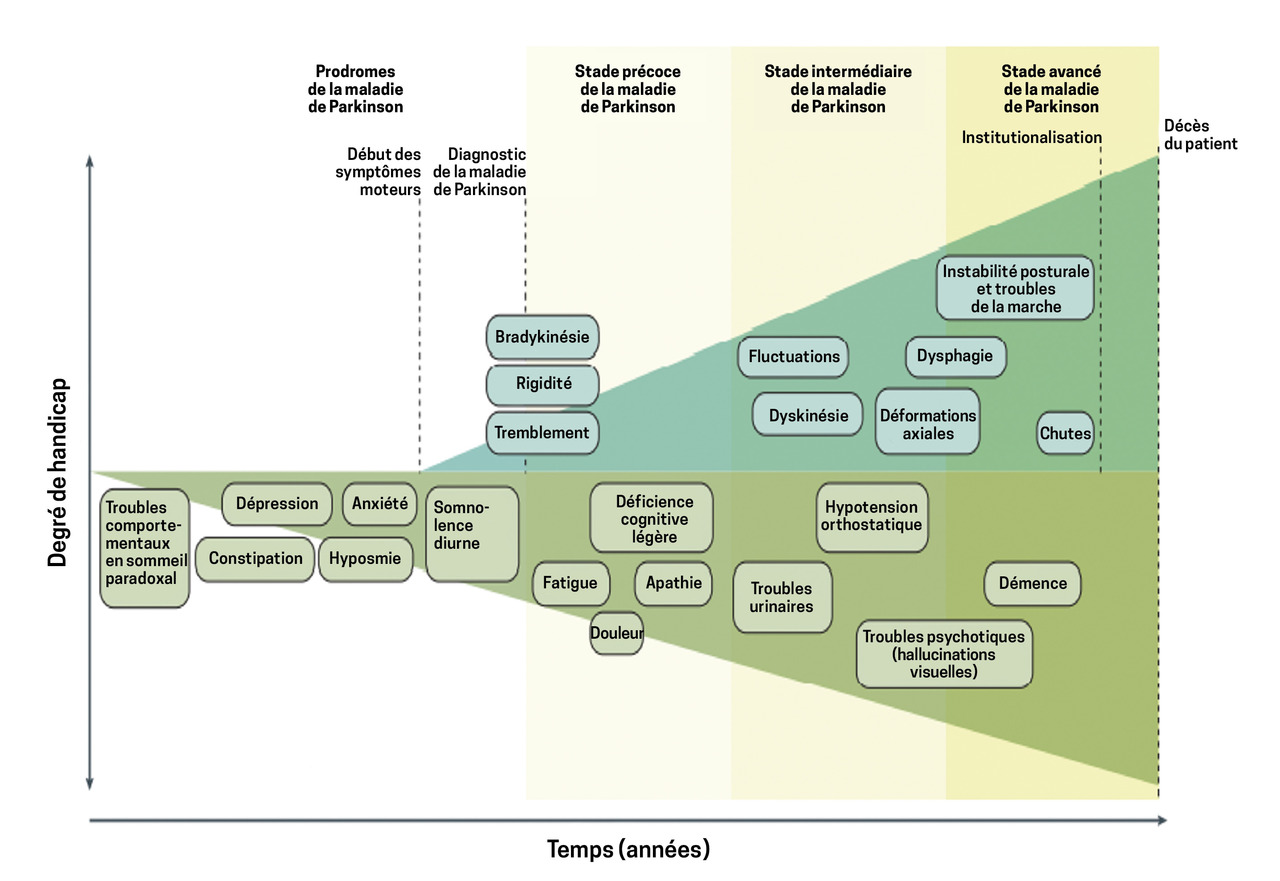
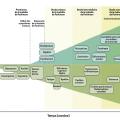
Une évolution en plusieurs phases
Les signes prodromaux tels que l’hyposmie, la constipation ou les troubles du comportement en sommeil paradoxal débuteraient plusieurs années, voire plusieurs dizaines d’années, avant les premiers symptômes moteurs, qui conduisent généralement au diagnostic.
Une fois les premières lignes thérapeutiques initiées, il existe une phase d’état durant laquelle les patients ressentent une amélioration, du fait de l’efficacité du traitement dopaminergique.
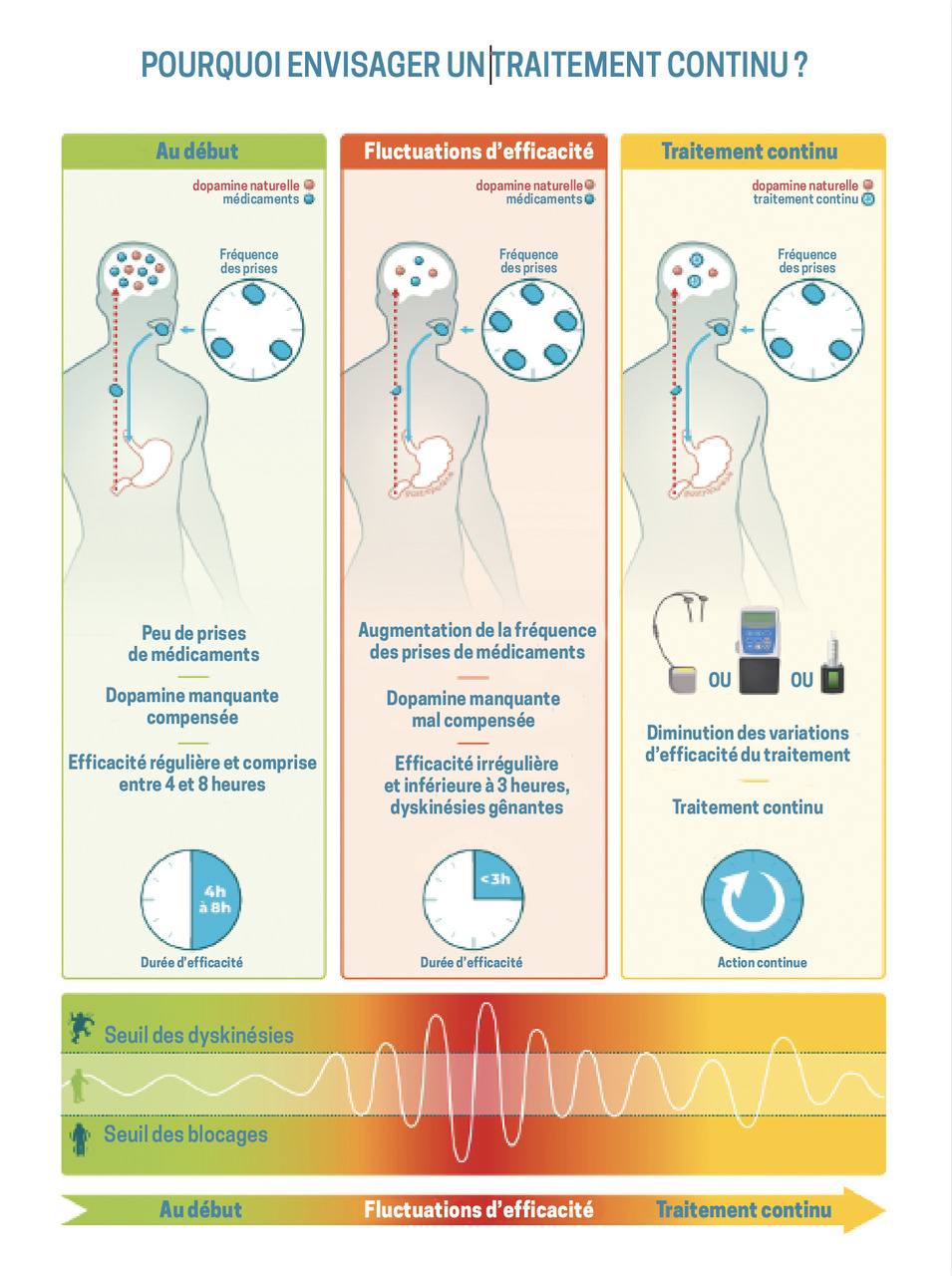
Après plusieurs années de traitement, apparaissent les complications motrices liées au caractère pulsatile du traitement par lévodopa :
• fluctuations d’efficacité du traitement (akinésie de fin de dose, akinésies nocturne et matinale, imprévisibilité de la réponse et phénomène on/off*) ;
• dyskinésies (mouvements anormaux involontaires touchant le tronc, les membres et le visage), qui correspondent au pic de concentration plasmatique des traitements.
À un stade avancé de la maladie, le patient entre dans la phase de déclin moteur et cognitif. Il existe au premier plan des signes moteurs axiaux non sensibles à la lévodopa : dysarthrie, dysphagie, troubles posturaux (attitude en triple flexion, camptocormie, syndrome de Pise) et troubles de la marche (freezing, festination). Sur le plan cognitif, les patients développent un syndrome dysexécutif pouvant évoluer jusqu’à une démence. À ce stade, les traitements dopaminergiques peuvent favoriser les psychoses et les hallucinations. L’existence de troubles cognitifs est l’un des symptômes les plus handicapants dans la maladie de Parkinson, menant à l’institutionnalisation.
une prise en charge personnalisée
Une prise en charge multidisciplinaire doit s’organiser avec les autres professionnels de santé (kinésithérapeute, orthophoniste, ergothérapeute, psychologue...) [
La stimulation cognitive du patient et la prise en charge psychologique sont fondamentales pour le patient et son entourage. Il existe des programmes d’éducation thérapeutique permettant aux patients d’acquérir des compétences pour gérer au mieux leur vie avec la maladie et pour maintenir ou pour améliorer leur qualité de vie. Le médecin généraliste est souvent le premier interlocuteur et constitue le pilier central de cette prise en charge sur mesure ; c’est également à lui d’aider le patient dans les démarches administratives et de réaliser la demande d’affection de longue durée.
Traitements médicamenteux
Parmi les traitements, on distingue d’abord ceux de première ligne, qui permettent de contrôler les symptômes de la maladie pendant plusieurs années.
Les traitements de seconde ligne visent, eux, à limiter les complications motrices et reposent sur le principe de la stimulation dopaminergique continue (
Quels effets indésirables ?
Cette même stratégie s’applique en cas d’hallucinations visuelles, et des traitements spécifiques doivent être proposés pour les symptômes anxiodépressifs et les troubles du sommeil.
Des pistes thérapeutiques prometteuses
La recherche dans le domaine est très active. L’enjeu est de cibler les processus physiopathologiques dès les premiers stades de la maladie ; pour cela, de nombreux travaux cherchent à identifier des biomarqueurs biologiques ou d’imagerie qui permettraient un diagnostic plus précoce.
En outre, l’administration d’anticorps anti-alpha-synucléine, protéine à l’origine de la neurodégénérescence, est l’une des principales pistes, tout comme l’administration de facteurs à visée neuroprotectrice.
Précautions concernant la conduite automobile
L’arrêté du 28 mars 2022 mentionne la maladie de Parkinson dans la liste des affections potentiellement incompatibles avec le maintien du permis de conduire.
Aucune disposition légale n’oblige un patient à rendre son permis de conduire. Toutefois, en raison du ralentissement moteur, des troubles cognitifs et de la somnolence, il est essentiel d’en discuter avec le patient et ses proches.
Le neurologue peut donner son avis à propos de l’impact de la maladie sur la capacité à conduire.
Dans le cadre d’une démarche volontaire, le patient peut consulter un médecin agréé par la préfecture pour statuer sur l’aptitude ou l’inaptitude à la conduite automobile.
Que dire à vos patients ?
La maladie de Parkinson ne nécessite pas d’examens complémentaires pour poser le diagnostic, qui repose sur un faisceau d’arguments cliniques.
La maladie de Parkinson ne touche pas que les sujets âgés et il existe autant de formes de la maladie que de patients.
Il existe des centres experts Parkinson qui peuvent aider à la prise en charge médicamenteuse et non médicamenteuse, avec des programmes d’éducation thérapeutique et l’accès à des protocoles de recherche clinique pour les patients souhaitant bénéficier de thérapies innovantes.
L’association France Parkinson, créée en 1984, apporte des informations aux patients et à leurs aidants (https://www.franceparkinson.fr).
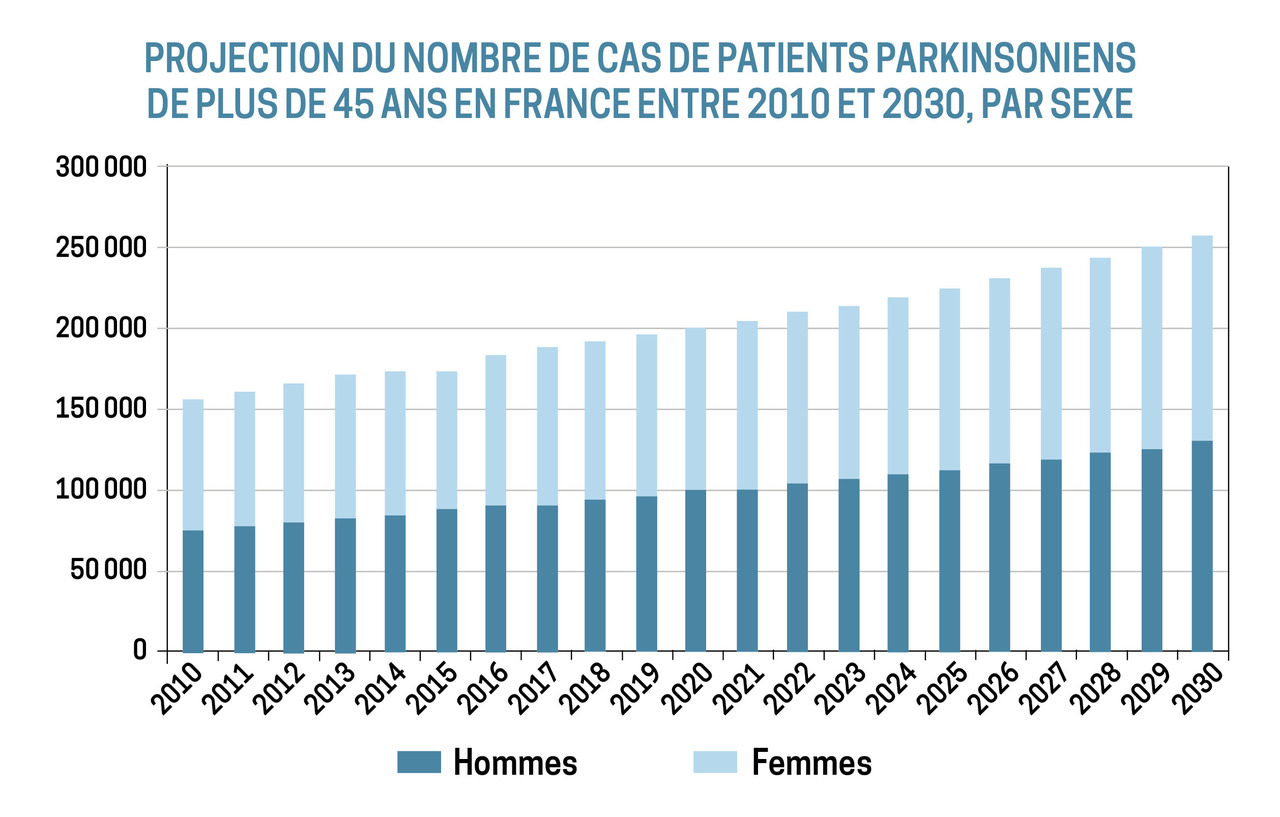
2. Moisan F, Wanneveich M, Kab S, Moutengou E, Boussac-Zarebska M, Caracaillon Bentatata L et al. Fréquence de la maladie de Parkinson en France en 2015 et évolution jusqu’en 2030. Bulletin épidémiologique hebdomadaire. 2018 ;(8-9) :128-40. http://invs.santepubliquefrance.fr/beh/2018/8-9/2018_8-9_1.htlm
3. Alty JE et Kempster PA. A Practical Guide to the Differential Diagnosis of Tremor. Postgraduate Medical Journal 2011;87(1031):623‑9.
4. Postuma RB, Berg D, Stern M, et al. MDS Clinical Diagnostic Criteria for Parkinson’s Disease: MDS-PD Clinical Diagnostic Criteria. Movement Disorders 2015;30(12):1591‑9.
5. Chaudhuri KR, Schapira A HV. Non-Motor Symptoms of Parkinson’s Disease: Dopaminergic Pathophysiology and Treatment. Lancet Neurol 2009;8(5):464‑74.
6. Poewe W, Seppi K, Tanner CM et al. Parkinson disease. Nature Reviews Disease Primers 2017;3:17013.
7. https://www.parkinsuite.fr/

 Encadrés
Encadrés