objectifs
Connaître les principaux agents infectieux causes de diarrhées. Reconnaître les signes de gravité d’une diarrhée infectieuse. Connaître les indications et savoir interpréter les résultats d’un examen bactériologique, virologique et parasitologique des selles. Connaître les principes des traitements des diarrhées infectieuses. Connaître les principes de prévention de la toxi-infection alimentaire et savoir la diagnostiquer. Connaître les principes de la conduite à tenir en cas de toxi-infection alimentaire familiale ou collective.
Connaître les principaux agents infectieux causes de diarrhées.
Reconnaître les signes de gravité d’une diarrhée infectieuse.
Connaître les indications et savoir interpréter les résultats d’un examen bactériologique, virologique et parasitologique des selles.
Connaître les principes des traitements des diarrhées infectieuses.
Connaître les principes de prévention de la toxi-infection alimentaire et savoir la diagnostiquer.
Connaître les principes de la conduite à tenir en cas de toxi-infection alimentaire familiale ou collective.
La définition du terme « diarrhée » est l’émission quotidienne trop fréquente de selles trop abondantes, liquides ou pâteuses, de poids supérieur à 300 grammes par jour.
Par extension et pour plus de praticité, on emploie le mot diarrhée dès lors qu’il existe plus de trois émissions de selles molles ou liquides par jour.
Le caractère aigu d’une diarrhée est défini par une durée de moins de 15 jours. À noter qu’au-delà d’un mois on qualifie la diarrhée de chronique.
Reconnaître les signes de gravité d’une diarrhée infectieuse.
Connaître les indications et savoir interpréter les résultats d’un examen bactériologique, virologique et parasitologique des selles.
Connaître les principes des traitements des diarrhées infectieuses.
Connaître les principes de prévention de la toxi-infection alimentaire et savoir la diagnostiquer.
Connaître les principes de la conduite à tenir en cas de toxi-infection alimentaire familiale ou collective.
La définition du terme « diarrhée » est l’émission quotidienne trop fréquente de selles trop abondantes, liquides ou pâteuses, de poids supérieur à 300 grammes par jour.
Par extension et pour plus de praticité, on emploie le mot diarrhée dès lors qu’il existe plus de trois émissions de selles molles ou liquides par jour.
Le caractère aigu d’une diarrhée est défini par une durée de moins de 15 jours. À noter qu’au-delà d’un mois on qualifie la diarrhée de chronique.
Diarrhée infectieuse
Environ 80 % des diarrhées aiguës sont d’origine infectieuse. Les autres origines sont ischémique, inflammatoire, médicamenteuse ou toxique.
On distingue deux grands cadres nosologiques qui diffèrent par leurs mécanismes, leurs symptomatologies et leurs agents responsables(tableau 1) .
On distingue deux grands cadres nosologiques qui diffèrent par leurs mécanismes, leurs symptomatologies et leurs agents responsables
Syndrome dysentérique d’origine bactérienne
Salmonella
Salmonella typhi et paratyphi A, B, C sont des entérobactéries responsables de pathologies d’importation : la fièvre typhoïde et la fièvre parathyphoïde. Ce sont des pathologies à déclaration obligatoire (DO). L’incubation varie de 10 à 20 jours. Durant la phase d’invasion, lors de la première semaine symptomatique, on constate l’installation de signes généraux : fièvre avec pouls dissocié, asthénie, amaigrissement, et des signes digestifs avec une tendance à la constipation et une splénomégalie. Suit la phase d’état où la fièvre culmine à 40 °C et où apparaissent un syndrome dysentérique, des signes neurologiques avec somnolence, insomnie, troubles de la vigilance (tuphos diurne), des signes cutanés dont l’apparition de macules rosées thoraco-abdominales. Le taux de mortalité en l’absence de traitement s’élève à 10 %.Le diagnostic s’effectue via des hémocultures (bactériémies prédominant lors de la première semaine) et des coprocultures (présence inconstante de la bactérie). La sérologie (test de Widal et Félix) ne doit plus être pratiquée car elle se positive tardivement et n’est pas spécifique.
Les céphalosporines de 3e génération sont le traitement probabiliste de première intention pour une durée de 5 jours.
Les fluoroquinolones sont le traitement préféré si la souche y est sensible pour une durée de 5 jours dans les formes simples et de 10 jours dans les formes compliquées.
En cas de formes sévères, une corticothérapie est indiquée.
La vaccination polysaccharidique via l’antigène capsulaire Vi est préconisée pour les voyageurs en zone endémique dans des conditions à risque et reste obligatoire pour les personnels de laboratoire.
Salmonella non typhique est fréquemment retrouvée dans les toxi-infections alimentaires collectives, avec un pic estival. Le délai d’incubation varie entre 12 et 48 heures. L’évolution est spontanément favorable.
Shigella
Le genre Shigella comporte 4 espèces : sonnei, dysenteriae, flexneri, et boydii. Le mode de transmission peut être interhumain par péril fécal ou par ingestion d’eau ou d’aliments souillés. L’incubation varie entre 24 et 72 heures. Elle peut se compliquer de syndrome hémorragique et urémique ou de mégacôlon toxique.Campylobacter jejuni
Il peut être responsable d’arthralgies ou bactériémies.La présentation peut, rarement, être un abdomen aigu ou une fausse invagination intestinale du nourrisson.
Yersinia enterocolitica ou paratuberculosis
La présentation clinique peut se résumer à une adénite mésentérique, à une douleur en fosse iliaque droite ou à des signes extradigestifs (rash cutané, érythème noueux, arthralgies, atteintes oculaires). Une bactériémie avec localisations secondaires peut survenir.Le diagnostic repose sur la coproculture. La sérologie aide au diagnostic des manifestations postinfectieuses.
Escherichia coli
Les formes dysentériques sont liées aux sérotypes entéro- invasifs et entéro-hémorragiques. Ils sont responsables de formes sévères, notamment chez l’enfant.Le sérotype le plus célèbre pourvoyeur de syndrome hémorragique et urémique est le O157, mais d’autres peuvent en être responsables.
Syndrome cholériforme d’origine bactérienne
Escherichia coli entérotoxinogène (ECET)
Ces entérobactéries sont responsables de la majorité des diarrhées lors de voyages tropicaux. Leur pathogénicité s’explique par la production d’une entérotoxine thermolabile ou thermostable. La symptomatologie évolue favorablement en 2 à 4 jours. Le diagnostic demeure clinique.Staphylococcus aureus
C’est un agent responsable de toxi-infections alimentaires collectivesVibrio cholerae
Les souches épidémiques, majoritairement retrouvées en Inde et en Afrique, relèvent des sérovars 01 et 0139. Le réservoir principal reste l’homme, à l’origine d’une transmission féco-orale directe ou indirecte (via l’eau). Il existe une phase d’infection où, après avoir été ingérés, les vibrions se multiplient et produisent une protéase ; puis une phase d’intoxication où la toxine pénètre l’entérocyte et perturbe le cycle de l’adénosine monophosphate (AMP) cyclique.Cliniquement, l’incubation se limite à 6 jours. La symptomatologie a pour caractéristique un début brutal, composée de diarrhées décrites en « eau de riz » afécales, grumeleuses, très abondantes et de vomissements en jets. Le tout suscite un risque élevé et rapide de déshydratation et de troubles hydro-électrolytiques qui signent la gravité du pronostic.
La confirmation diagnostique s’effectue par l’examen direct microbiologique des selles à l’état frais affichant des bacilles à Gram négatif de petite taille, curvilignes, et la mise en culture sur un milieu sélectif.
Les mesures d’hygiène sont alors primordiales : décontamination des selles et des vomissements, lavage des mains, isolement des malades.
Causes virales
Rotavirus
Ce virus non enveloppé à ARN fragmenté dont le groupe A est quasiment exclusif en France est responsable de la majorité des gastro-entérites, prédominant chez l’enfant avec un pic hivernal. La période de contagiosité s’étend jusqu'à 8 jours après la fin de la symptomatologie.Le diagnostic demeure clinique en pratique, mais la recherche des antigènes viraux par méthodes immuno-enzymatiques est possible.
La vaccination n’est plus recommandée en France depuis 2015 en raison de cas décrits d’invaginations intestinales.
Norovirus, astrovirus, adénovirus
De transmission féco-orale, ces virus sont responsables de tableau de gastro-entérites chez l’adulte comme chez l’enfant. Aucun examen complémentaire n’est requis.Virus de l’immunodéficience humaine (VIH)
Le VIH est un pourvoyeur direct de diarrhées qu’il faut savoir évoquer face à toute diarrhée chronique. L’immunodéficience induite par le VIH peut être responsable de multiples causes de diarrhées bactériennes (en particulier à Salmonella mais aussi à mycobactéries atypiques), virales (CMV, herpès), parasitaires (cryptosporidies, Isospora belli, Microsporidies) et fongiques (Candida, Histoplasma capsulatum).Causes parasitaires
Les parasitoses font partie des étiologies à évoquer devant un tableau de diarrhée aiguë, mais sont principalement la cause de diarrhées chroniques.
cryptosporidiose (Cryptosporidium spp) ;
isosporose (Isospora belli) ;
cyclosporose (Cyclospora cayetanensis) ;
microsporidiose (Enterocytozoon bieneusi, Encephalitozoon intestinalis).
Amibiase intestinale (Entamoeba histolytica)
La contamination s’effectue par ingestion de kystes dans un contexte d’hygiène précaire. Le tableau est le plus souvent celui d’une diarrhée subaïgue ou chronique, mais il existe un risque rare de dissémination hématogène avec localisations secondaires. Le tableau d’amibiase intestinale aiguë est marquée par des diarrhées glairo-sanglantes accompagnées de douleurs abdominales. Le diagnostic est réalisé par un examen parasitologie des selles où sont retrouvés trophozoïtes ou kystes. Le traitement repose sur le métronidazole.Giardiase (Giardia duodenalis, Giardia lamblia)
La contamination s’effectue aussi par ingestion de kystes, favorisée par un niveau d’hygiène précaire. L’incubation s’étend de 7 à 20 jours. Le tableau est variable : portage sain, diarrhées blanchâtres avec altération de l’état général. Le diagnostic s’opère par examen parasitologie des selles mettant en évidence des formes végétatives ou des kystes. Le traitement repose aussi sur le métronidazole.Autres
Citons aussi quelques parasites à suspecter chez l’immunodéprimé :cryptosporidiose (Cryptosporidium spp) ;
isosporose (Isospora belli) ;
cyclosporose (Cyclospora cayetanensis) ;
microsporidiose (Enterocytozoon bieneusi, Encephalitozoon intestinalis).
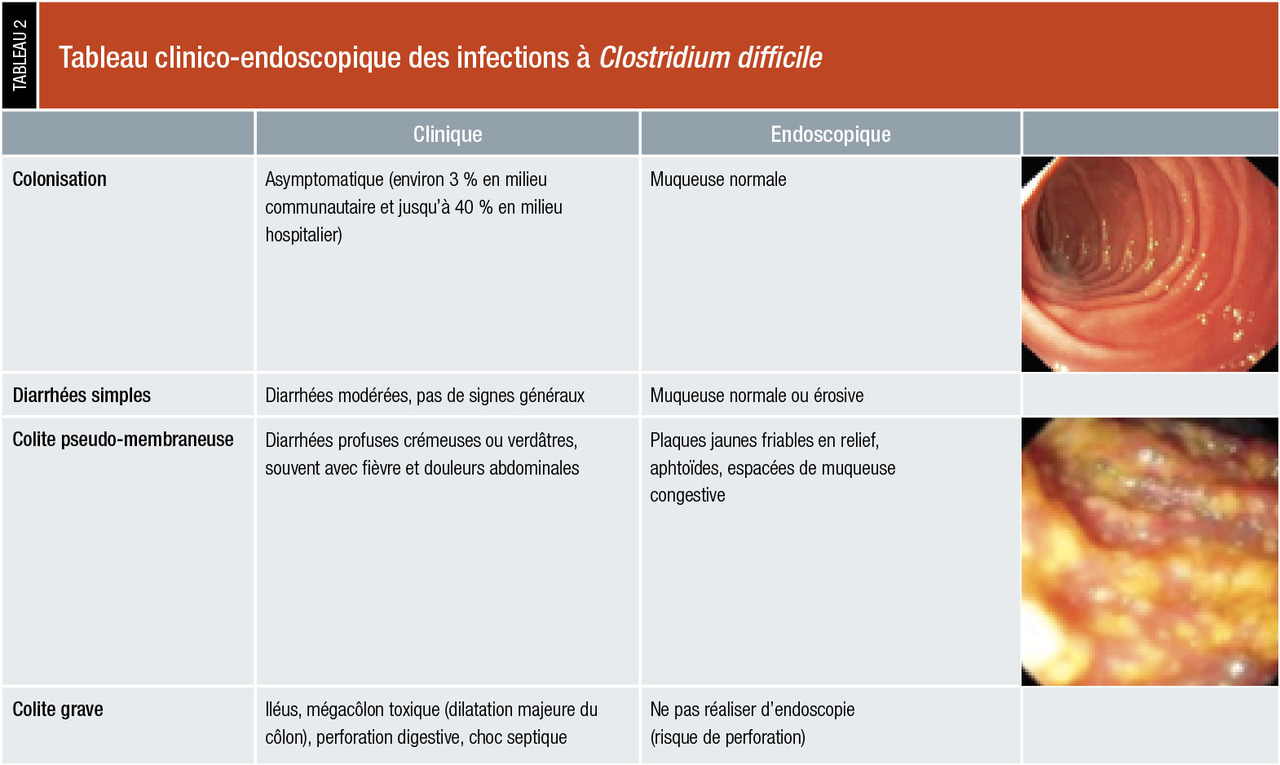
Diarrhées à Clostridium difficile
Clostridium difficile est une bactérie bacillaire à Gram positif, anaérobie stricte, sporulée.
C’est la première cause de diarrhées infectieuses liées aux soins. Ce germe représente la cause de 15 à 25 % des diarrhées post-antibiotiques. Le risque semble particulièrement élevé après la prise de céphalosporines, d’amoxicilline associée à de l’acide clavulanique, de clindamycine, et de quinolones.
Enfin, le déséquilibre de la flore intestinale à la suite de la prise d’antibiotiques est à l’origine de diarrhées infectieuses à d’autres germes comme Klebsiella oxytoca et Salmonella.
Il faut néanmoins savoir l’évoquer aussi en dehors du contexte nosocomial, car l’incidence des infections communautaires à Clostridium difficile croît.
Le pouvoir pathogène des toxines A (TcdA) et B (TcdB) s’explique par la destruction des jonctions serrées des entérocytes d’une part, et par l’inflammation de la muqueuse avec recrutement de polynucléaires et de monocytes, d’autre part.
(tableau 2) .
À noter que Clostridium difficile est responsable de 95 % des diarrhées pseudo-membraneuses.
Une diarrhée à Clostridium difficile doit faire rechercher des signes de gravité, et réciproquement un tableau de diarrhées avec des signes de sévérité doit faire rechercher ce germe.
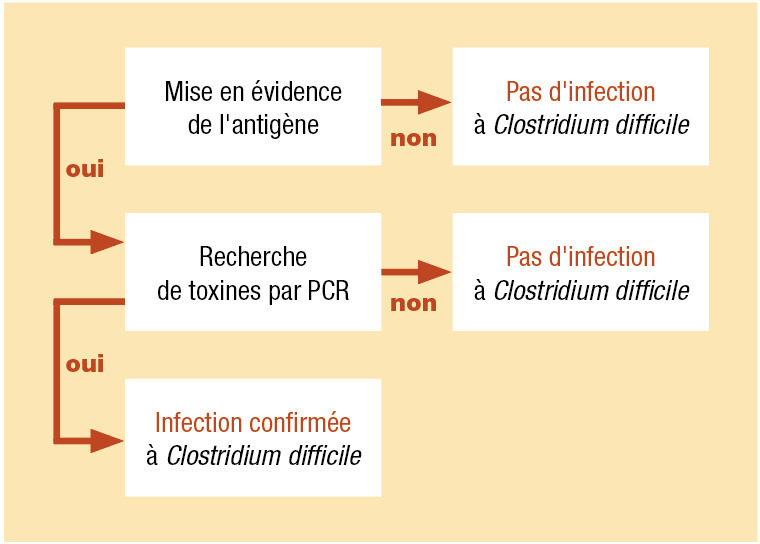
(fig. 1) .
(tableau 3) .
En cas d’infection symptomatique, des mesures de précaution complémentaire « contact » sont mises en place ainsi qu’un lavage des mains au savon (la solution hydro-alcoolique n’élimine pas les spores !) et un lavage de la chambre à l’eau de Javel (seul désinfectant actif sur les spores).
Quelle que soit la présentation clinique, les traitements ralentisseurs du transit sont strictement proscrits ! Et tout traitement par IPP doit être réévalué.
Il existe une résistance naturelle aux céphalosporines et aux fluoroquinolones (antibiotiques souvent prescrits dans le cadre de diarrhée infectieuse).
Le contrôle de l’absence de germe est inutile en fin de traitement.
Épidémiologie
Les facteurs de risque d’infections à Clostridium difficile sont l’âge supérieur à 65 ans, la prise d’antibiotiques, les hospitalisations, et tout facteur modifiant la flore ou la motilité intestinale.C’est la première cause de diarrhées infectieuses liées aux soins. Ce germe représente la cause de 15 à 25 % des diarrhées post-antibiotiques. Le risque semble particulièrement élevé après la prise de céphalosporines, d’amoxicilline associée à de l’acide clavulanique, de clindamycine, et de quinolones.
Enfin, le déséquilibre de la flore intestinale à la suite de la prise d’antibiotiques est à l’origine de diarrhées infectieuses à d’autres germes comme Klebsiella oxytoca et Salmonella.
Il faut néanmoins savoir l’évoquer aussi en dehors du contexte nosocomial, car l’incidence des infections communautaires à Clostridium difficile croît.
Physiopathologie
La transmission s’effectue par voie féco-orale soit directement par manuportage, soit via l’environnement (la résistance des spores explique ce mode de contamination fréquent).Le pouvoir pathogène des toxines A (TcdA) et B (TcdB) s’explique par la destruction des jonctions serrées des entérocytes d’une part, et par l’inflammation de la muqueuse avec recrutement de polynucléaires et de monocytes, d’autre part.
Clinique
La présentation clinique est variableÀ noter que Clostridium difficile est responsable de 95 % des diarrhées pseudo-membraneuses.
Une diarrhée à Clostridium difficile doit faire rechercher des signes de gravité, et réciproquement un tableau de diarrhées avec des signes de sévérité doit faire rechercher ce germe.
Diagnostic
Clostridium difficile doit être recherché devant toute diarrhée post-antibiotique, tout diarrhée hospitalière de plus de 3 jours, et devant toute diarrhée sans cause retrouvée chez les plus de 2 ansRécidive
Les récidives surviennent dans 20 % des cas. Le risque de récidive est majoré par le nombre d’épisodes (40 % après une première récidive, 60 % après deux ou plusieurs récidives). Les facteurs de risque reconnus de récidive sont : la poursuite de l’antibiothérapie inductrice et l’utilisation d’inhibiteurs de la pompe à protons (IPP).Traitement
Les formes asymptomatiques ne nécessitent pas d’antibiothérapieEn cas d’infection symptomatique, des mesures de précaution complémentaire « contact » sont mises en place ainsi qu’un lavage des mains au savon (la solution hydro-alcoolique n’élimine pas les spores !) et un lavage de la chambre à l’eau de Javel (seul désinfectant actif sur les spores).
Quelle que soit la présentation clinique, les traitements ralentisseurs du transit sont strictement proscrits ! Et tout traitement par IPP doit être réévalué.
Il existe une résistance naturelle aux céphalosporines et aux fluoroquinolones (antibiotiques souvent prescrits dans le cadre de diarrhée infectieuse).
Le contrôle de l’absence de germe est inutile en fin de traitement.
Signes de gravité d’une diarrhée infectieuse
Déshydratation
Chez l’adulte : une perte de poids dépassant les 10 %, une fièvre élevée ou une hypothermie, des signes de déshydratation (tableau 4) qu’ils soient intra- ou extracellulaires, une hypokaliémie pouvant se manifester par des crampes ou une acidose métabolique signent la gravité d’une diarrhée aiguë.
L’objectif est d’éviter toute déshydratation. Il faut donc repérer les facteurs de risque : âges extrêmes, prise de diurétiques, vomissements itératifs empêchant l’hydratation per os.
En pédiatrie : le réflexe à adopter est de peser l’enfant afin d’évaluer sa perte pondérale.
La prise en charge chez l’enfant nécessite à titre préventif un soluté de réhydratation orale dès que possible.
En cas de déshydratation modérée (perte de poids mesurée entre 5 et 10 %) déjà présente, le soluté de réhydratation orale s’impose.
Si une déshydratation sévère (perte pondérale dépassant les 10 %) est déjà installée, une hospitalisation est préconisée afin d’assurer une réhydratation parentérale. Après calcul des besoins volumiques, on administrera 50 % de la dose calculée sur les 6 premières heures puis le reste sur les 18 heures suivantes.
Le déficit hydrique = eau totale (natrémie observée - natrémie normale/natrémie normale)
= 0,6 poids x (natrémie observée - 140/140).
Par exemple, pour un sujet de 60 kg présentant une hypernatrémie à 150 mmol/L :
0,6 60 (150-140/140) = 2,6 L dont 1,3 L à passer sur les 6 premières heures.
L’objectif est d’éviter toute déshydratation. Il faut donc repérer les facteurs de risque : âges extrêmes, prise de diurétiques, vomissements itératifs empêchant l’hydratation per os.
En pédiatrie : le réflexe à adopter est de peser l’enfant afin d’évaluer sa perte pondérale.
La prise en charge chez l’enfant nécessite à titre préventif un soluté de réhydratation orale dès que possible.
En cas de déshydratation modérée (perte de poids mesurée entre 5 et 10 %) déjà présente, le soluté de réhydratation orale s’impose.
Si une déshydratation sévère (perte pondérale dépassant les 10 %) est déjà installée, une hospitalisation est préconisée afin d’assurer une réhydratation parentérale. Après calcul des besoins volumiques, on administrera 50 % de la dose calculée sur les 6 premières heures puis le reste sur les 18 heures suivantes.
Le déficit hydrique = eau totale (natrémie observée - natrémie normale/natrémie normale)
= 0,6 poids x (natrémie observée - 140/140).
Par exemple, pour un sujet de 60 kg présentant une hypernatrémie à 150 mmol/L :
0,6 60 (150-140/140) = 2,6 L dont 1,3 L à passer sur les 6 premières heures.
Colite aiguë grave
Il s’agit d’une réelle urgence thérapeutique.
Il est primordial de rechercher les critères de sévérité de sepsis dont les critères ont été modifiés lors du 3e consensus portant sur le sepsis*.
Un tableau pseudo-occlusif doit alerter sur une potentielle colite aiguë grave. Si celle-ci n’est pas compliquée, une prise en charge médicale exclusive peut être suffisante.
Une chirurgie doit être envisagée d’emblée en cas de rectorragies massives, de mégacôlon toxique, de perforation colique ou de péritonite.
Il est primordial de rechercher les critères de sévérité de sepsis dont les critères ont été modifiés lors du 3e consensus portant sur le sepsis*.
Un tableau pseudo-occlusif doit alerter sur une potentielle colite aiguë grave. Si celle-ci n’est pas compliquée, une prise en charge médicale exclusive peut être suffisante.
Une chirurgie doit être envisagée d’emblée en cas de rectorragies massives, de mégacôlon toxique, de perforation colique ou de péritonite.
Indications et interprétation des résultats d’un examen bactériologique, virologique et parasitologique des selles
Que rechercher et quand réaliser une coproculture ?
L’examen comprend une recherche de Salmonella, Shighella, Yersinia enterocolitica, et Campylobacter jejuni.
Il n’est indiqué que si le patient présente une immunodépression en particulier, des signes de gravité, un syndrome dysentérique, une toxi-infection alimentaire collective, au retour d’un voyage à l’étranger ou une diarrhée de plus de 3 jours.
Il n’est indiqué que si le patient présente une immunodépression en particulier, des signes de gravité, un syndrome dysentérique, une toxi-infection alimentaire collective, au retour d’un voyage à l’étranger ou une diarrhée de plus de 3 jours.
Quand demander la recherche de toxines produites par Clostridium difficile ?
C’est le cas devant des diarrhées dans les suites d’une antibiothérapie, d’épidémie, ou si la présentation clinique décline un tableau de colite pseudomembraneuse.
Quand réaliser une recherche de virus dans des selles ?
Chez l’immunocompétent, les examens virologiques n’ont d’intérêt qu’en épidémiologie (par exemple lors d’une épidémie dans une collectivité).
Chez l’immunodéprimé, la prescription se fait au cas par cas (polymerase chain reaction [PCR], cytomégalovirus [CMV]…).
Chez l’immunodéprimé, la prescription se fait au cas par cas (polymerase chain reaction [PCR], cytomégalovirus [CMV]…).
Quand et comment réaliser un examen parasitologique des selles ?
Il s’impose dans les suites d’un séjour en zone d’endémie de Giardia duodenalis et d’Entamoeba histolytica ou d’helminthes.
Il est réalisé chez le sujet immunodéprimé, à la recherche de cryptospordies, microsporidies, Isospora belli, Cyclospora cayetanensis, Giardia duodenalis.
La recherche comprend 3 prélèvements successifs.
Il est réalisé chez le sujet immunodéprimé, à la recherche de cryptospordies, microsporidies, Isospora belli, Cyclospora cayetanensis, Giardia duodenalis.
La recherche comprend 3 prélèvements successifs.
Quand réaliser un bilan biologique ?
Il n’est indiqué que si le patient présente une immunodépression, des signes de gravité, un syndrome dysentérique ou une diarrhée de plus de 3 jours.
On recherche :
des troubles ioniques (hypokaliémie, dysnatrémie) ;
une insuffisance rénale (principalement fonctionnelle) ;
une hémoconcentration ;
des hémocultures en cas de fièvre à la recherche de l’identification du germe.
Tout pic fébrile peut être documenté par une paire d’hémocultures.
On recherche :
des troubles ioniques (hypokaliémie, dysnatrémie) ;
une insuffisance rénale (principalement fonctionnelle) ;
une hémoconcentration ;
des hémocultures en cas de fièvre à la recherche de l’identification du germe.
Tout pic fébrile peut être documenté par une paire d’hémocultures.
Principes des traitements des diarrhées infectieuses
La prévention de la transmission croisée est fondamentale via des règles d’hygiène individuelle et collective (hygiène des mains, précautions complémentaires « contact »).
Le traitement symptomatique veillant à prévenir ou corriger des troubles hydro-électrolytiques est essentiel quel qu’en soit le mécanisme.
L’usage d’antisécrétoires prolongeant l’effet des enképhalines, type racécadotril est possible, mais son efficacité est discutée. Les ralentisseurs du transit sont strictement contre-indiqués en cas de syndrome dysentérique.
La place de l’antibiothérapie se résume aux diarrhées présentant des signes de gravité et aux syndromes dysentériques. Dans ces cas, de manière empirique, on privilégie les fluoroquinolones pour 3-5 jours.
Une seule prise d’antibiotiques (fluoroquinolones ou azithromycine) est nécessaire pour les syndromes cholériformes dont la symptomatologie n’est pas atténuée par des traitements symptomatiques seuls.
L’antibiothérapie peut aussi être adaptée si les résultats de microbiologie le permettent (cf.tableau 5, E. Pilly, 2016).
Le traitement symptomatique veillant à prévenir ou corriger des troubles hydro-électrolytiques est essentiel quel qu’en soit le mécanisme.
L’usage d’antisécrétoires prolongeant l’effet des enképhalines, type racécadotril est possible, mais son efficacité est discutée. Les ralentisseurs du transit sont strictement contre-indiqués en cas de syndrome dysentérique.
La place de l’antibiothérapie se résume aux diarrhées présentant des signes de gravité et aux syndromes dysentériques. Dans ces cas, de manière empirique, on privilégie les fluoroquinolones pour 3-5 jours.
Une seule prise d’antibiotiques (fluoroquinolones ou azithromycine) est nécessaire pour les syndromes cholériformes dont la symptomatologie n’est pas atténuée par des traitements symptomatiques seuls.
L’antibiothérapie peut aussi être adaptée si les résultats de microbiologie le permettent (cf.
Toxi-infection alimentaire collective
Une toxi-infection alimentaire collective (TIAC) est définie par l’existence d’au minimum 2 cas présentant la même symptomatologie, généralement digestive, dont l’origine peut être attribuée au même repas.
Épidémiologie
En 2014, 1 380 foyers de toxi-infection alimentaire collective ont été déclarés en France, affectant 12 109 personnes, dont 649 (5 %) ont été hospitalisées et 2 sont décédées (données Santé Publique France).
Dans près d’un quart des cas, aucun germe n’a été mis en évidence.
Dans près d’un quart des cas, aucun germe n’a été mis en évidence.
Physiopathologie
La source des toxi-infections alimentaires collectives provient d’aliments contaminés par des bactéries ou des toxines. La toxinogenèse peut se dérouler au sein de l’aliment (Bacillus cereus, Staphylococcus aureus) ou au niveau digestif (Clostridium perfringens).
Prévention
Les principes de base de prévention luttent contre les facteurs de risque de toxi-infection alimentaire collective : rupture de la chaîne du froid (p. ex. : réfrigérateur endommagé dont la surveillance répétée par des prises de température peut être un moyen de lutte), fautes lors de la préparation des aliments (p. ex : cuisinier présentant un panaris qui doit donc bénéficier d’un arrêt de travail jusqu’à résolution des symptômes) ou un délai dépassé entre la préparation et la consommation (la traçabilité de chaque étape tient alors un rôle primordial).
L’ensemble des moyens de prévention peut être décliné en 5 catégories :
le milieu : surfaces de travail lisses lavables et système d’évacuation des eaux ;
le matériel : pièce ou meuble réfrigéré, équipement lavable contrôlé et système de transport adapté ;
la main-d’œuvre : formation du personnel, visite médicale et accoutrement spécifique ;
les matières : agrément d’origine et conditionnement ;
la méthode : propreté, hygiène manuelle et gestion des déchets.
Enfin, le signalement de tout diagnostic de toxi-infection alimentaire collective permet de mener une enquête afin de définir la source et donc limiter le risque de transmission.
Le signalement et la déclaration sont obligatoires depuis 1997.
Le signalement, dans un premier temps, auprès du médecin de l’agence régionale de santé doit être effectué devant toute suspicion de toxi-infection alimentaire collective.
La notification se déroule ensuite après confirmation diagnostique, via une fiche spécifique (disponible sur le site internet de santepubliquefrance.fr et mise en exemple ci-dessus,(fig. 2) toujours auprès du médecin de l’agence régionale de santé.
L’ensemble des moyens de prévention peut être décliné en 5 catégories :
le milieu : surfaces de travail lisses lavables et système d’évacuation des eaux ;
le matériel : pièce ou meuble réfrigéré, équipement lavable contrôlé et système de transport adapté ;
la main-d’œuvre : formation du personnel, visite médicale et accoutrement spécifique ;
les matières : agrément d’origine et conditionnement ;
la méthode : propreté, hygiène manuelle et gestion des déchets.
Enfin, le signalement de tout diagnostic de toxi-infection alimentaire collective permet de mener une enquête afin de définir la source et donc limiter le risque de transmission.
Le signalement et la déclaration sont obligatoires depuis 1997.
Le signalement, dans un premier temps, auprès du médecin de l’agence régionale de santé doit être effectué devant toute suspicion de toxi-infection alimentaire collective.
La notification se déroule ensuite après confirmation diagnostique, via une fiche spécifique (disponible sur le site internet de santepubliquefrance.fr et mise en exemple ci-dessus,
Diagnostic
Le tableau clinique, le type d’aliments ingérés et le délai entre la prise alimentaire partagée et le début de la symptomatologie permettent fortement d’orienter l’étiologie de la toxi-infection alimentaire collective.
Un tableau de toxi-infection alimentaire digestive justifie des examens microbiologiques : coprocultures, examens des vomissements, hémocultures en cas de fièvre et analyse des aliments soupçonnés. Des analyses complémentaires peuvent être effectuées sur les selles selon le germe suspecté : recherche de toxine de Staphylococcus aureus, sérotypage en cas de Salmonella, PCR vérotoxines face à un Escherichia coli suspect d’être pourvoyeur d’un syndrome hémolytique et urémique.
Un tableau de toxi-infection alimentaire digestive justifie des examens microbiologiques : coprocultures, examens des vomissements, hémocultures en cas de fièvre et analyse des aliments soupçonnés. Des analyses complémentaires peuvent être effectuées sur les selles selon le germe suspecté : recherche de toxine de Staphylococcus aureus, sérotypage en cas de Salmonella, PCR vérotoxines face à un Escherichia coli suspect d’être pourvoyeur d’un syndrome hémolytique et urémique.
Étiologie
Les trois germes les plus fréquemment pourvoyeurs de toxi-infection alimentaire collective sont Salmonellae non typhi, Staphylococcus aureus et Clostridium perfringes (tableau 6) .
La découverte d’un staphylocoque doré doit amener à rechercher un portage cutané (narines, panaris, furoncle) chez le personnel.
La découverte d’un staphylocoque doré doit amener à rechercher un portage cutané (narines, panaris, furoncle) chez le personnel.
Conduite à tenir en cas de toxi-infection alimentaire familiale ou collective
Les TIAC font partie des maladies à déclaration obligatoire (art. 3113-1 du code de la santé publique) (tableau 7) .
L’antibiothérapie n’est indiquée qu’en cas d’immunodépression, de signes de gravité, ou de syndrome dysentérique.
L’antibiothérapie n’est indiquée qu’en cas d’immunodépression, de signes de gravité, ou de syndrome dysentérique.
Diarrhées du voyageur
La survenue de diarrhées aiguës lors de voyages (tropicaux ou non) a lieu jusque dans 50 % des cas si le séjour dure plus de 3 semaines.
Généralement sans gravité, elle doit nécessiter une consultation médicalisée chez les sujets d’âge extrême, en cas de tableau dysentérique ou de persistance au-delà de 24 heures ou de signes de gravité. Plus de la moitié des cas sont de cause bactérienne (Escherichia coli entérotoxinogène en tête).
Les indications des examens complémentaires (coprocultures, hémocultures) sont similaires au cadre des diarrhées aiguës sans contexte de voyage. Un syndrome dysentérique doit faire évoquer une Salmonella, un Campylobacter. Mais toute fièvre au retour d’un voyage en pays tropical impose la réalisation en urgence d’un frottis sanguin-goutte épaisse afin d’écarter le diagnostic d’un accès palustre potentiellement grave(tableau 8) !
La prévention repose sur des mesures de précaution : lavage des mains, eau filtrée, aliments cuits… L’antibiothérapie prophylactique ne doit être discutée qu’en cas de pathologies intestinales ou chez l’immunodéprimé sévère.
Le traitement est avant tout symptomatique (hydratation).
Il est important d’éduquer les voyageurs à l’interdiction de consommer des antidiarrhéiques moteurs en cas de syndrome dysentérique.
L’antibiothérapie reste indiquée seulement dans les formes cliniques moyennes ou sévères ou devant un tableau dysentérique(tableau 9). Elle peut être discutée en traitement minute (une seule prise de fluoroquinolones ou de macrolides) face à une diarrhée cholériforme s’étalant plus de 24 heures. Le cotrimoxazole peut être une alternative thérapeutique en cas d’échec d’une première ligne.
Diarrhées aiguës sans signe d’invasion muqueuse (gastro-entérites saisonnières et « turista ») 3e vague de réévaluation des médicaments par la Haute Autorité de santé, 2006.
Prise en charge clinique de la diarrhée aiguë par l’Organisation mondiale de la santé, 2004.
Actualisation des recommandations pour le traitement des infections à Clostridium difficile, ESCMID, 2014.
The third international consensus definitions for sepsis and septic shock. Mervyn Singer et al. JAMA 2016;315(8):801-10.
Recommandations sanitaires pour les voyageurs, BEH du 31 mai 2016.
Avis du Haut Conseil de la santé publique du 20 avril 2016.
Généralement sans gravité, elle doit nécessiter une consultation médicalisée chez les sujets d’âge extrême, en cas de tableau dysentérique ou de persistance au-delà de 24 heures ou de signes de gravité. Plus de la moitié des cas sont de cause bactérienne (Escherichia coli entérotoxinogène en tête).
Les indications des examens complémentaires (coprocultures, hémocultures) sont similaires au cadre des diarrhées aiguës sans contexte de voyage. Un syndrome dysentérique doit faire évoquer une Salmonella, un Campylobacter. Mais toute fièvre au retour d’un voyage en pays tropical impose la réalisation en urgence d’un frottis sanguin-goutte épaisse afin d’écarter le diagnostic d’un accès palustre potentiellement grave
La prévention repose sur des mesures de précaution : lavage des mains, eau filtrée, aliments cuits… L’antibiothérapie prophylactique ne doit être discutée qu’en cas de pathologies intestinales ou chez l’immunodéprimé sévère.
Le traitement est avant tout symptomatique (hydratation).
Il est important d’éduquer les voyageurs à l’interdiction de consommer des antidiarrhéiques moteurs en cas de syndrome dysentérique.
L’antibiothérapie reste indiquée seulement dans les formes cliniques moyennes ou sévères ou devant un tableau dysentérique
Diarrhées aiguës sans signe d’invasion muqueuse (gastro-entérites saisonnières et « turista ») 3e vague de réévaluation des médicaments par la Haute Autorité de santé, 2006.
Prise en charge clinique de la diarrhée aiguë par l’Organisation mondiale de la santé, 2004.
Actualisation des recommandations pour le traitement des infections à Clostridium difficile, ESCMID, 2014.
The third international consensus definitions for sepsis and septic shock. Mervyn Singer et al. JAMA 2016;315(8):801-10.
Recommandations sanitaires pour les voyageurs, BEH du 31 mai 2016.
Avis du Haut Conseil de la santé publique du 20 avril 2016.
* Mervyn Singer, et al. The third international consensus definitions for sepsis and septic shock, JAMA 2016;315(8):801-10.
TEXTES DE RECOMMANDATIONs
Laffont MA, Marchou B, Martin-Blondel G. Conduite à tenir devant une diarrhée du voyageur. Rev Prat 2015;65(4):503-8.
Lalande V, Eckert C, Barbut F. Colites à Clostridium difficile. Rev Prat 2015;65(1):21-5.
Diarrhées aiguës sans signe d’invasion muqueuse (gastro-entérites saisonnières et « turista ») 3e vague de réévaluation des médicaments par la Haute Autorité de santé, 2006.Prise en charge clinique de la diarrhée aiguë par l’Organisation mondiale de la santé, 2004.Actualisation des recommandations pour le traitement des infections à Clostridium difficile, ESCMID, 2014.The third international consensus definitions for sepsis and septic shock. Mervyn Singer et al. JAMA 2016;315(8):801-10.Recommandations sanitaires pour les voyageurs, BEH du 31 mai 2016.Avis du Haut Conseil de la santé publique du 20 avril 2016.
Lalande V, Eckert C, Barbut F. Colites à Clostridium difficile. Rev Prat 2015;65(1):21-5.
Diarrhées aiguës sans signe d’invasion muqueuse (gastro-entérites saisonnières et « turista ») 3e vague de réévaluation des médicaments par la Haute Autorité de santé, 2006.Prise en charge clinique de la diarrhée aiguë par l’Organisation mondiale de la santé, 2004.Actualisation des recommandations pour le traitement des infections à Clostridium difficile, ESCMID, 2014.The third international consensus definitions for sepsis and septic shock. Mervyn Singer et al. JAMA 2016;315(8):801-10.Recommandations sanitaires pour les voyageurs, BEH du 31 mai 2016.Avis du Haut Conseil de la santé publique du 20 avril 2016.