Une réanalyse des essais européens et américains aux résultats en apparence contradictoires et un nouvel essai britannique permettent de faire le point sur un dépistage controversé.
en débat
Avec 46 000 nouveaux cas et 8 700 décès en 2015, le cancer de la prostate reste le plus fréquent des cancers chez l’homme en France malgré la baisse de l’incidence observée depuis 2005. Le dépistage du cancer de la prostate par dosage sanguin de l’antigène spécifique de la prostate (PSA pour prostate specific antigen) est le sujet d’une controverse depuis plusieurs années. Défini par l’Organisation mondiale de la santé (OMS) dès 1970 comme une démarche de prévention secondaire,1 le dépistage consiste à identifier parmi des sujets asymptomatiques des porteurs d’une maladie. Les critères de justification d’un dépistage sont rappelés dans letableau 1 . La controverse sur le dépistage du cancer de la prostate était entretenue par les résultats de deux essais perçus comme contradictoires, l’un réalisé en Europe (ERSPC), l’autre aux États-Unis. Les données de ces deux essais ont été réanalysées2 et les résultats d’un troisième essai viennent d’être publiés.3 C’est le moment de faire le point.
Avec 46 000 nouveaux cas et 8 700 décès en 2015, le cancer de la prostate reste le plus fréquent des cancers chez l’homme en France malgré la baisse de l’incidence observée depuis 2005. Le dépistage du cancer de la prostate par dosage sanguin de l’antigène spécifique de la prostate (PSA pour prostate specific antigen) est le sujet d’une controverse depuis plusieurs années. Défini par l’Organisation mondiale de la santé (OMS) dès 1970 comme une démarche de prévention secondaire,1 le dépistage consiste à identifier parmi des sujets asymptomatiques des porteurs d’une maladie. Les critères de justification d’un dépistage sont rappelés dans le
Trois essais
Les résultats de trois essais réalisés en Europe, aux États-Unis et en Grande-Bretagne sont disponibles. Ces essais ont inclus respectivement environ 160 000, 77 000 et 410 000 personnes, invitées ou non à un dépistage du cancer de la prostate. Leurs caractéristiques sont résumées dans le tableau 2 . La population étudiée avait 55-69 ans, 55-74 ans ou 50-69 ans selon l’essai. Hormis dans l’essai britannique dans lequel le traitement était randomisé entre chirurgie, radiothérapie et surveillance active, la recommandation en cas de cancer de la prostate était la prostatectomie radicale.
Conciliation des données de l’essai européen et de l’essai américain
Les données de l’essai européen et de l’essai américain étaient considérées comme contradictoires car l’essai américain ne montrait pas de réduction significative de la mortalité par cancer de la prostate contrairement à l’essai européen.
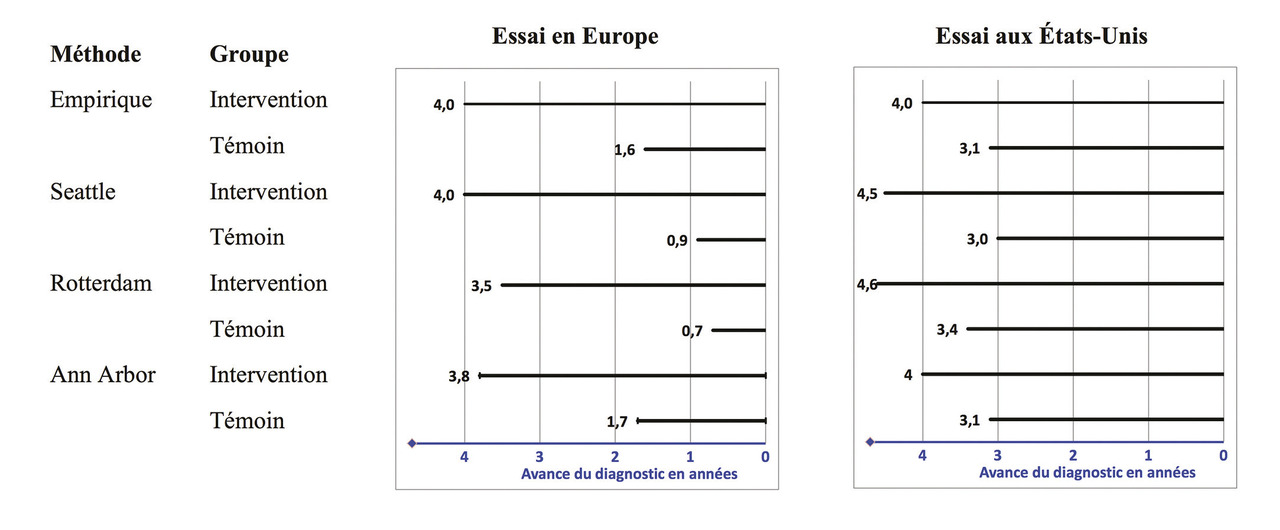
Une analyse conjointe des données individuelles des deux essais2 démontre la compatibilité de leurs résultats. Les auteurs ont d’abord homogénéisé le suivi en le tronquant à 11 ans dans chaque essai, car l’essai américain avait un suivi médian plus long que l’essai européen (12,5 ans vs 11 ans). L’avance du diagnostic, indicateur de l’intensité du dépistage, a été estimée d’une manière empirique par comparaison avec l’incidence du cancer de la prostate en 1986 dans le registre Surveillance, Epidemiology and End Results (registre SEER) aux États-Unis, et au moyen de trois modèles développés indépendamment par deux équipes américaines et une équipe hollandaise (Seattle, Ann Arbor et Rotterdam). Lafigure 1 montre ces estimations qui sont concordantes : l’avance du diagnostic dans le groupe témoin est beaucoup plus importante dans l’étude américaine que dans l’étude européenne. Cette avance du diagnostic dans le groupe témoin est un marqueur de contamination de ce groupe par le dépistage.
En effet, dans l’essai européen, le dosage du PSA était peu répandu au début de l’essai et la contamination du groupe témoin est inférieure à 15 %, alors que dans l’essai américain, au moins 45 % des participants avaient eu au moins un dosage du PSA avant inclusion et les participants du groupe témoin ont été dépistés en moyenne 2,7 fois pendant les 6 années de l’essai, le groupe intervention ayant un dépistage annuel. Quand on évalue la réduction de la mortalité par cancer de la prostate en ajustant sur cette avance du diagnostic, on montre que l’absence apparente de bénéfice du dépistage dans l’essai américain provient de la contamination du groupe témoin, très exposé au dépistage. Cette conciliation des essais américain et européens,2 en prenant en compte le poids de l’intensité du dépistage, a montré que le dépistage diminuait la mortalité par cancer de la prostate de 7 à 9 % par année d’avance au diagnostic, et ce quel que soit le bras de l’essai américain. D’après cette analyse, les deux essais vont donc dans le sens d’une amélioration du pronostic par le dépistage.
Une analyse conjointe des données individuelles des deux essais2 démontre la compatibilité de leurs résultats. Les auteurs ont d’abord homogénéisé le suivi en le tronquant à 11 ans dans chaque essai, car l’essai américain avait un suivi médian plus long que l’essai européen (12,5 ans vs 11 ans). L’avance du diagnostic, indicateur de l’intensité du dépistage, a été estimée d’une manière empirique par comparaison avec l’incidence du cancer de la prostate en 1986 dans le registre Surveillance, Epidemiology and End Results (registre SEER) aux États-Unis, et au moyen de trois modèles développés indépendamment par deux équipes américaines et une équipe hollandaise (Seattle, Ann Arbor et Rotterdam). La
En effet, dans l’essai européen, le dosage du PSA était peu répandu au début de l’essai et la contamination du groupe témoin est inférieure à 15 %, alors que dans l’essai américain, au moins 45 % des participants avaient eu au moins un dosage du PSA avant inclusion et les participants du groupe témoin ont été dépistés en moyenne 2,7 fois pendant les 6 années de l’essai, le groupe intervention ayant un dépistage annuel. Quand on évalue la réduction de la mortalité par cancer de la prostate en ajustant sur cette avance du diagnostic, on montre que l’absence apparente de bénéfice du dépistage dans l’essai américain provient de la contamination du groupe témoin, très exposé au dépistage. Cette conciliation des essais américain et européens,2 en prenant en compte le poids de l’intensité du dépistage, a montré que le dépistage diminuait la mortalité par cancer de la prostate de 7 à 9 % par année d’avance au diagnostic, et ce quel que soit le bras de l’essai américain. D’après cette analyse, les deux essais vont donc dans le sens d’une amélioration du pronostic par le dépistage.
Résultats de l’essai européen en fonction des centres
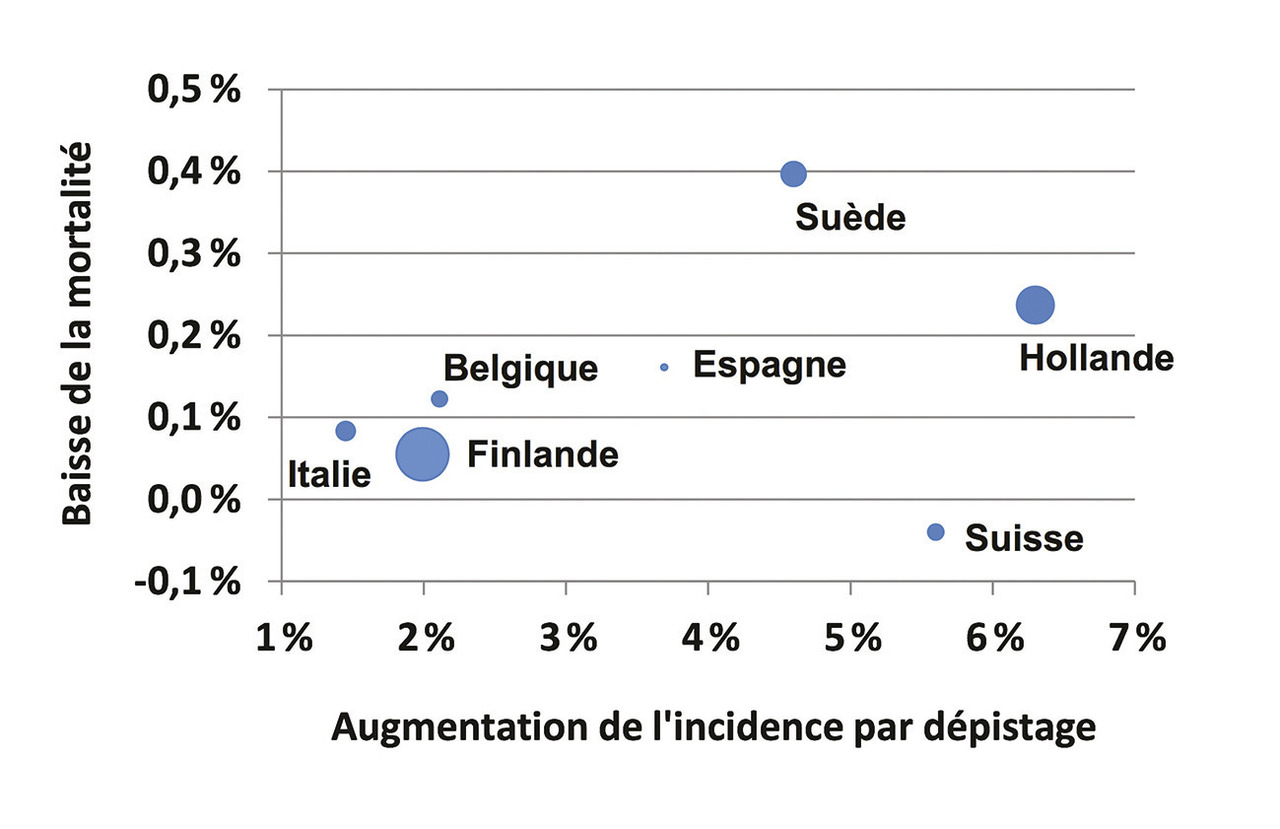
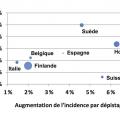
Les données de l’essai européen ont été présentées par centre de façon synthétique.4 Cette analyse permet de mettre en évidence une grande hétérogénéité des résultats ainsi que des méthodes en fonction des pays. Ces différences concernent aussi bien le seuil du PSA choisi, l’intervalle entre les dépistages, et la sélection des parti- cipants, rendant caduque l’interprétation globale de certains résultats sur l’essai entier. Le tableau 3 et la figure 2 montrent la réduction de la mortalité par cancer de la prostate dans le groupe dépistage comparé au groupe témoin, indicateur du bénéfice du dépistage, en fonction de la différence d’incidence du cancer de la prostate entre les deux groupes. La différence d’incidence entre les deux groupes, lue à la lumière de la réduction de la mortalité, peut être utilisée comme indicateur de surdiagnostic. Le surdiagnostic est le fait de diagnostiquer un cancer asymptomatique (principe du dépistage), qui n’évoluera jamais vers une forme symptomatique pendant la vie du patient et qui ne sera pas responsable de la mort du patient. Le surdiagnostic est principalement observé dans les cancers à évolution très lente lorsque le décès est alors secondaire à une autre cause. La figure 2 montre que les différents centres ont eu des intensités de dépistage très variables comme indiqué par la variabilité de l’effet du dépistage sur l’incidence du cancer de la prostate. Les indicateurs de surdiagnostic et de bénéfices sont très variables d’un pays à l’autre. La réduction de la mortalité est généralement plus grande quand la différence d’incidence est plus grande. Les auteurs de cette analyse par centre concluent en insistant sur l’importance d’évaluer la balance bénéfice-risque dans toute décision de dépistage du cancer de la prostate.4 Dans Nature en 2015,5 un autre auteur résumait efficacement le dilemme du dépistage, tel que vu dans la figure 3 . Pour 1 000 hommes dépistés, on attend 100 à 120 faux positifs, 50 complications liées au traitement et on évite au mieux un décès par cancer de la prostate.
Données de l’essai britannique
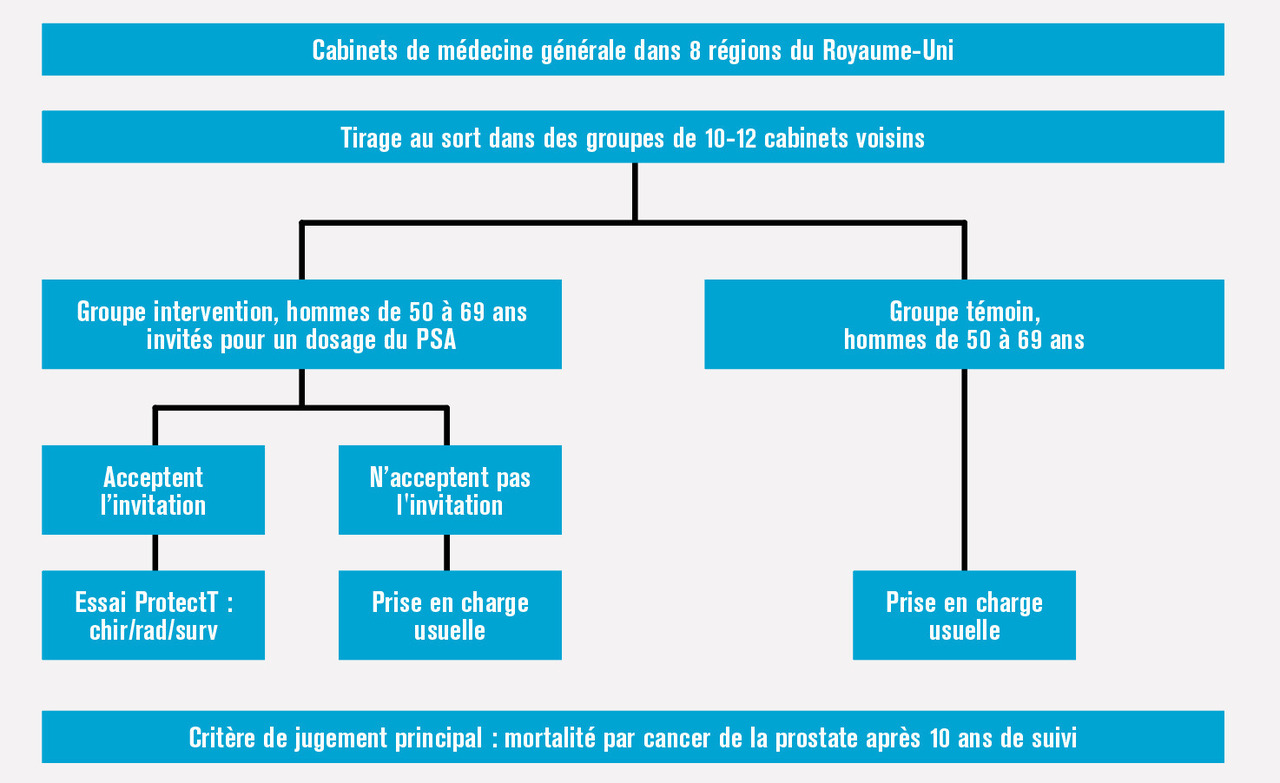
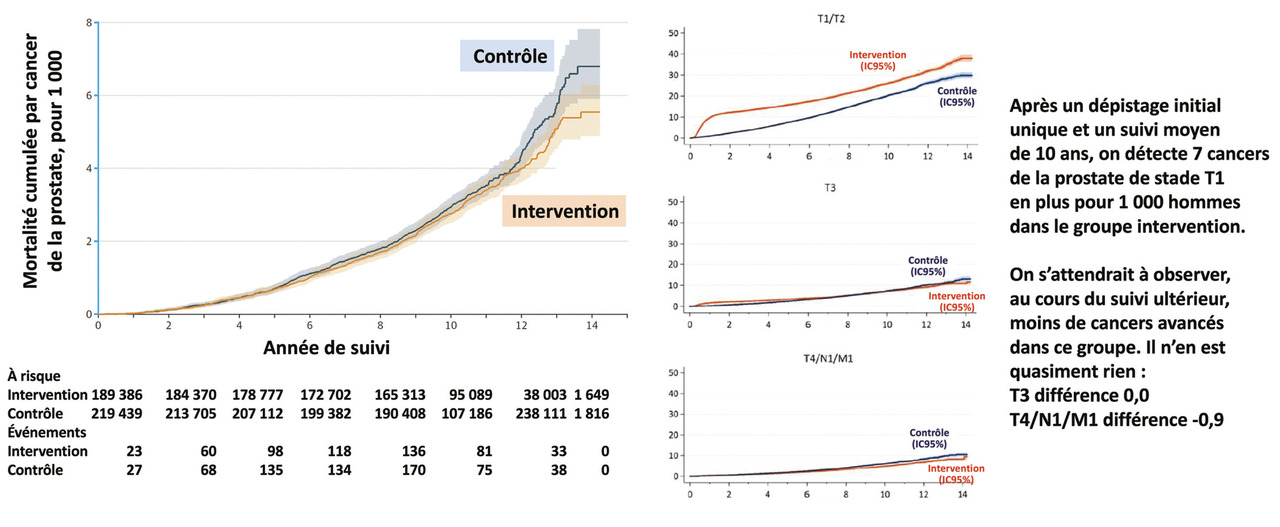
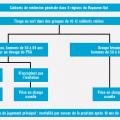
Les résultats du très grand essai britannique sont maintenant disponibles. L’organisation de l’essai est décrite dans la figure 4 , les principaux résultats dans le tableau 4 et la figure 5 et l’analyse dans le tableau 5 . L’essai s’appuie sur l’organisation du système de santé du Royaume-Uni, dans lequel chaque personne est prise en charge par un cabinet médical de référence, responsable de la population d’une zone géographique définie. On évite ainsi en partie la contamination du groupe témoin par des dosages de PSA non programmés liés notamment au nomadisme médical ; de plus, le recrutement se faisait lors d’une consultation de routine, ce qui réduit le biais lié au volontariat des participants. L’invitation unique peut expliquer le faible taux de participation (36 % des patients du groupe intervention ont réalisé un dosage du PSA) tandis que la contamination dans le groupe témoin était estimée entre 10 et 15 %. Ce taux de contamination faible est appuyé par la détection de cancers de grades plus élevés dans le groupe témoin. Cet essai présente la comparaison de la mortalité par cancer de la prostate en tenant compte de l’observance. Cela se fait en considérant la randomisation comme variable instrumentale, c’est-à-dire en étudiant dans quelle mesure la randomisation prédit la participation au dépistage et prédit la mortalité par cancer de la prostate, et en utilisant ensuite ces informations pour comprendre comment le dépistage prédit la mortalité par cancer de la prostate. L’essai montre un nombre de cancers de la prostate diagnostiqués plus important dans le groupe intervention que dans le groupe témoin (8 054 vs 7 856, soit 4,3 % vs 3,6 % ; risque relatif [RR] : 1,19 ; intervalle de confiance [IC] à 95 % : 1,14-1,25). Cependant le risque relatif de mortalité par cancer de la prostate ajusté sur l’observance n’était pas statistiquement significatif (RR : 0,93 ; IC à 95 % : 0,67-1,29] après un suivi médian de 10 ans. Ainsi cet essai très bien fait montre que le dépistage du cancer de la prostate avance son diagnostic mais ne diminue pas sa mortalité.
Position de l’AFU
L’Association française d’urologie (AFU) « plaide pour une information des hommes dès 45 ans et un premier dosage vers 45 ans pour les patients à risque, et 50 ans pour les autres. En fonction du résultat de ce premier dosage et de l’appartenance ou non à un groupe à risque, l’urologue proposera soit de cesser pour un temps les PSA, soit d’en refaire un tous les 2 ans, soit enfin de suivre de manière plus régulière (une fois par an) l’évolution du PSA ».6 L’AFU continue donc à recommander un dépistage quasi systématique, mais cherche à en réduire les inconvénients : « Il est ainsi apparu évident qu’un grand nombre de patients ne nécessitaient pas de traitement et que certains patients décéderaient d’une autre cause que leur cancer de la prostate. La surveillance active est ainsi née de cette constatation que le dépistage pouvait aboutir à un surdiagnostic de cancers indolents, chez lesquels un traitement invasif par prostatectomie ou radiothérapie externe était inutile et à risque de complications (impuissance, incontinence urinaire, sténose urétrale, cystite ou rectite radique…) ».7
Mais la surveillance active n’est proposée qu’aux patients à faible risque, et ces hommes reviennent tous les ans pour un nouveau dosage et éventuellement des biopsies, ce qui est traumatisant. Les urologues annoncent souvent avec satisfaction que les cancers métastatiques sont devenus plus rares, c’est négliger les rôles de l’avance du diagnostic et du surdiagnostic. En effet, la fréquence des métastases osseuses au diagnostic est automatiquement diminuée par le dépistage par avance du diagnostic ; de plus, le surdiagnostic induit par le dépistage entraîne une augmentation du nombre de cancers non métastatiques, donc une diminution de la fraction des cancers métastatiques dans l’ensemble des cancers dépistés. En effet, la plupart des cancers destinés à rester latents ne sont pas métastatiques. Cela ne démontre pas l’efficacité du dépistage. Si l’avance du diagnostic réduisait beaucoup le risque ultérieur de métastases, la mortalité ultérieure par cancer de la prostate serait diminuée par le dépistage, or les essais ne démontrent pas cette réduction.
Mais la surveillance active n’est proposée qu’aux patients à faible risque, et ces hommes reviennent tous les ans pour un nouveau dosage et éventuellement des biopsies, ce qui est traumatisant. Les urologues annoncent souvent avec satisfaction que les cancers métastatiques sont devenus plus rares, c’est négliger les rôles de l’avance du diagnostic et du surdiagnostic. En effet, la fréquence des métastases osseuses au diagnostic est automatiquement diminuée par le dépistage par avance du diagnostic ; de plus, le surdiagnostic induit par le dépistage entraîne une augmentation du nombre de cancers non métastatiques, donc une diminution de la fraction des cancers métastatiques dans l’ensemble des cancers dépistés. En effet, la plupart des cancers destinés à rester latents ne sont pas métastatiques. Cela ne démontre pas l’efficacité du dépistage. Si l’avance du diagnostic réduisait beaucoup le risque ultérieur de métastases, la mortalité ultérieure par cancer de la prostate serait diminuée par le dépistage, or les essais ne démontrent pas cette réduction.
Position des collèges de médecine générale
En juin 2011, le Collège national des généralistes enseignants (CNGE) indiquait déjà qu’« il n’existait aucun argument pour recommander un dépistage systématique du cancer de la prostate par le toucher rectal et/ou le dosage du PSA et qu’en dehors de situations particulières à risque ou de demande individuelle de patients bien informés au préalable, le CNGE recommandait aux médecins géné- ralistes de ne pas pratiquer de dépistage systématique ».8 De même, en 2011, le Collège de la médecine générale (CMG) considérait qu’« assimiler les cellules cancéreuses prostatiques à un cancer maladie est un abus de langage qui explique la difficulté à communiquer sur ce sujet difficile ».9 Le CMG invite les médecins généralistes « à informer clairement les hommes de plus de 50 ans à la fois sur les avantages espérés et les inconvénients potentiels du toucher rectal et du dosage du PSA dans le sang, tant que persisteront des inconnues sur le rapport bénéfices-risques d’un dépistage systématique du cancer de la prostate ».9, 10 Le CMG rappelait dans ses recommandations l’un des fondements du serment d’Hippocrate : « Primum non nocere » (« avant tout, ne pas nuire »).
PAS DE DÉPISTAGE SYSTÉMATIQUE
Une fois le dosage du PSA réalisé et le diagnostic posé, le patient est entré dans l’engrenage du dépistage. Il est passé de l’état d’homme bien portant à l’état de patient atteint d’un cancer. Croire avoir résolu le problème du surdiagnostic parce qu’une partie des patients chez qui le dépistage a conduit à découvrir un cancer échappent au traitement dans l’immédiat est une erreur. De plus, si le surtraitement est délétère, le surdiagnostic en lui-même expose également à des troubles, notamment psychologiques. Dans un éditorial du JAMA,11, Michael Barry a écrit : « In a biological sense, of course, screening does not cause prostate cancer, but in a practical sense, it does », autrement dit « Dans un sens biologique, bien sûr, le dépistage ne cause pas le cancer de la prostate, mais dans un sens pratique, il le fait ». C’est exactement le problème du dépistage du cancer de la prostate par dosage du PSA.
Alors que l’heure est au questionnement sur la place et le coût de l’imagerie par résonance magnétique dans le diagnostic du cancer de la prostate, aujourd’hui utilisée de manière exploratoire dans les cancers dépistés par la méthode clinico-biologique, il faut rappeler que le dépistage systématique du cancer de la prostate n’est recommandé par aucune autorité de santé, ni en France ni ailleurs. Il ne faut pas proposer un dosage du PSA à un homme sans symptômes ni facteurs de risque.
Alors que l’heure est au questionnement sur la place et le coût de l’imagerie par résonance magnétique dans le diagnostic du cancer de la prostate, aujourd’hui utilisée de manière exploratoire dans les cancers dépistés par la méthode clinico-biologique, il faut rappeler que le dépistage systématique du cancer de la prostate n’est recommandé par aucune autorité de santé, ni en France ni ailleurs. Il ne faut pas proposer un dosage du PSA à un homme sans symptômes ni facteurs de risque.
Références
1. Wilson JMG, Jungner G. Principes et pratique du dépistage des maladies. Genève : Organisation mondiale de la santé, 1970.
2. Tsodikov A, Gulati R, Heijnsdijk EAM, et al. Reconciling the effects of screening on prostate cancer mortality in the ERSPC and PLCO trials. Ann Intern Med 2017;167:449-55.
3. Martin RM, Donovan JL, Turner EL, et al.; CAP trial group. Effect of a low-intensity PSA-based screening intervention on prostate cancer mortality. JAMA 2018;319:883-95.
4. Auvinen A, Moss SM, Tammela TLJ, et al. Absolute effect of prostate cancer screening: balance of benefits and harms by center within the European randomized study of prostate cancer screening. Clin Cancer Res 2016;22:243-9.
5. Sohn E. Screening: diagnostic dilemma. Nature 2015;528:S120-2.
6. Association française d’urologie. Communiqué de presse du 5 décembre 2016. www.urofrance.org ou https://bit.ly/2MFxyjN
7. Dariane C. Surveillance active du cancer de la prostate. Prog Urol 2015;25:884-7. www.urofrance.org ou https://bit.ly/2Nkoz8E
8. Collège national des généralistes enseignants. Communique de presse du 15 septembre 2011. www.cnge.fr ou https://bit.ly/2MKFBfg
9. Collège de la médecine générale. Vous avez dit « prostate ! », comme c’est bizarre… Communiqué du 1er février 2011. www.sfmg.org ou https://bit.ly/2KFNfa8
10. Haute Autorité de santé, Assurance maladie, Collège de la médecine générale, Institut national du cancer. Éléments d’information destinés aux médecins concernant la première prescription du PSA chez l’homme asymptomatique, mars 2016. www.e-cancer.fr ou https://bit.ly/1SO09yG
11. Barry M. Screening for prostate cancer. Is the third trial the charm? JAMA 2018;319:868-9.
2. Tsodikov A, Gulati R, Heijnsdijk EAM, et al. Reconciling the effects of screening on prostate cancer mortality in the ERSPC and PLCO trials. Ann Intern Med 2017;167:449-55.
3. Martin RM, Donovan JL, Turner EL, et al.; CAP trial group. Effect of a low-intensity PSA-based screening intervention on prostate cancer mortality. JAMA 2018;319:883-95.
4. Auvinen A, Moss SM, Tammela TLJ, et al. Absolute effect of prostate cancer screening: balance of benefits and harms by center within the European randomized study of prostate cancer screening. Clin Cancer Res 2016;22:243-9.
5. Sohn E. Screening: diagnostic dilemma. Nature 2015;528:S120-2.
6. Association française d’urologie. Communiqué de presse du 5 décembre 2016. www.urofrance.org ou https://bit.ly/2MFxyjN
7. Dariane C. Surveillance active du cancer de la prostate. Prog Urol 2015;25:884-7. www.urofrance.org ou https://bit.ly/2Nkoz8E
8. Collège national des généralistes enseignants. Communique de presse du 15 septembre 2011. www.cnge.fr ou https://bit.ly/2MKFBfg
9. Collège de la médecine générale. Vous avez dit « prostate ! », comme c’est bizarre… Communiqué du 1er février 2011. www.sfmg.org ou https://bit.ly/2KFNfa8
10. Haute Autorité de santé, Assurance maladie, Collège de la médecine générale, Institut national du cancer. Éléments d’information destinés aux médecins concernant la première prescription du PSA chez l’homme asymptomatique, mars 2016. www.e-cancer.fr ou https://bit.ly/1SO09yG
11. Barry M. Screening for prostate cancer. Is the third trial the charm? JAMA 2018;319:868-9.