Diagnostiquer une douleur abdominale et lombaire aiguë chez l’enfant.
Identifier les situations d’urgence et planifier leur prise en charge.
Introduction
Le diagnostic repose sur un interrogatoire précis de la famille et de l’enfant, sur un examen clinique soigneux de l’abdomen, qui doit être regardé, palpé et ausculté, et si nécessaire sur des examens biologiques simples (bandelette urinaire, numération formule sanguine, dosage de la CRP…) complétés par une imagerie abdomino-pelvienne plutôt par échographie que par scanner afin de limiter l’irradiation des enfants.
Diagnostic positif
Chez le nourrisson, une douleur abdominale doit être évoquée devant des accès de pleurs, des cris inconsolables malgré une tétine, ou des tortillements du nourrisson. Cependant, aucun de ces signes fonctionnels n’est spécifique d’une douleur abdominale.
Chez l’enfant, une douleur abdominale est plus facilement rapportée, mais son caractère permanent ou intermittent (coliques) et surtout sa topographie sont souvent vagues, fréquemment de siège périombilical. Chez l’enfant avec un retard de développement ou des troubles du spectre autistique, les signes rapportés sont plus difficiles à interpréter.
L’interrogatoire des parents ou de l’enfant, s’il est en âge de comprendre, doit préciser :
- l’existence d’un contage viral : notion de gastroentérite aiguë familiale ou à l’école ;
- l’association à des nausées ou à des vomissements alimentaires, à une diarrhée (définie par > 3 selles liquides/24 heures) ou à une constipation (définie par < 3 selles dures par semaine). Des vomissements verts sont très évocateurs d’une occlusion intestinale ;
- la survenue éventuelle d’une fièvre (définie par une température ≥ 38 °C) ou de frissons ;
- l’examen du carnet de santé identifie les hospitalisations antérieures ou d’éventuels actes chirurgicaux ; il précise si les courbes de croissance staturo-pondérale sont harmonieuses ou objectivent un infléchissement ou une cassure ; enfin, il atteste que les vaccinations sont à jour.
- poids sur un pèse-bébé (< 10-12 kg) ou un pèse-personne (> 10-12 kg) ;
- température en utilisant un thermomètre électronique auriculaire ou rectal, mais pas frontal ;
- fréquence cardiaque (FC) et saturation pulsée en oxygène (SpO2) en utilisant un oxymètre de pouls avec un capteur adapté à l’enfant ;
- fréquence respiratoire (FR) en comptant les mouvements respiratoires sur 1 minute ;
- temps de recoloration cutanée (TRC), périphérique ou central, < 3 s. Des extrémités froides et mal colorées constituent le meilleur signe d’un état de choc ;
- pression artérielle, systolique (PAS) et diastolique (PAD) à l’aide d’un appareil oscillométrique en utilisant un brassard de taille adaptée à l’enfant (mesure du périmètre brachial) ;
- échelle de coma de Glasgow (GCS) adaptée à l’enfant, cotée entre 3 et 15 ;*
- échelle de douleur (échelle visuelle analogique [EVA] entre 0 et 10, échelle des visages ou échelle d’hétéro-évaluation type EVENDOL, selon l’âge).†
- urgence « vitale », qui doit être immédiatement prise en charge par un médecin senior dans la salle d’accueil des urgences vitales (SAUV) ;
- urgence « prioritaire », qui doit être normalement prise en charge dans les 15 minutes de l’arrivée aux urgences ;
- urgence « semi-prioritaire », qui doit être normalement prise en charge dans l’heure qui suit l’arrivée aux urgences ;
- urgence ou consultation « simple », qui peut être prise en charge après les autres urgences.
- l’inspection observe en premier si la démarche est aisée ou malaisée de l’enfant pour entrer dans la salle d’examen et s’il monte facilement ou avec peine sur la table d’examen :
. puis à l’enfant de sautiller debout : une douleur au niveau de la fosse iliaque droite (FID) est suspecte d’une appendicite aiguë,
. on recherche des cicatrices opératoires ;
- la palpation douce de l’abdomen se pratique avec les deux mains réchauffées de l’examinateur qui explorent les quatre quadrants abdominaux :
. anormalement, on peut ressentir une défense (tension abdominale sensible qui interdit toute palpation appuyée) ou une contracture abdominale (franche contraction abdominale très douloureuse à la moindre palpation),
. l’ombilic et les orifices herniaires inguinaux sont systématiquement palpés, de même que les organes génitaux externes masculins,
. le toucher rectal sera réservé au chirurgien pédiatrique ;
- l’auscultation de l’abdomen est aussi importante. Un transit intestinal normal se caractérise par des bruits hydro-aériques caractéristiques. Un silence abdominal évoque un iléus intestinal (occlusion). Ne pas oublier d’ausculter les poumons car, chez l’enfant, une pneumonie peut se révéler par des douleurs abdominales trompeuses.
Diagnostic d’une urgence chirurgicale abdominopelvienne chez l’enfant
- état de choc : extrémités froides et mal colorées, pouls mal perçus, tachycardie ;
- détresse respiratoire : polypnée, signes de lutte, cyanose, sueurs ;
- détresse neurologique : altération de la conscience (GCS < 13-14) ;
- tous signes qui doivent faire transférer l’enfant dans le service d’accueil des urgences vitales afin de débuter le traitement : remplissage vasculaire et vasopresseurs, antibiothérapie, oxygénothérapie nasale ou à haut débit, intubation et ventilation mécanique en urgence, et appeler une réanimation pédiatrique ou le SMUR.
Volvulus complet du grêle
Il s’agit souvent d’un jeune nourrisson mais parfois d’un jeune enfant qui développe un état de choc, alors qu’il vomit « vert » et que le ventre est plat et silencieux.
Cette association doit faire décider une prise en charge chirurgicale en extrême urgence pour une détorsion rapide du volvulus et la remise de l’intestin en situation de mésentère commun avec, si nécessaire, fixation du mésentère libre à la paroi postérieure.
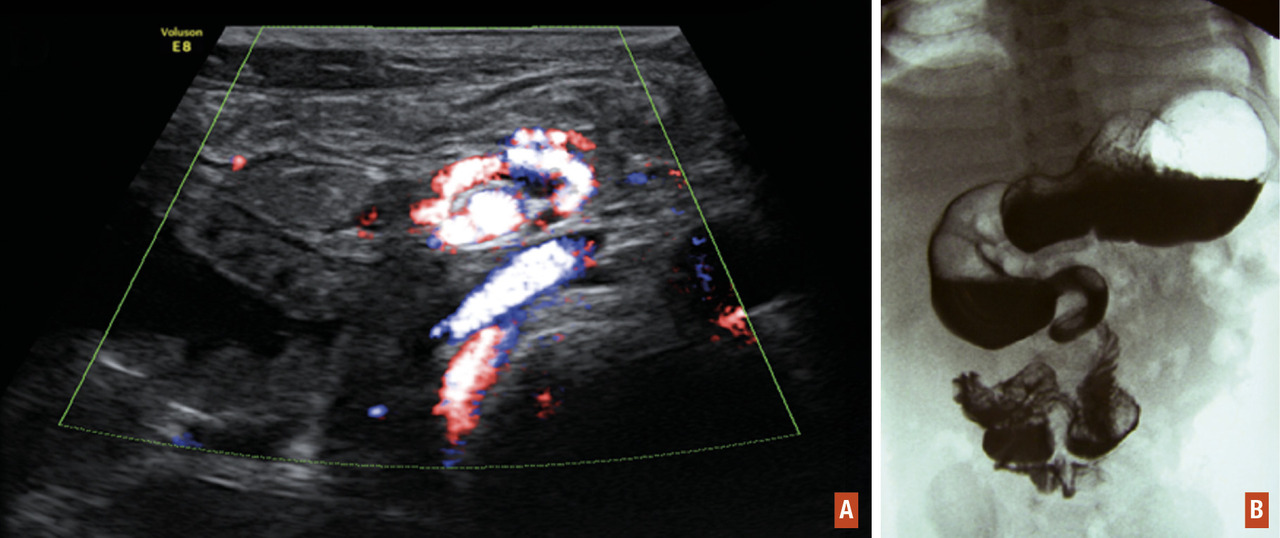
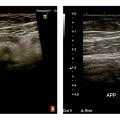
Une échographie Doppler en urgence montre la rotation des vaisseaux mésentériques à leur racine et l’absence de perfusion mésentérique distale. En cas de doute, une opacification du cadre duodénal montre l’absence d’angle de Treitz (
Le problème est d’organiser un transfert rapide par le SMUR vers un centre pédiatrique spécialisé disposant d’un bloc opératoire et d’un service de réanimation pédiatrique, car tout retard dans la prise en charge peut aboutir à une large résection de l’intestin grêle ischémique, avec pour séquelles, un « grêle court » qui peut nécessiter des années d’alimentation parentérale, avec ses complications propres (infection et/ou thrombose sur cathéter, cholestase hépatique, etc.).[5]
Torsion du testicule
Chez un adolescent prépubère ou pubère, survenue brutale d’une douleur scrotale unilatérale intense, avec parfois une irradiation inguinale ou lombaire.
Elle est souvent accompagnée de nausées, voire de vomissements, mais sans fièvre.
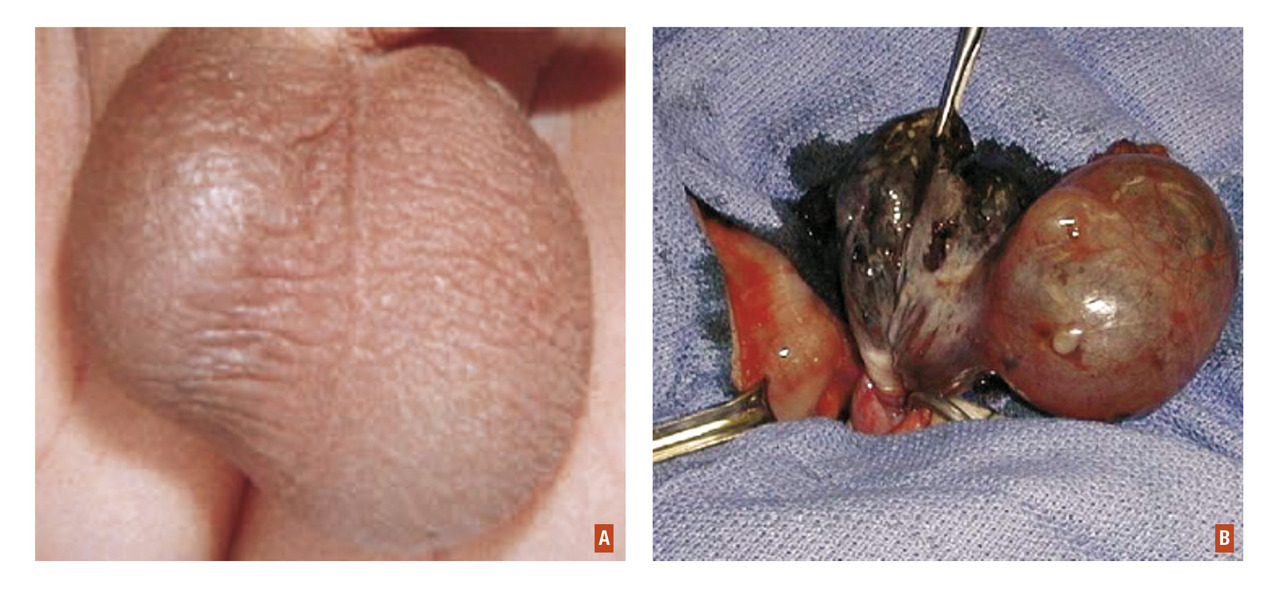
La palpation du testicule œdématié est très douloureuse ; le réflexe crémastérien est aboli (
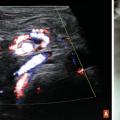
Parfois, l’enfant ne consulte que tardivement,[7] ou en cas de doute notamment avec une orchi-épididymite, l’échographie scrotale en urgence avec Doppler couleur montre un testicule non vascularisé, à l’inverse du testicule controlatéral.
On peut tenter une détorsion du cordon testiculaire de la droite vers la gauche, comme « on ouvre les pages d’un livre », mais en cas d’échec il faudra réaliser une détorsion chirurgicale en urgence sous anesthésie générale. La difficulté est de trouver une équipe chirurgicale et anesthésique qui puisse opérer l’enfant sans induire de retard à la prise en charge, qui entraînerait une nécrose testiculaire irréversible ».[8]
Torsion de l’ovaire
Chez une adolescente prépubère mais surtout pubère, survenue brutale d’une douleur abdominopelvienne unilatérale.
L’interrogatoire peut retrouver des épisodes analogues régressifs.
L’examen clinique met en évidence une défense abdominopelvienne qui, si elle était à droite, pourrait évoquer une appendicite aiguë.
C’est l’échographie abdominopelvienne pratiquée en urgence qui permet de poser le diagnostic devant un kyste de l’ovaire mesurant ≥ 2,5 cm de diamètre avec un contenu ultrasonore « vide » (liquidien, plutôt en faveur d’un kyste ovarien fonctionnel) ou hétérogène (sang plutôt en faveur d’une torsion du kyste).[10]
La détorsion chirurgicale sous laparoscopie doit être réalisée en extrême urgence afin de préserver la vitalité de l’ovaire (
Hernie inguinale étranglée[11]
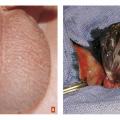
L’examen clinique constate une tuméfaction inguinale dure, tendue et douloureuse jusque-là méconnue ou un aspect modifié d’une hernie inguinale connue.
Devant toute hernie engouée, la réduction manuelle en exerçant une pression douce et continue dans l’axe du canal inguinal doit être tentée, souvent aidée par une sédation associant midazolam (0,3-0,4 mg/kg) par voie intranasale ou intrarectale et nalbuphine (0,2 mg/kg) par voie IV.
En cas d’échec, l’enfant doit être transféré vers un centre de chirurgie pédiatrique.
Une hernie inguinale, souvent bilatérale, survient fréquemment chez les anciens prématurés chez qui le risque d’incarcération est double, ce qui justifie une intervention chirurgicale préventive optimale vers la 40e semaine d’âge corrigé [AC (semaines) = âge gestationnel (AG) + âge postnatal].[12]
Invagination intestinale aiguë (IIA)
L’IIA primaire est la plus fréquente, favorisée par une adénite mésentérique virale, avec une prédominance automnale ou hivernale, chez un jeune nourrisson (pic de fréquence 9 mois) plutôt de sexe masculin.
L’IIA secondaire est plus rare, favorisée par un purpura rhumatoïde, une mucoviscidose, un diverticule de Meckel ou une duplication digestive, chez un enfant à tout âge.
Les signes cliniques évocateurs sont la survenue brusque :
- de crises douloureuses abdominales paroxystiques entrecoupées d’accalmie ;
- d’accès de pâleur au décours d’accès de pleurs ;
- certaines IIA se manifestant par des épisodes de léthargie confinant au coma.[13] La séquence « pleurs, pâleur, hypotonie » est évocatrice ;
- d’un refus du biberon ;
- de vomissements alimentaires, bilieux jaunes puis verts (tardifs) ;
- à un stade tardif, de selles sanglantes.
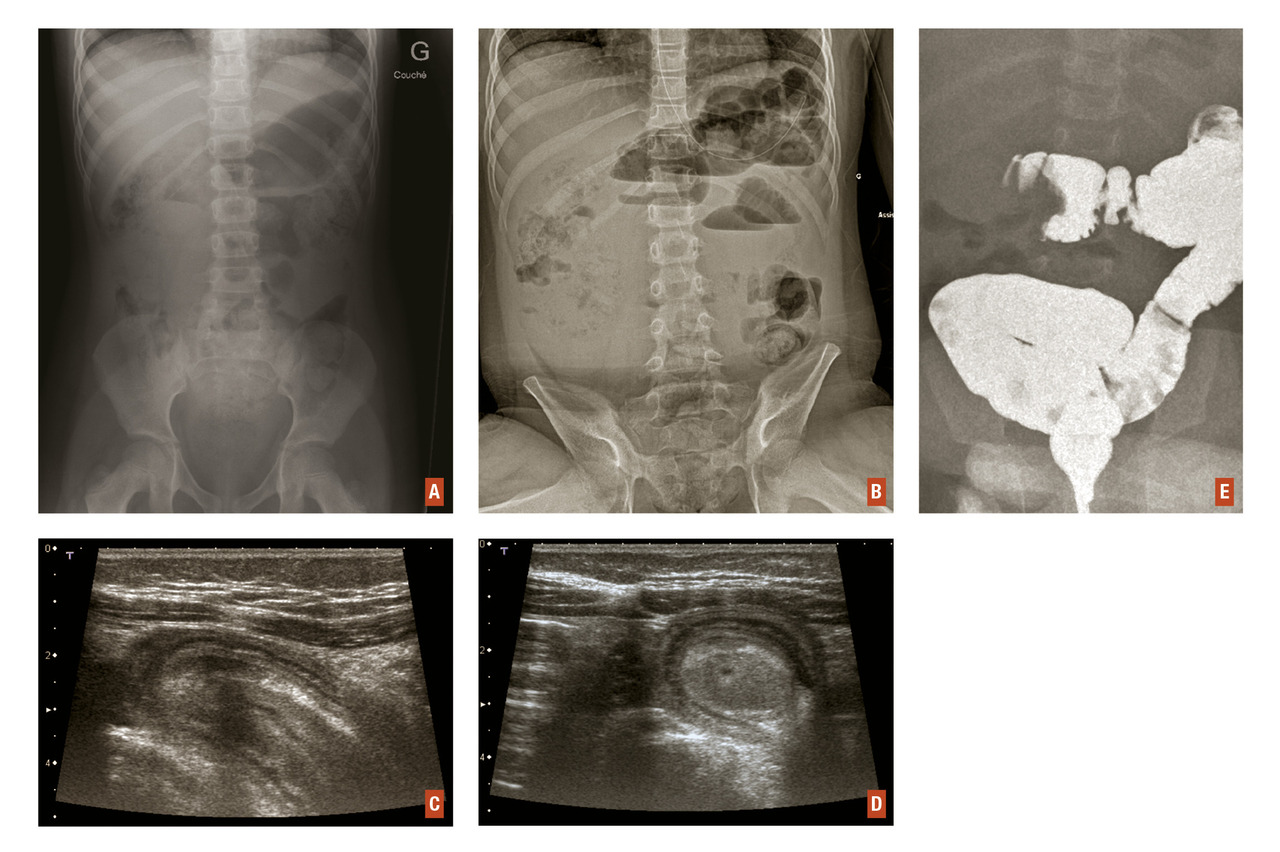
- une masse oblongue et sensible (boudin) sous-hépatique, voire dans l’épigastre ;
- une FID comme « déshabitée ».
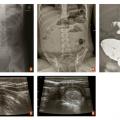
- soit de « cocarde » en incidence transversale ;
- soit de « sandwich » en incidence longitudinale (
fig. 3 ).
Les suites de cette désinvagination « médicale » sont généralement simples :[16]
- observation de quelques heures aux urgences pédiatriques ;
- réalimentation par biberon. Si l’enfant ne vomit pas et émet des gaz ou des selles, il peut rentrer à domicile, avec pour consigne de reconsulter en cas de récidive.[17] Si, au contraire, la désinvagination pneumatique n’a pas été possible ou n’a été que partielle et que l’enfant continue notamment de vomir, il convient de transférer l’enfant dans un service de chirurgie pédiatrique pour une éventuelle désinvagination par voie laparoscopique.
Appendicite aiguë
La fiabilité des symptômes, des signes cliniques et biologiques a été évaluée par une méta-analyse de 42 articles publiés entre 1966 et 2007 : [18]
- une fièvre > 38 °C augmente la probabilité diagnostique (risque relatif (RR) = 3,4 ; intervalle de confiance à 95 % [IC95] = 2,4-4,8], et au contraire son absence diminue celle-ci (RR = 0,32 [0,16-0,64]) ;
- une douleur à la décompression de la fosse iliaque droite (FID) multiplie la probabilité diagnostique par un facteur 3,0 [2,3-3,9], tandis que son absence diminue celle-ci d’un facteur 0,28 [0,14-0,55] ;
- une douleur abdominale irradiant vers la FID multiplie la probabilité diagnostique d’appendicite aiguë par un facteur de 1,2 (1,0-1,5), soit plus qu’une douleur spontanée de la FID. Il convient d’en rapprocher la douleur provoquée de la FID au sautillement.
- un nombre de globules blancs < 10 000/mm3 diminue la probabilité d’appendicite aiguë (risque relatif [RR] = 0,22 [0,17-0,30]), de même qu’un nombre absolu < 6,750/mm3 de polynucléaires neutrophiles (RR = 0,06 [0,03-0,16]) ;
- c’est pourquoi il a été proposé d’utiliser des scores cliniques d’Alvarado ou de Samuel, qui combinent ces éléments cliniques et biologiques afin de déterminer une probabilité moyenne (score < 5/10) ou élevée (score > 5/10) d’appendicite aiguë.[19] Au contraire, un score de Kharbanda < 5/10 identifie les enfants à bas risque d’appendicite aiguë ;[20
- le problème réside dans le manque de reproductibilité des signes cliniques soit par un même observateur à deux moments différents, soit entre deux observateurs.[21]
Le traitement de l’appendicite aiguë est chirurgical : appendicectomie en urgence sous laparoscopie ;[23] ou médical : antibiothérapie associant une bêtalactamine et du métronidazole par voie IV associée à une surveillance clinique.[24] Tandis que le traitement chirurgical en urgence s’impose en cas de péritonite appendiculaire, le traitement médical est préféré en cas de plastron appendiculaire, avec appendicectomie « à froid » à distance de l’épisode initial.[25]
Douleurs abdominales médicales
Leur distinction (
- un interrogatoire non autosuggestif de l’enfant et de sa famille ;
- un examen clinique attentif de l’enfant, en particulier de l’abdomen ;
- des examens complémentaires ciblés.
Gastroentérite aiguë[26]
Principalement liée à de multiples virus (rotavirus, norovirus, adénovirus, etc.) et se manifestant par des vomissements et/ou une diarrhée aqueuse plus ou moins associés à une fièvre modérée. Plus rarement liée à des entérobactéries pathogènes (Salmonella typhi ou sp., Shigella sp. Campylobacter jejunii, Escherichia coli entéropahogène, etc.) et se manifestant par une douleur abdominale, une fièvre élevée avec frissons et une diarrhée glairo-sanglante.
Le risque est la déshydratation, qui doit être prévenue ou traitée par un soluté de réhydratation orale (SRO) administré par petites quantités répétées, et en cas d’échec par la perfusion IV d’un soluté isotonique.
La place de l’antibiothérapie (azithromycine par voie orale ou ceftriaxone par voie IV) dans le traitement des gastroentérites aiguës est limitée, et ne doit être prescrite qu’après coproculture et identification de la bactérie.
Pyélonéphrite aiguë[27]
Une pyélonéphrite doit être suspectée chez tout nourrisson avec une fièvre > 39 °C et des frissons durant > 48 heures, isolée sans notion de contage ou signes respiratoires. Chez l’enfant, elle s’accompagne souvent d’une douleur abdominale et/ou lombaire et de signes fonctionnels urinaires : brûlures mictionnelles, dysurie, pollakiurie.
Une infection urinaire est plus fréquente chez le nourrisson de sexe masculin non circoncis et chez l’enfant de sexe féminin. Elle est favorisée par une uropathie malformative, notamment un reflux vésico-urétéral.
Son diagnostic repose sur l’examen des urines recueillies par une méthode de référence (sondage vésical ou en milieu de jet) après une toilette soigneuse des organes génitaux externes :
- une bandelette urinaire positive (leucocytes et nitrites) doit être complétée par un examen cytobactériologique des urines (ECBU) au laboratoire. Une bandelette urinaire négative (leucocytes et nitrites) élimine une IU ;
- une leucocyturie > 104/mm3 et une bactériurie > 105 UFC/mL affirment l’IU ;
- celle-ci est confirmée par la culture, qui met en évidence une seule entérobactérie pathogène comme un E. coli.
Purpura rhumatoïde de Henoch-Schönlein
Parfois, ces douleurs abdominales sont intenses et permanentes et elles s’accompagnent de vomissements verts, voire de rectorragies conséquences d’épisodes d’invaginations et de désinvaginations de l’intestin grêle.
Le pronostic de cette vascularite à IgA, souvent réputée guérir spontanément, dépend de la sévérité de l’atteinte glomérulaire, d’où la nécessité d’un suivi prolongé comportant un dosage régulier de la protéinurie et une mesure régulière de la pression artérielle et dans les cas défavorables l’indication d’une biopsie rénale.[29]
Crise vaso-occlusive (CVO) drépanocytaire[30]
On estime qu’un enfant drépanocytaire consulte en moyenne 2 ou 3 fois par an pour une complication et notamment une CVO abdominale caractérisée par une douleur abdominale brutale et intense.
Tandis que les autres étiologies de douleur abdominale doivent être éliminées, l’enfant sera hospitalisé pour surveillance, un bilan biologique prélevé comportant notamment une numération formule sanguine (NFS) + réticulocytes et un traitement antalgique adapté à l’échelle de douleur.
Une douleur abdominale peut être trompeuse et révélatrice d’autres causes
- d’une pneumopathie ou pleuropneumopathie bactérienne ou virale (radiographie de thorax) ;
- d’une pancréatite aiguë (valeur de l’amylasémie et de la lipasémie).
La douleur d’une spondylodisciite ou sacro-iliite peut se projeter au niveau abdominal.
Douleurs abdominales fonctionnelles récurrentes
Coliques du nourrisson et migraine intestinale
Au décours de ces crises, l’aspect clinique est rassurant : nourrisson souriant, appétit conservé, transit normal, surtout croissance pondérale normale (~30 g/j dans les 3 premiers mois de vie).
C’est la répétition des crises qui évoquent le diagnostic. Aucun examen complémentaire n’est nécessaire.
Longtemps interprétées comme des douleurs abdominales,[32] il a été récemment montré une association entre coliques du nourrisson et épisodes migraineux de l’enfant.[33]
Constipation et intestin irritable
Il s’agit d’une cause fréquente (~5 % des consultations en pédiatrie) de douleur abdominale.
L’interrogatoire doit préciser l’ancienneté des troubles (délai d’émission du méconium dans les premiers jours de vie, dépistage néonatal de l’hypothyroïdie et de la mucoviscidose), le régime et la date de diversification alimentaire, les habitudes de défécation, le nombre et l’aspect des selles (dureté des selles), une éventuelle souillure de la culotte (encoprésie), les conditions de vie scolaire, les éventuelles difficultés familiales, de possibles sévices, notamment sexuels.
L’examen clinique de l’abdomen apprécie le degré de météorisme, la palpation d’éventuels fécalomes, notamment dans la fosse iliaque gauche, examine l’anus et le réflexe anal inhibiteur, évalue la croissance staturo-pondérale.
En faveur d’une cause organique plaident un retard d’émission du méconium, une constipation à début néonatal, des épisodes subocclusifs avec vomissements suivis d’une débâcle de selles, une cassure de la courbe staturo-pondérale et l’échec d’un traitement symptomatique bien conduit. Les étiologies les plus fréquentes sont une maladie de Hirschsprung, une pseudo-obstruction intestinale chronique (POIC), une malformation anorectale haute ou basse, une mucoviscidose, une maladie cœliaque, une encéphalopathie ou une anomalie médullaire.
En faveur d’une cause fonctionnelle plaident l’oubli fréquent des enfants d’aller aux toilettes à heures régulières, parce qu’ils sont trop occupés à jouer ou parce qu’ils craignent de souffrir en poussant, des difficultés sociales ou psychologiques rencontrées dans la vie scolaire ou familiale.[34]
Le traitement de la constipation repose essentiellement sur l’administration orale de polyéthylène-glycol (PEG) [Movicol ou Forlax] à bonnes doses (traitement d’attaque 1,5 g/kg et d’entretien 0,5 g/kg par jour), puis adaptées au transit intestinal (selles et traitements doivent être consignés sur un petit carnet). Ce traitement par voie orale à des posologies adaptées a rendu quasi-obsolètes les lavements évacuateurs redoutés par les enfants et les autres traitements (régimes, eau Hépar, etc.).
On peut rapprocher de la constipation chronique le syndrome de l’intestin irritable. Il se caractérise par une douleur abdominale récurrente (≥ 1 jour par semaine au cours des 3 derniers mois), des troubles de la défécation (douleur et changement de consistance des selles) survenant chez un patient n’ayant aucune pathologie organique (critères de Rome IV) et qui seraient liés à des modifications du système nerveux intrinsèque intestinal.
Gastrite, ulcére gastroduodénal et infection à Helicobacter pylori
Elle se manifeste par des épigastralgies modulées par les repas et évoluant par poussées, qui sont évocatrices d’un ulcère gastrique et/ou duodénal et sont susceptibles d’évoluer vers le cancer gastrique à l’âge adulte.
Le diagnostic de certitude repose sur de multiples biopsies gastriques suivies d’un test rapide à l’uréase et d’une culture.[36]
Le traitement repose sur l’association d’un inhibiteur de la pompe à protons, de deux antibiotiques (amoxicilline + clarithromycine ou métronidazole) plus ou moins associés à des sels de bismuth pendant une durée de 14 jours
Vérification de l’éradication par Breath Test ou par la négativation des antigènes d’H. pylori dans les selles 2-4 semaines plus tard.
Maladies inflammatoires chroniques intestinales (MICI)
La maladie de Crohn associe :[37]
- douleurs abdominales récurrentes souvent localisées à la fosse iliaque droite ;
- diarrhée et anorexie. Il existe des formes dans lesquelles l’anorexie est au premier plan, avec une absence de diarrhée ;
- perte de poids ou retard de croissance staturo-pondérale.
- douleurs abdominales souvent localisées à la fosse iliaque gauche ;
- diarrhée presque toujours sanglante ;
- répercussion moindre sur le poids et la courbe de croissance.
Douleur abdominale fonctionnelle et contexte psychologique et sociofamilial particulier
Conclusion
POINTS FORTS À RETENIR
Une douleur abdominale est un motif fréquent de consultation chez l’enfant.
La difficulté est d’identifier les rares urgences chirurgicales des fréquentes douleurs abdominales médicales ou fonctionnelles, aiguës, récurrentes ou chroniques.
Ceci repose sur un interrogatoire précis de l’enfant et/ou de ses parents, un examen clinique systématique, en particulier de l’abdomen, des orifices herniaires et des organes génitaux.
Des examens complémentaires peuvent s’avérer nécessaires :
– biologiques comme une simple bandelette urinaire, une numération formule sanguine, une CRP, un ionogramme sanguin et urinaire ;
– d’imagerie en privilégiant l’échographie abdomino-pelvienne non irradiante au scanner.
D’où l’importance d’une approche multidisciplinaire impliquant pédiatres des urgences, radiologues et chirurgiens.
La constipation est une cause fréquente de douleur abdominale chez l’enfant. Son traitement repose sur l’administration orale de PEG à posologie adéquate.
Les douleurs abdominales fonctionnelles récurrentes sont souvent révélatrices de difficultés psychologiques, d’un harcèlement scolaire ou d’une mésentente familiale.
Les douleurs abdominopelviennes ou lombaires fébriles doivent faire rechercher une pyélonéphrite aiguë (bandelette urinaire, ECBU, hémoculture).
Douleurs abdominales et lombaires aiguës chez l’enfant et chez l’adulte
Une douleur abdominale chez l’enfant pourrait figurer dans de nombreux dossiers transverses de pédiatrie, depuis un malaise du nourrisson (savoir évoquer une invagination intestinale aiguë), une gastroentérite aiguë (où la réhydratation hydrique est primordiale), une infection urinaire (avec réalisation des analyses d’urine et la bonne prescription antibiotique), en passant par un syndrome de Münchhausen (devant des douleurs d’allure fonctionnelle).
Il est essentiel de connaître les signes de gravité chez un enfant qui consulte pour une douleur abdominale aiguë : signes d’occlusion intestinale (vomissements verts évoquant un volvulus du grêle), signes de choc hypovolémique (déshydratation compliquant une gastroentérite aiguë) ou de choc septique (compliquant une pyélonéphrite aiguë).
L’interrogatoire et l’examen clinique sont essentiels pour une démarche diagnostique raisonnée. La prescription d’examens complémentaires biologiques, microbiologiques ou radiologiques n’est pas systématique.
2. Fleming S, Thompson M, Stevens R, Heneghan C, Plüdemann A, Maconocchie I, et al. Normal ranges of heart rate and respiratory rate in children from births to 18 years of age: a systematic review of observational studies. Lancet 2011;377:1011-8.
3. van Veen M, Steyeberg EW, Ruige M, et al. Manchester Triage System in paediatric emergency care: prospective observational study. BMJ 2008;337:a1501.
4. Gravel J, Gouin S, Goldman RD, Osmond MH, Fitzpatrick MH, Boutis K, et al. The canadian triage and acuity scale for children: a prospective multicenter evaluation. Ann Emerg Med 2012;60:71-7.
5. Polites SF, et al. Implications of transfer status on bowel loss in children undergoing emergency surgery for malrotation. J Pediatr Surg 2019, doi10.1016.
6. Boettcher M, Bergholz R, Krebs TF, Wenke K, Aronson DC. Clinical predictors of testicular torsion in children. Urology 2012;79:670-4.
7. Bayne CE, Villanueva J, Davis TD, Pohl HG, Rushton HG. Factors associated with delayed presentation and misdiagnosis of testicular torsion: a case-control study. J Pediatr 2017;186:200-4.
8. Arevalo MK, Sheth KR, Menon VS, Ostrov L, Hennes H, Singla N, et al. Straight to the operating room: an emergent track for acute testicular torsion transfers. J Pediatr 2018;192:178-83.
9. Dasgupta R, Renaud E, Goldin AB, Baird R, Cameron DB, Arnold MA, et al. Ovarian torsion in pediatric and adolescent patients: a systematic review. J Pediatr Surg 2018;53:1387-91.
10. Schallert AK, Abbas PI, Mehollin-Ray AR, Price MC, Dietrich JE, Orth RC. Physiologic ovarian cysts versus other ovarian and annexial changes in the preadolescent and adolescent population: US and Surgical follow-up. Radiology 2019;292(1):172-8.
11. Galinier P, Bouali O, Juricic M, Smail N. Hernie inguinale chez l’enfant : mise au point pratique. Arch Pédiatr 2007;14:399-403.
12. Lautz TB, Rahal MV, Reynolds M. Does timing matter? A national perspective on the risk of incarceration in premature neonates with inguinal hernia. J Pediatr 2011;158:573-7.
13. Sassower KC, Allister LM, Westra SJ. Case 12-2012: a ten-month-old girl with vomiting and episodes of unresponsiveness. N Engl J Med 2012;366(16): 1527-36.
14. Mendez D, Caviness AD, Ma L, Macias CC. Diagnosis of intussusception by physician novice sonographers in the Emergency Department. Ann Emerg Med 2012;60(3):264-8.
15. Bouali O, Mouttalib S, Vial JP, Galinier P. Conduite à tenir devant une invagination intestinale du nourrisson et de l’enfant. Arch Pédiatr 2015;22:1312-7.
16. Gilmore AW, Reed M, Tenenbein M. Management of childhood intussusception after reduction by enema. Am J Emerg Med 2011;29:1136-40.
17. Gray MP, Li SH, Hoffmann RG, Gorelick MH. Recurrence rates after intussusception enema reductions: a meta-analysis. Pediatrics 2014;134(1):110-9.
18. Bundy DG, Byerley JS, Liles AE, Perrin EM, Katznelson J, Rice HE. Does this child have appendicitis? JAMA 2007;298(4):438-51.
19. Schneider C, Kharbanda A, Bachur R. Evaluating appendicitis scoring systems using a prospective pediatric cohort. Ann Emerg Med 2007;49:778-84.
20. Kharbanda AB, Taylor GA, Fishman FJ, Bachur RG. A clinical decision rule to identify children with low-risk for appendicitis. Pediatrics 2005;116:709-16.
21. Kharbanda AB, Stevenson MD, Macias CG, Sinclair K, Dudley NC, Bennett J, et al. for the Pediatric Emergency Medicine Collaborative Research Committee of the American Academy of Pediatrics. Interrater reliability of clinical findings in children with possible appendicitis. Pediatrics 2012;129:695-700.
22. Bachur RG, Hennelly K, Callahan MJ, Monuteaux MC. Advanced radiologic imaging for pediatric appendicitis, 2005-2009: trends and outcomes. J Pediatr 2012;160:1034-8.
23. Serres SK, Cameron DB, Glass CC, Graham DA, Zurakowski D, Karki M, et al. Time to appendicectomy and risks of complicated appendicitis and adverse outcomes in children. JAMA Pediatr 2017;171(8):740-6.
24. Salmiren P, Tuominen R, Paajanen H, Rautio T, Nordström P, Aarnio M, et al. Five-year follow-up of antibiotic therapy for uncomplicated acute appendicitis in the APPAC randomized clinical trial. JAMA 2018;320(12):1259-65.
25. Kessler U, Mosbahi S, Walker B, Hau EM, Cotton M, Peiry B, et al. Conservative treatment versus surgery for uncomplicated appendicitis in children: a systematic review and meta-analysis. Arch Dis Child 2017;102:1118-24.
26. Guarino A, Ashkenazi S, Gendrel D, Lo Vecchio A, Shamir R, Szajewska H. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition/European Society for Pediatric Infectious Diseases evidence-based guidelines for the management of acute gastroenteritis in children in Europe: Update 2014. JPGN 2014;59(1):132-52.
27. Montini G, Tullus K, Hewitt I. Febrile urinary tract infections in children. N Engl J Med 2011;365:239-50.
28. Oni L, Sampath S. Childhood IgA vasculitis (Henoch Schonlein purpura) – Advances and knowledge gaps. Front Pediatr 2019 Jun 27;7. doi. 10.3389/ped.2019.00257
29. Rauen T, Eitner F, Fitzner C, Sommerer C, Zeier M, Otte B et al. Intensive supportive care plus immunosuppression in IgA nephropathy. N Engl J Med 2015 ;373(23):2225-36.
30. Ware RE, de Montalembert M, Tshilolo L, Abboud MR. Sickle cell disease. Lancet 2017;390:311-23.
31. Wolke D, Bilgin A, Samara M. Systematic review and meta-analysis: fussing and crying durations and prevalence of colic in infants. J Pediatr 2017;185:55-61.
32. Rhoads JM, Collins J, Fatheree MY, Hashmi SS, Taylor CM, Luo M et al. Infant colic represents gut inflammation and dysbiosis. J Pediatr 2018;203:55-61.
33. Romanello S, Spiri D, Marcuzzi E, Zanin A, Boizeau P, Rivière S, et al. Association between childhood migraine and history of infantile colic. JAMA 2012;2013(15):1607-12.
34. Tabbers MM, DiLorenzo C, Berger MY, Faure C, Langendam MW, Nurko S, et al. Evaluation and treatment of functional constipation in infants and children: Evidence-based recommendations from ESPGHAN and NASPGHAN. JPGN 2014;58(2):258-74.
35. Ford AC, Lacy BE, Talley NJ. Irritable bowel syndrome. N Engl J Med 2017;376:2566-78.
36. Jones NL, Koletzko S, Goodman K, Bontemps P, Cadranel S, Casswall T et al. on behalf of ESPGHAN, NASGHAN. Joint ESPGHAN/NASGHAN guidelines for the management of Helicobacter pylori in children and adolescents (Update 2016). JPGN 2017;64:991-1003.
37. Torres J, Mehandru S, Colombel JF, Peyrin-Biroulet L. Crohn’s disease. Lancet 2017;389:1741-55.
38. Ungaro R, Mehandru S, Allen PB, Peyrin-Biroulet L, Colombel JF. Ulcerative colitis. Lancet 2017;389:1756-70.
39. Glaser D, Davis P. Forty years of fabricated or induced illness: where next for paediatricians? Management of perplexing presentations. Arch Dis Child 2019;104(1):7-11.

 Encadrés
Encadrés