La drépanocytose est une maladie génétique auto- somique récessive. La mutation du gène de la β-globine entraîne un remplacement de l’hémoglobine A par la S, à l’origine des manifestations cliniques vaso-occlusives et d’une hémolyse chronique avec anémie de degré variable. Les syndromes drépanocytaires majeurs (SDM) regroupent les sujet homozygotes SS et les hétérozygotes composites. Ils font partie des affections de longue durée (liste ALD 30) avec exonération du ticket modérateur, en raison de leur évolutivité et de leur retentissement sur la vie quotidienne.
Dès que le diagnostic est confirmé, le patient intègre un circuit de soins dédié : consultations hospitalières pluriannuelles dans un centre de référence/compétence ; bilans annuels mais aussi hospitalisations en cas de complications aiguës ; éducation thérapeutique ; accompagnements social et psychologique.
Chez les jeunes malades, la prise en charge s’appuie sur le protocole national de diagnostic et de soins (PNDS)2 : éducation parentale ; antibioprophylaxie visant le pneumocoque ; calendrier vaccinal renforcé ; dépistage annuel de la vasculopathie cérébrale (doppler transcrânien, DTC) dès l’âge de 12-18 mois.
Chez l’enfant, la maladie se manifeste par : des crises douloureuses vaso-occlusives, une anémie, une susceptibilité aux infections ; une complication peut déclencher ou aggraver ces symptômes.
Douleurs : éduquer les parents
En relais de l’équipe hospitalière, le médecin traitant participe à l’éducation thérapeutique des patients et de leur entourage (parents, aidants) afin qu’ils soient capables d’évaluer et gérer la douleur (prise des antalgiques et connaissance des paliers ;
Le professionnel de santé et/ou la famille doi-vent savoir identifier les signes de CVO graves nécessitant une consultation hospitalière urgente :
– douleur de localisation thoracique avec ou sans gêne respiratoire, priapisme… ;
– résistante aux antalgiques en ambulatoire ou mal tolérée ;
– accompagnée de fièvre, aggravation de l’anémie ou signes neurologiques…
Anémie : chronique et régénérative ?
Au quotidien, l’anémie chronique explique la fatigabilité des enfants, avec un retentissement possible sur la scolarité (difficultés à se concentrer, lenteur…).
Son aggravation aiguë peut mettre en jeu le pronostic vital. Principales causes : séquestration splénique aiguë (augmentation de taille de la rate de 2 cm associée à une chute du taux d’hémoglobine de base d’au moins 2 g/dL) et primo-infection à Parvovirus B19. Les signes doivent être connus du patient et de son entourage (se rendre aux urgences) :
– pâleur palmo-plantaire ou conjonctivale ;
– essoufflement ou fatigabilité inhabituels ;
– perte d’appétit ou somnolence accrue, surtout chez le nourrisson ;
– aggravation de l’ictère cutanéo-conjonctival et apparition d’urines plus foncées…
Risque infectieux : le prévenir est crucial
Respect du calendrier vaccinal
Le risque infectieux est particulièrement important vis-à-vis des germes encapsulés, en premier lieu le pneumocoque mais aussi Haemophilus influenzae, méningocoques et salmonelles, responsables de tableaux invasifs sévères, de localisations variées (sepsis, méningite, pneumonie, ostéomyélite) et potentiellement fulminants.
Dès l’âge de 2 mois, le nourrisson reçoit une anti- bioprophylaxie : Oracilline à raison de 100 000 U/kg/j en 2 ou 3 prises quotidiennes (puis à partir de 10 kg : 50 000 U/kg/j) ; on la poursuit jusqu’à l’âge de 5 ans au moins (généralement jusqu’à l’adolescence).
Le calendrier vaccinal doit être adapté (
Malgré cela, en Angleterre, en 2015, le risque d’infections invasives à pneumocoque (IIP) restait chez l’enfant drépanocytaire 36 fois supérieur à celui de la population pédiatrique générale. Les IIP n’ont pas été éradiquées ; leur recul après l’âge de 5 ans et l’implication de sérotypes non vaccinaux posent la question de la durée de la prophylaxie par Oracilline. Il est donc très important d’expliquer son but à chaque consultation, de remotiver la famille et plus tard l’enfant.
Le risque d’hospitalisation pour grippe des enfants ayant un SDM est très élevé par rapport à celui de population générale pédiatrique, multiplié par 2 versus celui des malades atteints de mucoviscidose. L’infection peut facilement se compliquer d’un syndrome thoracique aigu (STA). Ainsi, la vaccination annuelle des patients et idéalement de leur entourage est recommandée.
L’arrivée de 3 vaccins tétravalents (Fluarix Tetra et Vaxigrip Tetra à partir de 6 mois, et Influvac Tetra à partir de 3 ans) améliore le spectre (2 souches A et 2 B) ; la primovaccination jusqu’à l’âge de 8 ans révolus nécessite toujours 2 injections espacées de 1 mois, à dose entière (0,5 mL).
Les autres vaccinations prévues par le calendrier ne doivent être ni retardées ni négligées, ce qui peut impliquer certains mois jusqu’à 3 injections le même jour (à réaliser dans la face latéro-externe du quadriceps, avec 2 piqûres/cuisse espacées de 2 cm environ). Il est conseillé d’associer du paracétamol, car fièvre et douleur chez l’enfant drépanocytaire sont des signes d’alerte.
Tous ces vaccins sont pris en charge à 100 % dans le cadre de l’ALD ; ce n’est pas le cas pour ceux recommandés lors de voyages en zones d’endémie (fièvre jaune, typhoïde, hépatite A).
La grande difficulté actuelle est de suivre ces recommandations malgré les pénuries et ruptures de stock, rendant les vaccins indisponibles en ville.
Gestion de la fièvre
Toute fièvre > 38,5 °C chez les moins de 3 ans impose une consultation aux urgences de proximité. Quel que soit l’âge, en cas d’aspect toxique (teint gris, asthénie, pâleur, geignements, troubles de conscience) ou de température > 39,5 °C, une antibiothérapie efficace contre le pneumocoque (ceftriaxone ou amoxicilline à forte dose selon l’état clinique) est systématiquement instaurée, avec une surveillance hospitalière. Dans de rares situations (âge > 3 ans, site infectieux identifié, parents éduqués et fiables, accès facile aux urgences), après initiation de l’antibiothérapie, une prise en charge ambulatoire peut être envisagée.
Situations spécifiques
Il existe un rapport intriguant entre paludisme et drépanocytose, avec un contraste entre la forte mortalité chez les patients homozygotes et le maintien de la prévalence du gène drépanocytaire (polymorphisme équilibré). En effet, les porteurs sains du trait drépanocytaire (hétérozygotes S/A) sont relativement protégés contre les accès palustres graves, ce qui expliquerait que cette mutation ait été sélectionnée dans les régions très exposées au paludisme. Toutefois, chez les malades, ce dernier est la première cause de CVO et d’anémie sévère dans les pays endémiques. En cas de voyage à risque, la prophylaxie est donc indispensable.
L’érythrovirus (Parvovirus B 19) est responsable chez l’enfant du mégalérythème épidémique. L’arrêt temporaire de l’érythropoïèse entraîne une anémie sévère mais d’installation progressive, parfois assez bien supportée. Ce virus étant très contagieux, la fratrie (si atteinte de drépanocytose) doit être surveillée biologiquement et cliniquement lors d’un cas familial. Il peut également induire une séquestration splénique aiguë, des infarctus cérébraux silencieux, une nécrose médullaire aiguë. L’immunité post-infection est durable, sans récidive. L’hydroxyurée pourrait peut- être atténuer les symptômes.
Formes sévères : intensifier le traitement ?
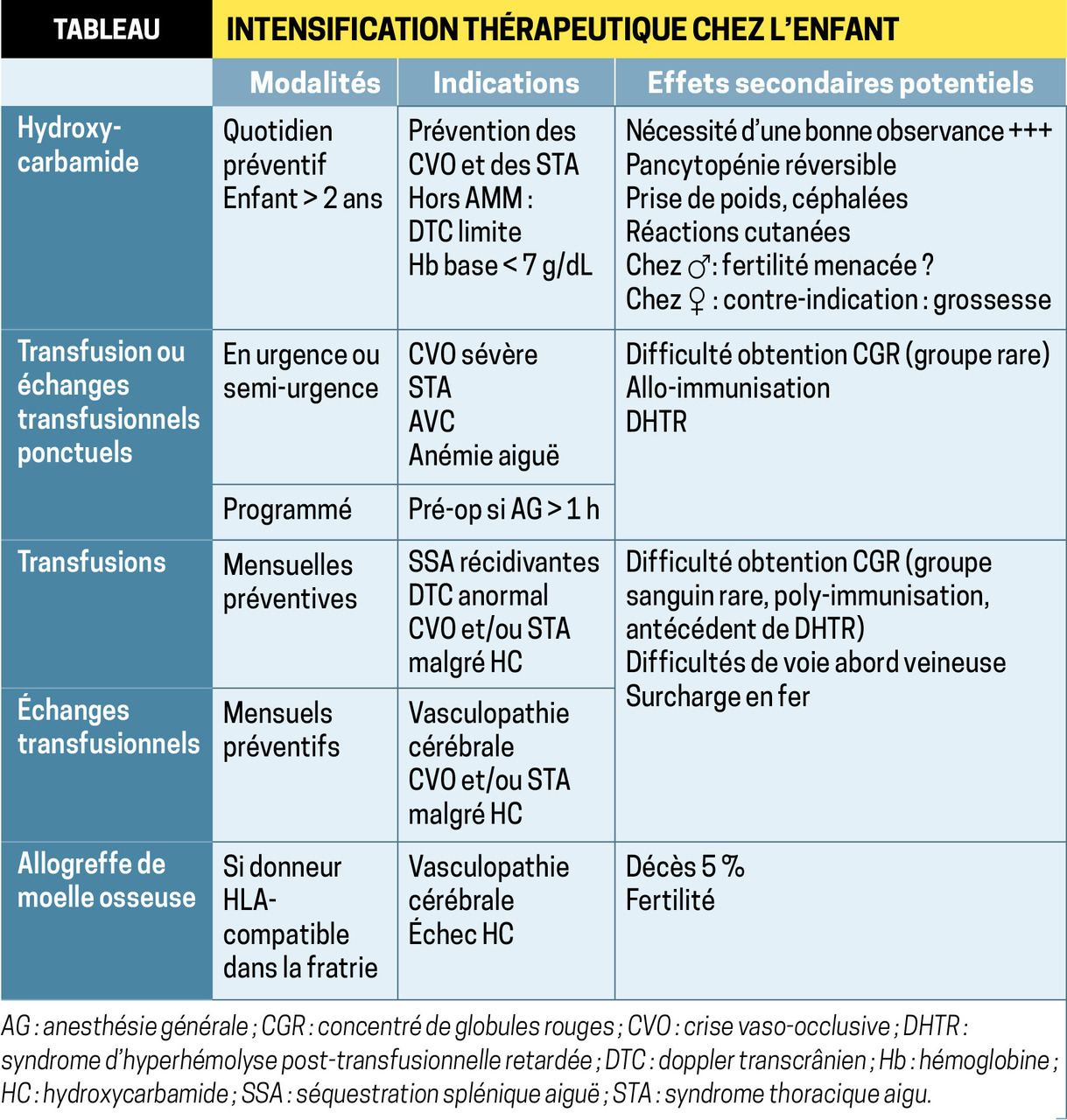
Hydroxycarbamide
L’HC est relativement peu coûteuse. À l’heure actuelle, environ 50 % des enfants ont une drépanocytose sévère sur le plan vaso-occlusif et pourraient donc en bénéficier ; plus de 20 % des jeunes patients suivis à l’hôpital Trousseau sont traités par cette molécule (efficace dans la majorité des cas).
L’HC augmente l’expression de l’hémoglobine fœtale (par rapport aux taux antérieurs, variables selon les enfants), qui s’intercale entre les molécules d’HbS en diminuant leur polymérisation et donc la falciformation responsable des crises douloureuses. L’HC aurait d’autres effets bénéfiques : diminution de l’adhésion des globules rouges à l’endothélium vasculaire, de l’activation des leucocytes, vasodilatation puissante via l’augmentation du monoxyde d’azote. Ainsi, elle permet de réduire de manière significative la fréquence des CVO et des STA, le nombre et la durée des hospitalisations ainsi que les besoins transfusionnels. Sur le plan biologique, outre l’HbF, elle augmente le taux d’Hb d’environ 0,5 à 1 g/dL ainsi que le volume globulaire moyen (indicateur d’une bonne obser- vance), et diminue le nombre des neutrophiles.
Indication officielle (AMM) : prévention des CVO récurrentes y compris celle du STA, à partir de 2 ans, chez les patients symptomatiques. De plus en plus d’équipes proposent ce traitement après une seule CVO ou un seul STA, s’ils sont très sévères.
Il est également prescrit afin d’augmenter le taux d’Hb de base (si < 7 g/dL) et/ou d’améliorer la circulation cérébrale chez l’enfant ayant un DTC limite sans anomalie à l’angio-IRM cérébrale. Aux États-Unis, l’HC est proposée à tous les nourrissons > 9 mois quelle que soit la gravité de la maladie dans l’objectif d’empêcher l’altération de la fonction d’organes (rein, rate…).
L’HC est instaurée dans un centre hospitalier de référence ou de compétence. La posologie initiale, 15 mg/kg/j, est augmentée par paliers de 2,5 à 5 mg/kg/j, après vérification de la NFS, jusqu’à la dose d’entretien (entre 20 et 25 mg/kg/j). En cas de non-réponse clinique, elle peut atteindre 30 voire 35 mg/kg/j, sous étroite surveillance hématologique (comme aux États- Unis). Les comprimés (100 mg et 1 000 mg, quadri- sécables) peuvent se désagréger immédiatement avant l’ingestion, dans une petite cuillère avec un peu d’eau (1 prise/j, pas de nécessité d’être à jeun ; se laver les mains avant et après les avoir manipulés). En cas de toxicité hématologique (neutrophiles < 2 000/mm3, plaquettes < 80 000/mm3, Hb < 4,5 g/dL, réticulocytes < 80 000/mm3 si Hb < 9 g/dL), arrêt temporaire jusqu’à normalisation, en 2 semaines habituellement, puis reprise à dose réduite. Il faut vérifier les fonctions hématologique, rénale et hépatique 15 jours après toute augmentation de dose, puis tous les 2 à 3 mois (plus souvent si posologie de 30-35 mg/kg/j).
La durée de traitement dépend de l’état clinique et hématologique de l’enfant ; en général, plusieurs mois ou années.
Effets secondaires par ordre de fréquence : neutro- pénie, thrombopénie, anémie, toutes réversibles ; céphalées, réactions cutanées (pigmentation unguéale, sécheresse), prise de poids. Chez la femme, il faut l’arrêter 3 à 6 mois avant une grossesse (effet non connu sur le fœtus) ; l’allaitement est contre-indiqué. Un impact sur la fertilité masculine est décrit (oligo- spermie et azoospermie réversibles, données manquantes chez l’enfant), même si on peut incriminer aussi la sévérité de la maladie. Ainsi, une cryopréservation de sperme est proposée en amont à partir de l’adolescence. La tolérance à long terme est bonne ; pas d’effet rapporté sur la croissance ni de survenue de cancers secondaires. La prise de ce médicament ne contre-indique aucun vaccin même vivant.
L’HC est une des avancées majeures de ces 20 dernières années. Une bonne observance est primordiale, parfois difficile à respecter. Elle peut être améliorée grâce à l’éducation thérapeutique (mallette Drépacure conçue par le groupe de travail de la filière MCGRE), l’utilisation d’un pilulier et un travail de fond sur les représentations et les répercussions psychiques de la maladie.
Transfusions : de plus en plus fréquentes
Ce traitement est fait en urgence (CVO, STA, AVC, anémie grave par séquestration splénique aiguë [SSA] ou par érythroblastopénie à Parvovirus B19) ou de façon chronique : transfusions simples ou échanges transfusionnels (saignée-transfusion) en prévention de certaines complications (SSA récidivantes avant splénectomie jamais réalisée avant l’âge de 2 ans, vasculopathie cérébrale afin de réduire le risque d’AVC, CVO et/ou STA récidivants malgré un traitement par HC bien conduit) ou en préopératoire (si anesthésie générale > 1 h). La transfusion simple ou les échanges de concentrés de globules rouges (CGR) visent à corriger et/ou maintenir le taux d’Hb ≥ 8 g/dL en apportant des érythrocytes, et aussi abaisser le pourcentage d’HbS en dessous de 30 à 40 % grâce à l’HbA.
Il importe cependant de bien peser le bénéfice/risque au préalable et de ne pas se fier à la seule valeur du taux d’Hb. En effet, une RAI et une épreuve de compatibilité directe négatives n’éliminent pas totalement une allo-immunisation ni le risque d’une hémolyse post-transfusionnelle.
Les patients atteints de drépanocytose ont de multiples particularités immuno-hématologiques qui peuvent allonger les délais pour obtenir un CGR compatible et complexifient l’approvisionnement (groupe sanguin rare, poly-immunisation…).
Les besoins transfusionnels doivent être anticipés avec le site local de l’EFS, qui fera appel au Centre national de référence pour les groupes sanguins (CNRGS), coordinateur du « programme sang rare ». Environ 30 % des demandes de sang rare en France concernent des patients drépanocytaires.7
L’hyperhémolyse post-transfusionnelle retardée (DHTR) est une complication rare mais potentiellement gravissime. Elle se caractérise par une chute importante de l’Hb, en dessous du niveau prétransfusionnel, ce qui traduit une destruction à la fois des hématies transfusées et d’une partie des globules rouges autologues. Une nouvelle transfusion exacerbe alors le plus souvent la chute de l’Hb mettant en jeu le pronostic vital. Cette hyperhémolyse est difficile à diagnostiquer car elle peut mimer une nouvelle crise drépanocytaire. Ainsi, toute CVO survenant dans les 3 à 15 jours suivant une transfusion doit alerter, surtout si associée à des signes cliniques d’hémolyse (pâleur, ictère, urines foncées, forte augmentation des LDH, hémoglobinurie). Le diagnostic est confirmé par le dosage de l’HbA, qui est effondré. Les RAI peuvent mettre en évidence un allo- ou un auto-anticorps mais de façon inconstante. Le patient doit être adressé vers un centre de référence avec service de soins continus ou de réanimation. Il est indispensable d’éduquer malades et médecins à en faire le diagnostic afin d’éviter un nouvel acte transfusionnel potentiellement fatal.
La transfusion chronique entraîne un risque de surcharge en fer, avec des conséquences essentiellement hépatiques. Le recours à des érythraphérèses (soustraction sélective des hématies, compensée par des CGR à l’aide d’un séparateur de cellules) plutôt qu’à des échanges manuels diminue ce risque. Dans certains cas, un chélateur du fer (per os) est nécessaire.
Allogreffe de moelle
Perspectives
Accompagnement social
Certains enfants ont des difficultés scolaires liées à un absentéisme en rapport avec les CVO intempestives (hospitalisées ou traitées à domicile) mais aussi avec la fatigabilité liée à l’anémie chronique et parfois, une vasculopathie cérébrale silencieuse.
En outre, la maladie peut provoquer, pour les parents, des absences professionnelles répétées ou prolongées. Dans ces cas, des aides peuvent être proposées (
Scolarité et vie professionnelle
Une auxiliaire de vie scolaire peut faciliter l’intégration à l’école des enfants bénéficiant de l’AEEH. Elle intervient dans la classe, aide l’élève à suivre ou à comprendre les cours et à réaliser le travail demandé sous la responsabilité pédagogique de l’enseignant.
Dans les cas les plus graves, d’autres aménagements sont possibles, comme le SESSAD (service d’éducation spéciale et de soins à domicile). Ce service mobile du secteur médico-social apporte aux familles conseils et accompagnement afin de favoriser l’inclusion scolaire grâce à des moyens médicaux, paramédicaux, éducatifs et pédagogiques (actes médicaux spécialisés, soutien dispensé par un enseignant spécialisé).
Il faut aborder la question du projet professionnel précocement et régulièrement avec le jeune patient et ses parents, car la maladie interdit certaines filières : sport de haut niveau, travail en altitude (métiers de l’aéronautique), ou changements de température brutaux (cuisinier…). À l’âge adulte, le patient peut parfois bénéficier d’un poste protégé s’il est reconnu travailleur handicapé (RQTH).
Les associations de lutte contre la drépanocytose sont un relais d’information important sur ces questions inhérentes à la vie quotidienne.
Rôle des soignants de ville
1. De quoi parle-t-on ?
Syndrome drépanocytaire majeur (SDM) : ensemble des hémoglobinopathies liées à la synthèse d’une hémoglobine anormale, l’HbS. Soit 3 formes génétiques principales : homozygotes SS (la plus fréquente), hétérozygotes composites SC ou S-β-thalassémies. Ils affectent principalement les populations d’Afrique subsaharienne, des Antilles et d’Afrique du Nord.
Crises vaso-occlusives (CVO) : épisodes aigus secondaires à la falciformation des hématies, entraînant des phénomènes pro-inflammatoires et ischémiques très douloureux, de localisation généralement osseuse. Avant 2 ans : œdèmes des extrêmités volontiers fébriles (syndrome pied-main).
Hémoglobine de base : taux de référence du patient, en dehors de toute complication aiguë et/ou transfusion.
Syndrome thoracique aigu (STA) : nouvel infiltrat pulmonaire chez un patient drépanocytaire ayant des symptômes respiratoires, une fièvre ou des douleurs thoraciques. Il est d’origine plurifactorielle et peut aboutir rapidement à une détresse respiratoire aiguë nécessitant une ventilation le plus souvent non invasive.
2. Maniement des antalgiques lors d’une CVO
Paracétamol : 30 mg/kg lors de la première prise à partir de 1 an puis 15 mg/kg toutes les 6 heures sans dépasser 1 g par prise.
Si algie persistant plus de 30-40 minutes et en l’absence de déshydratation : ibuprofène (10 mg/kg/8 h ou 7,5 mg/kg/6 h sans dépasser 400 mg/prise) en alternance avec paracétamol, toutes les 6 heures.
En cas de douleur très intense : tramadol (1 à 2 mg/kg/ toutes les 6 heures sans dépasser 8 mg/kg/j ; 1re prescription hospitalière).
Hyperhydratation en même temps +++ (per os si possible : 2 L/m/J).
Codéine à partir de 12 ans (en association avec le paracétamol).
3. Nouveautés spécifiques du calendrier vaccinal
Contre le pneumocoque. Prevenar : 3 injections à 2, 3 et 4 mois (asplénie et haut risque d’IIP), avec un rappel dès 11 mois. Vaccin polyosidique (Pneumovax) : à 24 mois pour élargir le spectre des sérotypes ; il est maintenant possible de réadministrer une nouvelle dose (et une seule) 5 ans après (vers 7 ans).
La vaccination contre le méningocoque C (Neisvac) a été avancée pour tous à l’âge de 5 mois, puis rappel à 1 an. Le vaccin conjugué ACYW est possible à partir de 6 semaines, avec un schéma à 2 doses espacées de 2 mois et un rappel à l’âge de 1 an : seul Nimenrix a eu cette extension d’AMM. Un rappel tous les 5 ans est nécessaire dans ce contexte d’asplénie, ce d’autant que les enfants drépanocytaires sont souvent des voyageurs en zone d’endémie. On peut également faire une injection de Neisvac à l’âge de 4 mois, puis un rappel à 12 mois avec Nimenrix.
Le vaccin contre le méningocoque B est également recommandé. Une extension d’AMM européenne de Bexsero permet désormais un schéma à 2 doses au lieu de 3 : à 3 et 5 mois, plus un rappel entre 12 et 15 mois. La nécessité d’une injection ultérieure n’est pas établie. Il est conseillé d’associer du paracétamol.
4. Quelles prestations sociales ?
ALD (affection de longue durée)
Cette prestation, attribuée dès la confirmation diagnostique, permet l’exonération des soins en rapport avec la maladie. Le dossier initial est rempli par le pédiatre hospitalier du centre de référence ou de compétence.
AEEH : allocation d’éducation enfant handicapé
Non soumise à des conditions de ressource, son attribution est coordonnée par les maisons départementales des personnes handicapées (MDPH) et permet la reconnaissance du degré de handicap de l’enfant de moins de 20 ans (versement d’une allocation, mise en place d’aides à la scolarité ou autres dispositifs…).
Congé de présence parentale
Si la maladie s’aggrave (programme d’échanges transfusionnels, AVC…), un parent peut se trouver obligé de suspendre son activité salariée. Ce congé est attribué sans condition d’ancienneté pour une période maximale de 310 jours ouvrés, par enfant et par maladie, accident ou handicap. À la place de sa rémunération, il perçoit l’allocation journalière de présence parentale (AJPP).
2. HAS. Syndromes drépanocytaires majeurs de l’enfant et de l’adolescent. Protocole national de diagnostic et de soins pour une maladie rare (PNDS). Janvier 2010. https://bit.ly/2GX4dld
3. Charache S, Terrin ML, Moore RD, et al.; Investigators of the Multicenter Study of Hydroxyurea in Sickle Cell Anemia. Effect of hydroxyurea on the frequency of painful crises in sickle cell anemia. N Engl J Med 1995;332:1317-22.
4. Ferster A, Vermylen C, Cornu G, et al. Hydroxyurea for treatment of severe sickle cell anemia: a pediatric clinical trial. Blood 1996;88:1960-4.
5. Stepanian A, Betolaud PO, Mesples B, et al. Allo-immunisation anti- érythrocytaire chez les sujets atteints d’un syndrome drépanocytaire majeur: étude d’une cohorte pédiatrique. Transfus Clin Biol 2011;18:330.
6. Allali S, Peyrard T, Amiranoff D, et al. Prevalence and risk factors for red blood cell alloimmunization in 175 children with sickle cell disease in a French university hospital reference centre. Br J Haematol 2017;177:641-7.
7. Peyrard T. The French national rare blood program. Immunohematology 2016;32:23-5.
8. Runel-Belliard C, Lesprit E, Quinet B, Grimprel E. Sickle cell children traveling abroad: primary risk is infection. J Travel Med 2009;16:253-7.
9. Niakaté A. Le médecin généraliste et le patient voyageur. Concours Med 2016;138;305-7.
HCSP. Vaccinations des patients immunodéprimés et aspléniques.Décembre 2014. https://bit.ly/2XkTPcF
Recommandations sanitaires pour les voyageurs, 2018. BEH du 25 mai 2018.
Pour les ruptures de stock : sites Infovac France et Ansm, au mieux en s’inscrivant pour recevoir les alertes.

 Encadrés
Encadrés