Selon la classification du DSM-5, une durée minimale du trouble de 6 mois et sa manifestation dans 75-100 % des cas sont nécessaires pour poser le diagnostic.
Cette nouvelle définition permet de rassurer les hommes ayant une symptomatologie récente ou des pannes occasionnelles, mais ne doit pas dissuader le praticien de débuter la prise en charge. En effet, cette dernière est d’autant plus efficace que le diagnostic est précoce et que l’homme n’est pas entré dans le cercle vicieux de l’angoisse de performance.
On dispose de nombreux outils pour évaluer la dysfonction érectile (Sexual Health Inventory for Men [SHIM], International Index of Erectile Fonction [IIEF], Erection Hardness Score [EHS], Quality of Erection Questionnaire [QEQ], Self-Esteem And Relationship questionnaire [SEAR]…). Le score EHS de rigidité de l’érection (
Plusieurs caractéristiques cliniques gardent toute leur valeur :
– une dysfonction érectile réactionnelle, situationnelle, avec des érections réflexes de bonne qualité, évoque une problématique psychogène prédominante ;
– les érections nocturnes réflexes étant testostérone-dépendantes, leur disparition doit faire rechercher un facteur organique et/ou un déficit en testostérone ;
– l’absence de capacité érectile résiduelle (rigidité suffisante pour une pénétration) est un facteur organique pronostique péjoratif.
Cependant, l’approche classique opposant dysfonction érectile organique et psychogène est aujourd’hui remplacée par une vision globale, multifactorielle, interactive, intégrant des facteurs biologiques (organiques et iatrogènes ;
La responsabilité des traitements, notamment des antihypertenseurs, est souvent surestimée. Les seuls médicaments antihypertenseurs paraissant, après ajustement sur les comorbidités, comme potentiellement délétères pour la fonction érectile sont les diurétiques thiazidiques, la spironolactone et les bêtabloquants non sélectifs.
Les inhibiteurs calciques et les IEC n’ont pas d’effet. Paradoxalement, les ARA II (sartans) auraient même un impact positif. Il faut donc savoir rassurer et veiller à ce qu’un hypertendu n’arrête pas son traitement antihypertenseur, l’exposant à la survenue d’un accident cardiovasculaire aigu.
Un symptôme sentinelle
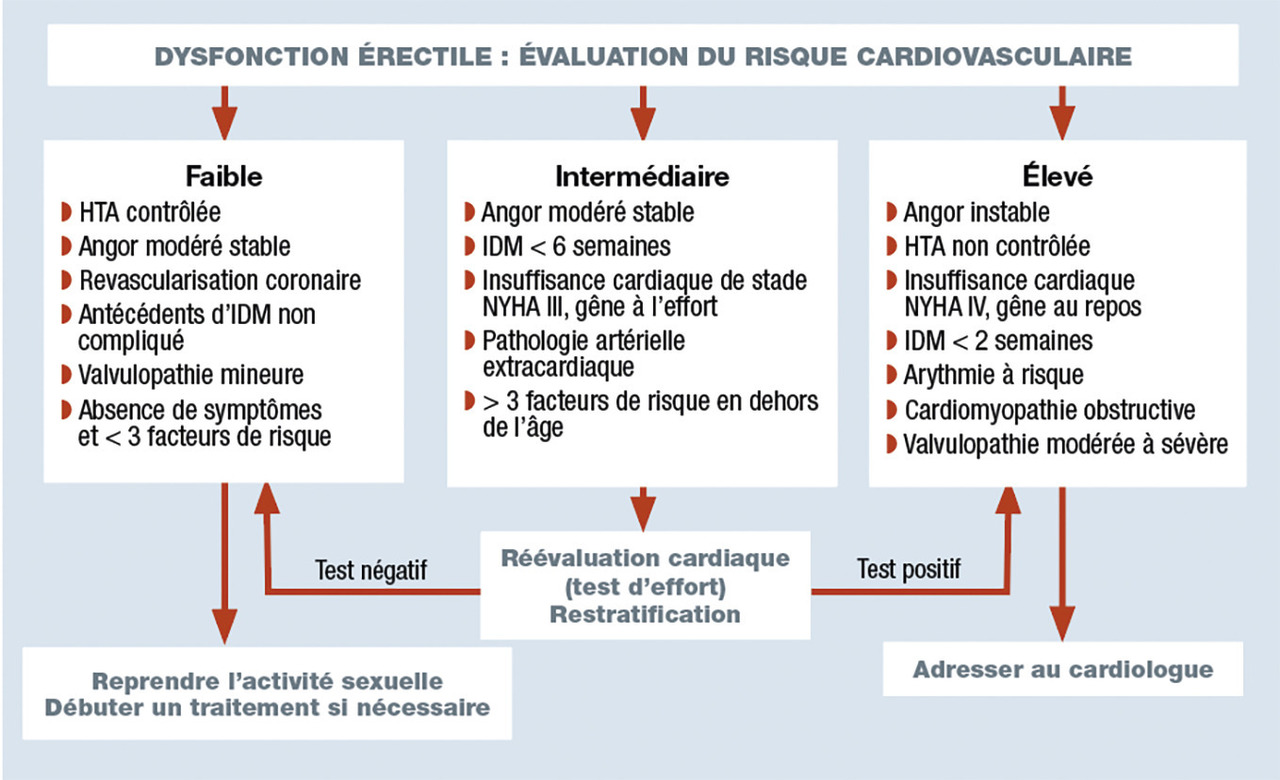
C’est un marqueur avéré de maladie endothéliale et un symptôme sentinelle d’athérosclérose coronaire infraclinique. Selon la 3e Conférence de consensus de Princeton, la prise en charge de la dysfonction érectile doit être considérée comme une occasion de réduire le « fardeau » cardiovasculaire (
Dans l’hypertrophie bénigne prostatique, la prévalence de la dysfonction érectile est de 43 à 82,5 %. Ces dernières années, de nombreuses études ont souligné les liens épidémiologiques mais également physiopathologiques entre ces 2 pathologies, et l’efficacité d’un inhibiteur de la phosphodiestérase 5 (tadalafil)dans cette double indication.
Quel bilan biologique ?
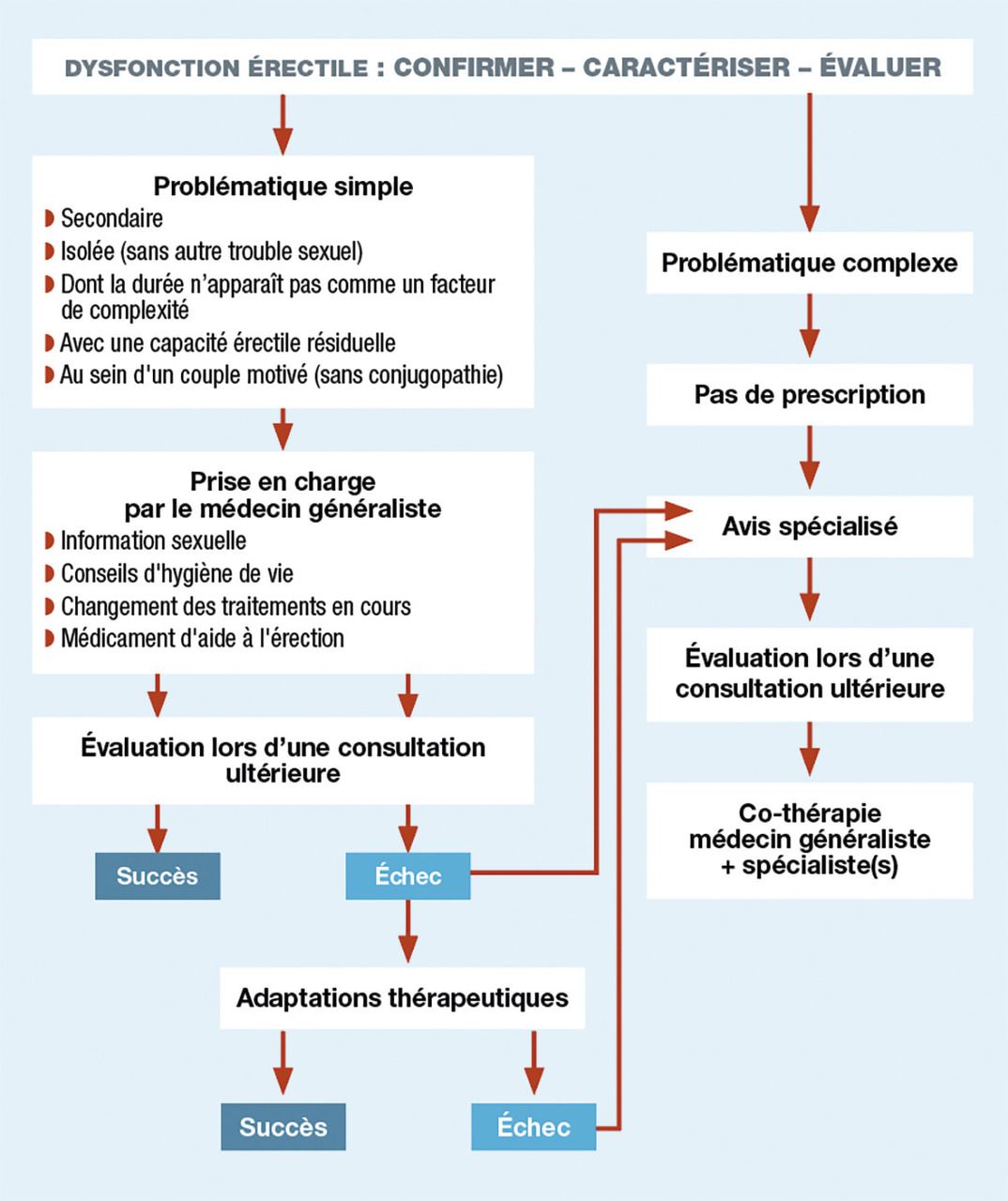
Règles d’or de la prise en charge
Il faut évaluer la demande réelle du sujet en tenant compte du couple (
Le patient – et éventuellement sa [son] partenaire – doit participer autant que possible au choix du traitement. Il est fondamental de lui apporter une information détaillée sur les modalités de prise, les bénéfices attendus, les risques possibles, le coût du traitement.
Avant d’envisager une thérapie pharmacologique, il est recommandé de sensibiliser le patient à l’importance de l’hygiène de vie, afin de combattre le syndrome métabolique : alimentation équilibrée, sevrage du tabac et d’éventuelles autres substances addictives, lutte contre la sédentarité. Il faut insister sur les mesures hygiénodiététiques, y compris en cas de prescription médicamenteuse, pour obtenir une meilleure réponse thérapeutique.
Préalablement au traitement d’aide à l’érection, vérifier que le patient peut facilement monter 2 étages ou marcher rapidement durant 20 minutes.
Inhibiteurs de la PDE5
Quel que soit le produit, les taux d’efficacité sont de l’ordre de 65 à 85 %, les causes d’échec pouvant être organiques (atteinte neurogène), psychogènes ou liées à l’absence d’explications lors de la prescription. Ces médicaments nécessitent une stimulation sexuelle, et l’effet – qui peut être visible dès la première prise – s’améliore souvent au fil du traitement, raison pour laquelle un minimum de 4 à 6 essais est recommandé.
Cette classe pâtit encore d’une réputation de cardiotoxicité. Mais les effets secondaires sont presque toujours d’intensité minime – bouffées vasomotrices, céphalées, sensations vertigineuses, altération de la vision des couleurs, dyspepsie, palpitations, congestion nasale, et douleurs dorsales pour le tadalafil –, dépendants de la dose et régressifs à l’arrêt.
Attention aux interactions médicamenteuses avec les inhibiteurs du cytochrome P450 : érythromycine, kétoconazole, ritonavir, rifampicine, jus de pamplemousse augmentent la demi-vie des 4 inhibiteurs de la PDE5 en diminuant leur catabolisme hépatique.
Le respect strict des contre-indications est fondamental (infarctus, AVC récent < 6 mois, insuffisance cardiaque non contrôlée, angor instable, hypotension). La principale est la prise de dérivés nitrés ou donneurs de monoxyde d’azote (risque de choc ;
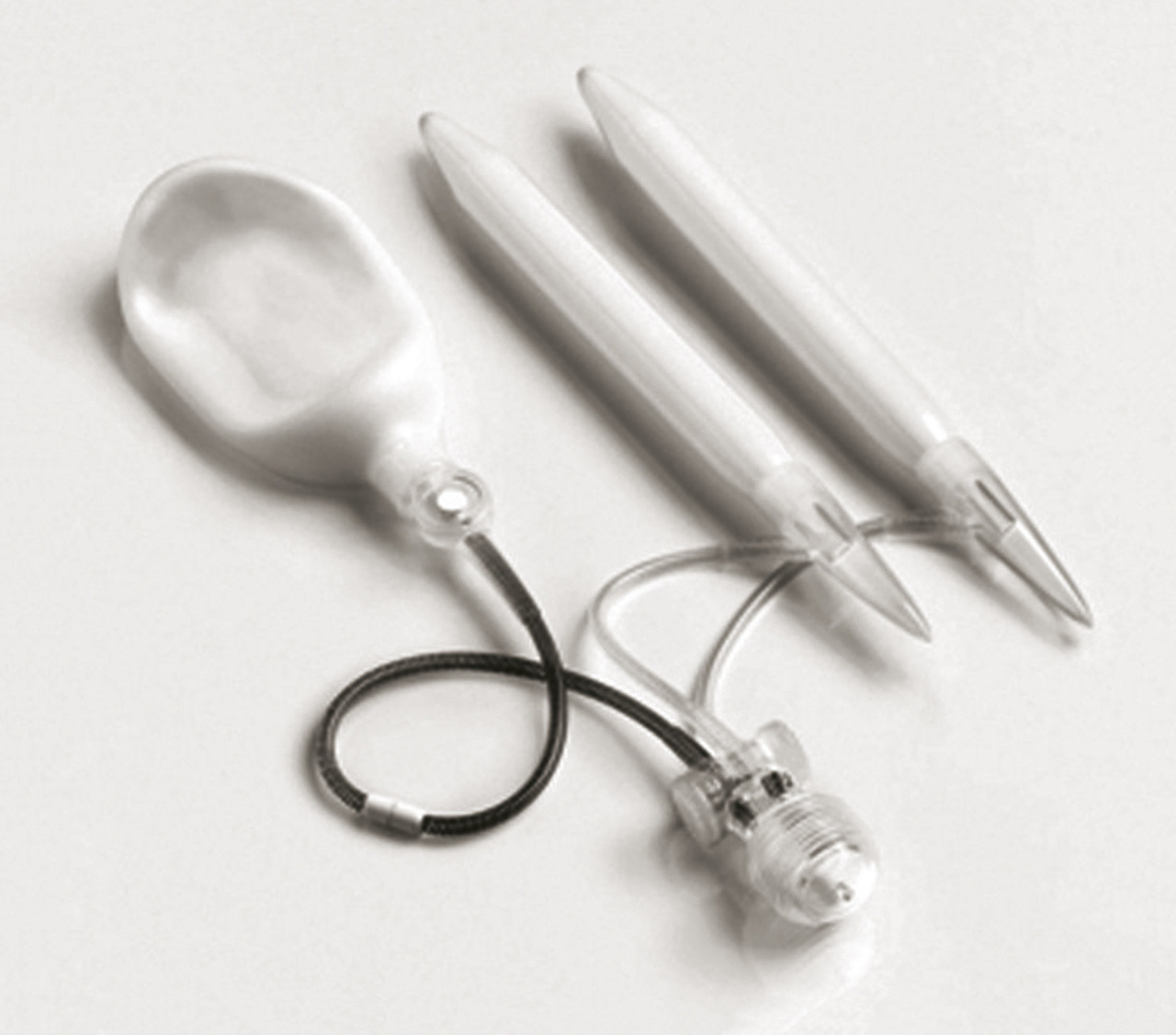
Thérapies locales ou injectables
Aujourd’hui, la seule molécule disponible en France est la prostaglandine E1 (PGE1) ou alprostadil (injection intracaverneuse [IIC] ou application intra-urétrale), qui agit par une voie AMPc-dépendante.
L’efficacité des injections intracaverneuses de PGE1 (Edex et Caverject aux dosages de 10 et 20 µg) est de 55 à 93 %. Il faut faire un ou plusieurs tests au cabinet pour enseigner les auto-injections au patient et déterminer la dose optimale (commencer à 2,5 µg et augmenter progressivement, afin de prévenir le priapisme).
Principaux effets secondaires : douleurs (jusqu’à 29 % des cas), hématomes au point de ponction, érections prolongées, priapismes (1-2 %), fibroses localisées des corps caverneux. Pas de contre-indication dans les pathologies cardiovasculaires, ni en cas de thérapie anticoagulante.
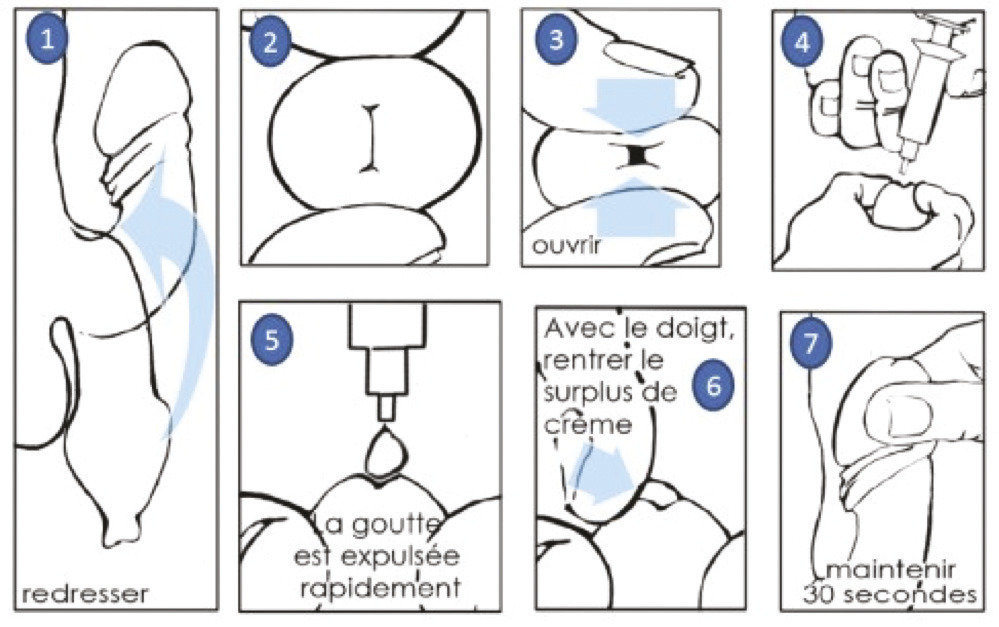
La voie intra-urétrale a l’avantage d’être moins invasive. L’alprostadil topique (Vitaros 300 crème ;
Comme les IIC de PGE1, Vitaros est remboursé dans certaines indications (
L’information du patient est essentielle : stimulation pénienne de plusieurs minutes avant le rapport indispensable, cas exceptionnels de priapisme, conservation au réfrigérateur, port du préservatif obligatoire si la femme n’est pas ménopausée. En raison du passage de l’alprostadil dans le sperme et le liquide séminal, éviter la prescription chez un patient dont la partenaire est enceinte ou susceptible de l’être. Avant de conclure à l’inefficacité, mener un interrogatoire soigneux sur les conditions d’utilisation : on retrouve fréquemment une prise trop tardive, juste avant le rapport. Les effets secondaires systémiques sont rapportés chez seulement 3 % des hommes traités. L’efficacité clinique observée dans les essais de phases II et III allait jusqu’à 83 %.
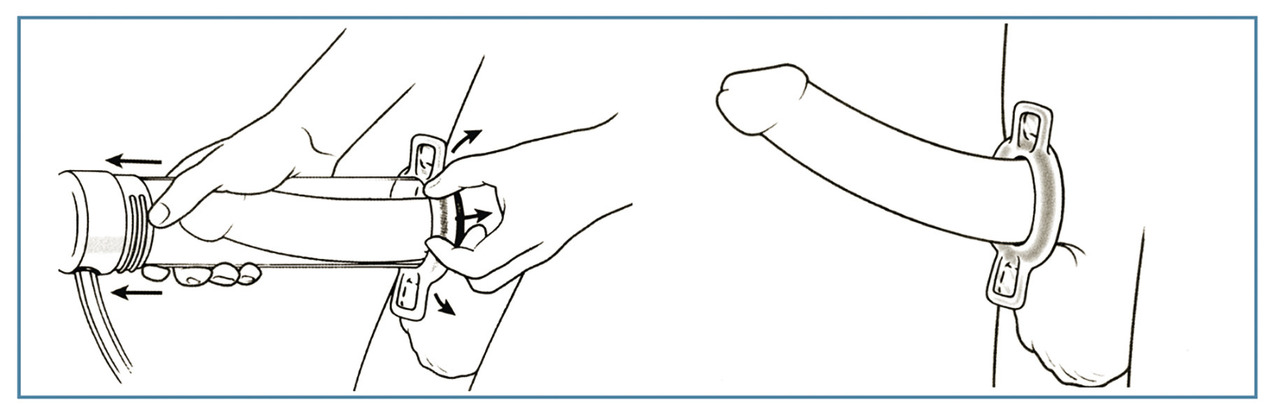
Pompe à dépression ou vacuum
Cet outil peut cependant avoir un intérêt,seul ou en complément d’un autre traitement pharmacologique. Il peut satisfaire un patient âgé désirant obtenir une érection suffisante pour se masturber ou avoir un rapport doux. Il pourrait également avoir une place après une prostatectomie pour maintenir la longueur du pénis, mais les études paraissent insuffisantes.
Implants péniens
Même si la prothèse pénienne est devenue plus efficace et fiable,6 le patient doit bénéficier d’une information précise sur les modalités d’intervention, les suites habituelles et les possibles complications (défaillance mécanique et risque infectieux), bien qu’elles soient moins fréquentes actuellement grâce à l’amélioration des dispositifs et des protocoles chirurgicaux (implants pré-enduits d’antibiotique notamment). D’après une étude récente, 60 % des implants restent fonctionnels après 15 ans d’utilisation. Le taux de satisfaction est de 90 %.
Et demain ?
Dans la dysfonction érectile, elles provoqueraient des microtraumatismes de la membrane cellulaire et un stress mécanique, entraînant une libération de facteurs angiogéniques (VEGF, NO-synthase, facteur de von Willebrand) qui induisent l’angiogenèse et la vascularisation tissulaire. Elles augmenteraient ainsi le flux sanguin et améliorerait la fonction endothéliale.
Dans une étude prospective chez 29 patients atteints de dysfonction érectile sévère en échec des inhibiteurs de la PDE5, une augmentation de 3,5 points du score IIEF a été observée après 2 séances par semaine pendant 3 semaines. L’hémodynamique du pénis était meilleure et le débit sanguin évalué par pléthysmographie accru. Ces résultats ont été confirmés par un essai plus récent, randomisé, en double aveugle, contrôlé chez 58 hommes. Plus de 50 % de ceux recevant le traitement (contre aucun dans le groupe contrôle) ont eu une érection suffisamment rigide pour la pénétration vaginale. Même si aucun effet indésirable immédiat n’a été signalé, les effets à long terme ne sont pas encore connus. Des études multicentriques sur de plus grands effectifs avec un suivi plus long sont attendues.
Parmi les traitements per os, l’apomorphine (Uprima) a été mise sur le marché entre 2001 et 2006 : ce médicament entraînait un temps moyen d’érection de 12 minutes avec environ 50 % d’efficacité, mais au prix d’une mauvaise tolérance (nausées, hypotension). Dans cette même voie, 2 agonistes dopaminergiques spécifiques du récepteur D4 sont actuellement étudiés chez le rat et seraient mieux tolérés. La combinaison d’agents dopaminergiques et d’inhibiteurs de la PDE5 semble prometteuse.
Deux agonistes des récepteurs de la mélanocortine (molécule impliquée dans l’induction de l’érection pénienne et la régulation du comportement sexuel) sont en cours d’expérimentation : le mélanotan II et le brémélanotide. Dans un essai récent, le premier induit une érection chez 17 des 20 hommes qui l’ont reçu, avec une rigidité > 80 % pendant en moyenne 41 minutes. Effets secondaires : nausées et bâillements. Le début de l’érection est différé d’approximativement 2 heures. Le brémélanotide peut être administré par voie intranasale et a un début d’action plus rapide. Dans un essai de phase IIb, une utilisation pendant 3 mois a induit une augmentation significative du score IIEF. Cependant, la tolérance était, là encore, mauvaise (nausées, hypertension).
Plusieurs activateurs solubles de la guanylate cyclase sont à l’étude, au stade préclinique. L’efficacité des inhibiteurs des IPDE5 dépend de la production de GMPc, qui repose, elle, sur l’activation de la guanylate cyclase soluble par le monoxyde d’azote. Chez certains patients, en particulier ceux ayant eu une prostatectomie et les diabétiques, cette voie est perturbée en raison d’une neuropathie.
Un inhibiteur de la Rho-kinase (agissant sur l’enzyme myosine phosphatase du muscle lisse), récemment développé, a montré des résultats prometteurs dans une étude contre placebo et sildénafil.
Un gel de PGE1 (alprostadil) associé à un activateur de l’absorption transmuqueuse à appliquer au niveau du gland, commercialisé au Canada (Topiglan), a entraîné des réponses érectiles, avec des effets secondaires minimes. Son efficacité est améliorée lorsqu’il est donné en combinaison aux inhibiteurs de la PDE5. L’injection intracaverneuse de VIP (vasoactive intestinal peptide) est également en cours d’étude.
La thérapie par cellules souches est une approche innovante (3 types : dérivées des tissus adipeux, de la moelle osseuse ou des muscles). Ces cellules multipotentes auraient des effets bénéfiques sur les tissus endommagés en libérant plusieurs médiateurs moléculaires, qui conduisent le tissu hôte à amorcer une réponse régénératrice ou curative.
Selon un récent essai clinique, l’IIC de cellules de moelle osseuse autologue chez 12 patients ayant une dysfonction érectile post-prostatectomie induirait des améliorations significatives de la satisfaction sexuelle et de la fonction érectile à 6 mois, sans effet secondaire grave.
La thérapie génique est à l’étude : 11 patients ont reçu une IIC d’une dose unique de hMaxi-K, plasmide d’ADN codant le gène de la sous-unité α du canal K du muscle lisse humain. Amélioration soutenue des scores IIEF pendant la durée de l’étude avec les deux posologies les plus élevées.
* IIC : injections intracaverneuses.
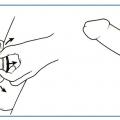
1. Score de rigidité érectile EHS*
Outil mesurant la rigidité et la qualité d’une érection. Il permet également d’évaluer l’efficacité du traitement. C’est une échelle de 1 à 4.
1. Absence d’érection.
2. Le pénis est rigide mais ne permet pas la pénétration.
3. Le pénis est rigide et permet d’obtenir une pénétration de qualité moyenne.
4. La rigidité du pénis est complète (absence de dysfonction érectile).
* EHS : Erection Hardness Score.
2. Facteurs médicaux ou organiques de DE*
Vieillissement
Diabète, pathologies cardiovasculaires
Cardiopathie ischémique, insuffisance cardiaque, AVC, artériopathies périphériques, HTA, dyslipidémie, obésité et syndrome métabolique
Maladies neurologiques
Parkinson, sclérose en plaques, blessé médullaire, AVC, neuropathie périphérique
Troubles du bas appareil urinaire
Hypertrophie bénigne de la prostate, hyperactivité vésicale
Hypogonadisme, trouble de la fertilité, maladie de Lapeyronie, antécédent de priapisme
Traumatismes
Pelviens périnéaux, fracture de verge
Toutes maladies chroniques
Risque de DE plus marqué (atteinte directe de la pathologie sur l’érection ou majoration de l’impact émotionnel du vécu de la maladie)
Tabac, alcool, toxicomanie
Iatrogénie
• Médicaments : antihypertenseurs de type diurétique et spironolactone, hypolipémiants, fibrates, psychotrop es antidépresseurs et neuroleptiques, inhibiteurs de la 5a-réductase
• Chirurgies pelvipérinéales : cancer de la prostate, de la vessie ou du rectum, du rétropéritoine, de même que la chirurgie pénienne ou testiculaire, radiothérapie et curiethérapie pelvienne
3. Médicaments contre-indiqués avec les IPDE5*
Dérivés nitrés
• Trinitrine : Discotrine, Lénitral, Natispray, Nitriderm, Trinitrine simple Laleuf, Trinipatch
• Isosorbide dinitrate : Isocard, Risordan
• Nitroprussiate de sodium : Nitriate
Donneurs de monoxyde d’azote
• Molsidomine : Corvasal cp, et génériques
Molécules à action de type nitré
• Nicorandil : Ikorel
Autres substances contenant des nitrites
• « Poppers » ou autres produits volatiles utilisés à des fins toxiques ou aphrodisiaques
4. Indications remboursées des IIC* et de Vitaros
• Neuropathie diabétique avérée
• Para- ou tétraplégie
• Séquelles de prostatectomie radicale, cystectomie totale et exérèse colorectale
• Radiothérapie abdomino-pelvienne
• Sclérose en plaques
• Séquelles de priapisme
• Séquelles de chirurgie vasculaire (anévrisme de l’aorte)
• Traumatismes du bassin compliqués de troubles urinaires
2.Cappelleri JC, Bushmakin AG, Symonds T, Schnetzler G. Scoring correspondence in outcomes related to erectile dysfunction treatment on a 4-point scale (SCORE-4). J Sex Med 2009;6:809-19.
3.Hatzichristou D, Kirana PS, Banner L, et al. Diagnosing sexual dysfunction in men and women: sexual history taking and the role of symptom scales and questionnaires. J Sex Med 2016;13:1166-82.
4.Nehra A, Jackson G, Miner M, et al. The Princeton III Consensus recommendations for the management of erectile dysfunction and cardiovascular disease. Mayo Clin Proc 2012;87:766-78.
5.Hatzimouratidis K, Giuliano F, Moncada I, et al.; European Association of Urology. Male sexual dysfunction. Guideline EAU. http://bit.ly/2sc7VR3
6.Levine LA, Becher E, Bella A, et al. penile prosthesis surgery: current recommendations from the International Consultation on Sexual Medicine. J Sex Med 2016;13:489-518.

 Encadrés
Encadrés