Les principaux traitements du cancer de la prostate entraînent des troubles sexuels. Une prise en charge alliant information sur ces effets, sur les règles hygiénodiététiques et sur les traitements possibles doit être réalisée, lors d’une consultation dédiée. Pour minimiser l’impact négatif des traitements du cancer de la prostate sur la fonction sexuelle, la prise en charge comprend des moyens médicamenteux et non médicamenteux.
Les modifications de la sexualité après traitement du cancer de la prostate sont très fréquentes et sources de préoccupation pour les patients et leurs partenaires. Les patients traités par prostatectomie radicale, radiothérapie ou hormonothérapie ont une altération significative à court ou à long terme de la fonction sexuelle et de la qualité de vie.1,2
Compte tenu de la prévalence du cancer de la prostate, de la fréquence des troubles sexuels secondaires aux traitements et de l’ampleur des conséquences psychologiques qui en résultent, des milliers de personnes sont probablement concernées en France.3 La prise en charge de la santé sexuelle devrait donc être au cœur des soins liés au cancer de la prostate.
Les traitements du cancer de la prostate altèrent systématiquement les fonctions sexuelles des patients. Environ 81 à 93 % des patients déclarent qu’ils ont un impact négatif sur leur vie sexuelle, 20 à 58 % des hommes rapportant un arrêt de l’activité sexuelle avec leur partenaire.4 L’image corporelle, l’estime de soi, la perception de la masculinité, l’état de santé général et les relations interpersonnelles sont également négativement affectés.5,6
Une information claire et adaptée doit être délivrée au patient et, idéalement, au partenaire, concernant l’impact attendu des traitements du cancer de la prostate sur la fonction sexuelle du patient et concernant l’impact potentiel au sein du couple. Les traitements des troubles sexuels, incluant notamment des stratégies de réhabilitation érectile, peuvent limiter cet impact et conduire à la récupération de l’activité sexuelle.
Compte tenu de la prévalence du cancer de la prostate, de la fréquence des troubles sexuels secondaires aux traitements et de l’ampleur des conséquences psychologiques qui en résultent, des milliers de personnes sont probablement concernées en France.3 La prise en charge de la santé sexuelle devrait donc être au cœur des soins liés au cancer de la prostate.
Les traitements du cancer de la prostate altèrent systématiquement les fonctions sexuelles des patients. Environ 81 à 93 % des patients déclarent qu’ils ont un impact négatif sur leur vie sexuelle, 20 à 58 % des hommes rapportant un arrêt de l’activité sexuelle avec leur partenaire.4 L’image corporelle, l’estime de soi, la perception de la masculinité, l’état de santé général et les relations interpersonnelles sont également négativement affectés.5,6
Une information claire et adaptée doit être délivrée au patient et, idéalement, au partenaire, concernant l’impact attendu des traitements du cancer de la prostate sur la fonction sexuelle du patient et concernant l’impact potentiel au sein du couple. Les traitements des troubles sexuels, incluant notamment des stratégies de réhabilitation érectile, peuvent limiter cet impact et conduire à la récupération de l’activité sexuelle.
Impacts multiples sur la fonction sexuelle
Tous les traitements du cancer de la prostate peuvent entraîner une dysfonction érectile. La plupart des hommes ne retrouvent pas leur fonction érectile antérieure au traitement, bien qu’une bonne fonction sexuelle avant traitement soit corrélée à une meilleure récupération. Cette relation existe indépendamment du type ou de la technique chirurgicale ou d’irradiation réalisée, et est constatée quel que soit le mode d’évaluation érectile.
D’autres dysfonctions sexuelles peuvent être observées, notamment la dysorgasmie, l’incontinence urinaire lors de l’orgasme, ou climacturie, la perte de longueur et de circonférence du pénis et la courbure du pénis (maladie de Lapeyronie).7 Même si la prévalence de ces dysfonctions est très variable, les patients peuvent subir des conséquences importantes, conduisant à l’évitement des relations sexuelles et à une altération de la qualité de vie.
L’hormonothérapie a des effets négatifs additionnels sur la libido : de nombreux hommes réduisent considérablement leur activité sexuelle ou l’arrêtent complètement. Une dépression, de l’anxiété et des troubles de l’humeur sont fréquemment signalés. Les changements anatomiques qui surviennent secondairement à l’hormonothérapie incluent la perte de la longueur du pénis et du volume testiculaire, la gynécomastie, les troubles de la pilosité et la prise de poids, ce qui peut avoir un impact considérable sur l’image corporelle des patients et sur la confiance en soi.8
D’autres dysfonctions sexuelles peuvent être observées, notamment la dysorgasmie, l’incontinence urinaire lors de l’orgasme, ou climacturie, la perte de longueur et de circonférence du pénis et la courbure du pénis (maladie de Lapeyronie).7 Même si la prévalence de ces dysfonctions est très variable, les patients peuvent subir des conséquences importantes, conduisant à l’évitement des relations sexuelles et à une altération de la qualité de vie.
L’hormonothérapie a des effets négatifs additionnels sur la libido : de nombreux hommes réduisent considérablement leur activité sexuelle ou l’arrêtent complètement. Une dépression, de l’anxiété et des troubles de l’humeur sont fréquemment signalés. Les changements anatomiques qui surviennent secondairement à l’hormonothérapie incluent la perte de la longueur du pénis et du volume testiculaire, la gynécomastie, les troubles de la pilosité et la prise de poids, ce qui peut avoir un impact considérable sur l’image corporelle des patients et sur la confiance en soi.8
Évaluation des troubles sexuels des patients et des partenaires
Une évaluation de la santé sexuelle est nécessaire compte tenu des dysfonctions sexuelles fréquemment rencontrées chez les patients traités pour un cancer de la prostate. L’évaluation des partenaires est utile, car les femmes peuvent présenter une sécheresse vaginale et une baisse du désir après la ménopause.9
Certains questionnaires d’évaluation peuvent être utilisés en consultation : International Index of Erectile Function (IIEF)10 pour l’évaluation de la sévérité de la dysfonction érectile, Erectile Dysfunction Inventory for Treatment and Satisfaction (EDITS)11 pour l’évaluation de l’efficacité du traitement de la dysfonction érectile, Peyronie’s Disease Questionnaire (PDQ)12 lorsqu’une maladie de Lapeyronie est associée aux autres troubles sexuels.
Certains questionnaires d’évaluation peuvent être utilisés en consultation : International Index of Erectile Function (IIEF)10 pour l’évaluation de la sévérité de la dysfonction érectile, Erectile Dysfunction Inventory for Treatment and Satisfaction (EDITS)11 pour l’évaluation de l’efficacité du traitement de la dysfonction érectile, Peyronie’s Disease Questionnaire (PDQ)12 lorsqu’une maladie de Lapeyronie est associée aux autres troubles sexuels.
Trois types de dysfonction sexuelle
Certaines règles hygiénodiététiques doivent être rappelées en consultation. L’activité physique est en effet associée à un risque plus faible de dysfonction érectile tandis que l’obésité, le tabagisme et la consommation d’alcool sont associés à une prévalence plus élevée de dysfonction érectile.13
Une information claire sur les dysfonctions sexuelles secondaires au traitement du cancer de la prostate, tels que les troubles de l’orgasme, la climacturie et la baisse de la libido, notamment dans le cadre d’une consultation sexologique, peut conduire à de meilleurs résultats.14
Une information claire sur les dysfonctions sexuelles secondaires au traitement du cancer de la prostate, tels que les troubles de l’orgasme, la climacturie et la baisse de la libido, notamment dans le cadre d’une consultation sexologique, peut conduire à de meilleurs résultats.14
Dysfonction érectile, le plus souvent
La dysfonction érectile est le trouble le plus fréquent et le plus étudié dans le cadre des traitements du cancer de la prostate. La conservation des bandelettes neurovasculaires au cours d’une prostatectomie radicale permet une meilleure réhabilitation érectile par rapport à une chirurgie non conservatrice.15
La réhabilitation érectile après un cancer de la prostate a pour objectif de minimiser l’impact négatif des traitements du cancer de la prostate sur la fonction sexuelle. Elle inclut une combinaison de traitements médicamenteux et non médicamenteux visant à préserver la longueur du pénis, la fonction érectile et la qualité des tissus caverneux. Les inhibiteurs de la phosphodiestérase de type 5 (iPDE5) sont couramment utilisés.16 Les traitements physiques, notamment par pompe à vide de type vacuum ou par système de traction pénienne, peuvent être proposés et pourraient avoir des avantages sur la préservation érectile et de la longueur du pénis.17
La réhabilitation érectile après un cancer de la prostate a pour objectif de minimiser l’impact négatif des traitements du cancer de la prostate sur la fonction sexuelle. Elle inclut une combinaison de traitements médicamenteux et non médicamenteux visant à préserver la longueur du pénis, la fonction érectile et la qualité des tissus caverneux. Les inhibiteurs de la phosphodiestérase de type 5 (iPDE5) sont couramment utilisés.16 Les traitements physiques, notamment par pompe à vide de type vacuum ou par système de traction pénienne, peuvent être proposés et pourraient avoir des avantages sur la préservation érectile et de la longueur du pénis.17
Altération de l’orgasme associée à d’autres symptômes
Les traitements du cancer de la prostate peuvent consister en l’ablation ou l’irradiation de la prostate, du col de la vessie, des vésicules séminales et des canaux déférents, ce qui peut entraîner une altération de l’orgasme.18 De plus, la dépression, l’altération de la fonction érectile et la réduction de la testostérone secondaires à l’hormonothérapie peuvent réduire davantage les chances d’atteindre l’orgasme ou provoquer une dysorgasmie.
Climacturie bénéficiant de différentes techniques
Il existe un nombre limité d’études évaluant l’efficacité d’une intervention chirurgicale pour le traitement de la climacturie, perte d’urines au moment de l’orgasme. Dans une série de 46 hommes ayant une climacturie et une incontinence urinaire d’effort après prostatectomie radicale, 100 % des hommes ont vu leur climacturie disparaître après la mise en place d’une bandelette transobturatrice, et 84 % ont vu leur incontinence urinaire d’effort traitée efficacement.19
Une amélioration de la climacturie et de l’incontinence urinaire d’effort a également été décrite dans des études portant sur la pose d’une mini-jupette après prostatectomie radicale : plus de 90 % des patients ont noté une résolution significative ou complète de la climacturie.20
Une amélioration de la climacturie et de l’incontinence urinaire d’effort a également été décrite dans des études portant sur la pose d’une mini-jupette après prostatectomie radicale : plus de 90 % des patients ont noté une résolution significative ou complète de la climacturie.20
Traitements de la dysfonction érectile
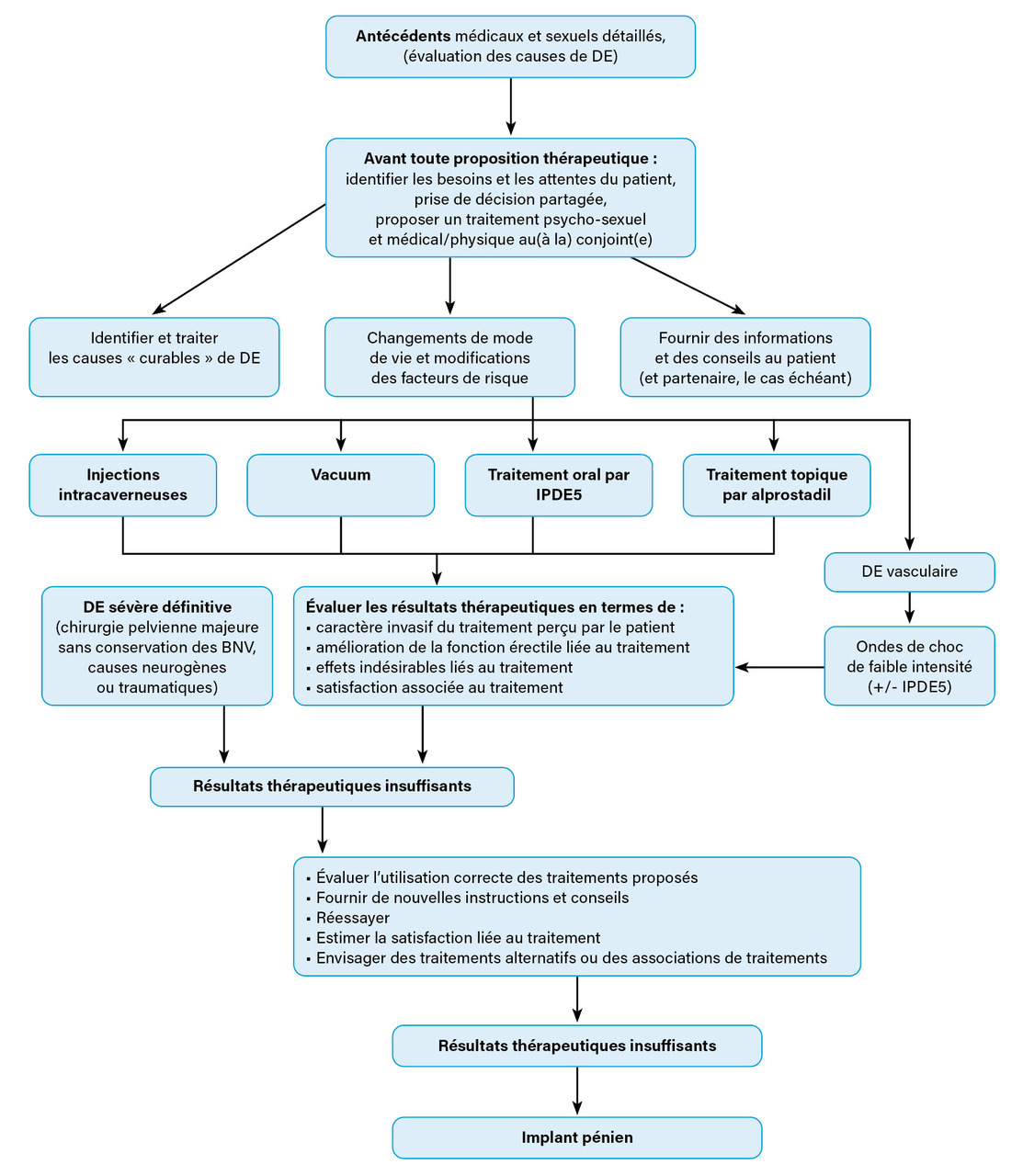
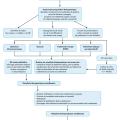
Les modalités de traitement de la dysfonction érectile comprennent les iPDE5 couramment utilisés,16 les injections intracaverneuses, les crèmes intra-urétrales, les traitements physiques, notamment les dispositifs d’érection par pompe à vide (vacuum) ou par système de traction pénienne, et les implants péniens ; ces outils thérapeutiques pourraient avoir des avantages sur la préservation érectile et de la longueur du pénis.17 L’approche du traitement doit être personnalisée : les besoins et attentes des patients doivent être entendues et ils doivent être informés en détail de l’efficacité, des risques et des résultats attendus de l’utilisation de ces outils thérapeutiques (fig. 1 ).
Quatre inhibiteurs de la phosphodiestérase de type 5 équivalents
Quatre iPDE5 disposent d’une autorisation de mise sur le marché (AMM) pour le traitement de la dysfonction érectile :21 le sildénafil, le tadalafil, le vardénafil et l’avanafil. Ils nécessitent une stimulation sexuelle pour faciliter l’érection. À ce jour, il n’existe pas de données provenant d’études multicentriques en double aveugle comparant l’efficacité et/ou la préférence des patients pour l’un ou l’autre des iPDE5. Le choix du médicament dépend de la fréquence des rapports sexuels (utilisation occasionnelle ou traitement régulier) et de l’expérience personnelle du patient.
Par ailleurs, concernant la tolérance cardiovasculaire, les résultats des essais cliniques n’ont montré aucune augmentation des taux d’infarctus du myocarde chez les patients traités par iPDE5, que ce soit dans le cadre d’essais cliniques randomisés ou par rapport aux taux attendus dans des populations masculines appariées en fonction de l’âge. Néanmoins, leur prescription doit être conditionnée à un bilan cardiovasculaire chez les patients à haut risque cardiovasculaire ou à risque intermédiaire, sur la base des recommandations du consensus de Princeton III.22
L’utilisation de dérivés nitrés constitue une contre-indication absolue aux iPDE5.
Les effets indésirables les plus fréquents sont les céphalées, les bouffées de chaleur, la dyspepsie et la congestion nasale.
Par ailleurs, concernant la tolérance cardiovasculaire, les résultats des essais cliniques n’ont montré aucune augmentation des taux d’infarctus du myocarde chez les patients traités par iPDE5, que ce soit dans le cadre d’essais cliniques randomisés ou par rapport aux taux attendus dans des populations masculines appariées en fonction de l’âge. Néanmoins, leur prescription doit être conditionnée à un bilan cardiovasculaire chez les patients à haut risque cardiovasculaire ou à risque intermédiaire, sur la base des recommandations du consensus de Princeton III.22
L’utilisation de dérivés nitrés constitue une contre-indication absolue aux iPDE5.
Les effets indésirables les plus fréquents sont les céphalées, les bouffées de chaleur, la dyspepsie et la congestion nasale.
Alprostadil par voie topique
L’alprostadil peut être administré par voie topique, sous forme d’une crème avec un applicateur facilitant son absorption par le méat urétral (Vitaros 300 μg).23 Les données cliniques sont encore limitées.
Les effets indésirables comprennent un érythème local, une sensation de brûlure pénienne et une douleur qui disparaissent généralement dans les deux heures suivant l’application. Les effets indésirables systémiques sont rares.
Les effets indésirables comprennent un érythème local, une sensation de brûlure pénienne et une douleur qui disparaissent généralement dans les deux heures suivant l’application. Les effets indésirables systémiques sont rares.
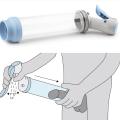
Pompe à vide ou vacuum d’action mécanique
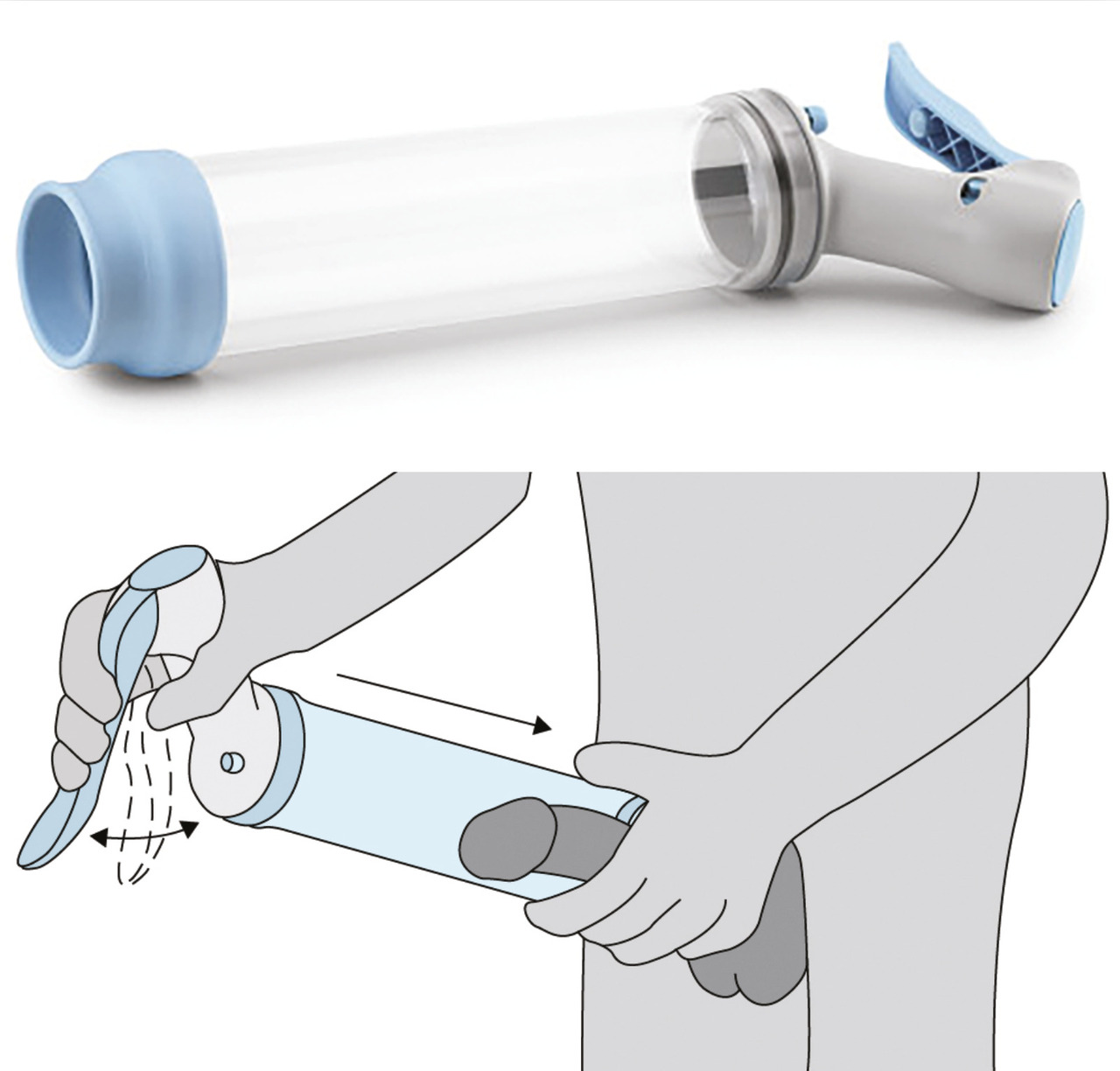
Les systèmes de pompe à vide, ou vacuum, assurent un remplissage passif des corps caverneux, avec un anneau de constriction placé à la base du pénis pour retenir le sang à l’intérieur des corps caverneux (fig. 2 ). Les données publiées indiquent que l’efficacité atteint 90 %, quelle que soit la cause de la dysfonction érectile, et que les taux de satisfaction varient entre 27 et 94 %.24 La plupart des hommes qui cessent d’utiliser les vacuums le font dans les trois mois. Leur utilisation à long terme diminue à 50 à 64 % après deux ans.25
Les effets indésirables les plus fréquents sont la douleur, l’incapacité à éjaculer, les pétéchies, les ecchymoses et l’engourdissement.
Les effets indésirables les plus fréquents sont la douleur, l’incapacité à éjaculer, les pétéchies, les ecchymoses et l’engourdissement.
Injection intracaverneuse d’alprostadil
L’alprostadil (Caverject, Edex) possède aussi une autorisation de mise sur le marché (AMM) pour une administration par injection intracaverneuse26 (seringue de 10 ou 20 μg). L’érection apparaît après cinq à quinze minutes et pour une durée variable, en fonction de la dose injectée, avec une hétérogénéité importante entre les patients. Un apprentissage de la technique d’injection lors d’une consultation dédiée est nécessaire. L’utilisation d’un stylo auto-injecteur permet d’éviter de voir l’aiguille et ainsi de dépasser la peur de la piqûre chez certains patients.
Des taux d’efficacité de plus de 70 % ont été observés dans la population générale, ainsi que dans des sous-groupes de patients, avec des taux de satisfaction de 87 à 93,5 % chez les patients et de 86 à 90,3 % chez les partenaires.
Les complications comprennent la douleur pénienne, des érections prolongées (5 %), le priapisme (1 %) et la fibrose (2 %).26
Malgré ces données favorables, des taux d’abandon de 41 à 68 % sont rapportés, la plupart se produisant dans les deux à trois premiers mois.27 Les raisons de l’abandon comprennent le désir d’un traitement permanent (29 %), l’absence de partenaire approprié (26 %), une réponse insuffisante (23 %), la peur des aiguilles (23 %), la peur des complications (22 %) et le manque de spontanéité (21 %).
Des taux d’efficacité de plus de 70 % ont été observés dans la population générale, ainsi que dans des sous-groupes de patients, avec des taux de satisfaction de 87 à 93,5 % chez les patients et de 86 à 90,3 % chez les partenaires.
Les complications comprennent la douleur pénienne, des érections prolongées (5 %), le priapisme (1 %) et la fibrose (2 %).26
Malgré ces données favorables, des taux d’abandon de 41 à 68 % sont rapportés, la plupart se produisant dans les deux à trois premiers mois.27 Les raisons de l’abandon comprennent le désir d’un traitement permanent (29 %), l’absence de partenaire approprié (26 %), une réponse insuffisante (23 %), la peur des aiguilles (23 %), la peur des complications (22 %) et le manque de spontanéité (21 %).
Prothèse pénienne, dans des cas particuliers
Le traitement chirurgical par prothèse pénienne peut être envisagé chez les patients qui ne sont pas éligibles aux différents traitements ou préfèrent un traitement définitif, et ne répondent pas aux traitements pharmacologiques. La plupart des hommes ayant une prothèse pénienne ont une cause organique de dysfonction érectile : une maladie vasculaire, un diabète et des antécédents de chirurgie pelvienne sont les plus courants. La durée moyenne des symptômes de dysfonction érectile avant l’intervention chirurgicale varie de trois à six ans.28
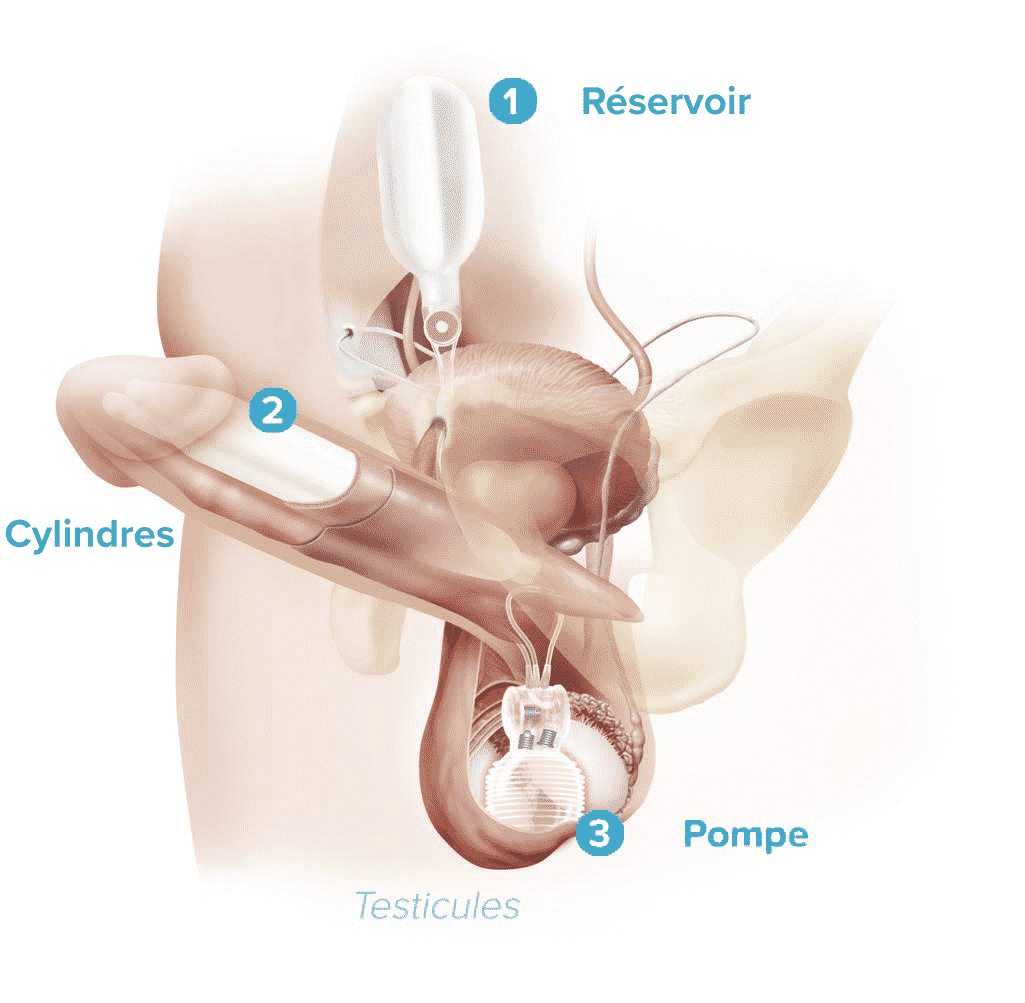
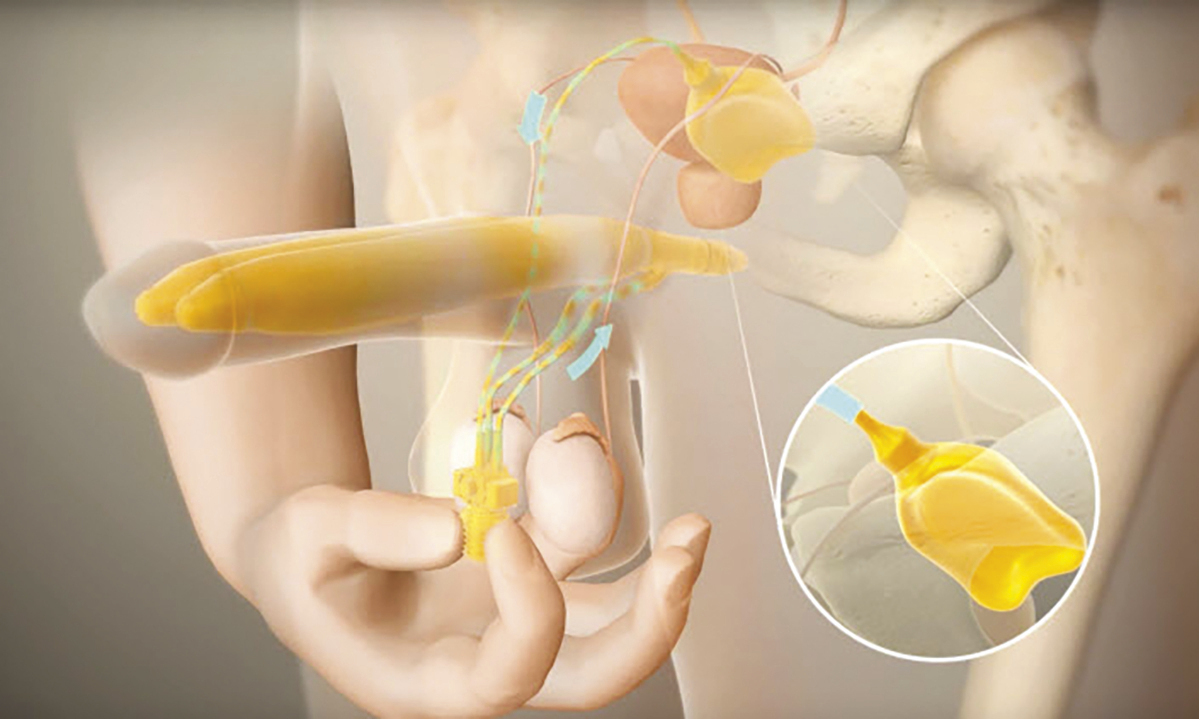
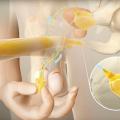
Les deux types d’implant pénien actuellement disponibles comprennent les dispositifs gonflables (deux et trois pièces) et les dispositifs semi-rigides (malléables). Les implants péniens gonflables trois pièces (hydrauliques) sont largement plus utilisés en raison des érections plus « naturelles » obtenues (fig. 3 et 4 ). Les prothèses semi-rigides donnent un pénis ferme, qui peut être placé manuellement selon l’utilisation et offrent l’avantage d’une technique d’implantation simple, ainsi qu’une utilisation facile pour le patient. En revanche, ils peuvent présenter l’inconvénient d’une érection persistante non naturelle et d’une moindre discrétion. Ils peuvent également être une option pour les hommes dont la dextérité manuelle est limitée, rendant difficile la gestion de la pompe scrotale. Les deux principales complications sont la dysfonction mécanique (inférieure à 5 % après 5 ans) et l’infection (2 à 3 % sur les premières implantations chez les patients à faible risque au sein de centres à haut volume).29
Les implants péniens sont une solution efficace, sûre et associée à un taux de satisfaction élevé, pour les patients qui ne répondent pas aux traitements plus conservateurs.30
Les deux types d’implant pénien actuellement disponibles comprennent les dispositifs gonflables (deux et trois pièces) et les dispositifs semi-rigides (malléables). Les implants péniens gonflables trois pièces (hydrauliques) sont largement plus utilisés en raison des érections plus « naturelles » obtenues (
Les implants péniens sont une solution efficace, sûre et associée à un taux de satisfaction élevé, pour les patients qui ne répondent pas aux traitements plus conservateurs.30
Aucun autre traitement n’est actuellement recommandé
Il n’existe pas de données suffisamment solides dans la littérature permettant de recommander l’utilisation d’ondes de choc ou d’injections de plasma riche en plaquettes (PRP) pour le traitement de la dysfonction érectile, en particulier chez les patients traités pour un cancer de la prostate.
Références
1. Penson DF, McLerran D, Fend Z, Li L, Albertsen PC, Gilliland FD, et al. 5-year urinary and sexual outcomes after radical prostatectomy: Results from the prostate cancer outcomes study. J Urol 2005;173(5):1701-5.
2. Matthew AG, Alibhai SMH, Davidson T, Currie KL, Jiang H, Krahn M, et al. Health-related quality of life following radical prostatectomy: Long-term outcomes. Qual Life Res 2014;23(8):2309-17.
3. Ploussard G, Fiard G, Barret E, Brureau L, Créhange G, Dariane, et al. French AFU Cancer Committee Guidelines - Update 2022-2024: Prostate cancer - Diagnosis and management of localised disease. Prog Urol 2022;32(15):1275-372.
4. Lehto US, Tenhola H, Taari K, Aromaa A. Patients’ perceptions of the negative effects following different prostate cancer treatments and the impact on psychological well-being: A nationwide survey. Br J Cancer 2017;116(7):864-73.
5. Harrington JM, Jones EG, Badger T. Body image perceptions in men with prostate cancer. Oncol Nurs Forum 2009;36(2):167-72.
6. Watson E., Shinkins B, Frith E, Neal D, Hamdy F, Walter F, et al. Symptoms, unmet needs, psychological well-being and health status in survivors of prostate cancer: Implications for redesigning follow-up. BJU Int 2016;117(6B):E10-9.
7. Frey A, Sønksen J, Jakobsen H, Fode M. Prevalence and predicting factors for commonly neglected sexual side effects to radical prostatectomies: Results from a cross‐sectional questionnaire‐based study. J Sex Med 2014;11(9):2318-26.
8. Potosky AL, Knopf K, Clegg LX, Albertsen PC, Stanford JL, Hamilton AS, et al. Quality-of-life outcomes after primary androgen deprivation therapy: Results from the Prostate Cancer Outcomes Study. J Clin Oncol 2001;19(17):3750-7.
9. Schover LR, Canada AL, Yuan Y, Sui D, Neese L, Jenkins R, et al. A randomized trial of internet-based versus traditional sexual counseling for couples after localized prostate cancer treatment: CAREss Counseling Program. Cancer 2012;118(2):500-9.
10. Rosen RC, Riley A, Wagner G, Osterloh IH, Kirkpatrick J, Mishra A. The international index of erectile function (IIEF): A multidimensional scale for assessment of erectile dysfunction. Urology 1997;49(6):822-30.
11. Althof SE, Corty EW, Levine SB, Levine F, Burnett AL, McVary K, et al. EDITS: Development of questionnaires for evaluating satisfaction with treatments for erectile dysfunction. Urology 1999;53(4):793-9.
12. Hellstrom WJG, Feldman R, Rosen RC, Smith T, Kaufman G, Tursi J, et al. Bother and distress associated with Peyronie’s disease: Validation of the Peyronie’s disease questionnaire. J Urol 2013;190(2):627-34.
13. Bacon CG, Mittleman MA, Kawachi I, Giovannucci E, Glasser SB, Rimm EB. Sexual function in men older than 50 years of age: Results from the health professionals follow-up study. Ann Intern Med 2003;139(3):161-8.
14. Paich K,Dunn R, Skolarus T, Montie J, Hollenbeck B, Palapattu G, et al. Preparing patients and partners for recovery from the side effects of prostate cancer surgery: A group approach. Urology 2016;88:36-42.
15. Nguyen LN, Head L, Witiuk K, Punjani N, Mallick R, Cnossen S, et al. The risks and benefits of cavernous neurovascular bundle sparing during radical prostatectomy: A systematic review and meta-analysis. J Urol 2017;198(4):760-9.
16. Padma-Nathan H,McCullough AR, Levine LA, Lipshultz LI, Siegel R, Montorsi F, et al. Randomized, double-blind, placebo-controlled study of postoperative nightly sildenafil citrate for the prevention of erectile dysfunction after bilateral nerve-sparing radical prostatectomy. Int J Impot Res 2008;20(5):479-86.
17. Toussi A Ziegelmann M, Yang D, Manka M, Franck I, Boorjian SA, et al. Efficacy of a novel penile traction device in improving penile length and erectile function post prostatectomy: Results from a single-center randomized, controlled trial. J Urol 2021;206(2):416-26.
18. Frey A, Sønksen J, Jakobsen H, Fode M. Prevalence and predicting factors for commonly neglected sexual side effects to radical prostatectomies: Results from a cross‐sectional questionnaire‐based study. J Sex Med 2014;11(9):2318-26.
19. Kannady C, Clavell-Hernández J. Orgasm-associated urinary incontinence (climacturia) following radical prostatectomy: A review of pathophysiology and current treatment options. Asian J Androl 2020;22(6):549-54.
20. Yafi FA. Andrianne R, Alzweri L, Brady J, Butcher M, Chevalier D, et al. Andrianne mini-jupette graft at the time of inflatable penile prosthesis placement for the management of post-prostatectomy climacturia and minimal urinary incontinence. J Sex Med 2018;15(5):789-96.
21. Yuan J, Zhang R, Yang Z, Lee J, Liu Y, Tia J, et al. Comparative effectiveness and safety of oral phosphodiesterase type 5 inhibitors for erectile dysfunction: A systematic review and network meta-analysis. Eur Urol 2013;63(5):902-12.
22. Nehra A, Jackson G, Miner M, Billups KL, Burnett AL, Buvat J, et al. The Princeton III Consensus recommendations for the management of erectile dysfunction and cardiovascular disease. Mayo Clin Proc 2012;87(8):766-78.
23. Hellstrom W, Anaissie J. Clinical use of alprostadil topical cream in patients with erectile dysfunction: A review. Res Rep Urol 2016;8:123-31.
24. Yuan J, Hoang AN, Romero CA, Lin H, Dai Y, Wang Rl. Vacuum therapy in erectile dysfunction-science and clinical evidence. Int J Impot Res 2010;22(4):211-9.
25. Cookson MS, Nadig PW. Long-term results with vacuum constriction device. J Urol 1993;149(2):290-4.
26. Porst H, Burnett A, Brock G, Ghanem H, Giuliano F, Glina S, et al. SOP conservative (medical and mechanical) treatment of erectile dysfunction. J Sex Med 2013;10(1):130-71.
27. Gupta R, Kirschen J, Barrow RC, Eid JF. Predictors of success and risk factors for attrition in the use of intracavernous injection. J Urol 1997;157(5):1681-6.
28. Bajic P, Mahon J, Faraday M, Sadghi-Nejad H, Hakim L, McVary KT. Etiology of erectile dysfunction and duration of symptoms in patients undergoing penile prosthesis: A systematic review. Sex Med Rev 2020;8(2):333-7.
29. Mandava SH, Serefoglu EC, Freier MT, Wilson SK, Hellstrom WJG. Infection retardant coated inflatable penile prostheses decrease the incidence of infection: A systematic review and meta-analysis. J Urol 2012;188(5):1855-60.
30. Akakpo W, Pineda MA, Burnett AL. Critical analysis of satisfaction assessment after penile prosthesis surgery. Sex Med Rev 2017;5(2):244-51.
2. Matthew AG, Alibhai SMH, Davidson T, Currie KL, Jiang H, Krahn M, et al. Health-related quality of life following radical prostatectomy: Long-term outcomes. Qual Life Res 2014;23(8):2309-17.
3. Ploussard G, Fiard G, Barret E, Brureau L, Créhange G, Dariane, et al. French AFU Cancer Committee Guidelines - Update 2022-2024: Prostate cancer - Diagnosis and management of localised disease. Prog Urol 2022;32(15):1275-372.
4. Lehto US, Tenhola H, Taari K, Aromaa A. Patients’ perceptions of the negative effects following different prostate cancer treatments and the impact on psychological well-being: A nationwide survey. Br J Cancer 2017;116(7):864-73.
5. Harrington JM, Jones EG, Badger T. Body image perceptions in men with prostate cancer. Oncol Nurs Forum 2009;36(2):167-72.
6. Watson E., Shinkins B, Frith E, Neal D, Hamdy F, Walter F, et al. Symptoms, unmet needs, psychological well-being and health status in survivors of prostate cancer: Implications for redesigning follow-up. BJU Int 2016;117(6B):E10-9.
7. Frey A, Sønksen J, Jakobsen H, Fode M. Prevalence and predicting factors for commonly neglected sexual side effects to radical prostatectomies: Results from a cross‐sectional questionnaire‐based study. J Sex Med 2014;11(9):2318-26.
8. Potosky AL, Knopf K, Clegg LX, Albertsen PC, Stanford JL, Hamilton AS, et al. Quality-of-life outcomes after primary androgen deprivation therapy: Results from the Prostate Cancer Outcomes Study. J Clin Oncol 2001;19(17):3750-7.
9. Schover LR, Canada AL, Yuan Y, Sui D, Neese L, Jenkins R, et al. A randomized trial of internet-based versus traditional sexual counseling for couples after localized prostate cancer treatment: CAREss Counseling Program. Cancer 2012;118(2):500-9.
10. Rosen RC, Riley A, Wagner G, Osterloh IH, Kirkpatrick J, Mishra A. The international index of erectile function (IIEF): A multidimensional scale for assessment of erectile dysfunction. Urology 1997;49(6):822-30.
11. Althof SE, Corty EW, Levine SB, Levine F, Burnett AL, McVary K, et al. EDITS: Development of questionnaires for evaluating satisfaction with treatments for erectile dysfunction. Urology 1999;53(4):793-9.
12. Hellstrom WJG, Feldman R, Rosen RC, Smith T, Kaufman G, Tursi J, et al. Bother and distress associated with Peyronie’s disease: Validation of the Peyronie’s disease questionnaire. J Urol 2013;190(2):627-34.
13. Bacon CG, Mittleman MA, Kawachi I, Giovannucci E, Glasser SB, Rimm EB. Sexual function in men older than 50 years of age: Results from the health professionals follow-up study. Ann Intern Med 2003;139(3):161-8.
14. Paich K,Dunn R, Skolarus T, Montie J, Hollenbeck B, Palapattu G, et al. Preparing patients and partners for recovery from the side effects of prostate cancer surgery: A group approach. Urology 2016;88:36-42.
15. Nguyen LN, Head L, Witiuk K, Punjani N, Mallick R, Cnossen S, et al. The risks and benefits of cavernous neurovascular bundle sparing during radical prostatectomy: A systematic review and meta-analysis. J Urol 2017;198(4):760-9.
16. Padma-Nathan H,McCullough AR, Levine LA, Lipshultz LI, Siegel R, Montorsi F, et al. Randomized, double-blind, placebo-controlled study of postoperative nightly sildenafil citrate for the prevention of erectile dysfunction after bilateral nerve-sparing radical prostatectomy. Int J Impot Res 2008;20(5):479-86.
17. Toussi A Ziegelmann M, Yang D, Manka M, Franck I, Boorjian SA, et al. Efficacy of a novel penile traction device in improving penile length and erectile function post prostatectomy: Results from a single-center randomized, controlled trial. J Urol 2021;206(2):416-26.
18. Frey A, Sønksen J, Jakobsen H, Fode M. Prevalence and predicting factors for commonly neglected sexual side effects to radical prostatectomies: Results from a cross‐sectional questionnaire‐based study. J Sex Med 2014;11(9):2318-26.
19. Kannady C, Clavell-Hernández J. Orgasm-associated urinary incontinence (climacturia) following radical prostatectomy: A review of pathophysiology and current treatment options. Asian J Androl 2020;22(6):549-54.
20. Yafi FA. Andrianne R, Alzweri L, Brady J, Butcher M, Chevalier D, et al. Andrianne mini-jupette graft at the time of inflatable penile prosthesis placement for the management of post-prostatectomy climacturia and minimal urinary incontinence. J Sex Med 2018;15(5):789-96.
21. Yuan J, Zhang R, Yang Z, Lee J, Liu Y, Tia J, et al. Comparative effectiveness and safety of oral phosphodiesterase type 5 inhibitors for erectile dysfunction: A systematic review and network meta-analysis. Eur Urol 2013;63(5):902-12.
22. Nehra A, Jackson G, Miner M, Billups KL, Burnett AL, Buvat J, et al. The Princeton III Consensus recommendations for the management of erectile dysfunction and cardiovascular disease. Mayo Clin Proc 2012;87(8):766-78.
23. Hellstrom W, Anaissie J. Clinical use of alprostadil topical cream in patients with erectile dysfunction: A review. Res Rep Urol 2016;8:123-31.
24. Yuan J, Hoang AN, Romero CA, Lin H, Dai Y, Wang Rl. Vacuum therapy in erectile dysfunction-science and clinical evidence. Int J Impot Res 2010;22(4):211-9.
25. Cookson MS, Nadig PW. Long-term results with vacuum constriction device. J Urol 1993;149(2):290-4.
26. Porst H, Burnett A, Brock G, Ghanem H, Giuliano F, Glina S, et al. SOP conservative (medical and mechanical) treatment of erectile dysfunction. J Sex Med 2013;10(1):130-71.
27. Gupta R, Kirschen J, Barrow RC, Eid JF. Predictors of success and risk factors for attrition in the use of intracavernous injection. J Urol 1997;157(5):1681-6.
28. Bajic P, Mahon J, Faraday M, Sadghi-Nejad H, Hakim L, McVary KT. Etiology of erectile dysfunction and duration of symptoms in patients undergoing penile prosthesis: A systematic review. Sex Med Rev 2020;8(2):333-7.
29. Mandava SH, Serefoglu EC, Freier MT, Wilson SK, Hellstrom WJG. Infection retardant coated inflatable penile prostheses decrease the incidence of infection: A systematic review and meta-analysis. J Urol 2012;188(5):1855-60.
30. Akakpo W, Pineda MA, Burnett AL. Critical analysis of satisfaction assessment after penile prosthesis surgery. Sex Med Rev 2017;5(2):244-51.