Souvent silencieuse, l’HTA est découverte la plupart du temps fortuitement, lors de contrôles médicaux de routine, par le généraliste ou le médecin du travail. Rarement, elle peut provoquer maux de tête, fatigue, acouphènes ou épistaxis. La dyspnée ne fait pas partie des symptômes fréquents, alors qu’elle est un signe courant de l’HTA pulmonaire (non abordée dans cet article).
Toutefois, son apparition chez un sujet hypertendu est un signal d’alarme devant faire rechercher différentes pathologies car elle reflète potentiellement la survenue d’une atteinte d’organe cible de l’HTA : cœur, rein, artère. On distingue deux situations cliniques : la dyspnée d’effort (la plus fréquente) et celle aiguë (la plus grave).
Dyspnée d’effort
Est-ce le cœur ?
La dyspnée d’effort est le premier signe fonctionnel de la cardiopathie hypertensive, forme la plus fréquente d’insuffisance cardiaque à fraction d’éjection (FE) préservée. Une radiographie pulmonaire de face et un dosage de BNP ou NT-pro-BNP peuvent aider à différencier l’origine cardiaque d’une cause pulmonaire. En faveur du cœur : un taux > à 450 ng/mL avant 50 ans, > 900 entre 50 et 75 ans et > 1 800 après 75 ans. Une valeur normale (< 300 ng/mL) plaide pour une origine pulmonaire : trouble obstructif, ventilatoire, pneumopathie, pleurésie, pneumothorax, embolie pulmonaire (même si dans ce dernier cas, le NT-pro-BNP peut être augmenté lorsqu’il y a retentissement sur le ventricule droit).
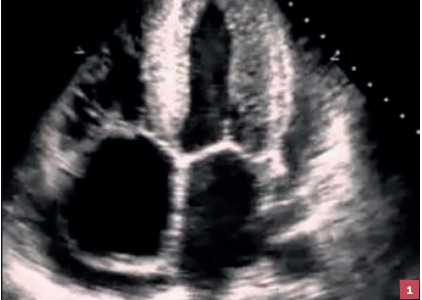
Le substrat physiopathologique est l’augmentation de la masse ventriculaire gauche, conduisant à une hypertrophie ventriculaire gauche (HVG ; fig. 1), souvent concentrique. Ainsi, le muscle cardiaque est épaissi et rigidifié. La relaxation et le remplissage myocardique sont perturbés. La dyspnée peut donc être liée soit au trouble de la relaxation par hausse des pressions de remplissage du VG et retentissement hémodynamique d’amont avec augmentation de la pression capillaire pulmonaire, soit à une coronaropathie secondaire à l’HVG par défaut de vascularisation.
L’HVG touche environ 20 % des hypertendus et augmente significativement le risque de maladie coronaire et d’insuffisance cardiaque. Pour la détecter, l’ECG, par la mesure de l’indice de Sokolow ou de Cornell, a une mauvaise sensibilité mais une bonne spécificité. Le déplacement de l’axe électrique du cœur vers la gauche ou l’apparition d’un bloc de branche gauche sur les ECG successifs est un signe évocateur utile en pratique courante.
Les échocardiographies transthoraciques (ETT) de contrôle, réalisées tous les 3 à 5 ans (en dehors de tout événement cardiovasculaire), sont importantes pour dépister cette atteinte d’organe cible témoignant du contrôle insuffisant de l’HTA.
Le traitement de l’insuffisance cardiaque à FE préservée a connu de nombreuses avancées ces dernières années, avec l’avènement des inhibiteurs de SGLT- 2. Les dernières recommandations européennes mettent également l’accent sur l’intérêt du traitement de toutes les comorbidités comme l’HTA, le diabète, l’obésité ou la fibrillation atriale. Un traitement de fond par diurétique de l’anse peut s’avérer nécessaire en cas de persistance de signes congestifs gauches ou droits.1
L’apparition d’une fibrillation atriale (FA) marque un tournant évolutif dans l’histoire de la cardiopathie hypertensive pure, car la perte surajoutée de la systole atriale peut entraîner une surcharge volémique responsable d’une aggravation de la dyspnée, voire d’un œdème aigu pulmonaire (cf. dyspnée aiguë). Il faut donc rechercher à l’interrogatoire des épisodes de palpitations, être attentif à la régularité des bruits du cœur à l’auscultation, faire un ECG au moins annuellement, prescrire un holter-ECG dès la moindre suspicion.
En cas de coronaropathie, la dyspnée apparaît après les douleurs angineuses à l’effort dans l’évolution de la maladie. C’est un facteur de mauvais pronostic associé à une mortalité plus élevée. Chez tout hypertendu dyspnéique,2 il faut donc rechercher à l’interrogatoire une symptomatologie angineuse. Si elle est présente, et en dehors de la suspicion d’un syndrome coronaire aigu, une ETT est pratiquée dans un premier temps. Schématiquement, une FE normale conduit au dépistage non invasif d’une ischémie par échocardiographie ou IRM de stress ou scintigraphie d’effort ; en cas d’anomalie, l’étape suivante est la coronarographie avec éventuelle revascularisation. Celle-ci peut être envisagée d’emblée en cas d’altération de la FEVG. À noter que le coroscanner est un examen morphologique, non un test d’ischémie. Il possède cependant une très bonne valeur prédictive négative, écartant toute suspicion de coronaropathie s’il est normal.
Est-ce le rein ?
Le déclin de la fonction rénale chez un patient hypertendu avec apparition d’une protéinurie de faible débit (< 1 g/24 h) évoque une néphropathie vasculaire de type néphro-angiosclérose ; chez les diabétiques, une atteinte glomérulaire peut être associée (néphropathie mixte).
De plus, il ne faut pas oublier que l’HTA est parfois liée à une maladie rénale chronique parenchymateuse (première cause d’HTA secondaire), dont les causes sont diverses (diabète, toxiques ou médicaments).
Ce n’est qu’en cas d’insuffisance rénale très avancée (DFG < 30 mL/min) qu’une dyspnée peut apparaître. Elle est principalement due à l’installation d’une anémie par baisse de la production d’EPO. Ainsi, la mesure régulière de la créatininémie, de la protéinurie sur échantillon et de l’hémoglobine est essentielle dans la surveillance des hypertendus ayant une atteinte rénale. Un traitement par EPO, toujours associé à une supplémentation en fer, est discuté en consultation de néphrologie. D’autres pistes thérapeutiques sont en cours d’étude (exemple : les inhibiteurs de l’HIF hydroxylase [ou hypoxia-inducible factor, facteur stimulant la sécrétion d’EPO] restaurent la production de l’hormone par le rein).3
Est-ce iatrogène ?
Bien qu’ils ne soient plus considérés comme un traitement de première intention de l’HTA, les bêtabloquants gardent une indication élective en cas d’angor. Ils restent cependant les plus pourvoyeurs de dyspnée.
Les non-cardiosélectifs, comme le propranolol, sont bronchoconstricteurs et peuvent faire décompenser un asthme ou une bronchopathie chronique obstructive, parfois méconnue (à suspecter de principe chez tout sujet tabagique actif de longue date ou ancien fumeur sevré).
Les bêtabloquants plus récents, cardiosélectifs (aténolol, bisoprolol, etc.), sont mieux tolérés au niveau respiratoire. Une méta-analyse de 2014 montre même leur effet protecteur contre les exacerbations de BPCO.4
Les IEC ont pour principal effet secondaire une toux sèche (10 %) mais ne causent pas de dyspnée à proprement parler, sauf en cas d’angiœdème (rare ; cf. dyspnée aiguë).
Enfin, les pneumopathies interstitielles médicamenteuses sont exceptionnelles. Dans la population hypertendue âgée, elles sont à suspecter en cas de prise d’amiodarone au long cours, par exemple par un patient ayant une fibrillation atriale paroxystique.
Autre cause ?
Chez le sujet âgé hypertendu, un rétrécissement aortique calcifié serré est suspecté en cas de souffle aortique systolique ; il est confirmé par une ETT.
La prise de poids et une désadaptation à l’effort chez un patient sédentaire sont aussi des causes classiques, mais doivent rester des diagnostics d’élimination.
Une NFS et un bilan martial sont à demander en cas de syndrome anémique (asthénie, pâleur, tachycardie), surtout si le patient reçoit un anticoagulant (si FA ou valve mécanique par exemple) ou un antiagrégant plaquettaire au long cours (en cas de coronaropathie ou d’atteinte polyathéromateuse). Toute découverte d’anémie microcytaire par carence en fer impose des explorations digestives et/ou gynécologiques, à la recherche d’une lésion responsable d’un saignement.
Dyspnée aiguë
OAP hypertensif
La forme la plus grave est l’œdème aigu pulmonaire, lié à la décompensation d’une cardiopathie hypertensive sous-jacente. Parmi les facteurs favorisants, une déstabilisation tensionnelle est souvent en cause, secondaire par exemple à une mauvaise observance, surtout chez des patients polymédiqués (arrêt d’un traitement diurétique de l’anse en cas de signes congestifs, écart de régime hyposodé) ou au passage en FA, responsables d’une surcharge volémique.
Sténose bilatérale des artères rénales
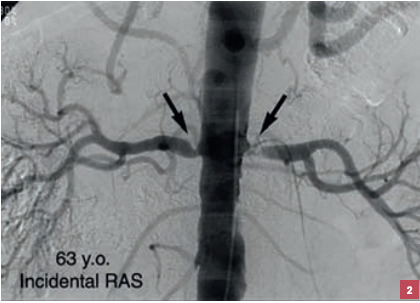
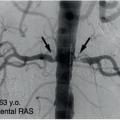
La répétition d’OAP flash (brutaux) avec poussées hypertensives associée à un déclin de la fonction rénale doit faire rechercher une sténose bilatérale des artères rénales liée essentiellement à l’athérosclérose – plus rarement à une dysplasie fibromusculaire – (fig. 2) chez des patients volontiers polyartériels, ou bien un rétrécissement de l’artère rénale sur un rein unique fonctionnel chez les plus jeunes. En effet, dans ces deux situations où l’excrétion de sodium est fortement diminuée, une ischémie rénale s’installe, provoquant un hyper-réninisme avec hyperaldostéronisme secondaire, qui s’accompagne rapidement d’une hypervolémie. L’HTA est dite volodépendante et n’est plus sensible aux bloqueurs du SRAA. Ainsi, toute surcharge hydrosodée, prise d’AINS ou interruption de traitement diurétique peut très rapidement conduire à un OAP.
L’échographie doppler des artères rénales est un moyen simple d’objectiver la ou les sténoses, et surtout d’identifier un retentissement hémodynamique d’aval. Un angioscanner peut également être pratiqué si la fonction rénale le permet, mais il ne fournit pas de renseignement d’ordre hémodynamique. C’est un point important car, dans certains cas, après avis spécialisé en staff médico-chirugical, une angioplastie d’une artère rénale est parfois réalisée, surtout si l’atteinte est ostiale. Cela peut s’avérer efficace pour contrôler l’HTA, prévenir les récidives d’OAP et peut-être aussi le déclin de la fonction rénale.5
Angiœdème
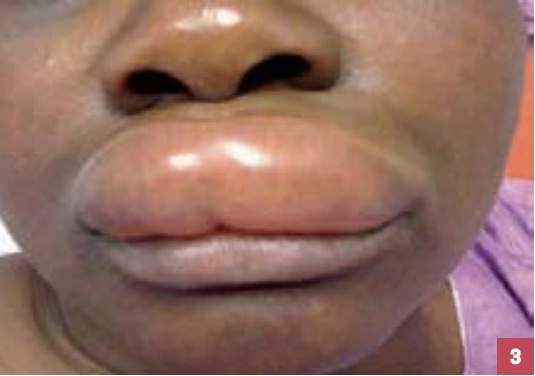
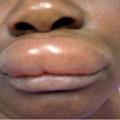
Les IEC provoquent un angiœdème neurotique dans moins de 1 % des cas (exceptionnellement sous ARA II), par augmentation de la bradykinine. Ce dernier touche principalement les voies aériennes supérieures – par ordre de fréquence : les lèvres et la bouche (96 % des cas ; fig. 3), la langue (72 %) et le larynx (13 %) – et est responsable d’une dyspnée aiguë grave nécessitant une prise en charge en urgence. Il apparaît le plus souvent au cours des premières semaines suivant la mise en route du traitement, et jusqu’à 6 mois après son arrêt.6
Qu’en retenir ?
La dyspnée chez l’hypertendu est un signe d’alarme et doit être explorée.
Complications possibles : insuffisance cardiaque décompensée, insuffisance rénale, sténose sévère des artères rénales.
Penser aux causes iatrogènes (bêtabloquants non-cardiosélectifs).
Messages à donner aux patients :
- Il faut consulter rapidement en cas de signe fonctionnel cardiovasculaire, comme une douleur dans la poitrine ou un essoufflement, pour une prise en charge précoce.
- Il n’est pas normal d’être essoufflé lorsqu’on est hypertendu !
- Il faut signaler toute mauvaise tolérance médicamenteuse et changer si besoin de classe thérapeutique.
2. Nakanishi R, Rana JS, Rozanski A, et al. Relationship of dyspnea vs. typical angina to coronary artery disease severity, burden, composition and location on coronary CT angiography. Atherosclerosis 2013;230(1):61-6.
3. Hermine O, Maciel T, Moura I. Quel pourrait être le futur de la prise en charge de l’anémie dans l’insuffisance rénale chronique ? Nephrol Ther 2017;13(6S):6S7-10.
4. Du Q, Sun Y, Ding N, et al. Beta-blockers reduced the risk of mortality and exacerbation in patients with COPD: a meta-analysis of observational studies. PLoS One 2014;9(11):e113048.
5. Manolis AS, Manolis AA, Melita H. Current Status of Renal Artery Angioplasty and Stenting for Resistant Hypertension: A Case Series and Review of the Literature. Curr Hypertens Rev 2017;13(2):93-103.
6. Makani H, Messerli FH, Romero J, et al. Meta-analysis of randomized trials of angioedema as an adverse event of renin-angiotensin system inhibitors. Am J Cardiol 2012;110(3):383-91.