Depuis une dizaine d’années, l’accroissement des prescriptions du dosage de la TSH (thyréostimuline) a entraîné une augmentation des surdiagnostics, donc des traitements par excès. Pourtant, les algorithmes de prise en charge diagnostique et thérapeutique sont maintenant bien codifiés, tant pour l’hyper- que pour l’hypothyroïdie.
L’augmentation de la prévalence des dysthyroïdies ces dernières années est probablement liée, dans les pays développés, à l’accroissement des prescriptions du dosage de la thyroid-stimulating hormone (TSH ou thyréostimuline), entraînant des diagnostics en excès. En effet, un taux de TSH anormal (selon les seuils du laboratoire) n’est pas forcément synonyme de dysthyroïdie : les valeurs de référence peuvent différer selon les populations, l’état de santé et l’âge du patient ; par ailleurs, les variations sont fréquentes au cours de la phase aiguë d’une pathologie non thyroïdienne, sans pour autant être pathologiques. Il est donc préférable de différer le dosage de la TSH dans des situations aiguës où la suspicion de dysthyroïdie est faible. Enfin, si un premier dosage de TSH est anormal, il doit toujours être contrôlé par un 2e dosage après quelques jours ou semaines.
Quand évoquer une dysthyroïdie ?
Le dépistage systématique en population générale n’est pas recommandé en l’absence de signes évocateurs.1
La symptomatologie de l’hypothyroïdie varie en fonction des personnes, de sa cause, de sa durée et de sa sévérité. Généralement, un ralentissement global de l’activité physique et mentale est observé, avec fatigue, frilosité, constipation, peau sèche et modification de la voix (tableau 1). Mais la spécificité des symptômes est faible.
En cas de thyrotoxicose (excès d’hormones thyroïdiennes quelle qu’en soit sa cause, alors que dans l’hyperthyroïdie la thyrotoxicose observée est liée à un hyperfonctionnement thyroïdien), la symptomatologie est aussi aspécifique (tableau 2). Certains signes sont évocateurs : perte de poids, agitation psychomotrice, tachycardie, voire troubles du rythme et de l’humeur. Un examen cardiovasculaire clinique est recommandé, et des explorations complémentaires peuvent être nécessaires selon les antécédents. Les signes oculaires (inflammation des paupières, exophtalmie...) sont clairement évocateurs de la maladie de Basedow et peuvent suffire au diagnostic étiologique.
Plusieurs situations spécifiques doivent faire rechercher une dysthyroïdie sous-jacente : arythmie cardiaque par fibrillation atriale (ACFA) de novo ou troubles du rythme cardiaque ; instauration de certains traitements (amiodarone, lithium) ; mise en évidence d’un nodule ou d’un goitre thyroïdien.
Quels bilans ?
Hypothyroïdie
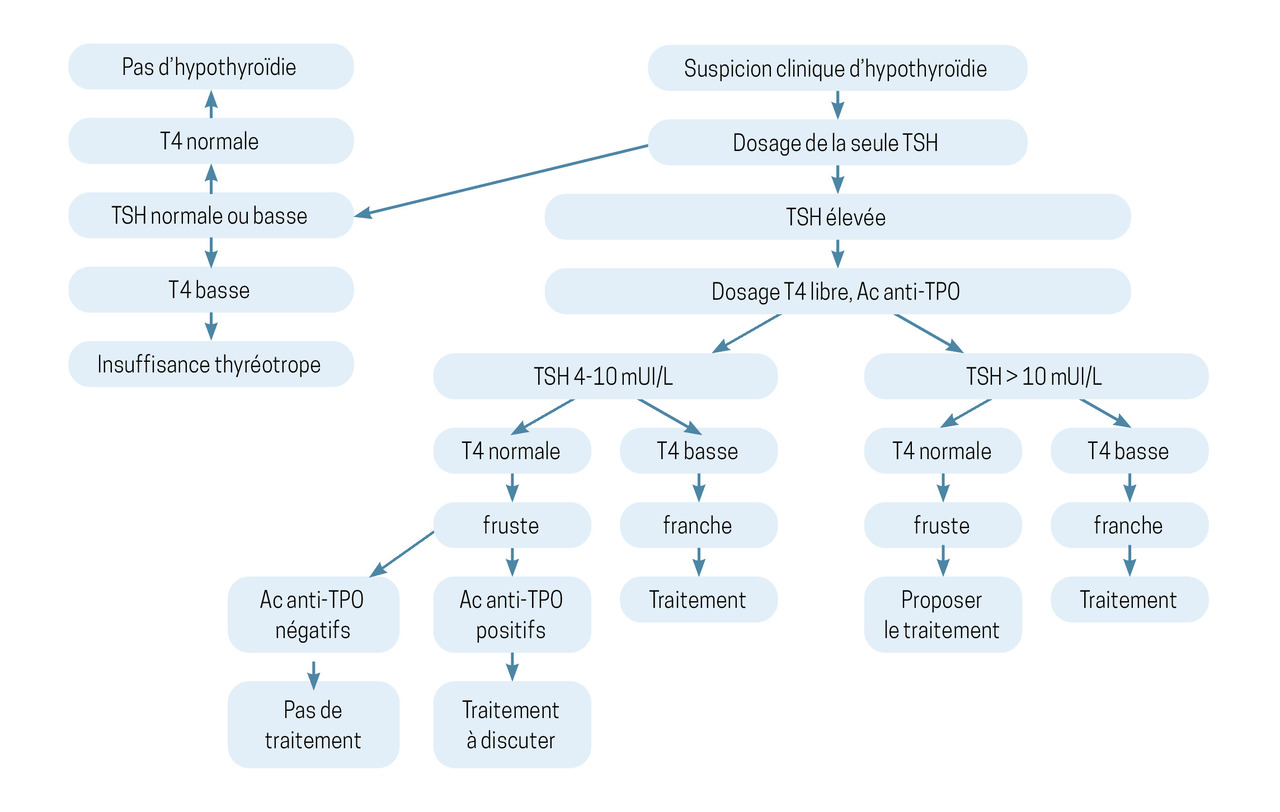
En cas de suspicion clinique d’hypothyroïdie, il faut prescrire en première intention uniquement le dosage sanguin de la TSH (algorithme diagnostique en fig. 1). Si ce dosage est normal, aucun examen complémentaire n’est nécessaire. Si le taux de TSH est élevé, le dosage de la T4L permet de distinguer différentes situations :
– 4 mUI/L < TSH < 10 mUI/L et T4L normale, correspondant à une hypothyroïdie fruste (infraclinique) ;
– TSH élevée (> 10 mUI/L) et T4L basse correspondant à une hypothyroïdie avérée ou franche.
Ces seuils sont usuels et donnés à titre indicatif. Ce sont l’examen clinique et la singularité du patient qui doivent orienter la prise en charge.
En cas de TSH élevée, le dosage des anticorps antithyropéroxydase (TPO) peut être réalisé. S’il est positif, il oriente vers un diagnostic de thyroïdite auto-immune, cause la plus fréquente des hypothyroïdies. Il n’est jamais nécessaire de contrôler le titre des anticorps, car il n’est pas corrélé à l’évolution clinico-biologique. Aucun autre dosage n’est nécessaire.
Hyperthyroïdie
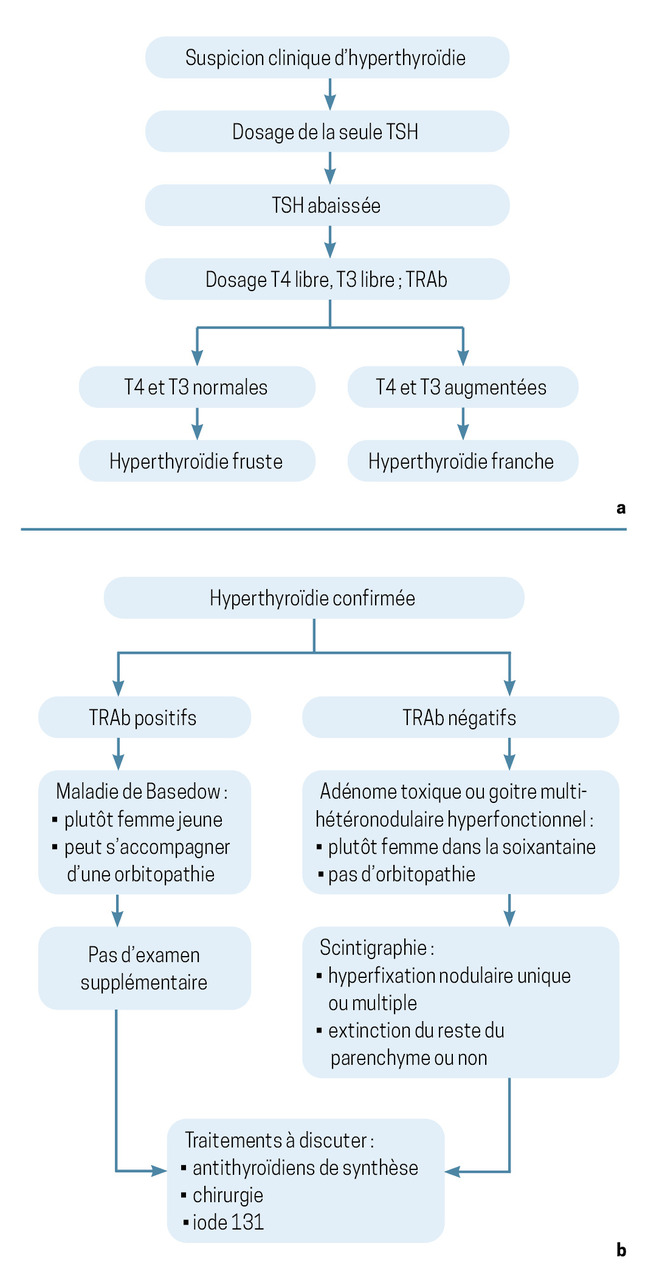
Le dosage de la TSH est fait en première intention. Sa diminution confirme le diagnostic et impose un bilan complémentaire.
Le dosage de la thyroxine, ou T4 (et éventuellement T3 si la T4 est normale), permet de juger de la sévérité de l’hyperthyroïdie. Elle est qualifiée de fruste ou d’infraclinique si ces hormones thyroïdiennes sont normales. Elle est franche ou avérée si elles sont augmentées (algorithme de prise en charge en fig. 2a).
Les causes les plus fréquentes d’hyperthyroïdie sont la maladie de Basedow, le goitre multi-hétéronodulaire hyperfonctionnel et l’adénome toxique ou nodule hyperfonctionnel.
Le résultat du dosage des anticorps antirécepteurs de la TSH (TRAb pour TSH receptor antibodies) permet d’orienter le diagnostic étiologique (algorithme de prise en charge en fig. 2b). Leur positivité suffit au diagnostic maladie de Basedow. En revanche, en cas de négativité des anticorps, la scintigraphie doit être réalisée pour rechercher une ou plusieurs hyperfixations focales et nodulaires, qui posent le diagnostic d’adénome toxique (nodule hyperfonctionnel isolé) ou de goitre multi-hétéronodulaire toxique.
La négativité des TRAb et une scintigraphie blanche doivent faire rechercher à l’interrogatoire une surcharge iodée (injection de produit de contraste iodé dans les 6 derniers mois ou prise d’amiodarone) ou, plus rarement, une thyroïdite de De Quervain (thyroïdite survenant dans un contexte de virose avec goitre douloureux, syndrome grippal et augmentation de la CRP).
Faut-il traiter toutes les dysthyroïdies ?
Hypothyroïdie : maintenir l’équilibre
L’objectif est de maintenir la TSH dans l’intervalle de référence et de permettre la disparition des symptômes.
La substitution hormonale par lévothyroxineper os à 1,5 à 1,8 µg/kg est indiquée. Les formes combinant lévothyroxine (T4) et tri-iodothyronine (T3) n’ont pas fait la preuve de leur intérêt. Un contrôle de la TSH doit être réalisé 8 à 12 semaines après l’instauration du traitement ou en cas de modification de posologie, puis à 6 mois et de manière annuelle en même temps qu’un examen clinique. La prise de lévothyroxine doit se faire de préférence le matin à jeun, avec un verre d’eau et au moins 30 min avant de s’alimenter ou de prendre tout autre médicament.
Lorsque l’hypothyroïdie est franche (tableau clinique évocateur, TSH élevée, T4 basse), l’introduction d’un traitement est indiscutable.
L’hypothyroïdie infraclinique reste à ce jour une anomalie biologique de signification clinique indéterminée. On réévalue le taux de TSH 6 à 12 semaines après le premier dosage et à distance de tout événement clinique, la TSH se corrigeant le plus souvent naturellement (pas répéter le dosage en l’absence de modification clinique). La littérature ne fait état, à ce jour, d’aucune donnée montrant un bénéfice de la substitution systématique des hypothyroïdies infracliniques.2,3
Il est généralement admis, mais sans données étayées justifiant cette attitude, de débuter un traitement par lévothyroxine en cas de TSH persistante > à 10 mUI/L (hormis chez le sujet âgé). En cas de TSH augmentée mais < à 10 mUI/L, un traitement peut être discuté au cas par cas. La positivité des anticorps anti-TPO peut être, ici, considérée comme un marqueur de risque de développer une hypothyroïdie franche et peut participer à la décision d’introduire un traitement.
Hyperthyroïdie : prise en charge individualisée
Plusieurs traitements sont possibles, selon sa cause.
Les antithyroïdiens de synthèse, ou ATS (méthimazole, carbimazole, propylthiouracile), inhibent la fonction thyroïdienne, avec un effet dose-dépendant. La diminution des hormones thyroïdiennes s’observe en quelques semaines et nécessite un suivi régulier. Un hémogramme hebdomadaire est nécessaire les 6 premières semaines afin de ne pas négliger une agranulocytose toxique (incidence de 0,4 % en moyenne ; le patient doit être informé de sa survenue possible, avec des consignes simples : réaliser un hémogramme en urgence et consulter en cas de fièvre ou d’infection ORL). La surveillance du bilan hépatique n’est pas obligatoire mais il peut être réalisé toutes les 2 semaines durant les 2 premiers mois de traitement. Chez les femmes en âge de procréer, une contraception efficace doit être instaurée (risque tératogène des ATS).
Le traitement par iode 131 équivaut à une radiothérapie interne vectorisée : une gélule ou une solution d’iode 131 administrée per os est métabolisée par les cellules thyroïdiennes, qui sont ensuite détruites par le rayonnement bêta émis par cet isotope. Ce traitement, réalisé en ambulatoire, a une efficacité progressive sur plusieurs semaines et permet un retour à l’euthyroïdie. Toutefois, plusieurs effets indésirables sont possibles, dont l’hypothyroïdie définitive ; un traitement insuffisant peut évoluer vers une récidive.
La chirurgie permet une guérison définitive tout en traitant une éventuelle problématique nodulaire. Mais il faut prendre en considération les risques liés à l’anesthésie et à la chirurgie (notamment en cas de lésion parathyroïdienne ou récurrentielle) ainsi que l’éventualité d’un traitement substitutif définitif par lévothyroxine selon le type de chirurgie (exérèse totale ou partielle par lobo-isthmectomie).
Dans le cas du goitre multi-hétéronodulaire ou du nodule hyperfonctionnel, le traitement par antithyroïdiens de synthèse n’est pas curatif ; il est utilisé en première ligne pour réduire les symptômes, éviter les complications et préparer le traitement curatif. Selon l’âge du patient, l’intensité de la fixation à la scintigraphie et la présence ou non d’autres nodules thyroïdiens, le traitement du nodule hyperfonctionnel unique peut être chirurgical ou par iode 131. Celui du goitre multinodulaire hyperfonctionnel est le plus souvent chirurgical afin de traiter la pathologie fonctionnelle et nodulaire.
Dans le cas de la maladie de Basedow, les trois options peuvent être discutées. Les pratiques françaises4 sont de proposer les antithyroïdiens de synthèse en première ligne (durant 12 à 18 mois) et un traitement chirurgical ou par iode 131 en cas d’échec ou de récidive.5
En cas d’hyperthyroïdie fruste (TSH abaissée, hormones thyroïdiennes normales), les causes et les traitements sont inchangés, mais leur temporalité et leurs indications sont discutées en fonction de la situation du patient en parallèle d’une surveillance clinico-biologique.
Pour la prise en charge des dysthyroïdies chez la femme enceinte ou le sujet âgé, voir ici : Baltzinger P, Fasciglione E, Goichot B. Prise en charge des dysthyroïdies. Rev Prat Med Gen 2022;36(1071):445-51.
Quand est-il inutile de traiter ?
Il n’est pas nécessaire de traiter un patient avec une symptomatologie, même très évocatrice d’hypothyroïdie, mais dont le bilan hormonal est normal. Il n’est pas non plus utile dans le cas de nodules thyroïdiens puisqu’il n’en modifie pas l’histoire naturelle. Dans les goitres non nodulaires, le traitement a au mieux un bénéfice limité et transitoire (qui disparaît en quelques mois après son arrêt) sur le volume du goitre.
Baltzinger P, Fasciglione E, Goichot B. Prise en charge des dysthyroïdies. Rev Prat Med Gen 2022;36(1071);445-51.
Références :
1. HAS. Pertinence des soins hypothyroïdie. 19 mars 2019.
2. Engum A, Bjøro T, Mykletun A, et al. An association between depression, anxiety and thyroïd function. A clinical fact or an artefact ? Act Psychiatr Scand 2002;106(1):27-34.
3. Feller M, Snel M, Moutzouri E, et al. Association of Thyroid Hormone Therapy With Quality of Life and Thyroid-Related Symptoms in Patients With Subclinical Hypothyroidism: A Systematic Review and Meta-analysis. JAMA 2018;320(13):1349.
4. Goichot B, Bouee S, Castello-Bridoux C, et al. Survey of Clinical Practice Patterns in the Management of 992 Hyperthyroid Patients in France. Eur Thyroid J 2017;6(3):152-9.
5. Goichot B, Leenhardt L, Massart C, et al. Diagnostic procedure in suspected Graves’ disease. Ann Endocrinol 2018;79(6):608-17.

 Encadrés
Encadrés