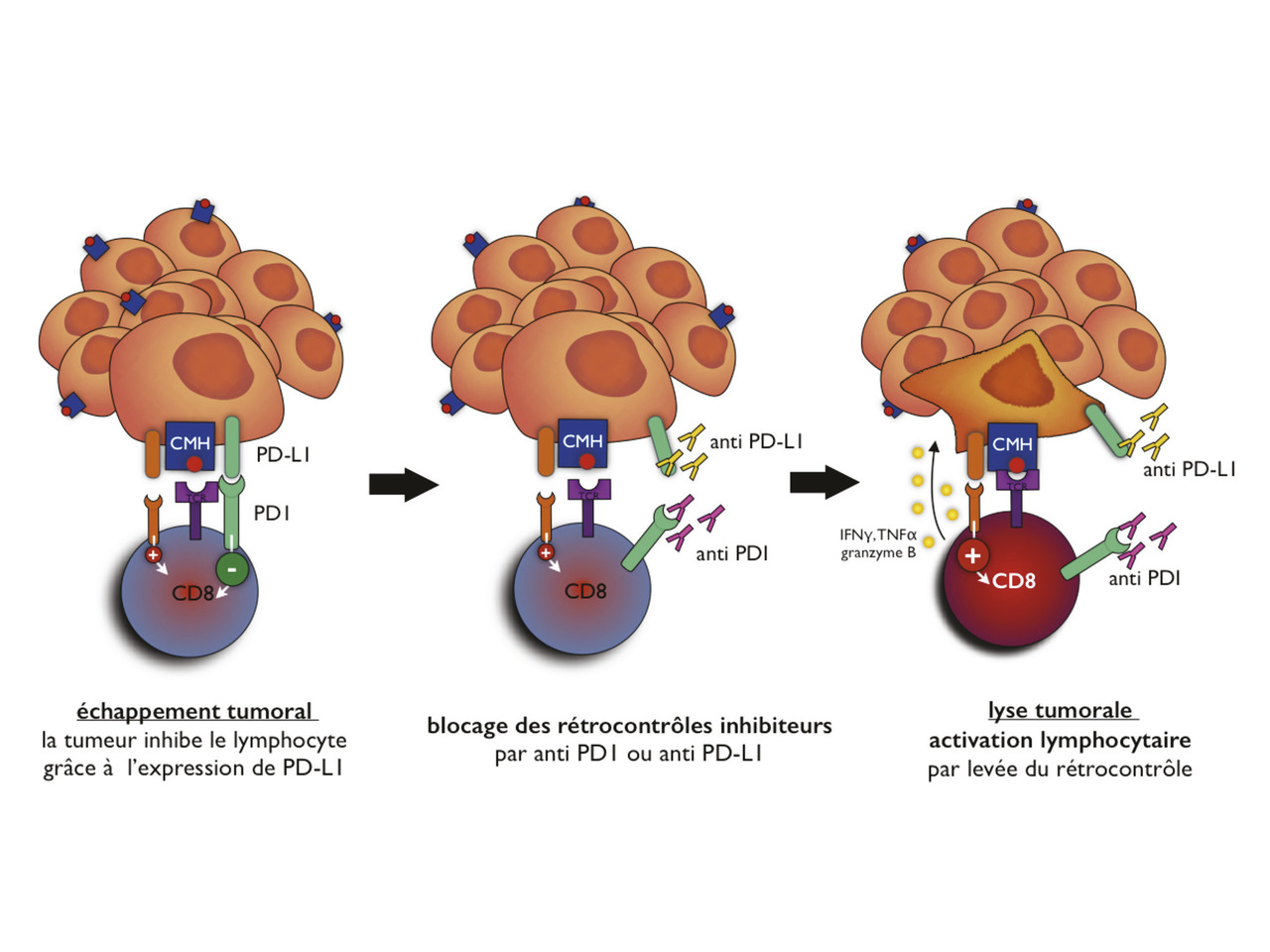
L’utilisation des inhibiteurs de point de contrôle immunitaire anti-PD-1 (récepteur programmed cell death 1 ; nivolumab ou pembrolizumab) et anti-PD-L1 (ligand du récepteur programmed cell death 1 ; atézolizumab, durvalumab ou avélumab) a révolutionné la prise en charge des cancers métastatiques, en particulier du mélanome, du cancer bronchopulmonaire et du cancer rénal. Ces anticorps immunomodulateurs agissent en inhibant le récepteur ou le ligand PD-1 et rétablissent ainsi l’immunité cellulaire T antitumorale (
Même si leur profil de tolérance est bien meilleur que celui des chimiothérapies, leur utilisation peut donner lieu à de nombreux effets indésirables, potentiellement graves et à l’origine d’interruption de traitement, qui doivent être connus.1,2 On estime que le taux de survenue d’effets indésirables s’élève à 75-82 %, avec des symptômes principalement de grade 1 (légers) ou 2 (modérés). Certains patients sont plus à risque de développer des effets secondaires, en particulier s’il existe déjà une maladie auto-immune ou en cas d’antécédents d’effets indésirables sévères sous une première immunothérapie. Une des particularités de ces effets indésirables liés à l’immunité est qu’ils peuvent survenir de façon retardée (parfois plusieurs mois après l’arrêt du traitement). Il est donc nécessaire de maintenir une attention particulière même si la tolérance initiale a été bonne.
Toxicité cutanée
Les effets secondaires les plus fréquemment rencontrés (35-45 %) sont cutanés. Ils surviennent dans les premières semaines après l’initiation du traitement. Prurit, lichen, psoriasis, vitiligo, pemphigoïde bulleuse sont les dermatoses les plus fréquemment rencontrées. Elles sont en général bénignes et bien contrôlées par un traitement par dermocorticoïdes topiques. Des effets secondaires plus graves peuvent cependant apparaître, comme des toxidermies : syndrome de Stevens-Johnson ou syndrome d’hypersensibilité médicamenteuse (DRESS syndrome).3
Toxicité endocrinienne
La survenue d’une altération de l’état général (avec asthénie marquée, céphalées, nausées) ou de troubles ioniques chez un patient sous immunothérapie anti-PD-L1 doit faire rechercher une hypothyroïdie, une hypophysite, une insuffisance surrénalienne ou un diabète de type 1. Un bilan biologique endocrinien doit être demandé, comprenant les dosages de TSH, T3, T4, ACTH, prolactine, GH, IGF-1, FSH/LH, cortisolémie à 8 h, et testostérone pour un homme. Une IRM hypophysaire peut également être discutée au cas par cas après un avis endocrinologique. Ces toxicités sont le plus souvent irréversibles et nécessiteront une supplémentation hormonale à vie pour permettre la poursuite de l’immunothérapie.4
Toxicité digestive et hépatique
L’immunothérapie anti-PD-L1 peut être à l’origine de diarrhées, de colites avec douleurs abdominales, de diarrhées sanglantes avec nausées et/ou vomissements et d’hépatite auto-immune. Une cause infectieuse (Clostridium difficile, cytomégalovirus) doit être recherchée, et une coloscopie est souvent réalisée. Plus de 4 selles par jour et une cytolyse élevée à 4 fois la normale malgré un traitement symptomatique doivent faire interrompre le traitement.5
Toxicité pulmonaire
La toxicité pulmonaire est souvent tardive et de présentation radiologique polymorphe (pneumopathies interstitielles, organisées, d’hypersensibilité ou granulomateuses). L’apparition d’une dyspnée doit faire évoquer une pneumopathie médicamenteuse mais ne doit pas faire oublier les diagnostics différentiels (infection pulmonaire ou progression de la maladie). Un bilan infectieux, un lavage broncho-alvéolaire et des imageries thoraciques doivent être réalisés. L’immunothérapie est souvent stoppée en cas de dyspnée invalidante (grade 3 ; sévère).6
Toxicité neurologique
L’apparition d’une toxicité neurologique est rare et survient entre 6 et 13 semaines après l’introduction de l’immunothérapie. Différents tableaux cliniques ont été décrits : syndrome de Guillain-Barré, méningite lymphocytaire, myasthénie, encéphalopathie, polyneuropathie, polyradiculopathie. L’immunothérapie doit être suspendue dès la suspicion de toxicité neurologique, et un traitement par corticoïdes et plasmaphérèses ou immunoglobulines doit être instauré.7,8
Toxicité cardiaque
L’incidence des toxicités cardiaques est rare (< 1 %), mais leur apparition peut engager le pronostic vital parfois brutalement, avec la survenue de péricardite, myocardite, décompensation cardiaque ou troubles du rythme. Un dépistage clinique et la réalisation d’un ECG et d’un cycle de troponine sont nécessaires. L’arrêt de l’immunothérapie et l’instauration d’une corticothérapie sont le plus souvent requis.9
Autres toxicités
D’autres toxicités sont également décrites : rénales,10 articulaires,11 hématologiques12 ou oculaires.13
Conduite à tenir
De façon générale, la prise en charge des effets indésirables des immunothérapies repose d’abord sur le traitement des symptômes, puis sur l’arrêt des inhibiteurs de point de contrôle, en association avec une corticothérapie systémique, voire avec des immunosuppresseurs de type anti-TNF en cas de persistance de l’effet indésirable (
La reprise d’une immunothérapie anti-PD-1/PD-L1 après une interruption pour effets indésirables reste possible mais doit être discutée de manière pluridisciplinaire en fonction de chaque situation propre à chaque patient. L’immunothérapie est suspendue en cas d’apparition d’effets indésirables de grade 2 (modérés). Les inhibiteurs de point de contrôle peuvent être réintroduits après un tel épisode d’immunotoxicité avec, si possible, une dose inférieure à 10 mg/j d’équivalent prednisone. Un arrêt définitif s’impose à l’apparition d’un effet indésirable de grade 4 (mettant en jeu le pronostic vital), en cas de symptôme de grade 3 (sévère) récurrent ou si un effet indésirable de grade 2 ne s’est pas amendé sous corticothérapie (sauf dans le cas des endocrinopathies sous traitement hormonal substitutif). Un avis spécialisé est systématiquement recommandé pour les grades 3 et 4.
Une meilleure connaissance et une prise en charge précoce des effets secondaires permettent le plus souvent de maintenir ces traitements. Des interactions entre le microbiote digestif, la réponse antitumorale aux inhibiteurs de point de contrôle immunitaire et leur immunotoxicité ont été récemment décrites.14 La modulation du microbiote permettrait d’optimiser encore les effets antitumoraux et la tolérance des inhibiteurs de point de contrôle.
1. Jacquin-Porretaz C, Nardin C, Puzenat E, et al. Effets secondaires des inhibiteurs de checkpoint utilisés dans le traitement des mélanomes et d’autres cancers. Presse Med 2017;46(9):808-17.
2. Martins F, Sofiya L, Sykiotis GP, et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol 2019;16(9):563-80.
3. Sibaud V, Boulinguez S, Pagès C, et al. Toxicités dermatologiques des inhibiteurs de checkpoint immunologiques. Ann Dermatol Venereol 2018;145(5):313-30.
4. Del Rivero J, Cordes LM, Klubo-Gwiezdzinska J, et al. Endocrine-Related Adverse Events Related to Immune Checkpoint Inhibitors: Proposed Algorithms for Management. Oncologist 2020;25(4):290-300.
5. Shivaji UN, Jeffery L, Gui X, et al. Immune checkpoint inhibitor-associated gastrointestinal and hepatic adverse events and their management. Therap Adv Gastroenterol 2019;12:1-15.
6. Delaunay M, Prévot G, Collot S, et al. Management of pulmonary toxicity associated with immune checkpoint inhibitors. Eur Respir Rev 2019;28(154):190012.
7. Psimaras D, Velasco R, Birzu C, et al. Immune checkpoint inhibitors-induced neuromuscular toxicity: From pathogenesis to treatment. J Peripher Nerv Syst 2019;24:S74-S85.
8. Dubey D, David WS, Reynolds KL, et al. Severe Neurological Toxicity of Immune Checkpoint Inhibitors: Growing Spectrum. Ann Neurol 2020;87(5):659-69.
9. Michel L, Rassaf T, Totzeck M. Cardiotoxicity from immune checkpoint inhibitors. Int J Cardiol Heart Vasc 2019;25:100420.
10. Shingarev R, Glezerman IG. Kidney Complications of Immune Checkpoint Inhibitors: A Review. Am J Kidney Dis 2019;74(4):529-37.
11. Kostine M, Truchetet ME, Schaeverbeke T. Clinical characteristics of rheumatic syndromes associated with checkpoint inhibitors therapy. Rheumatology (Oxford) 2019;58:vii68-vii74.
12. Michot JM, Lazarovici J, Tieu A, et al. Haematological immune-related adverse events with immune checkpoint inhibitors, how to manage? Eur J Cancer 2019;122:72-90.
13. Parikh RA, Chaon BC, Berkenstock MK. Ocular Complications of Checkpoint Inhibitors and Immunotherapeutic Agents: A Case Series. Ocul Immunol Inflamm 2020;1-6.
14. Anderson R, Theron AJ, Rapoport BL. Immunopathogenesis of Immune Checkpoint Inhibitor-Related Adverse Events: Roles of the Intestinal Microbiome and Th17 Cells. Front Immunol 2019;10:2254.