objectifs
Le premier électrocardiogramme (ECG) chez l’homme a été enregistré par le physiologiste anglais Augustus Waller en 1887 à l’aide d’un électromètre capillaire. L’enregistrement était de piètre qualité et ne comportait que deux déflections mal individualisées. Au même moment, le médecin hollandais Willem Einthoven améliora la technique de recueil de l’activité électrique cardiaque en utilisant un galvanomètre à corde. Il inventa le terme « elektrokardiogramme » en 1895 et publia ses résultats en 1901 et 1903. Il enregistra 5 potentiels successifs pour chaque cycle cardiaque qu’il nomma P, Q, R, S et T. Ces travaux, qui lui valurent le prix Nobel de médecine en 1924, furent à l’origine de la description et de la compréhension des troubles du rythme cardiaque.
De nos jours, le potentiel électrique recueilli par les électrodes posées sur la peau est amplifié, filtré, puis numérisé par l’appareil ECG. Le tracé est obtenu sur papier millimétré. Ses modalités de lecture doivent être systématisées afin de détecter toutes les anomalies.
Électrocardiogramme normal
La vitesse de déroulement du papier est, par défaut, 25 mm/s. En abscisse, 1 mm (1 petit carreau) équivaut à 0,04 seconde. L’amplitude du signal (en ordonnée) est de 1 mm pour 0,1 mV.
L’électrocardiogramme enregistre l’activité électrique du cœur dans 12 dérivations : 6 dérivations périphériques ou frontales (DI, DII, DIII, aVF, aVR et aVL) et 6 dérivations précordiales (V1 à V6). Les dérivations basales (V7, V8 et V9) et droites (V3R et V4R) sont enregistrées lorsque l’on veut rechercher une ischémie myocardique dans les territoires correspondants (
L’analyse d’un tracé doit toujours comprendre les points successifs suivants : fréquence cardiaque, nature du rythme cardiaque, onde P, espace PR, complexe QRS, segment ST, onde T et intervalle QT. La ligne isoélectrique, qui sert de référence à l’analyse de la déviation du PR et du ST, est habituellement celle du segment TP, soit entre la fin de l’onde T et le début de l’onde P du cycle suivant.
Fréquence cardiaque
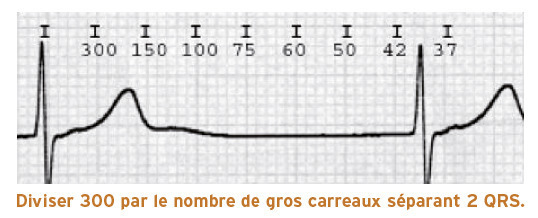
Lorsque la vitesse de déroulement du papier est bien de 25 mm/s, la fréquence cardiaque d’un rythme régulier s’obtient en utilisant la « règle des 300 » : on divise 300 par le nombre de gros carreaux de 5 mm séparant 2 QRS consécutifs (
En cas de rythme irrégulier (notamment fibrillation atriale), cette règle ne s’applique plus, et il faut alors utiliser la « méthode des 6 secondes » : on détermine le nombre de cycles par intervalle de 30 carreaux de 5 mm, soit 15 cm de tracé, et on multiplie ce nombre par 10 pour avoir la fréquence cardiaque par minute.
La fréquence cardiaque (ventriculaire) de repos est comprise entre 50 et 100 batt/min. En dessous, c’est une bradycardie, au-dessus, c’est une tachycardie
Rythme cardiaque normal
Il est sinusal et régulier. Le nœud sinusal, situé dans la partie haute de la paroi de l’oreillette droite près de l’abouchement de la veine cave supérieure, génère de façon automatique des potentiels d’action qui vont entraîner des dépolarisations des cellules atriales environnantes. Cette dépolarisation va emprunter successivement le nœud auriculo-ventriculaire (nœud de Tawara), le faisceau de His et ses branches droite et gauche et le réseau des fibres de Purkinje pour enfin dépolariser le myocarde ventriculaire.
Le rythme sinusal se définit ainsi : chaque onde P sinusale est suivie d’un complexe QRS, lequel est précédé d’une onde P.
De façon physiologique, la fréquence cardiaque augmente en fin d’inspiration et diminue au cours de l’expiration. Cette variation, appelée arythmie sinusale respiratoire, se voit surtout chez l’enfant à partir de 3 ans.
Onde P
Du fait de la localisation anatomique du nœud sinusal, l’onde P sinusale est la traduction d’une dépolarisation atriale qui progresse de haut en bas et de la droite vers la gauche. Elle est donc positive en DII, DIII, aVF et en DI. Elle est souvent biphasique en V1, avec une positivité suivie d’une négativité. Enfin, en DII sa durée est < 120 ms et son amplitude < 0,25 mV.
L’activité des oreillettes est la mieux vue en DII et V1 : c’est dans ces dérivations que l’on mettra le plus facilement en évidence une onde P anormale.
Espace PR
Il correspond à la dépolarisation du nœud auriculo-ventriculaire, du faisceau de His et du réseau de Purkinje. Il est mesuré du début de l’onde P jusqu’au début du complexe QRS (soit l’onde Q si elle existe, et on parle alors de l’espace PQ ; soit l’onde R, et on parle alors de l’espace PR). Il est isoélectrique et dure entre 120 et 200 ms.
Complexe QRS
Il correspond à la dépolarisation des deux ventricules. Quatre points doivent être analysés :
– la durée du QRS : mesurée sur la dérivation où elle est la plus longue. Elle est normalement < 100 ms ;
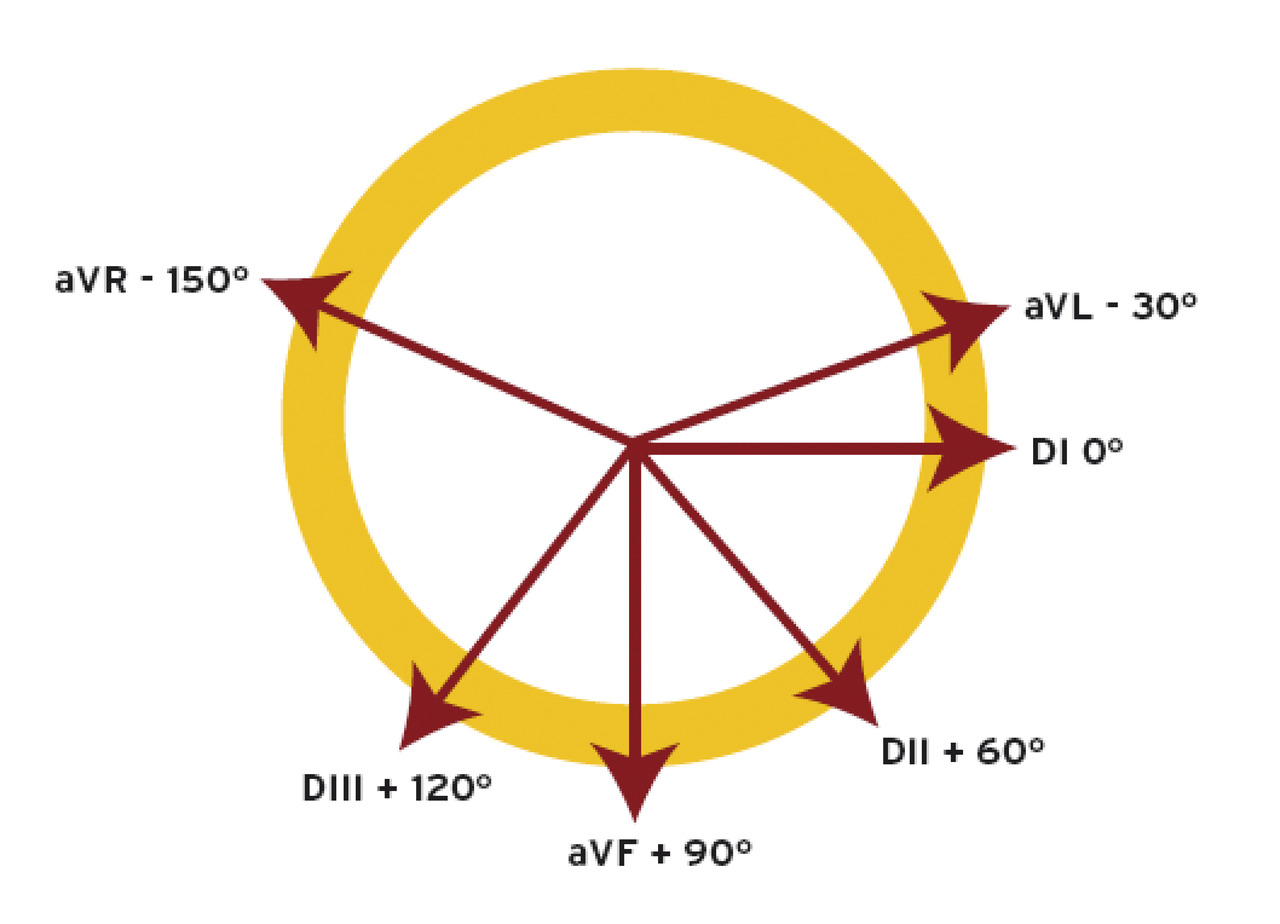
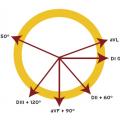
– l’axe du QRS : déterminé de façon simple à partir des dérivations DI, aVF et DII (fig. 2), il est compris entre – 30° et + 90° ;
– l’amplitude du QRS. Pour la recherche d’une hypertrophie ventriculaire gauche (HVG), on calculera l’indice de Sokolow (SV1 + RV5 ou V6) et l’indice de Cornell (SV3 + RaVL), plus sensible. Pour la recherche d’une hypertrophie ventriculaire droite (HVD), on évaluera les rapports R/S en V1-V2 et V5-V6 ;
– la morphologie du QRS : l’amplitude de l’onde R augmente progressivement entre V1 et V6, tandis que celle de l’onde S diminue. La zone où les amplitudes de R et de S sont égales, appelée zone de transition, est normalement située entre V3 et V4. Enfin, la présence d’une onde Q doit être recherchée. Elle est physiologique en aVR et V5-V6, et peut l’être en DIII.
Segment ST
Il correspond au début de la repolarisation ventriculaire et doit être isoélectrique. Une variante de la normale consiste en un sus-décalage particulier, appelé repolarisation précoce. Particulièrement visible dans les dérivations V3 à V5, le sus-décalage débute par un crochetage au point J (point de jonction entre le QRS et le ST), est concave et rejoint des ondes T amples. Cette variante se rencontre surtout chez les sujets sportifs ou de race noire.
Ondes T
Traduisant la fin de la repolarisation ventriculaire, elles ont généralement la même polarité que le complexe QRS (positives si le rapport R/S est > 1). Les ondes T normales sont asymétriques et peuvent être négatives de façon physiologique, notamment dans les dérivations précordiales droites chez l’enfant.
Intervalle QT
L’intervalle QT, mesuré du début du QRS à la fin de l’onde T, correspond à la dépolarisation et la repolarisation de l’ensemble des fibres myocardiques ventriculaires. Cet intervalle est dépendant de la fréquence cardiaque : il se raccourcit avec l’accélération de la fréquence cardiaque. Plusieurs formules de correction du QT (QTc) permettent d’ajuster le QT mesuré à la fréquence cardiaque. La plus fréquemment utilisée est la formule de Bazett, proposée en 1920 : QTc = QT/√RR (intervalle RR en secondes).
La durée du QTc varie entre 340 et 440 ms (450 ms chez la femme).
Ondes U
Inconstantes, il s’agit de petites déflections suivant l’onde T. Généralement positives et surtout visibles en V2-V4, elles correspondent à la repolarisation des cellules mid-myocardiques (entre l’épicarde et l’endocarde) et du système His-Purkinje. Les ondes U proéminentes se voient chez le sportif et en cas d’hypokaliémie ou d’hypercalcémie. La mesure de l’intervalle QT ne doit pas englober l’onde U.
Anomalies des signaux
Anomalies de l’onde P
Les anomalies de l’onde P sont de 3 types.
Les modifications du site d’activation atriale initiale : dans certaines conditions, ce n’est plus le nœud sinusal qui commande l’activité électrique cardiaque mais un autre foyer de l’oreillette droite ou provenant de l’oreillette gauche : soit parce qu’il y a une dysfonction sinusale ou un bloc sino-atrial, et on parle de rythme d’échappement atrial, soit parce qu’il y a un foyer atrial actif et on parle de rythme atrial ectopique. Dans les deux cas, l’onde P de ces rythmes atriaux a alors une morphologie différente de l’onde P sinusale.
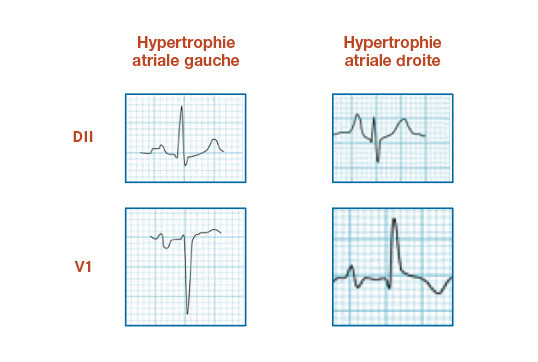
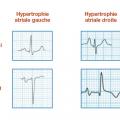
L’aspect d’hypertrophie atriale gauche : onde P large (>120 ms en DII) en double bosse, diphasique en V1 avec une négativité prédominante. Le même aspect se voit en cas de bloc de conduction inter-atrial (fig. 3).
L’aspect d’hypertrophie atriale droite : onde P ample (> 0,25 mV en DII), diphasique en V1 avec positivité prédominante (fig. 3).
Dans ces deux cas, il n’y a pas, le plus souvent, de corrélation entre l’aspect électrique et la taille de l’oreillette.
Anomalies de l’espace PR (ou PQ)
Les anomalies sont de 3 types.
Sous-décalage : c’est un signe précoce et quasi pathognomonique de la péricardite. Les autres causes de sous-décalage de l’espace PQ sont en effet beaucoup plus rares (infarctus atrial, rupture de la paroi de l’oreillette…).
PR court (< 120 ms) : le plus souvent, il traduit l’existence d’une préexcitation ventriculaire par un faisceau de Kent.
PR long (> 200 ms) : il s’agit d’un bloc auriculo-ventriculaire du 1er ou 2e degré type Mobitz I (ou Luciani-Wenckebach).
Anomalies du QRS
Allongement de la durée du QRS
Si un des ventricules est activé anormalement en retard, il s’agit alors d’un bloc de branche (tableau 2). Le bloc est incomplet si la durée du QRS est comprise entre 100 et 120 ms et complet si la durée des QRS est O 120 ms. Les blocs de branche peuvent s’accompagner de troubles de la repolarisation (changements de ST et/ou de T) non spécifiques.
Si un des ventricules est activé anormalement en avance, il s’agit le plus souvent d’un faisceau musculaire appelé faisceau de Kent qui relie directement une oreillette à un ventricule. L’activité électrique cheminant par ce faisceau n’est pas soumise au ralentissement observé dans le nœud auriculoventriculaire : le ventricule correspondant commence donc à être activé rapidement (PR court), puis l’influx provenant du nœud auriculoventriculaire dépolarise normalement l’autre ventricule. Le QRS résulte donc de la fusion entre ces deux voies d’activation : il présente un empâtement à son début (onde delta) et est anormalement large. La préexcitation ainsi définie constitue le syndrome de Wolff- Parkinson-White. Plus rarement, l’aspect de PR court est attribuable à des fibres de James (atrionodales).
Déviation axiale
Les principales causes (
Anomalies de l’amplitude des QRS
Critères diagnostiques d’une hypertrophie ventriculaire gauche :
– indice de Sokolow > 35 mm ;
– indice de Cornell > 28 mm chez l’homme et > 20 mm chez la femme ;
– dans les formes sévères, sous-décalage de ST et ondes T négatives en V5-V6 ;
– déviation axiale gauche inconstante.
Critères diagnostiques d’une hypertrophie ventriculaire droite :
– augmentation de l’amplitude de R en V1-V2 avec R/S > 1 ;
– augmentation de l’amplitude de SQ en V5-V6 avec R/S < 1 ;
– dans les formes sévères, aspect S1Q3 (onde S en DI, onde Q en DIII) ;
– déviation axiale droite.
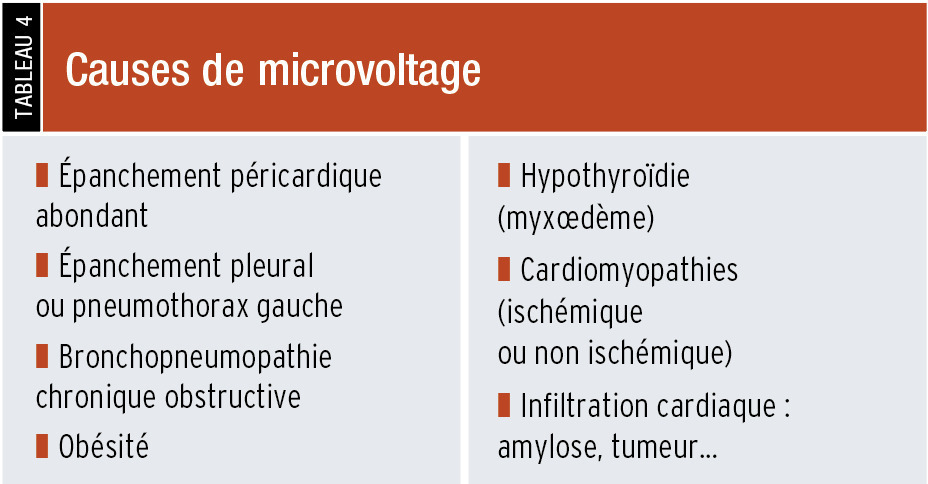
Microvoltage : Il est défini par une amplitude des QRS < 5 mm dans les dérivations frontales ou < 10 mm dans les dérivations précordiales. C’est la traduction soit de l’augmentation de la distance entre le cœur et la peau (par interposition d’air, de liquide, de graisse), soit de la diminution relative de la masse myocardique au sein de l’épaisseur pariétale (remplacée par de la fibrose au cours des cardiomyopathies, infiltration amyloïde…) [
Anomalies de la morphologie du QRS
Devant une grande onde R en V1-V2, il faut toujours garder à l’esprit qu’elle peut être l’image en miroir d’une onde Q en V7-V9 et donc témoigner d’un infarctus basal constitué (
L’onde Q est parfois physiologique. Le complexe QS (absence d’onde R) en est un équivalent. Cependant, la présence d’une onde Q ou d’un aspect QS doit toujours faire rechercher une séquelle d’infarctus du myocarde. L’onde Q dite de nécrose dure plus de 0,03 s et a une profondeur d’au moins 0,1 mV dans deux dérivations contiguës. L’onde Q peut se voir dans d’autres circonstances pathologiques, notamment la cardiomyopathie hypertrophique.
Anomalies du segment ST
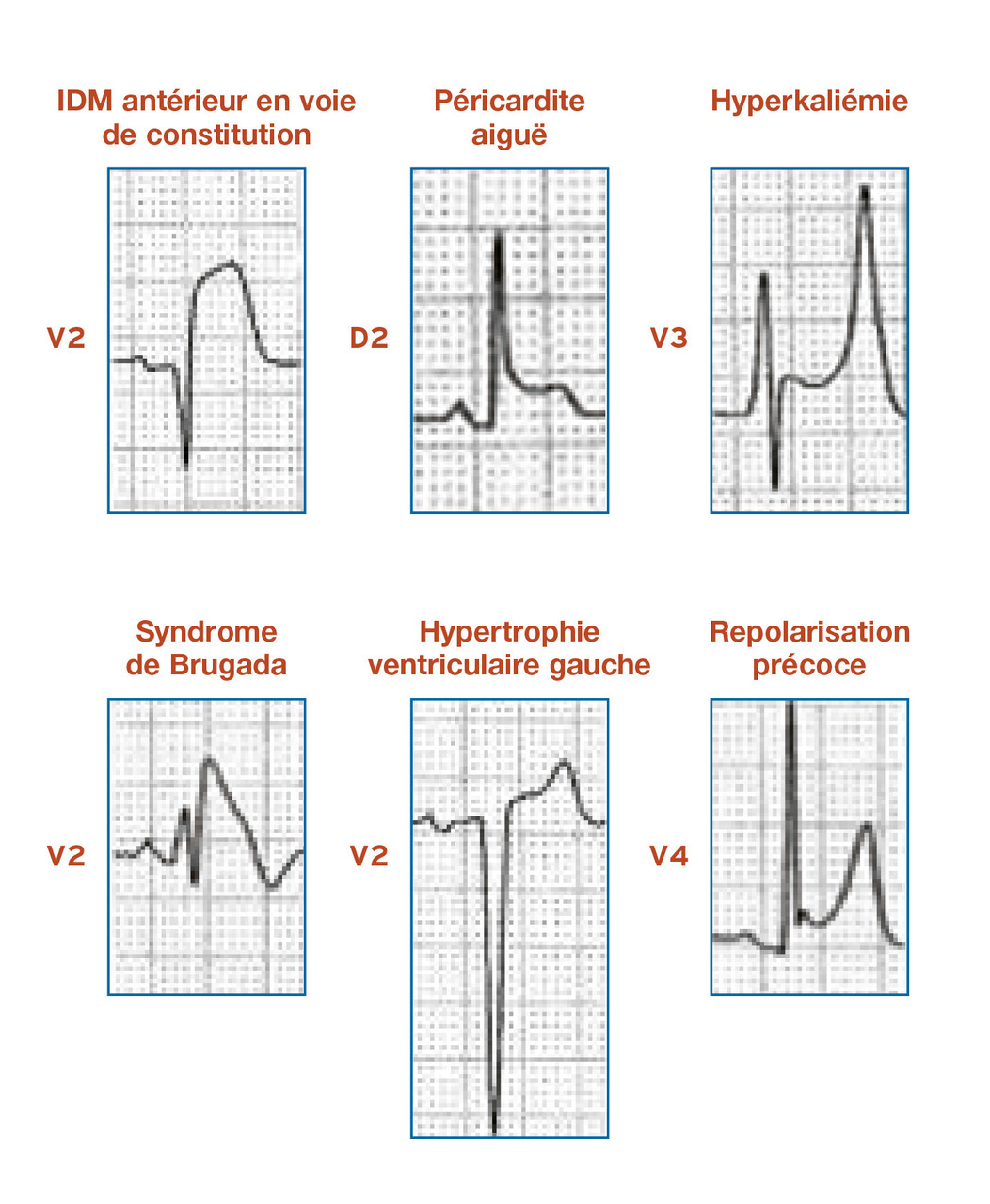
Un sus-décalage du segment ST (
– l’infarctus du myocarde ;
– le syndrome de Prinzmetal ou spasme coronarien ;
– la péricardite aiguë : sus-décalage diffus, concave en haut et sans miroir ;
– la variante de la normale (« repolarisation précoce ») ;
– une myocardite ;
– un bloc de branche gauche et hypertrophie ventriculaire gauche (localisé en V1-V2 ou V3) ;
– un syndrome de Brugada.
Un sus-décalage de ST est un signe précoce de l’infarctus du myocarde en voie de constitution. Dans cette situation, il est convexe en haut et peut englober l’onde T pointue (aspect d’onde de Pardee). Sa localisation correspond à un territoire coronarien et il s’associe à un sous-décalage de ST dans le territoire anatomiquement opposé (miroir). La persistance d’un sus-décalage trois semaines après l’infarctus peut témoigner de la constitution d’un anévrisme ventriculaire.
Le syndrome de Brugada associe un aspect de bloc de branche droit avec un sus-décalage du segment ST convexe en dôme de V1 à V3. D’origine génétique avec une transmission sur le mode autosomique dominant, il expose le patient à un risque de mort subite par tachycardie ou fibrillation ventriculaires.
Devant un sous-décalage du segment ST, on doit garder à l’esprit qu’il peut s’agir de l’image en miroir d’un sus-décalage dans un autre territoire au cours d’un infarctus. Il peut aussi témoigner d’une ischémie myocardique (surtout s’il est horizontal ou descendant dans des dérivations contiguës), d’un trouble secondaire de la repolarisation (hypertrophie ventriculaire…) ou de l’effet de la digoxine (« cupule digitalique »).
Anomalies de l’onde T
L’onde T ample, pointue, s’observe surtout très précocement au cours de l’infarctus (symétrique) et de l’hyperkaliémie (asymétrique). Plus rarement, il s’agit d’une hypertrophie ventriculaire ou d’un accident cérébrovasculaire. Elle peut aussi être physiologique.
L’onde T négative se rencontre aussi chez le sujet sain. Sinon, il peut s’agir :
– dans le cas d’ondes T négatives focalisées : une ischémie myocardique (aiguë ou post-infarctus), une hypertrophie ventriculaire, un bloc de branche, une préexcitation, une cardiopathie hypertrophique ;
– dans le cas d’ondes T négatives diffuses : une péricardite, une hypokaliémie, un traitement digitalique, une ischémie myocardique sévère (lésion du tronc commun ou atteinte tritronculaire), une hémorragie intracrânienne, un phénomène de mémoire transitoire (à l’arrêt d’une tachycardie notamment).
Anomalies de l’intervalle QT
Le QT peut être allongé de façon congénitale (syndrome du QT long congénital) ou acquise. Dans ce dernier cas, il peut être en rapport avec une bradycardie, un trouble métabolique (hypokaliémie, hypocalcémie) ou la prise de certains médicaments (anti-arythmiques de classe Ia et III, macrolides, antipaludéens, psychotropes… [liste complète sur www.qtdrugs.org]). Quelle qu’en soit la cause, cette anomalie favorise la survenue de torsades de pointes.
Le QT est plus rarement court, dans le cas d’une hyperkaliémie ou d’une hypercalcémie, d’une fièvre, d’un traitement par digoxine ou exceptionnellement de façon congénitale.
Anomalies du rythme
Bradycardies
On parle de bradycardie lorsque la fréquence cardiaque est inférieure à 50 batt/min.
Les bradycardies s’observent dans 3 situations (tableau 6) :
– anomalie de l’automaticité du nœud sinusal (dysfonction, voire paralysie sinusale) ;
– trouble de la conduction entre le nœud sinusal et l’oreillette (bloc sino-atrial ou BSA) ;
– trouble de la conduction entre les oreillettes et les ventricules (bloc auriculoventriculaire ou BAV).
Les troubles de conduction interatriaux ou intraventriculaires ne sont pas responsables de bradycardies. Les bloc sino-atrial et les blocs auriculoventriculaires sont étudiés plus en détail dans la question 284 : Troubles de la conduction intracardiaque.
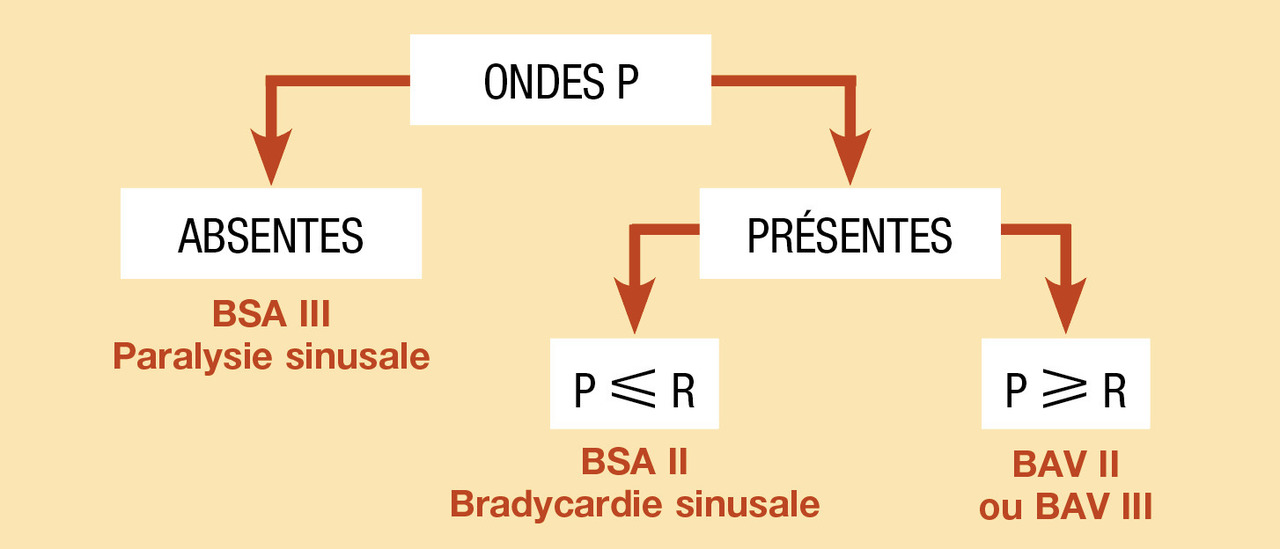
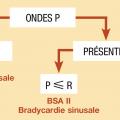
Pour préciser le mécanisme de la bradycardie, il faut comparer le nombre d’oreillettes et le nombre de ventricules (fig. 5).
Quel qu’il soit, la transmission défaillante de l’influx électrique peut parfois donner lieu à un phénomène d’échappement dont l’origine est située plus bas que le siège du bloc. En cas de dysfonction sinusale ou de bloc sino-atrial, l’échappement peut donc être atrial, jonctionnel (nodal ou hissien), ou ventriculaire (provenant d’une des branches du His, du Purkinje ou du myocarde ventriculaire). En cas de bloc auriculoventriculaire, l’échappement ne peut être que jonctionnel ou ventriculaire. La durée et la fréquence des QRS orientent vers le niveau de l’échappement. D’une manière générale, plus l’échappement est bas situé, plus le rythme d’échappement est lent. Un QRS fin correspond forcément à un échappement jonctionnel. Un QRS large correspond soit à un échappement jonctionnel avec aberration de la conduction vers les ventricules (l’influx emprunte une seule des branches du faisceau de His), soit à un échappement ventriculaire.
Dysfonction sinusale
L’activité électrique du nœud sinusal n’étant pas visible sur l’électrocardiogramme de surface, sa traduction est une bradycardie sinusale, voire, à l’extrême, une paralysie sinusale. Elle peut ne se manifester que par une accélération insuffisante de la fréquence cardiaque à l’effort, et on parle alors d’insuffisance chronotrope.
Blocs sino-atriaux
Ils sont de 3 types.
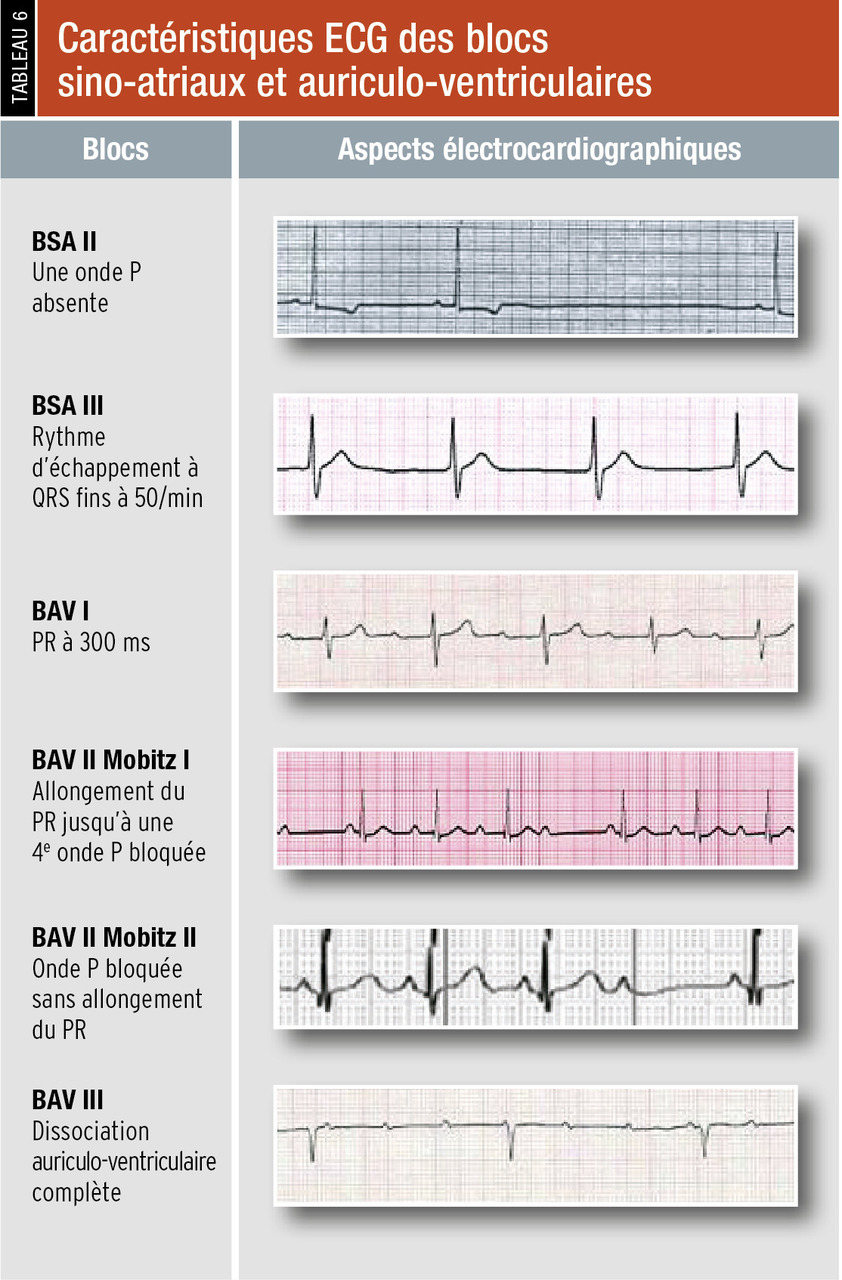
Bloc sino-atrial du premier degré : simple allongement de la conduction entre le nœud sinusal et l’oreillette, il n’a pas de traduction sur l’électrocardiogramme et n’est pas responsable de bradycardie.
Bloc sino-atrial du deuxième degré : existence d’un blocage intermittent de la conduction sino-atriale ; certaines ondes P sont absentes. Si l’intervalle PP encadrant l’onde P absente est égal à 2 fois le cycle PP normal, on parle de bloc sino-atrial de type Mobitz II. Si cet intervalle est plus court que le double du cycle PP, on parle de type Mobitz I.
Bloc sino-atrial du troisième degré : existence d’un blocage complet de la conduction sino-atriale ; il n’y a aucune onde P. Le rythme cardiaque est donc un rythme d’échappement. On parle de syndrome bradycardie-tachycardie ou de maladie rythmique auriculaire lorsqu’un patient présente, sans relation de cause à effet, une bradycardie supraventriculaire (bradycardie sinusale, paralysie sinusale, bloc sino-atrial) et une tachycardie d’origine atriale (fibrillation, flutter ou tachycardie atriale).
BAV
On en distingue 3 types.
Bloc auriculoventriculaire du premier degré : simple allongement fixe de l’espace PR, il n’est pas responsable de bradycardie. Il n’y a jamais d’onde P bloquée.
Bloc auriculoventriculaire du 2e degré : existence d’ondes P bloquées de façon intermittente, soit précédées d’un allongement progressif de l’espace PR (Mobitz I ou Luciani-Wenckebach) soit pas (Mobitz II). En cas de BAV 2/1, il est donc impossible de trancher entre un Mobitz I et un Mobitz II, puisqu’il est impossible de déterminer s’il y a eu un allongement du PR avant l’onde P bloquée. Compte tenu de ses propriétés électrophysiologiques (conduction décrémentielle), le nœud auriculoventriculaire est quasi exclusivement le siège des blocs auriculoventriculaires de type Mobitz I. Dans le cadre du Mobitz II, il s’agit en général d’une atteinte du tronc et/ou des branches du faisceau de His. Cependant, seule une exploration électrophysiologique endocavitaire peut préciser avec certitude le siège anatomique du bloc grâce à l’enregistrement du potentiel hissien.
Bloc auriculoventriculaire du 3e degré : toutes les ondes P sont bloquées et l’activité ventriculaire est sous la dépendance d’un rythme d’échappement. Les QRS sont donc régulièrement espacés, avec une dissociation auriculoventriculaire complète, et les oreillettes sont plus rapides que les ventricules.
Extrasystoles
Une extrasystole est une dépolarisation survenant prématurément par rapport à la dépolarisation prévue par le cycle cardiaque normal. Elle peut provenir des oreillettes (extrasystole auriculaire ou ESA), de la jonction auriculoventriculaire (extrasystole jonctionnelle ou ESJ) ou des ventricules (extrasystole ventricualire ou ESV).
Extrasystoles auriculaires : leur morphologie dépend de leur foyer d’origine et est différente de l’onde P sinusale. Selon leur précocité, elles sont conduites (aux ventricules) ou bloquées.
Extrasystoles jonctionnelles : elles ne sont pas visibles sur l’électrocardiogramme de surface, qui ne montre que leurs éventuelles conductions, rétrograde vers les oreillettes et/ou antérograde vers les ventricules.
Extrasystoles ventricualires : ce sont des complexes ventriculaires larges prématurés, non précédés d’une onde P. Leur morphologie dépend de la région ventriculaire (droite ou gauche) dont elles proviennent.
Les extrasystoles peuvent être :
– bigéminées (1 extrasystole pour 1 cycle normal) ou trigéminées (1 extrasystole pour 2 cycles normaux) ;
– isolées, en doublet, en triplet ou en salve ;
– monomorphes ou polymorphes (au moins 3 morphologies différentes).
Elles peuvent jouer un rôle important dans le déclenchement de troubles du rythme (v. infra).
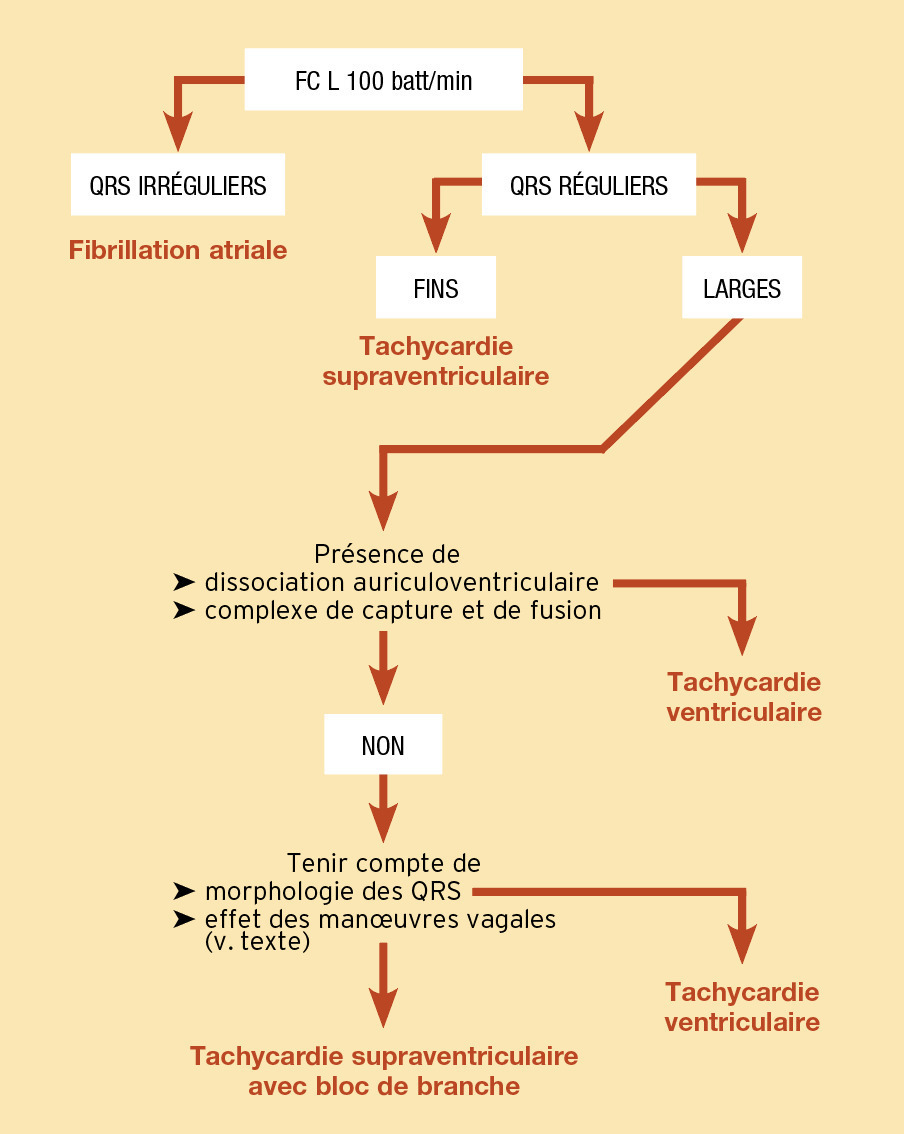
Tachycardies
On parle de tachycardie lorsque la fréquence cardiaque est supérieure à 100/min. Elles sont schématiquement classées en :
– tachycardies supraventriculaires (TSV), au sein desquelles on distingue les tachycardies atriales (fibrillation, flutter et tachycardie) et les tachycardies jonctionnelles ou rythme réciproque (soit par réentrée intranodale, soit sur une voie accessoire type faisceau de Kent) ;
– tachycardies ventriculaires (TV).
Tachycardies supraventriculaires (tableau 7 )
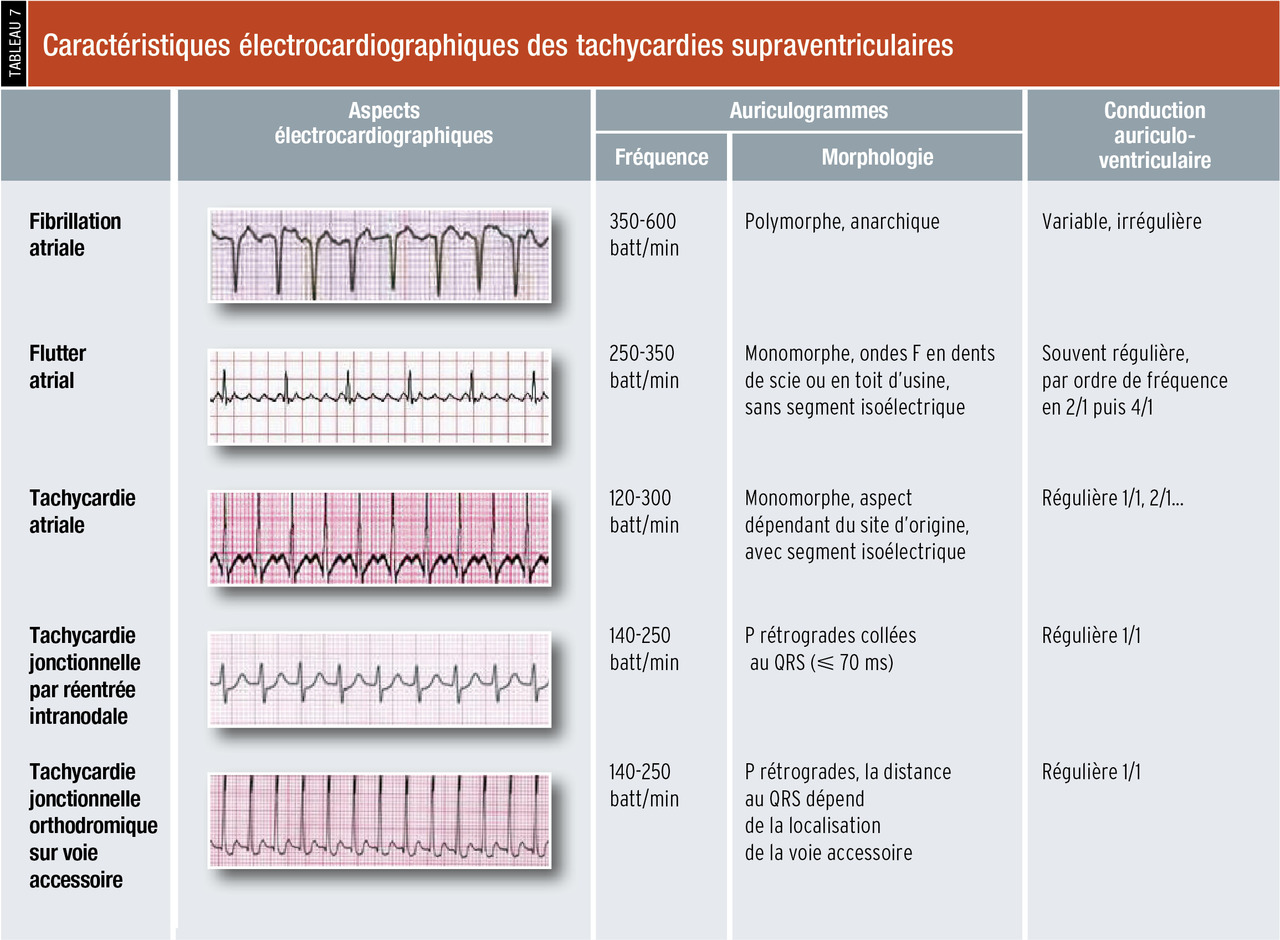
La fibrillation atriale : c’est l’arythmie la plus fréquente chez l’homme ; elle est due à la dépolarisation anarchique rapide des oreillettes (cf. question II-236 « Fibrillation auriculaire »). Cette dépolarisation peut résulter de la transmission à l’oreillette de l’activité de foyers ectopiques, souvent situés au niveau des veines pulmonaires, et/ou de l’existence de multiples circuits de micro-réentrée au sein du tissu atrial. Le nœud auriculoventriculaire filtre cette activité atriale extrêmement soutenue, mais la réponse ventriculaire reste rapide et surtout irrégulière.
Le flutter atrial : dans sa forme typique, il s’agit d’un circuit de macro-réentrée tournant à 300/min dans l’oreillette droite. Le circuit descend le long de la crista terminalis et de la paroi latérale de l’oreillette droite, passe par l’isthme cavo-tricuspide, remonte le long du septum interatrial, parcourt le toit de l’oreillette droite avant de redescendre. La conduction auriculoventriculaire est le plus souvent régulière en 2/1.
La tachycardie atriale : elle correspond à la propagation de l’influx électrique originaire d’un foyer atrial autre que le nœud sinusal. Lorsqu’elle est relativement lente, le nœud auriculoventriculaire conduit en 1/1 aux ventricules.
La tachycardie jonctionnelle par réentrée intranodale : le nœud auriculoventriculaire comprend 2 voies ayant des propriétés électrophysiologiques différentes. La voie dite rapide est celle normalement empruntée par l’influx électrique, et sa période réfractaire est longue. La voie dite lente a une période réfractaire courte. Si une extrasystole atriale survient de façon suffisamment précoce, elle peut trouver la voie rapide en période réfractaire et descendre uniquement par la voie lente. La voie rapide a alors le temps de sortir de sa période réfractaire et est dépolarisée par voie rétrograde. L’influx peut à nouveau redescendre par la voie lente, perpétuant un circuit de réentrée au sein du nœud auriculoventriculaire. L’oreillette est donc activée par voie rétrograde (d’où une onde P’ négative en DII-DIII-aVF) et le ventricule de façon antérograde habituelle.
La tachycardie jonctionnelle sur voie accessoire : la voie accessoire est congénitale et relie le plus souvent une oreillette à un ventricule (on parle alors de faisceau de Kent). En tachycardie, l’influx descend des oreillettes aux ventricules par la voie de conduction normale (les QRS sont donc fins) puis remonte à l’oreillette par la voie accessoire : c’est une tachycardie orthodromique. Les ondes P rétrogrades sont d’autant plus proches du QRS que la voie accessoire est située près de la voie de conduction normale. Plus rarement, l’influx descend par la voie accessoire et remonte par la voie de conduction normale : les QRS sont alors larges et la tachycardie est qualifiée d’antidromique. Ces tachycardies sont bénignes, sauf dans le cas d’une fibrillation auriculaire qui se transmettrait rapidement aux ventricules par la voie accessoire, avec un risque de fibrillation ventriculaire.
Tachycardies ventriculaires
Ce sont des tachycardies :
– constituées d’au moins 4 complexes ventriculaires ;
– régulières ;
– à QRS larges ;
– de fréquence comprise entre 100 et 250 batt/min (en dessous, on parle de rythme idioventriculaire accéléré ou RIVA ; au-dessus, de flutter ventriculaire) ;
– soutenues (par convention, de durée > 30 secondes) ou non soutenues ;
– monomorphes ou polymorphes.
En général, elles surviennent sur une cardiopathie sous-jacente qui comporte le substrat nécessaire à leur déclenchement et leur entretien : séquelle d’infarctus, cardiomyopathie dilatée, dysplasie ventriculaire droite arythmogène (DVDA) ou encore des anomalies des canaux ioniques cardiaques (syndromes de Brugada et du QT long congénital). Certaines tachycardies ventriculaires peuvent aussi survenir sur cœur apparemment sain : tachycardies ventriculaires infundibulaires (naissant au niveau de l’infundibulum pulmonaire, dans le ventricule droit) et tachycardies ventriculaires fasciculaires (naissant au niveau du réseau de Purkinje gauche).
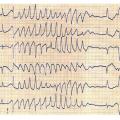
Les torsades de pointes constituent une forme particulière de tachycardie ventriculaire polymorphe. Leur aspect électrocardiographique est caractéristique, rendant le diagnostic aisé : la pointe des QRS est tantôt au-dessus, tantôt en dessous de la ligne isoélectrique (
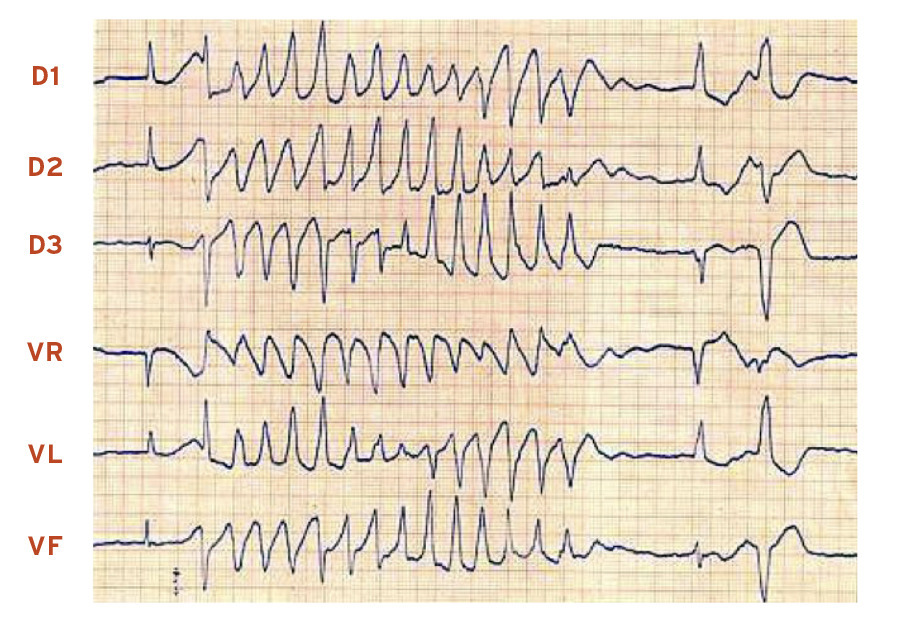
Orientation diagnostique devant une tachycardie régulière à QRS larges
Il peut s’agir soit d’une tachycardie ventriculaire, soit d’une tachycardie supraventriculaire avec bloc de branche (préexistant ou induit par la tachycardie). On peut s’aider d’électrocardiogrammes antérieurs retrouvant un bloc de branche préexistant ou des extrasystoles ventriculaires de même aspect que les complexes de la tachycardie.
Une tachycardie régulière à QRS large, notamment en cas de cardiopathie sous-jacente, est une tachycardie ventriculaire jusqu’à preuve du contraire. Le risque immédiat de la tachycardie ventriculaire est sa transformation en fibrillation ventriculaire (activité rapide anarchique des ventricules) entraînant un arrêt cardio-circulatoire.
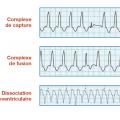
Il faut donc rechercher avec soin des éléments orientant vers une tachycardie ventriculaire en réalisant un tracé de longue durée (
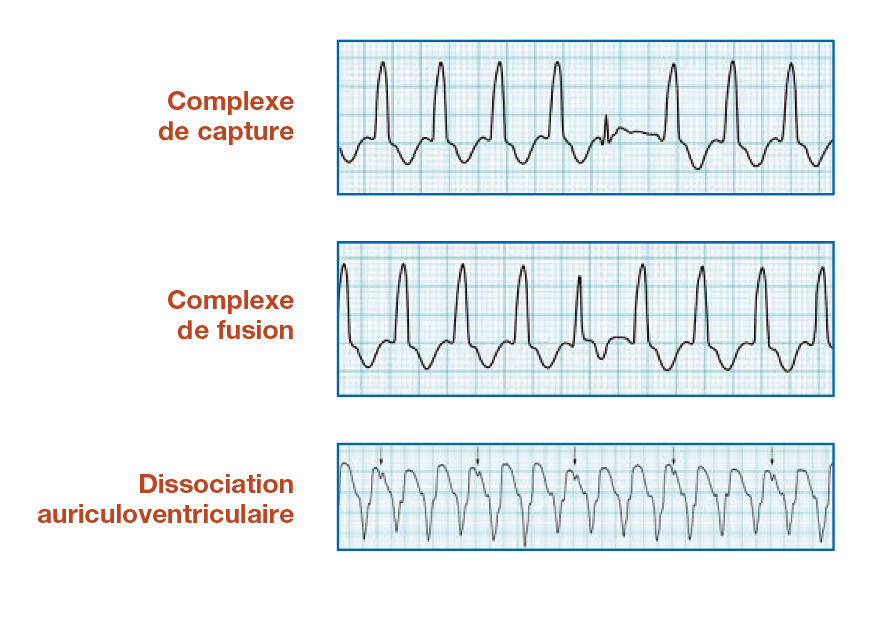
– dissociation auriculoventriculaire : les ondes P sont moins nombreuses que les complexes QRS et elles sont à leur fréquence propre. Ceci est pathognomonique d’une tachycardie ventriculaire ;
– complexes de capture : au milieu de la tachycardie, c’est un QRS fin précédé d’une onde P sinusale (l’influx sinusal s’est immiscé entre deux complexes de tachycardie, donnant un QRS fin) ;
– complexes de fusion : au milieu de la tachycardie survient un QRS de morphologie intermédiaire entre le complexe QRS sinusal (fin) et le complexe QRS de la tachycardie ventriculaire (large). Il témoigne de la dépolarisation des ventricules en partie par la tachycardie ventriculaire et en partie par un influx sinusal intercalé.
La présence de captures ou de fusions est pathognomonique d’une tachycardie ventriculaire. Leur absence n’a aucune valeur.
Les manœuvres vagales (massage sino-carotidien, manœuvre de Valsalva…) et l’injection d’adénosine ou Striadyne ralentissent transitoirement la conduction auriculoventriculaire. En cas de tachycardie supraventriculaire, elles peuvent interrompre la tachycardie si elle est jonctionnelle ou la ralentir si elle est atriale, permettant alors de voir l’activité des oreillettes entre deux QRS devenant plus espacés. La négativité de ces manœuvres ne permet aucune conclusion diagnostique.
Le plus souvent, le diagnostic différentiel n’a pu être établi à ce stade, et on s’aide alors de critères morphologiques. Schématiquement, plus la morphologie des QRS se rapproche d’un bloc de branche droit ou bloc de branche gauche classique, et plus la probabilité qu’il s’agisse d’une tachycardie supraventriculaire avec aberration de conduction est grande. À l’inverse, plus la morphologie des QRS est inhabituelle, et plus il risque de s’agir d’une tachycardie ventriculaire. Certains critères simples orientent vers une tachycardie ventriculaire :
– largeur des QRS > 140 ms (et encore plus si > 160 ms) ;
– largeur entre le début de l’onde R et le nadir de l’onde S >100 ms ;
– concordance des QRS (tous positifs ou tous négatifs) de V1 à V6.
Indications de l’électrocardiogramme
Parmi les indications communément admises pour la réalisation d’un électrocardiogramme, on peut retenir :
– diagnostic positif de cardiopathie devant des symptômes (douleur thoracique, dyspnée, palpitations, lipothymie ou syncope) ou des signes physiques évocateurs (insuffisance cardiaque, souffle, tachycardie…) ;
– suivi d’une cardiopathie, surtout en cas de changement du statut clinique ;
– évaluation de l’effet d’un traitement (efficacité et/ou tolérance : par exemple pour les β-bloquants, fréquence cardiaque au repos < 60 batt/min sans apparition de trouble conductif) ;
– dépistage de cardiopathie chez des sujets > 40 ans avec au moins 2 facteurs de risque cardiovasculaire ;
– recherche d’hypertrophie ventriculaire gauche dans le bilan initial d’une hypertension artérielle (inclus dans le bilan de l’Organisation mondiale de la santé) ;
– évaluation du retentissement cardiaque de maladies extra- cardiaques (insuffisance rénale, diabète, hypothermie…), de troubles électrolytiques ou de traitements potentiellement cardiotoxiques ;
– un électrocardiogramme annuel est obligatoire chez les sportifs inscrits sur la liste des sportifs de haut niveau ;
– bilan préopératoire : dans le cadre des références médicales opposables, il n’y a pas lieu de faire un électrocardiogramme avant une chirurgie courante chez un homme avant 40 ans ou une femme avant 50 ans, en l’absence d’antécédents pathologiques précis, de facteurs de risque ou d’anomalies de l’examen clinique. Dans le cas contraire, et notamment en cas de chirurgie lourde, l’électrocardiogramme est indispensable.
L’électrocardiogramme est un acte technique simple sans danger, indiqué, comme on l’a vu ci-dessus, dans de nombreuses situations. Le corollaire de cette utilisation large est le risque d’erreur d’interprétation avec des diagnostics manqués ou portés par excès. Pour réduire ce risque, il faut donc bien retenir les quelques principes suivants :
– la lecture de l’électrocardiogramme doit être systématique, en analysant les différents segments et ondes successivement ;
– l’électrocardiogramme n’a pas toujours une sensibilité parfaite. Deux exemples : 1) une anomalie peut n’être que transitoire ; 2) l’échographie est plus sensible que l’électrocardiogramme pour détecter une hypertrophie ventriculaire gauche ;
– l’électrocardiogramme n’a pas toujours une spécificité parfaite. Par exemple, une onde T négative peut se voir dans de multiples circonstances, et parfois de façon physiologique : sa spécificité pour détecter une ischémie myocardique est faible ;
– l’électrocardiogramme doit toujours être interprété en fonction de la clinique ;
– le mauvais placement ou l’inversion d’électrodes est une source fréquente d’erreurs ;
– personne n’est infaillible ! Ne pas hésiter à demander un avis spécialisé en cas d’électrocardiogramme inhabituel, et ne pas se fier aveuglément à l’interprétation automatisée du tracé telle qu’elle peut être fournie par certains appareils.
POINTS FORTS À RETENIR
La lecture de l’électrocardiogramme doit être systématique et tenir compte du contexte clinique.
Un électrocardiogramme normal n’élimine pas une cardiopathie, ni une arythmie qui peut n’être que paroxystique.
La connaissance des territoires électrocardiographiques est indispensable pour le diagnostic des ischémies et infarctus myocardiques.
Une tachycardie régulière à complexes larges est une tachycardie ventriculaire jusqu’à preuve du contraire. Il faut souvent un tracé long pour différencier tachycardie ventriculaire et tachycardie supraventriculaire avec aberration de conduction.
Devant une tachycardie, les manœuvres vagales sont utiles pour tenter de mettre en évidence l’activité des oreillettes.
En cas de trouble de la conduction, le rythme d’échappement est d’autant plus rapide qu’il est haut situé.
Qu'est-ce qui peut tomber à l'examen ?
Un ECG peut vous être proposé dans de nombreux dossiers de cardiologie ou de vasculaire.
Il est important d’analyser le tracé de manière systématique, mais en se demandant toujours quelles sont les hypothèses diagnostiques évoquées par le contexte clinique, par exemple :
– s’il s’agit d’un accident artériel embolique, la fibrillation auriculaire est évoquée en priorité ;
– s’il s’agit d’un infarctus du myocarde en état de choc, penser au bloc sino-auriculaire ou au bloc auriculoventriculaire complet en cas de bradycardie et à la tachycardie ventriculaire en cas de tachycardie ;
– s’il s’agit d’une douleur thoracique fébrile, rechercher les signes de la péricardite, etc.
L’interprétation de l’électro- cardiogramme peut conditionner la suite de la prise en charge. Dans un dossier, il est peu probable que vous ayez un tracé très difficile. L’électrocardiogramme proposé peut même être normal et alors servir à exclure un diagnostic.
Enfin, on peut vous demander d’évaluer l’efficacité ou la tolérance d’un médicament à travers son retentissement sur le rythme cardiaque.

 Encadrés
Encadrés