L’emphysème, composante alvéolaire de la bronchopneumopathie chronique obstructive (BPCO), correspond à une destruction irréversible des alvéoles pulmonaires. Sa principale cause est l’exposition tabagique, mais il peut également s’inscrire dans le cadre d’un déficit en alpha- 1 -antitrypsine (DAAT). Sa physiopathologie est complexe et partiellement comprise. Plusieurs mécanismes sont impliqués dans la genèse de l’emphysème : une réaction inflammatoire excessive et chronique, une majoration du stress oxydant, une augmentation de l’apoptose et de la sénescence des différents contingents cellulaires ainsi qu’une perturbation de l’équilibre protéases anti-protéases en faveur des protéases.1
Comment affirmer le diagnostic ?
Cliniquement, des symptômes identiques à ceux observés dans la BPCO (dyspnée, toux, expectorations) sont objectivés chez les patients ayant un emphysème pulmonaire.
Les épreuves fonctionnelles respiratoires permettent de confirmer l’existence d’un trouble ventilatoire obstructif irréversible, fréquemment associé à une distension thoracique (définie par une augmentation du volume résiduel [VR] et/ou du rapport VR/capacité pulmonaire totale [CPT]) et à une diminution de la capacité de transfert du monoxyde de carbone (DLCO).
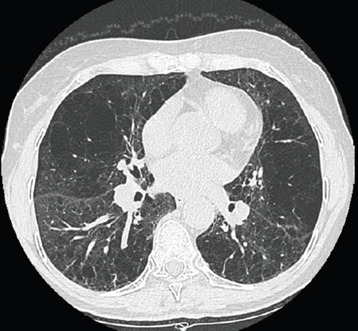
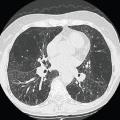
Le scanner thoracique est un élément central du diagnostic, permettant une analyse qualitative et quantitative de l’emphysème, avec éventuellement une mesure de la densité pulmonaire (fig. 1).
Un diagnostic différentiel ou associé doit être recherché en cas de dyspnée persistante.1,2
Une maladie fréquente, surtout environnementale, parfois génétique
Les principaux facteurs de risque d’emphysème connus sont les expositions environnementales telles que le tabagisme, l’inhalation de particules et de gaz toxiques provenant de la pollution de l’air domestique et extérieur.
Le déficit en AAT correspondant au variant Z du gène SERPINA1 à l’état homozygote est la cause génétique principale de l’emphysème. Cependant, les patients hétérozygotes ont également un risque accru de déclin accéléré de leur fonction respiratoire, principalement lorsqu’ils sont exposés à des particules toxiques. Il s’agit d’une des maladies génétiques autosomiques récessives les plus fréquentes dans le monde, avec une prévalence similaire à celle de la mucoviscidose (250 000 patients homozygotes dans le monde et près de 35 millions d’hétérozygotes).3
Des outils de dépistage simples sont disponibles et recommandés pour l’ensemble des patients atteints de BPCO.4 Doivent être réalisés successivement un dosage de l’AAT sérique à distance d’un syndrome inflammatoire (norme supérieure à 1,1 g/L) puis, en cas de déficit, un phénotypage (isoélectrofocalisation) ou un génotypage (PCR), enfin un séquençage en cas de suspicion de variant rare ou s’il existe une discordance entre les deux examens précédents.3
Deux comorbidités principales
Les comorbidités de la BPCO sont fréquentes, au premier rang desquelles les comorbidités cardiovasculaires et le cancer bronchopulmonaire. Il existe également une association entre BPCO et ostéoporose, sarcopénie, anxiété et dépression, indépendamment de l’âge ou du tabagisme.
Prise en charge pharmacologique et non pharmacologique
Revoir les règles hygiéno-diététiques pour tous
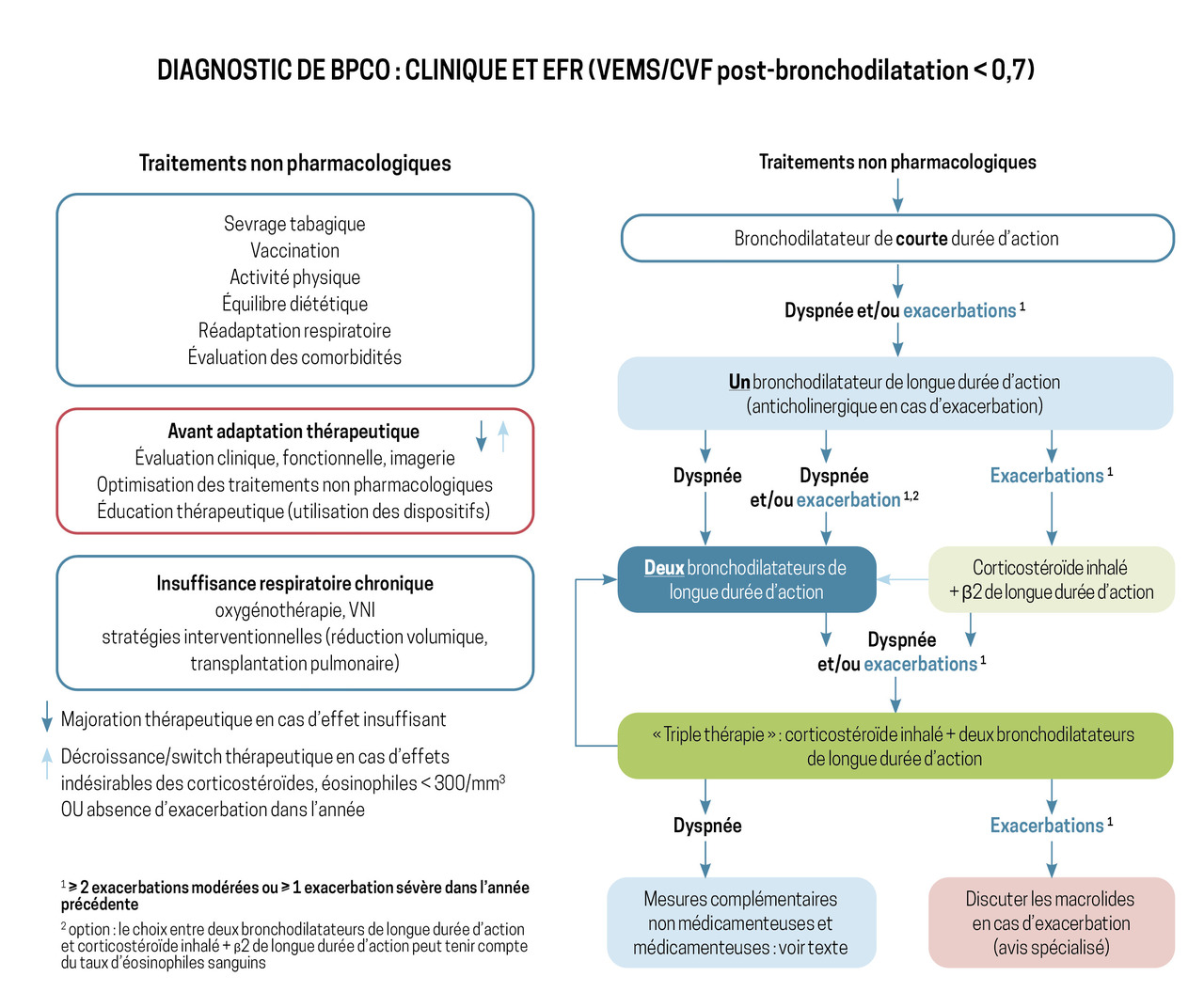
Lorsque l’emphysème s’intègre dans le cadre d’une BPCO, la prise en charge s’applique de manière identique. Une fois le diagnostic de BPCO confirmé par spirométrie avec l’existence d’un trouble ventilatoire obstructif (défini par un rapport VEMS/CVF < 0,7 après bronchodilatateur), les mesures générales dont l’efficacité a été démontrée avec un haut niveau de preuve doivent être mises en place pour tous les patients. Ainsi, il est nécessaire de proposer systématiquement (fig. 2) :
- une aide au sevrage tabagique ;
- les vaccinations antigrippale et antipneumococcique ;
- un bon équilibre diététique ;
- des conseils pour l’activité physique ;
- une réadaptation si une dyspnée et/ou un handicap persiste dans la vie quotidienne.
Traiter la dyspnée sévère
En cas d’insuffisance respiratoire sévère, une oxygénothérapie de longue durée, voire une ventilation non invasive, peut être proposée. Dans le cas d’un emphysème sévère, une réduction de volume, par voie endoscopique et/ou chirurgicale doit être discutée.
Bronchodilatateurs de courte et de longue durées d’action toujours !
Un bronchodilatateur de longue durée d’action antimuscarinique (LAMA) ou β2 -agoniste (LABA) doit être proposé en cas de symptômes quotidiens à type de dyspnée invalidante. Celle-ci est définie par un score modified medical research council (mMRC) supérieur ou égal à 1, ou des exacerbations fréquentes (deux exacerbations modérées définies par la nécessité d’une antibiothérapie ou d’une corticothérapie systémique, ou une exacerbation sévère définie par la nécessité d’une hospitalisation par an).
Un bronchodilatateur de courte durée d’action est systématiquement associé en cas de symptômes respiratoires aigus. En cas de persistance des symptômes (dyspnée et/ou exacerbation) malgré ce traitement de fond, une bithérapie (LABA-LAMA ou LABA-corticostéroïdes inhalés [CSI]), puis une trithérapie inhalée (LAMA-LAMA-CSI) peuvent être proposées (fig. 2).
Dans tous les cas, le choix du dispositif d’inhalation, l’observance et la technique d’utilisation du dispositif doivent être évalués régulièrement.
Indications des corticostéroïdes inhalés bien établies
La place des CSI est désormais bien définie ; leur prescription doit être envisagée chez des patients dont les exacerbations sont fréquentes (deux exacerbations modérées ou une sévère par an), ayant une éosinophilie sanguine supérieure ou égale à 300/µL ou un antécédent d’asthme associé.1 Ils ne sont pas dénués d’effets indésirables (pneumopathies, infections à mycobactéries non tuberculeuses, ostéoporose, diabète, cataracte), et leur prescription doit se faire après évaluation de la balance bénéfice/risque.2
Déficit profond en alpha- 1 -antitrypsine
Dans le cadre d’un DAAT associé à l’emphysème, et sous condition d’un sevrage tabagique total et d’un avis spécialisé en centre de référence maladies rares, un traitement substitutif hebdomadaire par AAT humaine (60 mg/kg) par voie intraveineuse peut permettre de restaurer une protection contre les élastases pulmonaires. L’indication concerne les patients homozygotes ZZ âgés de moins de 70 ans, non ou ex-fumeurs, ayant un emphysème et un volume expiratoire maximal par seconde (VEMS) compris entre 35 et 70 % de la valeur théorique.3
Réadaptation respiratoire en cas de dyspnée ou handicap persistant
Une réadaptation en cas de dyspnée et/ou handicap persistant dans la vie quotidienne est indispensable et peut être prescrite par tout médecin. Il s’agit d’une prise en charge globale du patient faisant intervenir l’éducation thérapeutique, la prise en charge diététique et l’activité physique. Cette réadaptation respiratoire, malgré des bénéfices clairement démontrés, reste sous-utilisée en France.5
Traiter l’hyperinflation pulmonaire
L’hyperinflation pulmonaire contribue au handicap respiratoire imposant une dyspnée d’effort puis de repos. Des techniques de réduction volumique peuvent être envisagées lorsque le handicap respiratoire est important.1,6
Places de la chirurgie et des traitements endoscopiques
Une prise en charge chirurgicale est possible, mais, s’agissant d’une technique invasive, les patients éligibles sont en nombre limité, et la morbimortalité induite est importante.
De nombreuses techniques endoscopiques moins invasives (réduction de volume biologique, valve endobronchique, coils et vapeur) se développent et s’adressent à un profil plus large de patients. Il s’agit alors de patients symptomatiques malgré un traitement médical optimal bien conduit ayant un VEMS entre 20 et 45 % de la théorique, un VR supérieur à 180 - 200 %, pouvant parcourir entre 100 et 500 mètres au test de marche de six minutes et n’ayant pas de bronchiectasies ni d’hypertension pulmonaire associée (pression systolique de l’artère pulmonaire inférieure ou égale à 50 mmHg à l’échocardiographie). Les patients doivent également avoir participé à un programme de réadaptation respiratoire et être sevrés du tabac. Enfin, une analyse précise de l’imagerie thoracique est nécessaire, et la prise en charge optimale est décidée en réunion de concertation pluridisciplinaire.6
Essor des valves endobronchiques
Les valves endobronchiques se sont rapidement développées : il s’agit de valves unidirectionnelles proximales empêchant l’entrée mais permettant la sortie d’air dans la zone emphysémateuse afin d’obtenir son atélectasie.
La première étude a été publiée en 2010 et incluait 321 patients atteints de BPCO.7 Ses résultats ont montré une amélioration du VEMS à six mois (différence moyenne entre les groupes : 6,8 % ; p = 0,005). Cet essai a permis de souligner l’importance de l’hétérogénéité de l’emphysème (différence moyenne sur le VEMS de 10,7 % ; p = 0,004 dans le sous-groupe, avec un score d’hétérogénéité à 15 %) et de l’intégrité des scissures (différence moyenne sur le VEMS de 16,2 % ; p < 0,001) afin de tirer un bénéfice maximal de la pose de valve. Ainsi, un examen attentif de l’imagerie (scanner, scintigraphie) et une épreuve per-endoscopique par cathéter de Chartis permettent de s’assurer de l’intégrité des scissures. Concernant les effets indésirables, la survenue d’exacerbations de BPCO ou de pneumothorax peut conduire au remplacement ou au retrait des valves.8
Perspectives thérapeutiques
Il est possible d’injecter des polymères sclérosants dans les bronches distales d’une zone emphysémateuse pour en provoquer l’atélectasie. Une étude contrôlée randomisée9 a montré des résultats satisfaisants, avec une amélioration de la fonction respiratoire (à six mois, augmentation de 100 mL, soit 18,9 % dans le groupe traité versus 10 mL et 1,3 % dans le groupe contrôle ; p = 0,043), des capacités à l’exercice (+ 31 min versus - 22 min ; p = 0,019) et de la qualité de vie. Il existait néanmoins un nombre important d’effets indésirables (syndrome pseudogrippal intense) dans le groupe traité. L’essai n’a pu être conduit jusqu’à son terme pour des raisons financières, mais une actualisation de la technique pourrait permettre de confirmer ces résultats encourageants.
Les autres techniques de type spirales endobronchiques, ou coils, à l’origine de nombreux effets indésirables, ne sont pas disponibles et leur développement a été interrompu.10
Réunion de concertation pluridisciplinaire pour décider du traitement
Au total, devant les nombreuses innovations thérapeutiques dans le domaine de l’emphysème pulmonaire, en cas d’exacerbations fréquentes ou de dyspnée importante, le patient doit être absolument adressé à un pneumologue, voire à un centre expert, afin de pouvoir discuter en réunion de concertation pluridisciplinaire des meilleures options thérapeutiques.
Que dire à vos patients ?
L’emphysème est fréquemment associé à la BPCO.
La prise en charge repose avant tout sur le sevrage tabagique.
Les mesures non pharmacologiques telles que l’activité physique, l’équilibre diététique, les vaccinations contre la grippe, le pneumocoque et le Covid- 19 sont essentielles.
Des associations de patients existent pour accompagner les patients mais aussi les aidants, comme Santé respiratoire France (https ://sante-respiratoire.com/)
En cas de handicap respiratoire, la réadaptation respiratoire est primordiale.
2. Zysman M, Ribeiro Baptista B, Soumagne T, et al. Optimisation du traitement médicamenteux des patients atteints de BPCO en état stable. Position de la Société de pneumologie de langue française. Actualisation 2021. Rev Mal Respir 2021;38(5):539‑61.
3. Mornex JF, Balduyck M, Bouchecareilh M, et al. French clinical practice guidelines for the diagnosis and management of lung disease with alpha 1-antitrypsin deficiency. Rev Mal Respir 2022;39(7):633‑56.
4. Chapuis Cellier C, Narjoz C, Zerimech F, et al. Screening for alpha1-antitrypsin deficiency using dried blood spot: Assessment of the first 20 months. Rev Mal Respir 2020;37(8):633‑43.
5. Guecamburu M, Coquelin A, Rapin A, et al. Pulmonary rehabilitation after severe exacerbation of COPD: A nationwide population study. Respir Res 2023;24(1):102.
6. Mal H, Bunel V, Marceau A, et al. Réduction de volume pulmonaire endoscopique dans l’emphysème. Rev Mal Respir 2019;36(7):880‑8.
7. Sciurba FC, Ernst A, Herth FJF, et al. A randomized study of endobronchial valves for advanced emphysema. N Engl J Med 2010;363(13):1233‑44.
8. Slebos DJ, Shah PL, Herth FJF, et al. Endobronchial Valves for Endoscopic Lung Volume Reduction: Best Practice Recommendations from Expert Panel on Endoscopic Lung Volume Reduction. Respiration 2017;93(2):138‑50.
9. Come CE, Kramer MR, Dransfield MT, et al. A randomised trial of lung sealant versus medical therapy for advanced emphysema. Eur Respir J 2015;46(3):651-62.

 Encadrés
Encadrés