Diagnostiquer une endocardite infectieuse.
Connaître les portes d’entrée et les agents infectieux
les plus fréquemment en cause.
Connaître les grands principes du traitement médical et chirurgical.
Connaître la prévention des endocardites infectieuses.
L’endocardite est une inflammation de l’endocarde et de ses structures (valves), le plus souvent d’origine infectieuse, décrite par William Osler en 1885. Les causes non infectieuses d’endocardite (auto-immunes, cancéreuses) sont exceptionnelles. L’endocardite infectieuse est une maladie rare (30 à 40 cas par million d’habitants par an en France) et sévère (15 à 25 % de mortalité à la phase aiguë de la maladie). Le diagnostic est retenu sur un faisceau d’arguments cliniques, microbiologiques et échocardiographiques (critères de Duke modifiés). Il est classique de distinguer les endocardites infectieuses sur valves natives (environ 80 % des cas), celles sur valves prothétiques (environ 15 à 20 % des cas, qualifiées de précoces en cas de survenue dans les douze mois après l’implantation [un quart des cas] ou de tardives au-delà de douze mois), et celles sur dispositif intracardiaque (5 à 7 % des cas). Concernant les endocardites infectieuses sur valve native, il s’agit d’une atteinte du cœur gauche dans 75 % des cas (valve aortique plus fréquemment que mitrale), du cœur droit dans 22 % des cas (toxicomanes intraveineux ou porteurs de cathéters veineux), voire d’une atteinte bilatérale dans 3 % des cas. Outre la prise en charge d’éventuelles complications, le traitement repose sur une antibiothérapie prolongée adaptée au micro-organisme, associée, pour 50 % des patients, à une chirurgie valvulaire.
Physiopathologie
Comment l’endocardite infectieuse se développe-t-elle ?
L’endothélium d’une valve native saine est résistant à la colonisation par les agents infectieux. Cependant, lorsqu’il existe une altération des structures valvulaires (d’origine dégénérative ou rhumatismale, du fait d'une prothèse valvulaire ou de dispositifs intracardiaques...) la matrice extracellulaire est exposée au flux sanguin circulant provoquant l’activation des plaquettes circulantes puis la constitution d’un dépôt fibrino-plaquettaire stérile. À l’occasion d’une bactériémie (ou d’une fongémie), des bactéries (ou des champignons), des polynucléaires peuvent adhérer, puis se multiplier au niveau de cet amas fibrino-plaquettaire pour constituer la végétation. L’adhésion des micro-organismes (notamment les Cocci à Gram +) à la végétation est possible grâce à la production par ceux-ci d’une matrice extracellulaire protéique et polysaccharidique (le slime) constituant un biofilm. Le biofilm se développe sur les tissus lésés mais surtout sur les matériaux étrangers : cathéters, pacemakers et prothèses valvulaires. Au sein du biofilm, les bactéries sont « à l’abri » de l’action des moyens de défense de l’organisme mais aussi de l’action des antibiotiques. Les bactéries enchâssées dans le biofilm ont une sensibilité aux antibiotiques 100 à 1 000 fois moindre que celle des bactéries libres dites « planctoniques ». Le biofilm constitue aussi une réserve de bactéries quiescentes, source d’infections récurrentes.
La végétation, masse friable mesurant de quelques millimètres à plusieurs centimètres, altère le fonctionnement valvulaire (insuffisance ou plus rarement obstruction valvulaire). À partir d’elle, l’infection peut s’étendre à l’ensemble de la valve, générant une destruction progressive avec possible perforation valvulaire, rupture de cordage, abcès annulaires, fistulisation à l’origine de tableaux plus ou moins sévères d’insuffisance cardiaque. La végétation peut également essaimer dans la circulation générale avec constitution de foyers infectieux secondaires (abcès tissulaires) ou être à l’origine d’embolies artérielles avec constitution d’infarctus spléniques, rénaux, cérébraux... Enfin, la végétation est à l’origine d’une circulation d’antigènes favorisant la production d’immuns complexes circulants (facteur rhumatoïde positif) pouvant conduire à des phénomènes vascularitiques (glomérulonéphrite, purpura, érythème de Janeway...). Au sein de la paroi des artères, la conjonction de lésions de vascularite et d’emboles septiques dans les vasa vasorum peut conduire au développement d’anévrismes dits mycotiques (terme consacré par Osler pour désigner l’origine infectieuse d’un anévrisme en raison de son aspect en forme de champignon) caractérisés par une paroi fine à l’origine d’hémorragies viscérales en cas de rupture.
Quels sont les patients les plus à risque de développer une endocardite infectieuse ?
Les patients à risque de développer une endocardite infectieuse sont ceux porteurs d’une pathologie cardiaque organique sous-jacente connue ou méconnue (
Il est rare qu’une endocardite infectieuse se développe en dehors de ces contextes.
Quelles sont les situations favorisant la survenue d’une endocardite infectieuse ?
Une bactériémie (ou fongémie) transitoire est l’élément déclenchant. Certains gestes invasifs qui provoquent le passage de bactéries dans le flux sanguin circulant à partir de la sphère dentaire ou ORL, du tractus digestif (biopsie de polype colique), urinaire (résection prostatique), respiratoire (biopsie transbronchique) ou de la peau (pose de voie veineuse périphérique ou centrale) sont ainsi associés à un risque accru d’endocardite infectieuse.
Cependant, dans la majorité des cas, il n’est pas retrouvé d’événement déclenchant, et la bactériémie survient spontanément à l’occasion d’un brossage de dents, par exemple, ou par voie cutanée par une effraction (plaie, piqûre...) passée inaperçue.
Épidémiologie
Après vingt ans de relative stabilité, l’incidence annuelle de l’endocardite infectieuse semble augmenter depuis 2010, mais les études sont contradictoires. Cette évolution est la conséquence d’une profonde modification du profil épidémiologique de la maladie tant sur le plan clinique que microbiologique.
L’âge moyen des patients au moment du diagnostic était de 62 ans en 2008 en France contre 58 ans en 1991, 50 ans dans les années 1980 et 30 ans dans les années 1950.
L’incidence annuelle augmente avec l’âge : elle est maximale entre 75 et 80 ans (plus de 200 cas par million d’habitants) et est 2 à 3 plus élevée chez les hommes que chez les femmes.
Ces modifications épidémiologiques (incidence stable et vieillissement des patients) sont la conséquence d’une quasi-disparition des valvulopathies post-rhumatisme articulaire aigu, qui affectaient de jeunes patients, compensée par une augmentation des implantations de prothèses valvulaires, de dispositifs intracardiaques (pacemakers, défibrillateurs), d’actes invasifs à risque de bactériémie chez des patients âgés présentant des scléroses valvulaires dégénératives souvent méconnues. Ainsi, dans une étude française de 2008, la proportion d’endocardites infectieuses associée aux soins atteignait 26,8 %, et dans 53 % des cas aucune valvulopathie préexistante n’était connue.
Étiologie
Dans plus de 90 % des cas, l’endocardite infectieuse est microbiologiquement documentée. Du fait de la recrudescence des formes associées aux soins et de la diminution des endocardites post-rhumatismales, les staphylocoques (S. aureus et staphylocoques à coagulase négative) occupent désormais la première place des bactéries isolées devant les streptocoques (oraux – anciennement S. viridans – et digestifs du groupe D : S. gallolyticus – anciennement S. bovis – ou autres) et les entérocoques. En dehors de ces trois principales familles qui représentent près de 90 % des causes, de nombreux autres micro-organismes (bactéries et levures) peuvent être responsables d’endocardite infectieuse (
En cas de chirurgie valvulaire, il est recommandé d’envoyer une partie du matériel explanté (valve native ou prothétique) en microbiologie afin de réaliser une culture conventionnelle complétée d’une détection du gène 16S ribosomal bactérien par PCR si les hémocultures sont négatives. Idéalement, une autre partie du matériel explanté peut être envoyée en anatomopathologie pour confirmer le diagnostic d’endocardite.
Diagnostic
Hormis les situations où un examen histologique valvulaire (en cas de chirurgie ou d’autopsie) permet un diagnostic formel, le diagnostic repose, le plus souvent, a posteriori, sur un faisceau d’arguments cliniques, d’imagerie (échocardiographie, TEP-scanner, scintigraphie aux leucocytes marqués, scanner cardiaque), biologiques et microbiologiques (hémoculture) regroupés en critères majeurs et mineurs dans la classification de la Duke University modifiée par l'European Society of Cardiology en 2015 (
Diagnostic clinique
Les modes de présentation clinique de l’endocardite infectieuse sont polymorphes, rendant son diagnostic parfois difficile. Pourtant, le pronostic dépend très fortement de la précocité du diagnostic (
Un syndrome infectieux : il peut s’agir d’une présentation clinique aiguë caractérisée par un syndrome infectieux bruyant rapidement progressif pouvant aller jusqu’au choc septique, ou subaiguë, voire chronique avec une symptomatologie qui se limite à une fièvre traînante avec ou sans frissons. La fièvre est présente dans 70 à 80 % des cas. S’y associe souvent une altération de l’état général.
Des manifestations cardiaques : il existe un souffle dans près de 85 % des cas. Il s’agit le plus souvent d’un souffle de régurgitation valvulaire (destruction valvulaire) mais parfois également d’un souffle éjectionnel (végétation obstructive) ou d’un souffle en rapport avec un shunt gauche-droit (fistule entre cavités gauche et droite par destruction des tissus). Un tableau d’insuffisance cardiaque gauche (œdème aigu du poumon) ou d’insuffisance cardiaque droite (œdèmes des membres inférieurs, turgescence jugulaire, hépatomégalie) aigu ou chronique peut alors survenir.
Des manifestations emboliques : dans 20 à 50 % des cas, l’endocardite infectieuse est associée à des emboles septiques cérébraux et/ou extracérébraux, notamment spléniques, rénaux et rachidiens. Les accidents vasculaires cérébraux transitoires ou constitués ischémiques et/ou hémorragiques sont fréquents et redoutés car à l’origine d’une forte morbi-mortalité. On retrouve également des ischémies de membres, des nécroses distales. Il peut y avoir des signes d’infection à distance (emboles septiques) : spondylodiscite, arthrite septique, méningite, signes neurologiques focaux en rapport avec des abcès cérébraux, endophtalmie...
Des signes de vascularite : les lésions de vascularite sont moins fréquentes mais doivent alerter et faire évoquer le diagnostic, surtout si elles sont associées à un syndrome infectieux. Il peut s’agir d’un purpura (membres, conjonctives...) sans ou avec (en cas de splénomégalie) thrombopénie, des taches de Roth (hémorragies associées à des exsudats blanchâtres au fond d’œil), d’un érythème palmoplantaire dit de Janeway, de nodosités digitales érythémateuses dites faux panaris d’Osler ou d’une insuffisance rénale aiguë par glomérulonéphrite.
Chez les sujets âgés, le syndrome infectieux n’est souvent pas au premier plan, notamment en cas d’infection staphylococcique ou streptococcique, et l’endocardite infectieuse se présente comme un tableau clinique d’altération de l’état général plus ou moins associé aux manifestations périphériques décrites précédemment.
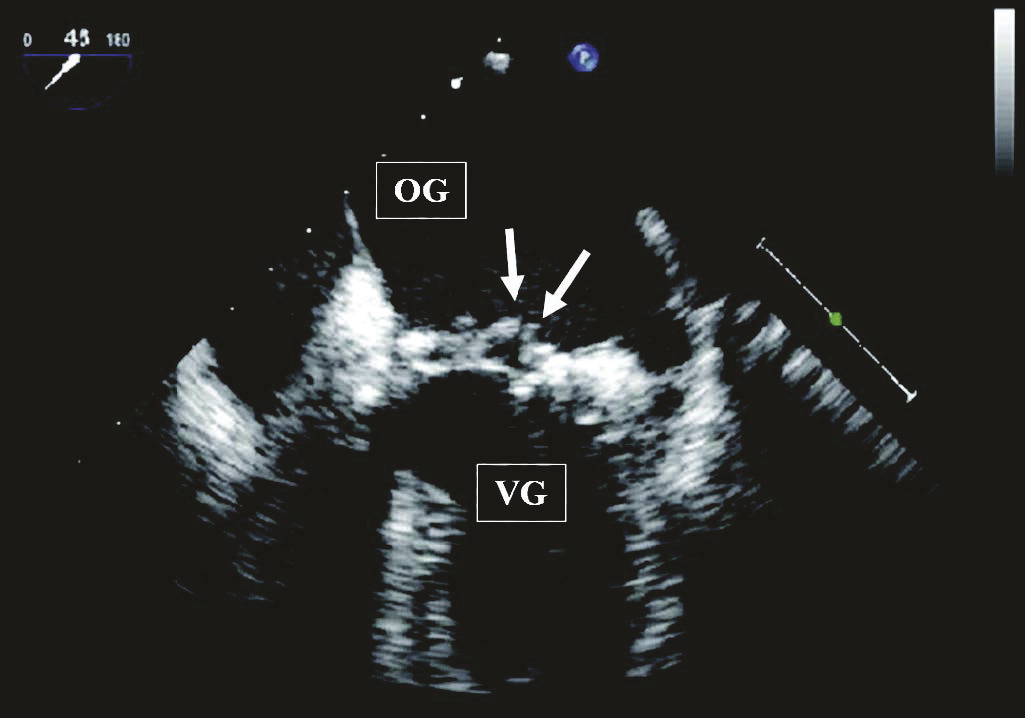
Diagnostic échocardiographique
L’échocardiographie est le premier examen d’imagerie à réaliser rapidement en cas de suspicion d’endocardite infectieuse.
En premier lieu, la réalisation d’une échocardiographie transthoracique (sensibilité aux alentours de 75 %) est proposée. En cas de normalité de cet examen, de présence d’une mauvaise fenêtre ultrasonore, d’une image douteuse, ou systématiquement chez les patients porteurs de matériel intracardiaque, une échocardiographie par voie transœsophagienne est réalisée (sensibilité aux alentours de 90 %) permettant une image de meilleure qualité (en l’absence de contre-indications : sténose œsophagienne, varices œsophagiennes non traitées, sclérodermie, tumeur de l’œsophage).
L’intérêt diagnostique de l’échocardiographie repose sur la mise en évidence des lésions intracardiaques spécifiques :
- la végétation (masse mobile appendue aux feuillets valvulaires natifs, aux prothèses valvulaires ou aux sondes de stimulateurs) ;
- l’abcès intracardiaque (épaississement hétérogène en zone périvalvulaire, le plus souvent au niveau du manchon aortique d’aspect « succulent » pouvant être plein ou détergé) ;
- la perforation valvulaire (solution de continuité au sein d’un feuillet valvulaire avec présence d’une régurgitation) ;
- la fistule (communication anormale entre deux cavités cardiaques, notamment entre l’oreillette gauche et le ventricule droit) ;
- la désinsertion d’une prothèse valvulaire avec présence d’une fuite paraprothétique.
L’échocardiographie a également un intérêt pronostique permettant d’évaluer la sévérité des valvulopathies et le retentissement hémodynamique.
Si l’échocardiographie transœsophagienne est normale et qu’il persiste une forte suspicion clinique d’endocardite infectieuse, le bilan est renouvelé dans les sept jours. En effet, des végétations ou des abcès de petite taille ne sont pas visualisés d’emblée.
L’examen peut également être complété par la réalisation d'un scanner cardiaque, notamment en présence d’un matériel prothétique valvulaire.
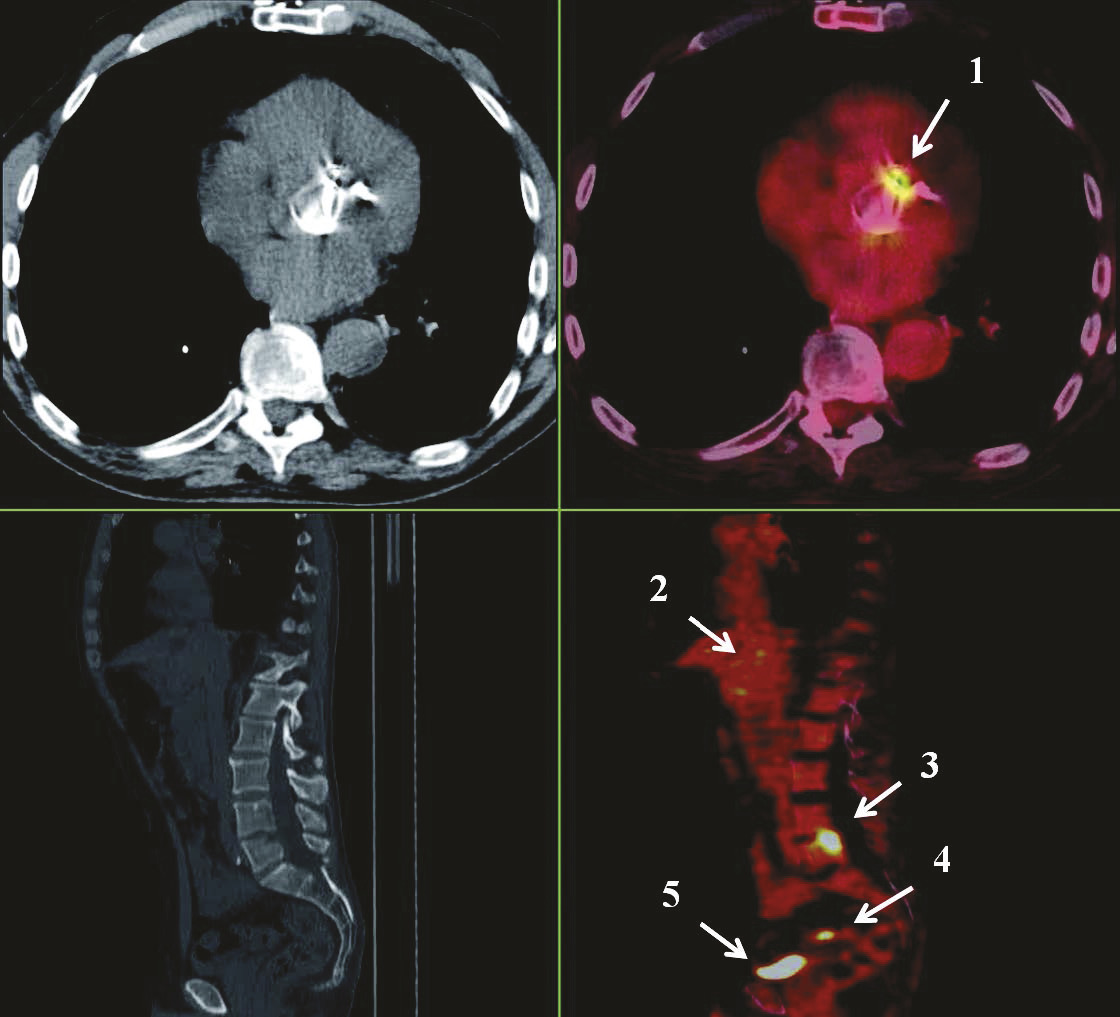
Diagnostic par TEP-scanner
La tomographie par émission de positons (TEP) au fluorodésoxyglucose marqué au fluor 18 (18F-FDG) couplée à un scanner cervico-thoraco-abdomino-pelvien est un examen qui permet à la fois le diagnostic positif d’une endocardite sur valve prothétique (critère majeur), le bilan d’extension de l’infection (hypermétabolisme au niveau des localisations septiques extracérébrales), voire la mise en évidence de la porte d’entrée de la bactérie (tumeur digestive par exemple). L’examen est généralement réalisé après avis d’une réunion de concertation pluridisciplinaire (RCP) d’infectiologie, et l’interprétation des images, exploitables plus de trois mois après tout geste chirurgical valvulaire, repose sur l’expertise d’un médecin nucléariste spécialisé. Dans certaines situations, le TEP-scanner peut être associé à une scintigraphie aux leucocytes marqués.
Diagnostic microbiologique
En cas d’endocardite infectieuse, la bactériémie (ou fongémie) est constante.
La réalisation de trois séries d’hémocultures (une série = un flacon aérobie et un flacon anaérobie) espacées d’une heure au minimum doit être systématique quelle que soit la température du patient durant les vingt-quatre premières heures, si possible avant de débuter l’antibiothérapie.
Le délai de positivité des hémocultures est exceptionnellement supérieur à cinq jours.
En l’absence de positivité après soixante-douze heures, il convient de répéter les hémocultures (2 séries), de discuter avec le microbiologiste l’ensemencement des hémocultures sur milieux spécifiques et la réalisation de techniques de biologie moléculaire (PCR ARN 16S) et d’entreprendre un bilan sérologique (v. Étiologie).
Bilans initial et d’extension
En cas de suspicion d’endocardite infectieuse, outre les hémocultures et l’échocardiographie, le bilan initial doit comprendre un électrocardiogramme (ECG) afin d’éliminer la présence d’un bloc auriculoventriculaire évocateur de la constitution d’un abcès du manchon aortique, un bilan biologique de routine (hémogramme, bilan de coagulation, protéine C-réactive [CRP], ionogramme, créatininémie, bilan hépatique...) afin d’évaluer la réaction inflammatoire, l’hémostase et d’adapter la posologie antibiotique au patient.
Dans l’optique de déceler d’éventuelles complications emboliques, il convient de réaliser dans les meilleurs délais un bilan d’extension comprenant facteur rhumatoïde, protéinurie des 24 heures, scanner thoraco-abdomino-pelvien avec injection de produit de contraste iodé (en l’absence d’allergie et si la fonction rénale du patient le permet) complété d’une imagerie cérébrale (scanner ou imagerie par résonance magnétique [IRM]) et éventuellement d’un fond d’œil en cas de suspicion d’endophtalmie. En présence de matériel implanté (valve prothétique, matériel de stimulation intracardiaque, dispositif d’assistance circulatoire), il est désormais fréquent qu’un TEP-scanner soit réalisé sur proposition de la RCP d’infectiologie dédiée aux endocardites infectieuses.
D’autres explorations paracliniques guidées par les résultats microbiologiques sont réalisées afin d’identifier la porte d’entrée du micro-organisme : consultation dentaire avec radiographie panoramique dentaire ou préférentiellement tomographie volumique à faisceaux coniques (Cone Beam Computed Tomography [CBCT]) en cas de streptocoque oral ou de bactérie du groupe HACEK, coloscopie en cas de présence de S. gallolyticus ou d’entérocoque...
Enfin, dans les situations nécessitant une intervention chirurgicale, il est nécessaire de réaliser un bilan préopératoire : bilan biologique classique (hémogramme, groupe sanguin ABO et Rhésus, recherche d’agglutinines irrégulières, bilan de coagulation, fonction rénale), exploration coronarienne (coronarographie ou coroscanner chez les patients jeunes).
Traitement
L’endocardite infectieuse est une infection complexe dont la prise en charge doit être collaborative entre cardiologues, infectiologues, radiologues, microbiologistes et chirurgiens. Depuis 2015, il est ainsi recommandé que la prise en charge de toute endocardite infectieuse soit validée par une équipe spécialisée (Endocarditis Team), le plus souvent au cours d’une RCP dédiée.
Traitement anti-infectieux
Le traitement anti-infectieux de l’endocardite infectieuse est une urgence thérapeutique et doit se faire en milieu hospitalier ; il doit être rapidement bactéricide (ou fongicide). Le choix des anti-infectieux est déterminé selon plusieurs critères : l’agent microbien en cause et sa sensibilité aux anti-infectieux, les caractéristiques de l’endocardite infectieuse (valve native, valve prothétique) mais également les caractéristiques du patient (comorbidités, contre-indications). Les antibiotiques sont initialement administrés par voie parentérale et à forte dose afin de favoriser la pénétration dans le biofilm, les valves cardiaques et dans les zones potentiellement embolisées (cerveau, os, œil...) pendant une durée prolongée. Avant documentation microbiologique, le traitement présomptif repose sur une association antibiotique susceptible de couvrir les principales bactéries responsables d’endocardites infectieuses communautaires. La durée habituelle de traitement des endocardites sur valve native est de deux à six semaines selon le micro-organisme et sa sensibilité aux anti-infectieux. Un relais par voie orale est envisageable après deux semaines de traitement par voie intraveineuse. Les endocardites sur valve prothétique liées au staphylocoque nécessitent un traitement plus prolongé d’au moins six semaines (
Traitement chirurgical
Une chirurgie cardiaque est réalisée chez approximativement 50 % des patients développant une endocardite infectieuse. Il s’agit d’une chirurgie à risque mais ayant prouvé son bénéfice dans plusieurs situations cliniques graves :
- insuffisance cardiaque aiguë en rapport avec une insuffisance valvulaire sévère (insuffisance aortique aiguë en particulier), une obstruction valvulaire ou une fistule. Un patient présentant une endocardite infectieuse compliquée d’insuffisance cardiaque doit être rapproché d’un centre de chirurgie cardiaque ;
- infection non contrôlée par le traitement antibiotique (augmentation de la taille des végétations, apparition de nouvelles lésions intracardiaques, hémocultures toujours positives après plus de 7 à 10 jours de traitement adapté, ce qui est souvent le cas en présence d’un abcès) ;
- prévention de l’embolie lorsqu’il existe une végétation à haut potentiel emboligène (les végétations les plus à risque sont les plus volumineuses, celles développées au niveau de la valve mitrale et celles associées à une endocardite infectieuse à S. aureus).
Une concertation médico-chirurgicale en RCP est nécessaire pour évaluer l’indication, le délai optimal de réalisation et la balance bénéfice/risque. Il peut s’agir d’une chirurgie en extrême urgence (cas du choc cardiogénique réfractaire en rapport avec une insuffisance aortique massive, par exemple) ou d’une chirurgie réalisée à l’issue du traitement anti-infectieux (cas des insuffisances valvulaires sans signe de mauvaise tolérance clinique). Les gestes chirurgicaux possibles sont les suivants : remplacement valvulaire par des valves prothétiques, végectomies, mise à plat des abcès, mise en place de patch pour fermeture de fistule, extraction de matériel de stimulation infecté, extraction et réimplantation de valve prothétique.
En peropératoire, l’anticoagulation nécessaire au système de circulation extracorporelle expose les patients à un risque hémorragique, notamment en cas d’embole cérébral (possible transformation hémorragique d’un accident vasculaire ischémique) ou d’anévrisme mycotique (possible rupture intra- ou extracérébrale).
En postopératoire, la morbi-mortalité dépend de l’état général antérieur (état nutritionnel, comorbidités...) et des pathologies chroniques associées (respiratoires, hépatiques, rénales...) qui décompensent fréquemment.
Autres traitements
Traitements des complications cardiaques
Il est fréquent qu’apparaisse un tableau d’insuffisance cardiaque aiguë au cours de l’endocardite infectieuse. Outre le traitement antibiotique et l’option chirurgicale, il est nécessaire d’initier et d’équilibrer le traitement médicamenteux de l’insuffisance cardiaque. Ce traitement associe oxygénothérapie, diurétiques, dérivés nitrés, inhibiteurs de l’enzyme de conversion et bêtabloquants en l’absence de signes de choc. En cas de choc cardiogénique, des catécholamines (dobutamine, adrénaline...) sont administrées.
Traitement des complications extracardiaques
Les traitements à envisager sont multiples et varient selon la nature des complications extracardiaques pouvant survenir au cours de l’endocardite infectieuse :
- éradication de foyers infectieux secondaires (ponction d’abcès tissulaire, lavage et/ou drainage articulaire, splénectomie...) ;
- traitement des complications vasculaires (oblitération d’un anévrisme mycotique sous artériographie, sonde de Fogarty en cas d’ischémie aiguë de membre...) ;
- lutte contre la dénutrition ;
- épuration extrarénale en cas d’insuffisance rénale aiguë...
Traitements antiagrégants et anticoagulants
Les traitements antiagrégants ou anticoagulants n’ont pas prouvé de bénéfice pour prévenir le risque embolique en rapport avec la présence de végétations et il n’est pas recommandé de les initier. En revanche, pour les patients sous antiagrégant ou anticoagulant au long cours (patients coronariens porteurs de stents, patients en fibrillation auriculaire et surtout patients porteurs de valves mécaniques), il n’est pas recommandé d’interrompre ces médicaments en l’absence de complications hémorragiques graves. Une surveillance stricte de l’anticoagulation est assurée par des dosages biologiques répétés pour éviter tout surdosage.
Traitement de la porte d’entrée
Il est nécessaire de traiter et d’éradiquer la porte d’entrée infectieuse présumée sous traitement antibiotique : résection de polypes coliques par coloscopie ou colectomie segmentaire ou totale si néoplasie, extractions dentaires...
Traitement prophylactique
La prophylaxie (primaire ou secondaire) de l’endocardite infectieuse est une stratégie préventive qui vise à réduire le risque d’infection quand il existe un risque de bactériémie. Son efficacité théorique n’a jamais été formellement démontrée. Il convient néanmoins d’informer les patients à risque, de les inciter à consulter sans délai en cas d’infection (notamment cutanée) et d’observer une stricte hygiène bucco-dentaire. De plus, en cas de geste à haut risque de bactériémie, les patients ayant une cardiopathie à haut risque d’endocardite infectieuse doivent bénéficier d’une antibioprophylaxie (
Surveillance
Durant la phase de traitement, les patients bénéficient d’une surveillance clinique (température, examen cardiovasculaire...) et électrocardiographique rapprochée. La surveillance biologique (généralement deux ou trois fois par semaine) porte sur l’efficacité et la tolérance du traitement anti-infectieux (CRP, hémogramme, créatininémie, dosages plasmatiques de certains antibiotiques...). Il est en outre recommandé, chaque semaine, de réaliser une hémoculture pour détecter une bactériémie persistante ainsi qu’une échocardiographie. En cas de défaillance cardiaque, la réévaluation échographique doit être plus précoce. Au décours du traitement (médical et/ou chirurgical), les patients sont habituellement revus à un mois, trois mois et six mois pour un examen clinique, un bilan biologique et une échocardiographie afin de confirmer la guérison et de dépister précocement des signes de récidive
POINTS FORTS À RETENIR
L’endocardite infectieuse est une maladie à suspecter en cas d’œdème aigu du poumon ou d’accident vasculaire cérébral associé à une fièvre ou de fièvre prolongée inexpliquée ou accompagnée de manifestations systémiques.
Le diagnostic repose sur la réalisation d’hémocultures et d’une échocardiographie.
Trois familles bactériennes dominent l’étiologie : staphylocoques, streptocoques et entérocoques.
La prise en charge nécessite une approche médico-chirurgicale.
Le traitement de la porte d’entrée et des complications de l’endocardite est systématiquement associé au traitement antibiotique bactéricide, à forte dose et prolongé.
L’antibioprophylaxie ne concerne que les patients à haut risque d’endocardite exposés à un geste à haut risque de bactériémie.
Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F, et al. 2015 ESC Guidelines for the management of infective endocarditis: The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by: European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015;36(44):3075-128.
Baddour LM, Wilson WR, Bayer AS, Fowler VG, Jr., Tleyjeh IM, Rybak MJ, et al. Infective endocarditis in adults: Diagnosis, antimicrobial therapy, and management of complications: A scientific statement for healthcare professionals from the American Heart Association. Circulation 2015;132(15):1435-86.
Camou F, Dijos M, Barandon L, Cornolle C, Greib C, Laine M, et al. Management of infective endocarditis and multidisciplinary approach. Med Mal Infect 2019;49(1):17-22.
Wang A, Gaca JG, Chu VH. Management considerations in infective endocarditis: A review. JAMA 2018;320(1):72-83.
Chambers HF, Bayer AS. Native-valve infective endocarditis. The New England Journal of Medicine 2020;383(6):567-76.
Talha KM, Baddour LM, Thornhill MH, Arshad V, Tariq W, Tleyjeh IM, et al. Escalating incidence of infective endocarditis in Europe in the 21st century. Open Heart 2021;8(2).
Iung B, Duval X. Infective endocarditis: Innovations in the management of an old disease. Nat Rev Cardiol 2019;16(10):623-35.
Habib G, Erba PA, Iung B, Donal E, Cosyns B, Laroche C, et al. Clinical presentation, aetiology and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: A prospective cohort study. Eur Heart J 2019;40(39):3222-32.
Pries-Heje MM, Wiingaard C, Ihlemann N, Gill SU, Bruun NE, Elming H, et al. Five-year outcomes of the Partial Oral Treatment of Endocarditis (POET) trial. The New England Journal of Medicine 2022;386(6):601-2.
Delahaye F, M'Hammedi A, Guerpillon B, de Gevigney G, Boibieux A, Dauwalder O, et al. Systematic search for present and potential portals of entry for infective endocarditis. J Am Coll Cardiol 2016;67(2):151-8.
Duval X, Le Moing V, Tubiana S, Esposito-Farese M, Ilic-Habensus E, Leclercq F, et al. Impact of systematic whole-body 18F-fluorodeoxyglucose PET/CT on the management of patients suspected of infective endocarditis: The prospective multicenter TEPvENDO study. Clinical infectious diseases : An official publication of the Infectious Diseases Society of America 2021;73(3):393-403.

 Encadrés
Encadrés