Une fois le difficile diagnostic d’endométriose posé, le traitement doit s’initier sans délai, ne serait-ce que pour soulager la patiente. Cet article propose un algorithme de prise en charge élaboré selon les recommandations conjointes de la Haute Autorité de santé et du Collège national des gynécologues et obstétriciens français (CNGOF).
Les retentissements et les conséquences de l’endométriose s’étendent, pour certaines formes, bien au-delà de la sphère gynécologique et justifient une approche thérapeutique ciblée et adaptée à chaque situation. Dans bien des cas, l’établissement d’un réel plan de soins personnalisé prend tout son sens.
Bilan d’imagerie de première intention
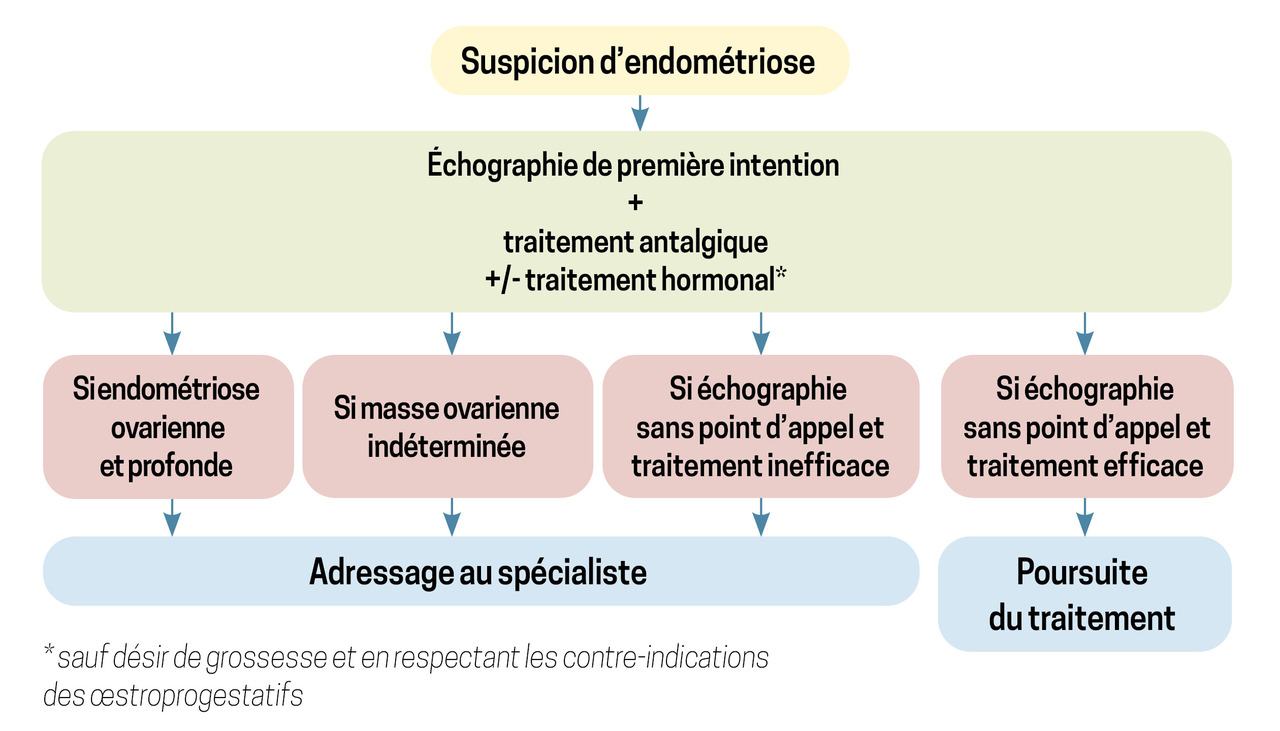
De prime abord et selon les recommandations du CNGOF et de la Haute Autorité de santé (HAS), une échographie pelvienne doit être demandée devant un faisceau d’arguments évoquant une endométriose.1 Cette première analyse iconographique a valeur d’orientation, en éliminant les diagnostics différentiels et en décrivant un possible endométriome de l’ovaire, un nodule d’endométriose profond pour les opérateurs les plus entraînés ou un hydro-/hématosalpinx, conséquence d’une obstruction tubaire, par exemple. Une échographie pelvienne normale ne peut exclure une éventuelle endométriose, même profonde. Il est aussi entendu que cet examen n’a pas pour vocation d’analyser l’ensemble des localisations possibles d’endométriose.
La recherche des complications liées à l’endométriose, et notamment une éventuelle compression urétérale par un nodule profond, est à rechercher, et il est pertinent de réaliser une étude de l’arbre urinaire dans le même temps que l’échographie pelvienne. Une lombalgie, bien que non spécifique, doit éveiller les soupçons, même si souvent la compression urétérale et l’atrophie rénale en conséquence se développent sournoisement sur le long cours, sans une réelle symptomatologie de type colique néphrétique.
Il faut également souligner que, devant un tableau clinique évocateur d’endométriose, il n’y a nul besoin d’attendre les résultats de l’échographie pour débuter un traitement, tout du moins probabiliste.
Examens de seconde intention
La réalisation d’examens de seconde intention, comme un examen clinique par un gynécologue référent, une échographie pelvienne réalisée par un radiologue référent en endométriose ou encore, et surtout, une IRM complémentaire ne sont indiqués secondairement qu’en présence de critères maintenant bien définis :
- symptômes persistants malgré un traitement hormonal bien conduit ;
- signes évocateurs d’endométriose sur l’échographie justifiant ainsi une cartographie plus aboutie des autres lésions potentielles ;
- infertilité ;
- masse ovarienne indéterminée.
Cette hiérarchisation de l’approche diagnostique introduit, depuis les recommandations de 2017, la notion de clinicien et de radiologue « référent » : c’est rappeler l’importance des filières de prise en charge de l’endométriose en cours de construction sur le territoire national. Il devient alors impératif de penser ces examens complémentaires comme autant de jalons intégrés dans un parcours de soins ciblé et organisé : binôme patiente-médecin généraliste, puis médecins référents jusqu’au médecin expert. C’est également rappeler la pertinence des annuaires et répertoires d’offre de soins à venir pour permettre une fluidité des prises en charge et une facilitation des voies d’adressage entre médecin généraliste et gynécologue/radiologue de référence.
Que faire en cas de symptomatologie évocatrice mais d’imagerie négative ?
La question de l’imagerie appelle celle de la certitude diagnostique de l’endométriose, et toute la problématique se cristallise sur l’endométriose pelvienne superficielle, possiblement très douloureuse et bien souvent difficile à caractériser sur les examens d’imagerie. Résoudre cette équation entre imagerie négative et clinique évocatrice n’est pas simple et les réponses apportées actuellement dépendent de multiples variables, souvent débattues en réunion de concertation pluridisciplinaire (RCP).
La référence pour affirmer ou non la présence de l’endométriose reste la cœlioscopie. Tout l’enjeu, notamment pour les praticiens référents, est de savoir où mettre le curseur entre nouvelle ligne de traitement hormonal et intervention chirurgicale. Certes, il est important de diagnostiquer, mais il faut avant tout soulager et traiter.
Dernièrement, la recherche a évolué, en particulier pour la détection et le diagnostic de l’endométriose. C’est toute l’actualité du développement du test salivaire de l’endométriose, encore en cours d’évaluation en France. Nouvelle approche de détection, ce test salivaire pourrait être un moyen aussi simple que fiable pour objectiver une endométriose en cas de symptomatologie évocatrice avec une imagerie négative. Reposant sur deux technologies innovantes que sont le séquençage de nouvelle génération et la physiopathologie des micro-ARN présents dans la salive, ce test a une sensibilité et une spécificité respectivement de 96,2 et 95,1 %.2
La stratégie de détection actuelle devrait donc se modifier dans un avenir proche, diminuant ainsi le nombre de cœlioscopies diagnostiques et, in fine, permettant une diminution significative des délais diagnostiques.
Prise en charge : que peut faire le médecin généraliste ?
Ces dernières années, le paradigme de la prise en charge de l’endométriose s’est considérablement modifié, passant d’un tout-chirurgie à une vision intelligemment médico-chirurgicale. Les thérapeutiques hormonales prennent maintenant une place prépondérante dans les plans personnalisés de soins proposés aux patientes, et ceci dès la suspicion diagnostique (fig. 1). Considérant l’aspect souvent chronique de l’endométriose, il s’agit d’organiser, par le biais des RCP, la chronologie des traitements en articulant hormones, chirurgie, aide médicale à la procréation et soins de support en fonction du parcours de chaque patiente, de ses souhaits et de ses attentes.
Pilule contraceptive, une première solution
Parce que l’endométriose est une pathologie hormonodépendante par définition, une des réponses thérapeutiques réside dans le détournement des pilules contraceptives (effets freinateurs sur l’axe gonadotrope). Dans bien des situations, il s’agit de la première approche thérapeutique proposée aux patientes, en relais ou en complément des traitements antalgiques et anti-inflammatoires, qu’il convient d’initier au plus tôt.
En diminuant la pression hormonale sur les lésions d’endométriose, celles-ci, schématiquement, n’évoluent plus sur un rythme cataménial, et les microhémorragies observées au sein des lésions péritonéales ou ovariennes cessent. Il en résulte une diminution de l’activité des lésions, une baisse de l’inflammation et, en corollaire, une diminution des douleurs. C’est principalement le progestatif contenu dans les contraceptifs oraux qui œuvre au contrôle des lésions, notamment par une action directe sur les récepteurs à la progestérone présents sur les cellules endométriosiques. Cette interaction entraîne une décidualisation puis une atrophie du tissu ectopique et une diminution de l’inflammation péritonéale.
Aucune contraception orale n’est supérieure à une autre pour le contrôle de l’endométriose. Tout le défi consiste à proposer un traitement adapté non seulement à la pathologie mais aussi aux autres critères qui régissent la prescription des contraceptifs : migraines, acné, surpoids, antécédents personnels ou familiaux de maladie thrombo-embolique. Les contre-indications générales doivent toujours être recherchées et actualisées à chaque consultation de suivi ; elles prévalent en effet sur la nécessité de traiter l’endométriose. La tolérance biologique des œstroprogestatifs doit être surveillée selon les recommandations dans leur indication contraceptive.
Gradation thérapeutique bien codifiée
Les recommandations HAS-CNGOF de décembre 2017 décrivent une certaine gradation dans le choix des traitements : contraceptif œstroprogestatif et dispositif intra-utérin au lévonorgestrel en première intention, puis contraception microprogestative orale au désogestrel, implant à l’étonogestrel, analogues de la GnRH en association à une add-back thérapie* ou encore le diénogest.1 La prescription des contraceptifs œstroprogestatifs en continu, visant l’aménorrhée, peut être préférée dans ce contexte de dysménorrhée. Il convient alors d’observer une phase d’arrêt de quatre à sept jours tous les 84 comprimés afin de réduire le risque de spotting.
En alternative aux contraceptifs œstroprogestatifs, l’utilisation des microprogestatifs en première intention, notamment en cas de contre-indications aux œstrogènes, reste bien entendu tout à fait possible dans cette vision de première prise en charge en cabinet de ville.
En conclusion de cet article, filigrane des recommandations du CNGOF, deux messages sont importants : d’une part, la nécessité d’explorer, au moins par un interrogatoire bien mené, toute dysménorrhée sous le prisme de l’endométriose, et ceci dès l’adolescence ; d’autre part, le rôle majeur joué par les praticiens de premier recours, acteurs principaux de cette prise en charge précoce de l’endométriose. Combattre l’errance diagnostique, c’est avant tout avoir ce réflexe et orienter au plus vite les patientes suspectes d’endométriose dans un parcours de soins adéquat. Combattre l’errance thérapeutique, c’est intégrer une filière dédiée à la prise en charge de l’endométriose, garante de la pertinence et de l’optimisation des soins.
Fertilité et endométriose : faire face à une question anxiogène
Contrairement à certaines mauvaises idées reçues, l’endométriose n’est pas synonyme d’infertilité. Cette situation concerne entre 30 et 40 % des patientes atteintes d’endométriose tous stades confondus. En cas d’infertilité de couple, la fréquence de l’endométriose varie entre 20 et 70 % selon les études.3
L’infertilité associée à l’endométriose est multimodale et s’explique en partie par l’inflammation pelvienne chronique, responsable d’adhérences, contraignant, voire interdisant, le passage tubaire des gamètes en créant des obstructions mécaniques.4 L’inflammation est également à l’origine de phénomènes directement toxiques pour l’ovocyte ou les spermatozoïdes.
La qualité de l’endomètre des patientes atteintes d’endométriose est également un facteur potentiel, notamment du fait d’une altération de la réceptivité endométriale.
À ces deux mécanismes, inflammation chronique et altération de l’endomètre, s’ajoute une possible dysfonction ovarienne, avec notamment une perturbation de la maturation des follicules par les endométriomes.
Les causes d’infertilité en cas d’endométriose sont hétérogènes, pour certaines encore débattues, et souvent intriquées. La prise en charge de ces couples infertiles et les stratégies qui leur sont proposées dépendent de multiples paramètres et doivent être discutées en réunions de concertation pluridisciplinaires : approche chirurgicale pour certaines ou aide médicale à la procréation pour d’autres. Dans bien des cas, les chances de grossesse et la fertilité globale peuvent être ainsi majorées.
Ressources
- MOOC National endométriose et sites internet des filières régionales de lutte contre l’endométriose.
- Recommandations HAS-CNGOF aux médecins généralistes, décembre 2017 : pistes de lecture et tableaux synoptiques.
- Ressources sur Santé.fr pour compléter les informations données à vos patientes en fonction de la chronologie de leur parcours endométriose.
- Ressources websérie Endaura pour compléter les informations données à vos patientes en fonction de la chronologie de leur parcours endométriose.
2. Bendifallah S, Dabi Y, Suisse S, et al. Validation of a Salivary miRNA Signature of Endometriosis. Interim Data. NEJM Evid 2023;2(7).
3. Mahmood TA, Templeton A. Prevalence and genesis of endometriosis. Hum Reprod 1991;6(4):544-9.
4. De Ziegler D, Borghese B, Chapron C. Endometriosis and infertility: Pathophysiology and management. Lancet Lond Engl 2010;376(9742):730-8.

 Encadrés
Encadrés