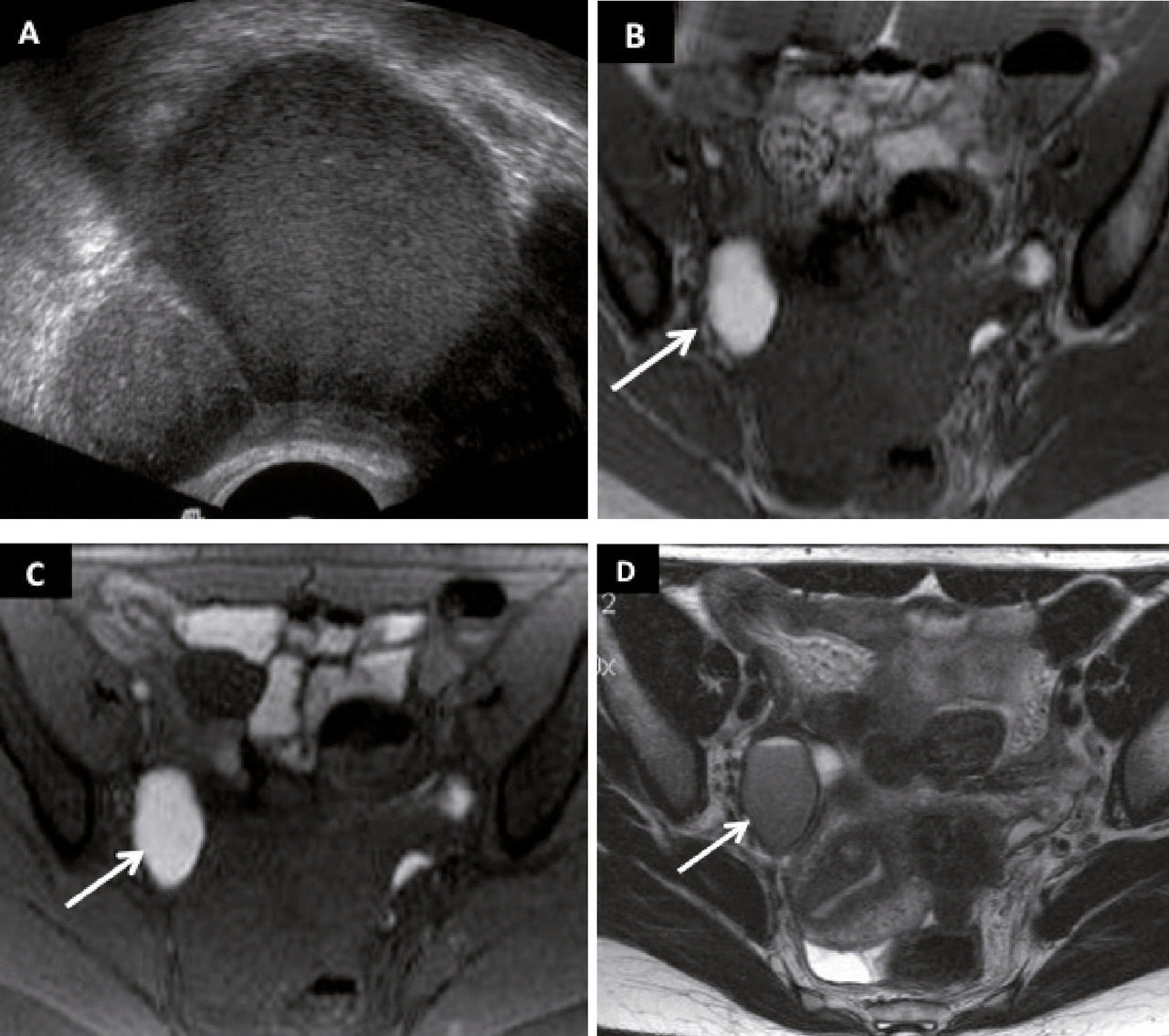
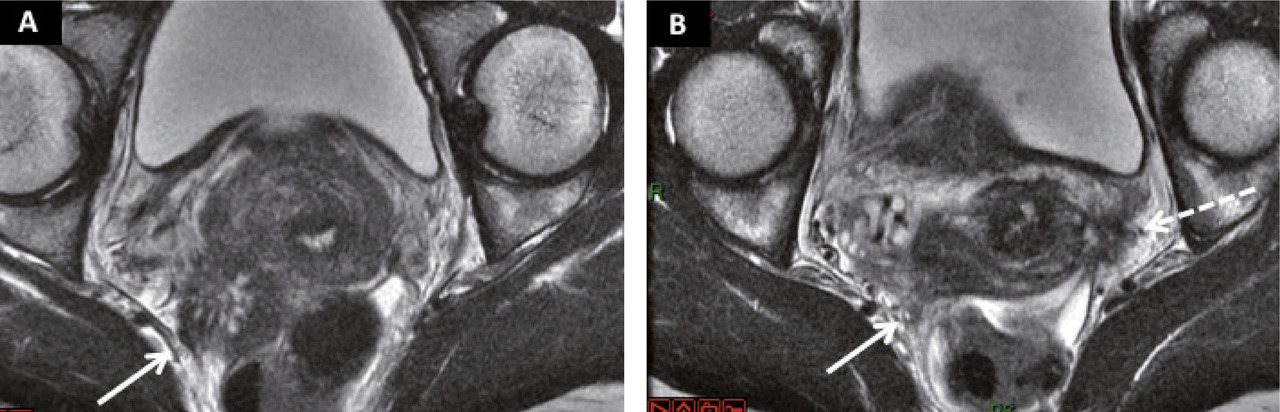
Le caractère cyclique des douleurs, avec une recrudescence cataméniale, est évocateur.
L’ endométriose est définie par la présence de tissu endométrial (glandes et stroma) en dehors de la cavité utérine. Cette pathologie bénigne touche 3 % de la population générale et environ 10 % des femmes en âge de procréer.1 La prévalence est encore plus élevée (20-30 %) chez les patientes infertiles, ce qui soutient la relation causale entre endométriose et infertilité.
Le diagnostic est porté devant 3 situations cliniques parfois intriquées : les algies pelviennes chroniques, l’infertilité ou la découverte d’un kyste ovarien.
Trois entités anatomocliniques sont décrites (mais elles sont souvent associées à des degrés variables) :
– l’endométriose péritonéale (cul-de-sac de Douglas et ligaments larges) ;
– ovarienne (endométriome ou faux kyste résultant d’une invagination des lésions endométriosiques primaires qui, secondairement, se remplissent du sang accumulé au moment des menstruations, au sein du tissu ectopique ; fig. 1) ;
– profonde (infiltration au-delà du péritoine – sur plus de 5 mm – des structures anatomiques ou de certains organes ; fig. 2).2
Cette dernière affecterait 20 à 35 % des patientes ayant une endométriose. Elle concerne, par ordre décroissant de fréquence, les ligaments utéro-sacrés, le torus uterinum (partie postérieure de l’utérus à la jonction corps et col où se rejoignent les ligaments utéro-sacrés), le vagin, le rectum, le côlon sigmoïde et la vessie.2
Plusieurs théories ont été proposées pour expliquer la formation et l’évolution des lésions (tableau 1).3 Celle de la transplantation, évoquant le reflux menstruel de tissu endométrial par les trompes dans la cavité péritonéale, reste la plus plausible. Des mécanismes immunologiques, une dérégulation hormonale et des facteurs environnementaux (perturbateurs endocriniens) seraient également impliqués. La participation d’une composante génétique et épigénétique est soutenue par de nombreuses études.
Diagnostic clinique
L’endométriose est bien souvent méconnue et les patientes errent parfois pendant plusieurs années avant d’être diagnostiquées et prises en charge.
A contrario, cette affection n’a pas obligatoirement de conséquence pathologique et peut être retrouvée même chez des femmes asymptomatiques et fertiles. Ces éléments justifient l’absence de dépistage systématique en population générale. En pratique, les principaux symptômes ne sont pas spécifiques.4
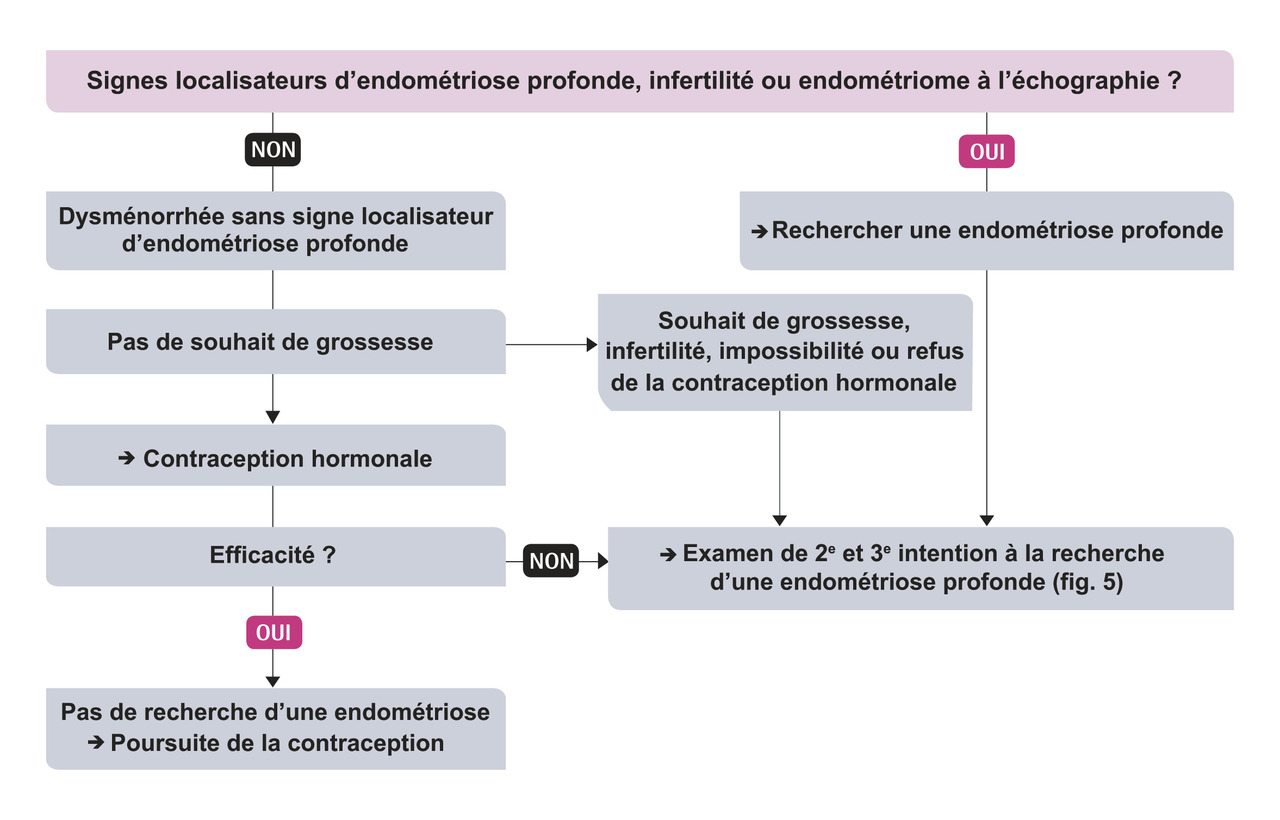
La dysménorrhée débute le plus souvent au premier jour des règles, mais peut les précéder, sans seuil d’intensité consensuel. Cependant, l’association d’une dysménorrhée sévère cotée supérieure à 7 sur une échelle visuelle analogique à une infertilité est quasiment pathognomonique d’une endométriose.
Une dyspareunie profonde et des douleurs pelviennes chroniques sont très évocatrices.
Les symptômes peuvent être digestifs et urologiques : dyschésie (difficulté à évacuer les selles), ténesme (tension douloureuse, avec sensation de brûlure et envie constante d’aller à la selle ou d’uriner), faux besoins d’aller à la selle, diarrhée, constipation et dysurie. Leur caractère cyclique avec recrudescence cataméniale fait suspecter le diagnostic, mais aucun d’entre eux n’est spécifique de la maladie.
Cependant, la maladie peut être asymptomatique et ce malgré des atteintes parfois très sévères.
L’examen gynécologique (sous spéculum) explore toutes les faces du vagin, en particulier le cul-de-sac postérieur, à la recherche de lésions violacées et/ou fibreuses rétractiles témoignant d’une atteinte vaginale.
Le toucher vaginal recherche une induration douloureuse de cet organe, des ligaments utéro-sacrés et/ou du torus uterinum, ainsi qu’une douleur à la mobilisation utérine.
Il permet également de mettre en évidence une masse annexielle.
Enfin, le toucher rectal est indispensable dans l’évaluation de l’étendue des lésions d’endométriose profonde, notamment en cas de suspicion de localisation colorectale.
On peut en effet palper des nodules de la cloison rectovaginale ou infiltrant la paroi rectale et évaluer l’extension sous-péritonéale latérale aux paramètres et aux lames sacro- génito-pubiennes.
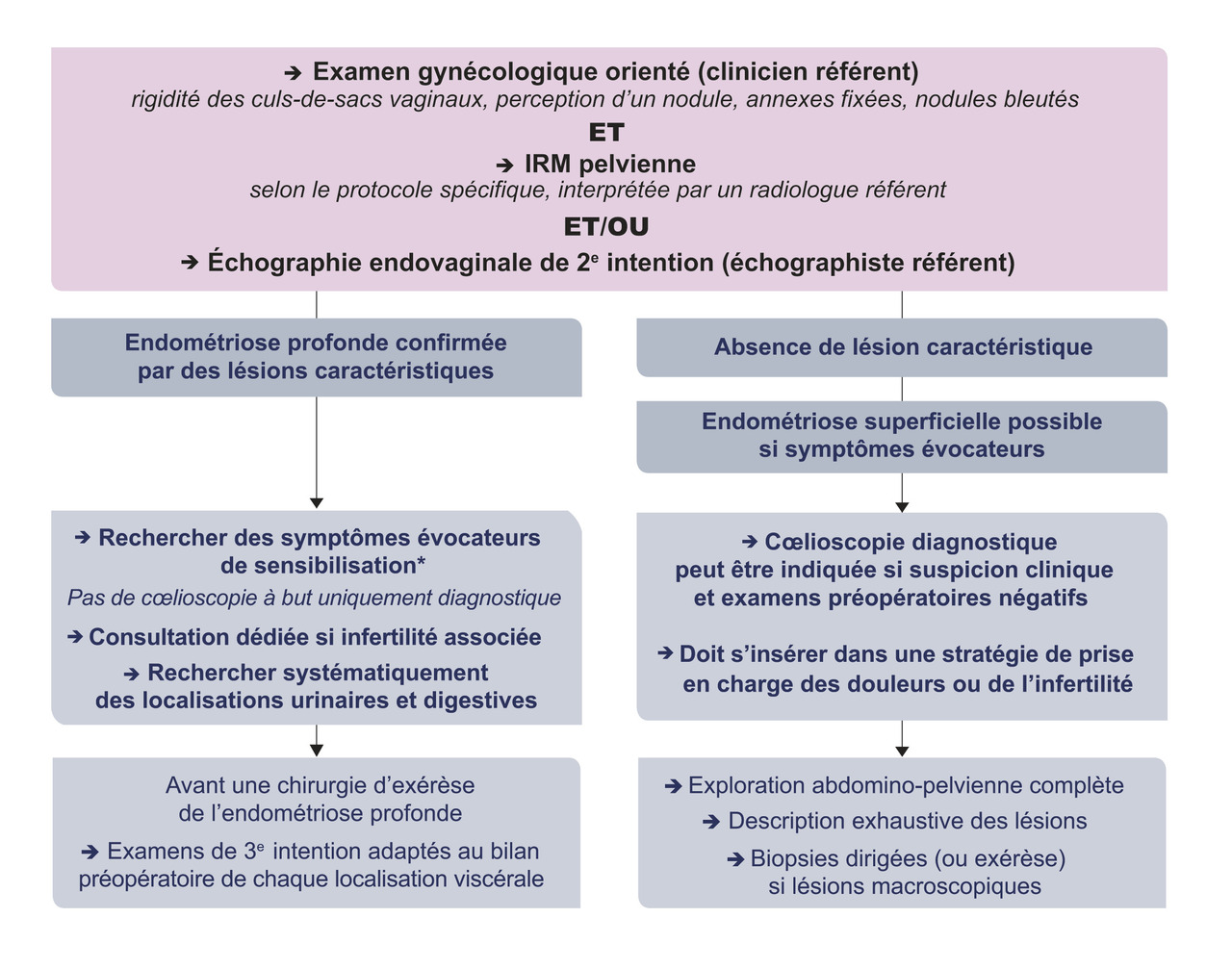
La stratégie diagnostique est bien codifiée (recommandations de la HAS-CNGOF 2017 ; fig. 3).4
Quelle imagerie ?
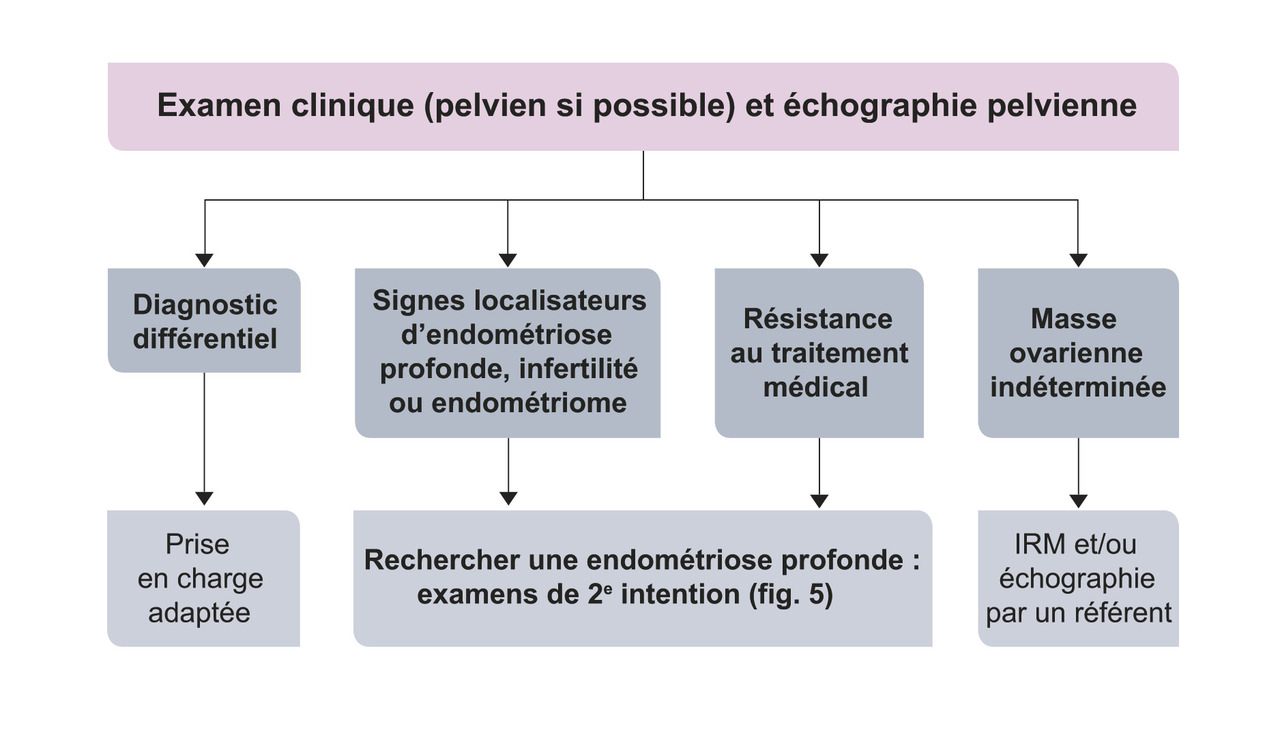
L’échographie pelvienne est l’examen de première intention (fig. 4). Ses performances sont très bonnes mais elles sont opérateur-dépendantes. De plus, si sensibilité et specificité sont très elevées dans le diagnostic d’endométriose ovarienne, les résultats sont plus variables en cas d’atteintes profondes. Ainsi, si le bilan est normal malgré une symptomatologie évocatrice, il convient d’adresser la patiente vers un centre expert.
En deuxième intention les recommandations de la HAS- CNGOF 2017 préconisent :4
– une IRM pelvienne (interprétée par un radiologue référent), qui permet d’effectuer une cartographie complète des lésions ovariennes et des localisations profondes antérieures et postérieures ;
– une échographie endovaginale, réalisée par un échographiste référent.
En cas d’IRM discordante avec la clinique ou l’échographie : proposer une seconde lecture par un radiologue expert.
Si l’on suspecte une endométriose profonde avec une atteinte digestive et lorsque les examens de deuxième intention (échographie endovaginale, IRM pelvienne) ne permettent pas de conclure à l’envahissement du côlon, une imagerie spécifique peut être proposée afin de préciser les caractéristiques de la maladie (multi- ou unifocalité, diamètre lésionnel, profondeur d’infiltration, hauteur, circonférence, caractère sténosant, distance par rapport à l’anus) : écho-endoscopie rectale pour les localisations rectosigmoïdiennes, coloscanner pour les atteintes coliques plus en amont.
Prise en charge médicale
En cas de douleur avec altération de la qualité de vie, plusieurs options sont possibles. En première intention et après évaluation globale de la douleur et de son retentissement, des antalgiques (paracétamol ou opioïdes de palier 2) peuvent être proposés. Cependant, leur efficacité est souvent partielle et transitoire. Les AINS ne sont pas recommandés (effets secondaires liés à une prescription au long cours). Si douleurs neuropathiques, un traitement par prégabaline (Lyrica) ou gabapentine (Neurontin) est envisageable (avis spécialisé).
En cas d’échec interviennent les traitements hormonaux. Le choix doit être guidé par les contre-indications, les effets indésirables potentiels, les traitements antérieurs et l’avis de la patiente.
Selon la HAS, on prescrit en première intention une contraception estroprogestative (COP) ou le SIU au lévonorgestrel à 52 mg (Mirena), qui ont démontré une efficacité sur la douleur.
En seconde intention :
– contraception microprogestative orale au désogestrel ;
– implant à l’étonogestrel (Nexplanon) ;
– antagonistes de la GnRH (GnRHa) : triptoréline (Decapeptyl), leuproréline (Enantone), nafaréline (Synarel) ; l’association à une hormonothérapie de substitution est recommandée au-delà de 3 mois de traitement (add back thérapie à base d’estrogène pour limiter la baisse de la densité minérale osseuse, associé ou non à un progestatif) ;
– diénogest (non remboursé dans cette indication).
Des thérapeutiques non pharmacologiques améliorent la qualité de vie et sont envisageables en complément de la prise en charge médicale de l’endométriose comme l’acupuncture, l’ostéopathie, le yoga.
Chirurgie : bien peser les risques
Les enjeux du traitement chirurgical sont multiples et doivent tenir compte des atteintes de la patiente, de son souhait de grossesse, des localisations de l’endométriose, du type et de son caractère plurifocal éventuel.4 Cette option est proposée après échec des thérapeutiques médicamenteuses.
Cependant, elle soulève de nombreuses problématiques : sélection des bonnes candidates à la chirurgie ; information sur les risques de complications per- et postopératoires, sur les modalités de préservation de la fertilité et sur les résultats attendus en termes de fertilité ; compétences requises pour la réaliser (centre expert).4
Devant une endométriose pelvienne minime à légère (stades I et II selon l’American Society of Reproductive Medicine – ASRM), il est recommandé de traiter de manière complète les lésions découvertes en cœlioscopie. Les techniques d’exérèse (ablation des lésions) et de destruction (par coagulation ou vaporisation) ont des efficacités comparables en termes d’amélioration des douleurs. Si la patiente est infertile, le traitement des lésions, associé à l’adhésiolyse, permet une augmentation du taux de grossesses spontanées.
En cas d’endométriome, la chirurgie peut réduire la réserve ovarienne par l’exérèse ou la destruction du parenchyme ovarien entourant le kyste, avec de possibles effets négatifs sur la fertilité (surtout si endométriomes volumineux de plus de 6 cm, récidivants ou bilatéraux). Ainsi, il faut discuter avec la patiente des possibilités de préservation de la fertilité.
On procède à une kystectomie intrapéritonéale cœlioscopique. Une ponction échoguidée simple est à éviter en raison du risque de persistance ou récidive rapide des douleurs et des endométriomes. De même, la technique destructive par coagulation bipolaire est associée à une baisse des grossesses postopératoires et à une augmentation des récidives.
La chirurgie des lésions profondes dépend de leur localisation. Si la vessie est infiltrée, une cystectomie partielle peut être proposée chez les patientes symptomatiques. En cas de lésions urétrales, les techniques conservatrices (urétérolyse) ou radicales (résection urétérale avec anastomose termino- terminale ou résection urétérale et réimplantation vésicale) sont efficaces sur la douleur et la dilatation des voies urinaires supérieures. Pour une forme infiltrant le côlon et le rectum, la voie d’abord cœlioscopique est préférée. En cas de localisation au niveau du bas rectum, il faut discuter une dérivation digestive temporaire et en informer la patiente. La résection des lésions pelviennes doit être aussi complète que possible.
Chez les femmes sans souhait de grossesse, une hystérectomie peut être proposée.
Pour prévenir le risque de récidive postopératoire, en l’absence de contre-indication et de désir de grossesse, il est recommandé de prescrire une COP ou le SIU au lévonorgestrel 52 mg.
Infertilité : chirurgie ou AMP ?
La physiopathologie de lʼinfertilité associée à l’endométriose serait expliquée par les adhérences pelviennes modifiant l’anatomie normale mais aussi par d’autres mécanismes : altération des gamètes, anomalies de fécondation et développement embryonnaire, diminution de la réceptivité endométriale. L’association fréquente d’un endométriome et/ou d’une adénomyose (endométriose interne, caractérisée par le développement d’une muqueuse endométriale dans la paroi musculaire de l’utérus) participe également à la diminution de la fertilité.
La prise en charge doit être conduite par des équipes pluridisciplinaires. En cas dʼendométriose minime à légère, une stimulation ovarienne, avec ou sans insémination intra- utérine, peut être envisagée (FIV après 3 échecs de IIU).
La FIV est proposée dʼemblée en cas dʼendométriose ovarienne ou profonde, ou sʼil existe un facteur associé dʼinfertilité, en particulier masculin.
Avant lʼhyperstimulation ovarienne en vue de fécondation in vitro, un prétraitement de 2 à 6 mois par agoniste de la GnRH ou de 6 à 8 semaines par estroprogestatif améliorerait les chances de grossesse.
Le choix entre option chirurgicale et FIV repose sur l’évaluation du rapport bénéfice/risque. Quel est le bénéfice en termes de fertilité à opérer une patiente ayant une endométriose profonde ? Une chirurgie exhaustive de tous les foyers endométriosiques est-elle nécessaire ? Et si ce bénéfice s’avère important, quels sont les risques liés à la chirurgie ? Sont-ils variables en fonction de la localisation de la maladie et des gestes réalisés ? La stratégie dépend des différents types d’endométriose4 (HAS-CNGOF 2017, tableau 2).
Centres experts pour les cas complexes
L’endométriose recouvre un large spectre de situations allant des cas asymptomatiques aux formes complexes et invalidantes. La prise en charge nécessite donc des moyens humains et techniques adaptés à la situation de chaque patiente, ainsi qu’une expertise multidisciplinaire hyperspécialisée, incluant l’assistance médicale à la procréation.
Le recours à des centres experts5 devrait être limité aux endométrioses qualifiées de complexes ou sévères (20 % des cas). En l’absence de définition consensuelle, elles correspondent à des pathologies qui requièrent des spécialités médicales et chirurgicales complémentaires (traitement antigonadotrope, AMP ou spécialité chirurgicale en dehors de la gynécologie obstétrique viscérale). Compte tenu de la complexité de la prise en charge, ces centres doivent travailler en réseau avec des praticiens de ville.
1. Nisolle M, Alvarez ML, Colombo M, et al. [Pathogenesis of endometriosis]. Gynecol Obst Fertil 2007;35:898-903.
2. Daraï E, Ploteau S, Ballester M, Bendifallah S. [Pathogenesis, genetics and diagnosis of endometriosis]. Presse Med 2017;46(12 Pt 1):1156-65.
3. Guo SW. Epigenetics of endometriosis. Mol Hum Reprod 2009;15: 587-607.
4. Collinet P, Fritel X, Revel-Delhom C, et al. [Management of endometriosis: CNGOF-HAS practice guidelines (short version)]. Gynecol Obstet Fertil Senol 2018;46:144-55.
5. Daraï E, Bendifallah S, Chabbert-Buffet N, Golfier F. [Creation of expert centers on endometriosis]. Presse Med 2017;46(12 Pt 1):1218-22.