Initialement cantonné au milieu hospitalier, le phénomène de multirésistance gagne du terrain en médecine de ville, suscitant une inquiétude croissante.
Les entérobactéries (dont Escherichia coli est le chef de file) sont fréquemment responsables d’infections communautaires, notamment urinaires. Leur principal mécanisme de résistance repose sur la production de β-lactamases. Parmi celles-ci, les BLSE (β-lactamases à spectre étendu) sont des enzymes capables d’inactiver l’ensemble des β-lactamines à l’exception des carbapénèmes.
S’y associent volontiers des résistances aux fluoroquinolones, aux aminosides et au cotrimoxazole. Les infections sévères à entérobactéries productrices de BLSE (E-BLSE) ont donc un pronostic plus défavorable que celles dues à des micro-organismes sensibles. Leur prise en charge est complexe : le nombre d’alternatives est moindre, et le recours à des molécules uniquement disponibles par voie parentérale plus fréquent.
Les entérobactéries (dont Escherichia coli est le chef de file) sont fréquemment responsables d’infections communautaires, notamment urinaires. Leur principal mécanisme de résistance repose sur la production de β-lactamases. Parmi celles-ci, les BLSE (β-lactamases à spectre étendu) sont des enzymes capables d’inactiver l’ensemble des β-lactamines à l’exception des carbapénèmes.
S’y associent volontiers des résistances aux fluoroquinolones, aux aminosides et au cotrimoxazole. Les infections sévères à entérobactéries productrices de BLSE (E-BLSE) ont donc un pronostic plus défavorable que celles dues à des micro-organismes sensibles. Leur prise en charge est complexe : le nombre d’alternatives est moindre, et le recours à des molécules uniquement disponibles par voie parentérale plus fréquent.
Quelle prévalence ?
Identifiées dans les années 1980, les E-BLSE ont été initialement considérées comme un problème strictement hospitalier, responsable d’épidémies dans les établissements de santé. Cependant, le signalement au début des années 2000 d’infections à E-BLSE chez des patients sans aucun contact préalable avec le système de soins a fait émerger la question d’une dissémination potentielle en ville.
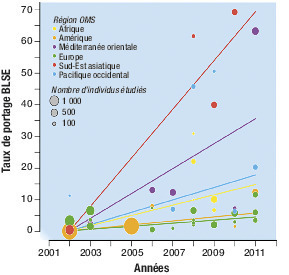
En 2016, on estimait, à l’échelle mondiale, à 14 % le pourcentage des individus en bonne santé porteurs d’une E-BLSE au niveau digestif, avec de grandes disparités entre les pays : 4 % en Europe, 15 % autour du bassin méditerranéen, et jusqu’à 46 % dans la région Pacifique.
En outre, entre 2002 et 2011, le portage de ces bactéries a considérablement augmenté, en particulier en Asie du Sud-Est (+ 7,2 %) et dans les régions du pourtour méditerranéen (+ 3,5 %).
En France, chez des sujets sains, il est passé de 0,6 % en 2006 à plus de 6 % en 2011, soit multiplié par 10 en 5 ans.1 Des taux plus élevés (10 %) ont été rapportés chez des enfants âgés de 6 à 24 mois en bonne santé.
En ville, d’après des études observationnelles, les E-BLSE seraient responsables de 5 à 6 % des bactériémies et des infections des voies urinaires.2
Les principaux facteurs de risque connus sont la notion de portage ou d’infection récents par une E-BLSE, la prise d’antibiotiques, une sonde vésicale à demeure, la résidence dans un établissement de soins de longue durée et un séjour récent en région de forte prévalence (figure ).
En 2016, on estimait, à l’échelle mondiale, à 14 % le pourcentage des individus en bonne santé porteurs d’une E-BLSE au niveau digestif, avec de grandes disparités entre les pays : 4 % en Europe, 15 % autour du bassin méditerranéen, et jusqu’à 46 % dans la région Pacifique.
En outre, entre 2002 et 2011, le portage de ces bactéries a considérablement augmenté, en particulier en Asie du Sud-Est (+ 7,2 %) et dans les régions du pourtour méditerranéen (+ 3,5 %).
En France, chez des sujets sains, il est passé de 0,6 % en 2006 à plus de 6 % en 2011, soit multiplié par 10 en 5 ans.1 Des taux plus élevés (10 %) ont été rapportés chez des enfants âgés de 6 à 24 mois en bonne santé.
En ville, d’après des études observationnelles, les E-BLSE seraient responsables de 5 à 6 % des bactériémies et des infections des voies urinaires.2
Les principaux facteurs de risque connus sont la notion de portage ou d’infection récents par une E-BLSE, la prise d’antibiotiques, une sonde vésicale à demeure, la résidence dans un établissement de soins de longue durée et un séjour récent en région de forte prévalence (
Quelles sources ?
Les 3 principaux réservoirs sont l’environnement et le tube digestif de l’homme et des animaux.
En France, des souches d’E. coli BLSE ont été retrouvées dans presque tous les échantillons environnementaux prélevés dans 11 sites du réseau d’eaux usées de la ville de Besançon (en amont de la station de traitement), leur quantité étant plus élevée dans celles provenant des hôpitaux.
En ce qui concerne la faune sauvage, une étude hollandaise a identifié des souches d’E coli BLSE dans 16 % des carcasses d’oiseaux appartenant à 21 espèces différentes.
La présence d’E-BLSE a été observée dans plus de 50 % des volailles à la découpe (selon plusieurs études européennes) et dans 92 % de celles vendues en France. La consommation de produits d’origine animale insuffisamment cuits serait une source potentielle d’acquisition de bactéries multirésistantes dans les zones à très haute prévalence.
Une attention croissante est portée aux animaux de compagnie, en raison de la proximité physique avec leur propriétaire (taux de portage digestif de 25 à 55 % chez les chats et les chiens aux Pays-Bas).
Jusqu’à présent, dans les régions à faible prévalence comme la France, les réservoirs humains d’E-BLSE étaient principalement des individus ayant été en contact avec le système de santé (notamment hospitalisés en France ou à l’étranger) ou ayant voyagé dans des zones à haute prévalence (personnel militaire servant outre-mer, réfugiés...).
En effet, un séjour à l’étranger est associé à des taux d’acquisition d’E-BLSE de près de 50 % (80 % après un retour d’Inde).3
En France, des souches d’E. coli BLSE ont été retrouvées dans presque tous les échantillons environnementaux prélevés dans 11 sites du réseau d’eaux usées de la ville de Besançon (en amont de la station de traitement), leur quantité étant plus élevée dans celles provenant des hôpitaux.
En ce qui concerne la faune sauvage, une étude hollandaise a identifié des souches d’E coli BLSE dans 16 % des carcasses d’oiseaux appartenant à 21 espèces différentes.
La présence d’E-BLSE a été observée dans plus de 50 % des volailles à la découpe (selon plusieurs études européennes) et dans 92 % de celles vendues en France. La consommation de produits d’origine animale insuffisamment cuits serait une source potentielle d’acquisition de bactéries multirésistantes dans les zones à très haute prévalence.
Une attention croissante est portée aux animaux de compagnie, en raison de la proximité physique avec leur propriétaire (taux de portage digestif de 25 à 55 % chez les chats et les chiens aux Pays-Bas).
Jusqu’à présent, dans les régions à faible prévalence comme la France, les réservoirs humains d’E-BLSE étaient principalement des individus ayant été en contact avec le système de santé (notamment hospitalisés en France ou à l’étranger) ou ayant voyagé dans des zones à haute prévalence (personnel militaire servant outre-mer, réfugiés...).
En effet, un séjour à l’étranger est associé à des taux d’acquisition d’E-BLSE de près de 50 % (80 % après un retour d’Inde).3
Quelle dynamique en ville ?
Plus récemment, la survenue d’infections à E-BLSE chez des individus sans facteur de risque suggère que les souches résistantes disséminent actuellement au sein de la communauté.
Le risque de transmission intracommunautaire depuis un porteur vers d’autres individus est encore mal connu. Cette propagation au sein des foyers familiaux a été montrée pour la première fois par une étude espagnole incluant des patients communautaires atteints d’infection urinaire à E. coli BLSE.4 Taux de portage : 27 % chez les membres de l’entourage immédiat du sujet, et seulement 7 % chez des témoins non apparentés.
Quelques observations similaires ont été rapportées chez les proches de patients regagnant leur domicile après une hospitalisation ou un voyage en zone d’endémie, ou dans des familles accueillant un enfant adopté à l’étranger. Cependant, aucun des auteurs n’a utilisé les nouvelles méthodes de séquençage (génome complet) pour confirmer la transmission des souches. De plus, la concentration d’E-BLSE dans le tube digestif n’a pas été corrélée avec le risque de transmission secondaire dans un foyer. Enfin, les facteurs épidémiologiques pouvant favoriser cette dissémination ne sont pas connus (habitudes alimentaires, hygiène des mains, fréquence des contacts entre les individus...).
Le risque de transmission intracommunautaire depuis un porteur vers d’autres individus est encore mal connu. Cette propagation au sein des foyers familiaux a été montrée pour la première fois par une étude espagnole incluant des patients communautaires atteints d’infection urinaire à E. coli BLSE.4 Taux de portage : 27 % chez les membres de l’entourage immédiat du sujet, et seulement 7 % chez des témoins non apparentés.
Quelques observations similaires ont été rapportées chez les proches de patients regagnant leur domicile après une hospitalisation ou un voyage en zone d’endémie, ou dans des familles accueillant un enfant adopté à l’étranger. Cependant, aucun des auteurs n’a utilisé les nouvelles méthodes de séquençage (génome complet) pour confirmer la transmission des souches. De plus, la concentration d’E-BLSE dans le tube digestif n’a pas été corrélée avec le risque de transmission secondaire dans un foyer. Enfin, les facteurs épidémiologiques pouvant favoriser cette dissémination ne sont pas connus (habitudes alimentaires, hygiène des mains, fréquence des contacts entre les individus...).
Que faire ?
La question n’est plus de s’interroger sur l’émergence des E-BLSE en milieu communautaire, puisque leur dissémination est avérée. L’enjeu est de quantifier l’importance de ces transmissions, d’identifier les facteurs de risque et de concevoir des stratégies collectives pour en limiter l’impact. Cela est d’autant plus important que l’émergence des entérobactéries hautement résistantes (productrices de carbapénémases), résistantes, elles, à tous les antibiotiques de première ligne, est devenue une menace mondiale majeure. Si leur propagation a été largement décrite dans les établissements de santé, leur transmission au sein de la communauté est mal caractérisée.
Faut-il s’alarmer ? En soi, la colonisation par une bactérie multirésistante n’est pas synonyme d’infection. Même si l’incidence des infections communautaires à bactéries multirésistantes augmente, les conséquences sont surtout potentiellement graves chez les patients fragiles ou porteurs de dispositifs invasifs (sondes vésicales à demeure, cathéters vasculaires).
Il est néanmoins crucial d’engager une lutte collective pour réduire globalement et durablement la dissémination de ces bactéries et bloquer l’émergence des souches hautement résistantes.
Tous les acteurs du système de soins ont un rôle clé à jouer : bon usage des antibiotiques (ne pas traiter les colonisations asymptomatiques, privilégier les molécules à spectre étroit et respecter les durées de traitement courtes), sensibilisation du grand public et des professionnels de santé aux stratégies de diagnostic, de prévention et contrôle de l’infection (vaccination grippe et pneumocoque chez les sujets à risque, hygiène).
Faut-il s’alarmer ? En soi, la colonisation par une bactérie multirésistante n’est pas synonyme d’infection. Même si l’incidence des infections communautaires à bactéries multirésistantes augmente, les conséquences sont surtout potentiellement graves chez les patients fragiles ou porteurs de dispositifs invasifs (sondes vésicales à demeure, cathéters vasculaires).
Il est néanmoins crucial d’engager une lutte collective pour réduire globalement et durablement la dissémination de ces bactéries et bloquer l’émergence des souches hautement résistantes.
Tous les acteurs du système de soins ont un rôle clé à jouer : bon usage des antibiotiques (ne pas traiter les colonisations asymptomatiques, privilégier les molécules à spectre étroit et respecter les durées de traitement courtes), sensibilisation du grand public et des professionnels de santé aux stratégies de diagnostic, de prévention et contrôle de l’infection (vaccination grippe et pneumocoque chez les sujets à risque, hygiène).
Références
1. Nicolas-Chanoine MH, et al. 10-Fold increase (2006-11) in the rate of healthy subjects with extended-spectrum β-lactamase-producing Escherichia coli faecal carriage in a Parisian check-up centre. J Antimicrob Chemother 2013;68:562-8.
2. Zahar JR, et al; BacterCom Study Group. Predominance of healthcare-associated cases among episodes of community-onset bacteraemia due to extended-spectrum β-lactamase-producing Enterobacteriaceae. Int J Antimicrob Agents 2017;49:67-73.
3. Ruppé E, et al. High Rate of Acquisition but Short Duration of Carriage of Multidrug-Resistant Enterobacteriaceae After Travel to the Tropics. Clin Infect Dis 2015;61:593-600.
4. Rodríguez-Baño J, et al. Faecal carriage of extended- spectrum beta-lactamase-producing Escherichia coli: prevalence, risk factors and molecular epidemiology. J Antimicrob Chemother 2008;62:1142-9.
5. Caron F, et al. Practice guidelines for the management of adult community-acquired urinary tract infections. Med Mal Infect 2018;48:327-58.
6. HAS. Antibiothérapie des infections à entérobactéries et à Pseudomonas aeruginosa chez l’adulte : place des carbapénèmes et de leurs alternatives. Recommandation de bonne pratique. Juillet 2019. https://bit.ly/2UFiqtW
2. Zahar JR, et al; BacterCom Study Group. Predominance of healthcare-associated cases among episodes of community-onset bacteraemia due to extended-spectrum β-lactamase-producing Enterobacteriaceae. Int J Antimicrob Agents 2017;49:67-73.
3. Ruppé E, et al. High Rate of Acquisition but Short Duration of Carriage of Multidrug-Resistant Enterobacteriaceae After Travel to the Tropics. Clin Infect Dis 2015;61:593-600.
4. Rodríguez-Baño J, et al. Faecal carriage of extended- spectrum beta-lactamase-producing Escherichia coli: prevalence, risk factors and molecular epidemiology. J Antimicrob Chemother 2008;62:1142-9.
5. Caron F, et al. Practice guidelines for the management of adult community-acquired urinary tract infections. Med Mal Infect 2018;48:327-58.
6. HAS. Antibiothérapie des infections à entérobactéries et à Pseudomonas aeruginosa chez l’adulte : place des carbapénèmes et de leurs alternatives. Recommandation de bonne pratique. Juillet 2019. https://bit.ly/2UFiqtW