Le paludisme continue de poser des défis en matière de prévention, de diagnostic et de prise en charge thérapeutique dans de nombreux pays industrialisés, bien qu’il y ait été éliminé. Il s’agit le plus souvent d’une pathologie d’importation observée chez des voyageurs, des migrants ou des militaires en provenance de zones endémiques, mais aussi par des sujets résidant en zone endémique en visite dans un pays non endémique. Exceptionnellement, le paludisme peut être transmis en zone non endémique, de manière accidentelle (greffe, transfusion, accident d’exposition au sang) ou par l’intermédiaire d’anophèles importés (par avion) : on le qualifie alors de paludisme « autochtone ». La France métropolitaine est le pays industrialisé qui recense le plus grand nombre de cas de paludisme d’importation. La surveillance de celui-ci en France métropolitaine repose sur un réseau d’une centaine d’hôpitaux volontaires, bénévoles, correspondants du Centre national de référence du paludisme (CNR du paludisme).
Situation du paludisme en France métropolitaine
Pour l’année 2017, un total de 2 721 cas de paludisme a été déclaré au CNR du paludisme par les correspondants du réseau métropolitain.1 Deux cas concernaient des cas considérés comme autochtones. Considérant la représentativité du réseau des correspondants, le nombre de cas de paludisme d’importation a été estimé à environ 5 220 pour l’ensemble de la France métropolitaine, en augmentation de 10,3 % par rapport à 2016.
Population exposée
En 2017, 82,8 % des cas déclarés étaient diagnostiqués chez des sujets d’origine africaine (en augmentation de 4,0 % par rapport à 2016) pour environ 15,3 % de Caucasiens. Les nourrissons (0 à 2 ans) représentaient 1,8 % des cas déclarés, les enfants (3 à 14 ans) 9,7 %, les adultes (15 à 59 ans) 78 %, et les plus de 60 ans représentaient 11 % des cas. Les femmes enceintes représentaient 1,4 % et étaient d’origine africaine pour 94,4 % d’entre elles.
Pays de contamination
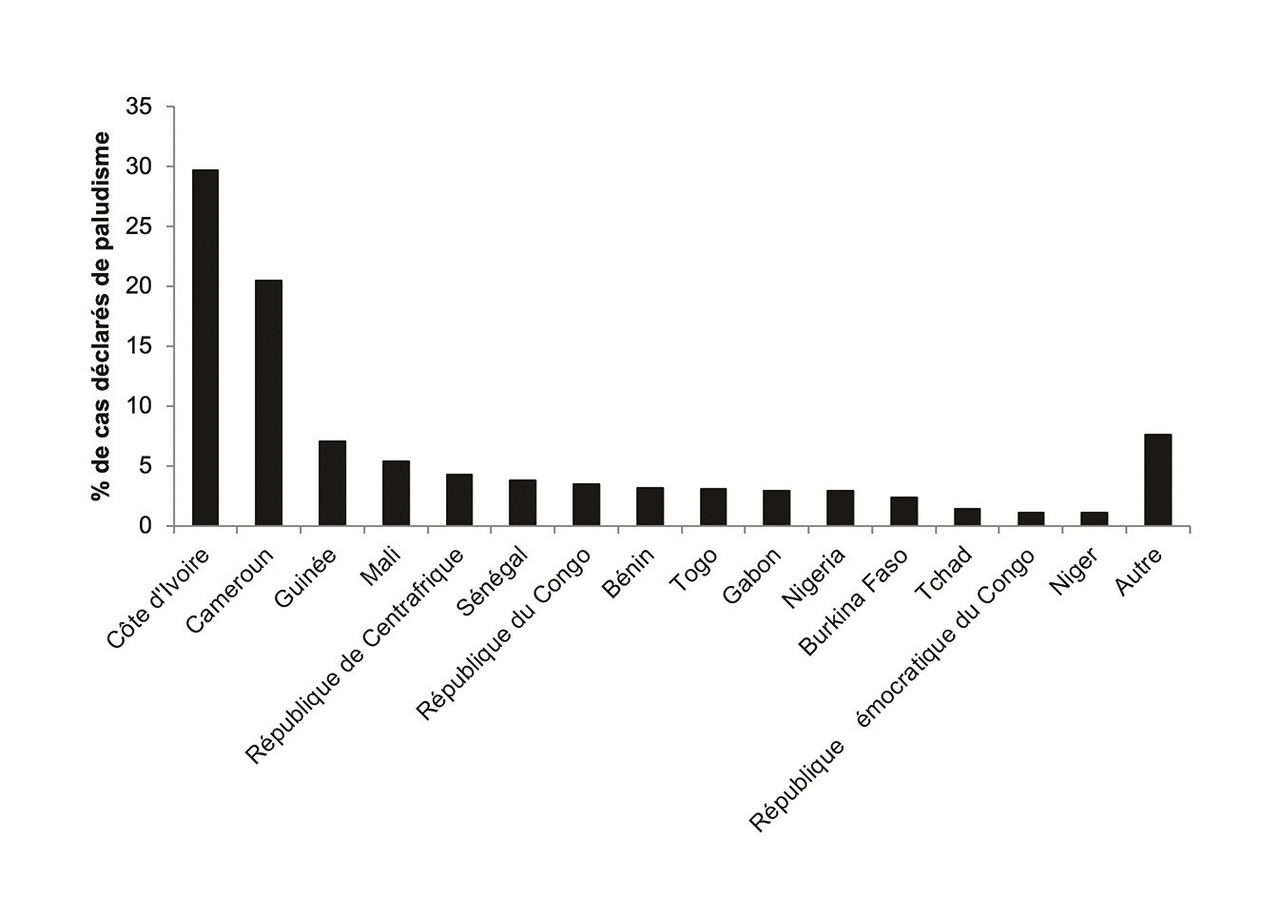
Le paludisme d’importation en France métropolitaine est contracté essentiellement en Afrique subsaharienne (plus de 95 % des cas). Sur les 59 pays cités comme pays de contamination, 15 pays représentent 92,4 % du total des cas déclarés (v. figure). On note une tendance à la baisse des cas en provenance du Mali (-26,4 %), de la république de Centrafrique (-7,7 %), de la République du Congo (-50,5 %), du Gabon (-14,6 %), du Burkina Faso (-15,7 %), du Tchad (-37,7 %) et de la république démocratique du Congo (-50,9 %) par rapport à 2016, mais ces pays restent néanmoins dans les 15 pays représentant 92,4 % des cas totaux. Différentes hypothèses peuvent expliquer ces diminutions, comme la baisse de transmission du paludisme dans ces pays mais surtout une diminution du nombre de voyageurs ou des militaires dans les pays où l’incidence a baissé. Les cas en provenance de Côte d’Ivoire, de la Guinée, du Sénégal, du Togo, du Bénin, du Nigeria, du Niger, du Ghana et de Madagascar sont en augmentation de plus de 17 % par rapport à 2016. Il y a eu, en 2017, 13 cas de paludisme d’importation au retour des Comores, contre 6 cas rapportés en 2016.
Méthodes de diagnostic et espèces identifiées
Le diagnostic biologique a reposé sur l’association frottis sanguin mince et goutte épaisse dans 64,8 % des cas. La détection antigénique sur bandelettes (tests de diagnostic rapide), lorsqu’elle était réalisée, était associée à une méthode microscopique dans la presque totalité des cas (81,2 %). L’espèce plasmodiale déclarée par les correspondants a été vérifiée (par microscopie et/ou biologie moléculaire) au CNR du paludisme sur les échan- tillons adressés dans 78,3 % des cas. L’espèce Plasmodium falciparum seule a été identifiée dans 87,5 % des échantillons, soit une légère augmentation de 1 % par rapport à 2016 (86,5 %). Si l’on considère les infections mixtes avec P. falciparum, cette espèce était retrouvée dans 87,8 % des cas. Plasmodium ovale, P. vivax, P. malariae, et les infections mixtes étaient retrouvées dans 6,4 %, 2,1 %, 2,0 % et 1,0 % des cas respectivement ; aucun cas à P. know- lesi n’a été observé. Les infections à P. falciparum étaient majoritairement (99,7 %) contractées sur le continent africain. Globalement, cette espèce était responsable de 89,4 % des accès en provenance d’Afrique. Elle était également responsable de 5,3 % des infections acquises en Asie, en diminution constante ces dernières années. Les infections à P. falciparum représentent 89,7 % des infections palustres chez les femmes enceintes. Les infections à P. ovale restent stables par rapport à 2016. P. vivax prédominait en Asie (89,5 %) et en Amérique du Sud (63,6 %).
Symptomatologie associée
Le délai médian d’apparition des symptômes était de 5 jours pour P. falciparum. Plus de 90 % des cas de paludisme à P. falciparum surviennent dans la semaine qui suit le retour de zone d’endémie. Pour les espèces P. ovale et P. vivax, les reviviscences n’ont pas été différenciées des accès de primo-invasion, ce qui explique la durée du délai médian d’apparition des symptômes très élevé pour ces espèces, 42 et 64 jours respectivement ; celui pour l’espèce P. malariae était de 26 jours.La parasitémie médiane des accès à P. falciparum a été évaluée à 0,3 % pour les accès simples [IQ25-75 : 0,1 %-1,0 %] contre 5 % pour les accès graves [IQ25-75 : 1,4 %-9,0 %]. Ces valeurs sont stables entre 2016 et 2017.Les accès déclarés étaient des accès simples avec ou sans vomissements dans 84,6 % des cas, toutes espèces confondues. Les accès graves, au nombre de 377 (14,5 % de la totalité des cas déclarés), étaient presque exclusivement observés avec l’espèce P. falciparum, diagnostiquée seule ou en association (97,9 %). Le nombre d’accès graves en 2017 (14,5 %) est en augmentation par rapport à 2016 (12,6 %). Les sujets de plus de 15 ans représentaient 87,9 % des sujets ayant un accès grave. Les sujets originaires d’Afrique (nés en Afrique ou en France) représentaient 71,9 % des patients avec un accès grave contre 26,5 % de Caucasiens. L’origine de la contamination des sujets avec un accès grave était l’Afrique subsaharienne dans 98,4 % des cas.Les critères de gravité les plus fréquemment rapportés étaient : une parasitémie supérieure à 4 % (59,4 %), isolée dans 80 cas (24,2 % des accès graves) ; une bilirubinémie totale supérieure ou égale à 50 μmol/L (32,5 %), isolée dans 15 cas ; des troubles neurologiques mineurs (29,3 %), isolés dans 21 cas ; des lactates supérieurs à 2 μmol/L (20,2 %), isolés dans 2 cas ; un ictère (19,4 %), isolé dans 1 cas, et un état de choc (7,5 %), isolé dans 5 cas.Au total, 13 décès ont été déclarés, soit une létalité de 0,48 % sur l’ensemble des cas et de 3,4 % des formes graves, en augmentation par rapport à 2016 (0,21 % sur l’ensemble des cas et 1,6 % des formes graves).
Attitude prophylactique
Plus de 88 % des sujets ont déclaré n’utiliser aucune protection antivectorielle et 76,9 % des sujets ne pas avoir suivi de chimioprophylaxie. Au total, 454 personnes ont fait un accès palustre à P. falciparum en ayant déclaré avoir pris une chimioprophylaxie et 122 sujets ont affirmé avoir suivi régulièrement une prophylaxie adaptée. La doxycycline était la première chimioprophylaxie (52,5 %) déclarée par les patients, suivie par l’atovaquone-proguanil (27,2 %) et la méfloquine (13,3 %).
Prise en charge thérapeutiques
Le traitement des accès graves en 2017 a été majoritairement l’artésunate intraveineux dans 71,5 % des cas, la quinine intraveineuse dans 7,5 % des cas, ou un traitement par voie orale dans 21 % des cas (dihydroartémisinine-pipéraquine, artéméther-luméfantrine, atovaquone-proguanil).
L’association arténimol (dihydro- artémisinine)-pipéraquine (49,9 %) est devenue la première ligne thérapeutique suivie par l’atovaquone-proguanil (32,6 %) et l’artémether-luméfantrine (17,5 %) pour la prise en charge des accès simples à P. falciparum.
L’association arténimol (dihydro- artémisinine)-pipéraquine (49,9 %) est devenue la première ligne thérapeutique suivie par l’atovaquone-proguanil (32,6 %) et l’artémether-luméfantrine (17,5 %) pour la prise en charge des accès simples à P. falciparum.
Insister sur le respect des mesures de prévention
À l’instar de ce qui est observé pour le paludisme en zone endémique, le nombre de cas de paludisme d’importation en France métropolitaine est en augmentation depuis ces quatre dernières années. Le non-respect des recommandations de prévention reste à l’origine de la plupart des cas de paludisme d’importation étudiés. Une information sur l’importance du respect des mesures de prévention doit être apportée par l’ensemble des structures impliquées dans l’organisation des voyages vers les zones avec une transmission du paludisme : les centres de santé et de conseils aux voyageurs bien sûr, mais également les autorités sanitaires, les aéroports, les compagnies aériennes, les agences de voyages et les sites Internet de ventes de voyages. Cet effort doit porter principalement sur les sujets originaires d’Afri- que qui retournent rendre visite à des proches dans leurs pays d’origine et qui supportent l’essentiel des paludismes d’importation en France. V
Remerciements Les auteurs tiennent à remercier l’ensemble des partenaires du Centre national de référence du paludisme qui participent à la surveillance du paludisme en France et dans ses territoires d’outre-mer. Sans leur participation, bon nombre de ces données n’existeraient pas. Ils remercient par ailleurs Santé publique France pour le soutien financier accordé au Centre national de référence du paludisme, et ce depuis plusieurs décennies.
Référence
1. Centre national de référence du paludisme CNRP. Rapport d’activité 2018 de l’année d’exercice 2017. Paris, France : Santé publique France, 2018.