Toute jeune femme épileptique en âge de procréer doit être interrogée sur un éventuel projet de grossesse. En cas de désir avéré, les maîtres mots sont programmation et information, avec si possible orientation du couple vers une consultation préconceptionnelle spécifique aux patientes épileptiques ou au minimum vers un neurologue.
La programmation permet :
–d’adapter le traitement antiépileptique : arrêt si l’épilepsie le permet (bon équilibre depuis plusieurs années, absence de facteur de risque avéré de récidive, syndrome épileptique non pharmacodépendant) ou à défaut : stopper les médicaments à potentiel tératogène, réduire le nombre et la posologie, fractionner les prises ;
– de débuter la prescription préconceptionnelle de folates à bonne dose (5 mg/j) : en effet, cela réduit le risque de traits autistiques et/ou leur sévérité chez les enfants nés de mères épileptiques supplémentées avant et pendant leurs 3 premiers mois de grossesse.1
Dépakine : à proscrire
Par ailleurs, il peut fragiliser le développement cognitif, qui est retardé avec un QI diminué de 9 points chez les enfants concernés par rapport à ceux exposés à la lamotrigine, avec là encore un effet probablement dose-dépendant (retard plus marqué pour les plus hautes posologies de valproate pendant la grossesse) et qui persiste chez les enfants en âge scolaire.3 En outre, un risque accru d’autisme infantile a été retrouvé chez les enfants nés de mères ayant, enceintes, pris du valproate (2,5 % vs 0,5 % dans la population contrôle).Pour les troubles du spectre autistique, les taux sont respectivement de 4,4 % et 1,5 %.4
Tératogénicité : en 4 points
Actuellement, lamotrigine (Lamictal) et lévétiracétam (Keppra) sont les 2 médicaments antiépileptiques les plus recommandés pendant la grossesse sans effet tératogène démontré.
La carbamazépine (Tégrétol) peut être autorisée mais à faible posologie du fait d’une potentielle tératogénicité dose- dépendante (au-delà de 600 à 800 mg/j selon les registres).
Pour les autres antiépileptiques, les données, trop parcellaires, incitent à la prudence (oxcarbazépine, Trileptal ; gaba- pentine, Neurontin ; prégabaline, Lyrica ; zonisamide, Zonegran ; lacosamide, Vimpat ; pérampanel, Fycompa).
Concernant le devenir cognitif des enfants nés de mères traitées par lamotrigine, lévétiracétam, carbamazépine ou topiramate, les données initiales sont rassurantes mais insuffisantes, obtenues sur de faibles effectifs avec souvent le biais du valproate pris comme comparateur. Des études prospectives de plus grande ampleur sont requises pour tous les antiépileptiques, y compris pour le risque d’autisme.
Surveillance de la grossesse
Ce risque est accru en cas de :
– mauvais équilibre de l’épilepsie avant la grossesse (les mois précédant la grossesse sont importants) ;
– arrêt ou remplacement du valproate en cours de grossesse : sa survenue non programmée sous valproate impose un avis neurologique en urgence ;
– absence de monitoring plasmatique du taux des médicaments antiépileptiques, certains chutant en cours de grossesse, requérant alors un ajustement des doses (parfois à titre préventif avant la récidive de crises).
Par ailleurs, un suivi échographique de bonne qualité est crucial en indiquant bien que la patiente prend des antiépileptiques et lesquels.
Accouchement et allaitement
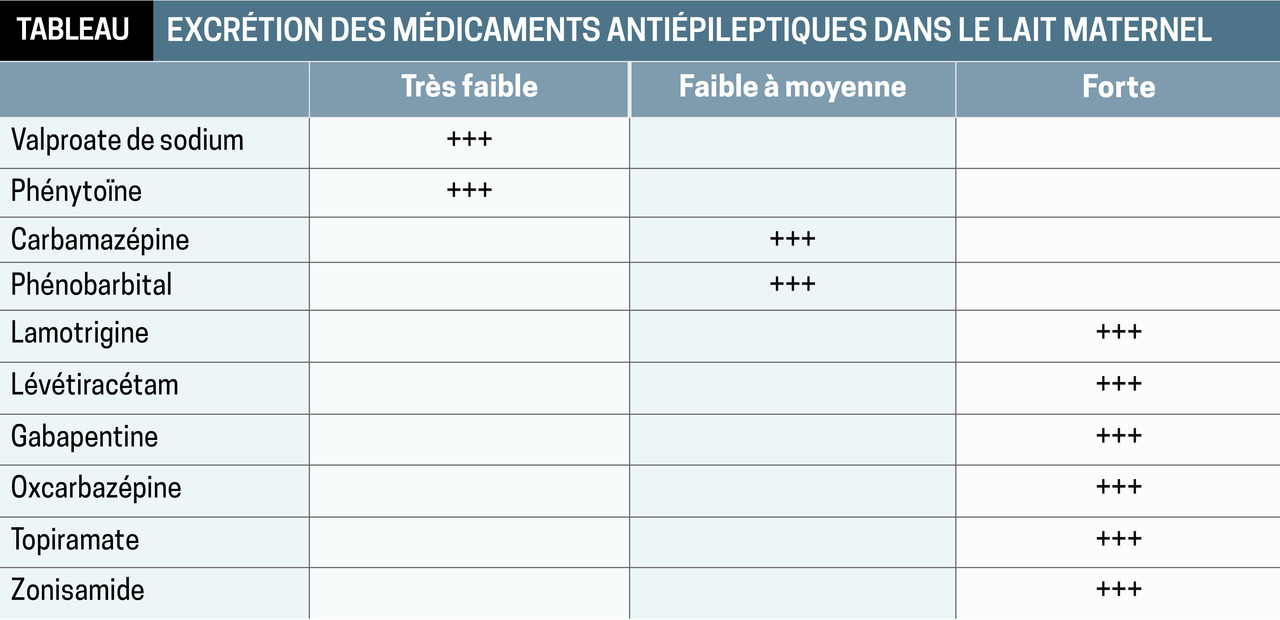
La décision d’allaiter est individuelle, prise conjointement en accord avec la patiente, le neurologue, le gynécologue et le pédiatre. L’allaitement est déconseillé en cas de polythérapie ou de médicaments très sédatifs (benzodiazépines notamment, barbituriques) ou d’épilepsie mal équilibrée, sensible à la privation de sommeil, à considérer au cas par cas si monothérapie à dose modérée.
Conclusion
Ces données ont conduit l’Ansm à une restriction d’utilisation du valproate ou de toutes les spécialités en contenant : Dépakine (valproate de sodium), Dépakote (divalproate de sodium), Dépamide (valpromide), Micropakine (valproate de sodium + acide valproïque) et génériques chez la fillette et chez les femmes en âge de procréer.
Depuis juin 2015, la prescription de toutes ces spécialités est réglementée : initiation réservée aux neurologues, psychiatres ou pédiatres après un accord de soins signé tout à la fois par le médecin initiateur et par la patiente (ou son représentant légal), renouvellement de prescription (sans accord de soin) autorisé ensuite pour les médecins généralistes mais durant une période n’excédant pas 1 an, renouvellement annuel de l’accord de soins par l’un des trois spécialistes autorisés, ce document signé étant requis pour la délivrance du médicament par le pharmacien.
Changer d’antiépileptique.
Programmer la grossesse 4 à 6 cycles après la dernière prise.
Ne pas arrêter brutalement (risque de récidive de crise, d’aggravation, d’état de mal épileptique ou même de mort subite…), mais baisser par paliers successifs (par exemple 1/2 comprimé de 500 mg en moins tous les 7 à 14 jours jusqu’à l’arrêt) en ajoutant des doses croissantes du nouvel antiépileptique (choisi par le neurologue).
Substitution sous surveillance clinique et si possible EEG pour évaluer les risques de crise et les précautions nécessaires (conduite automobile, sport, natation non surveillée…).
La grossesse est possible chez les femmes épileptiques.
Elle doit à tout prix être programmée, une contraception adaptée est donc souhaitable en attendant.
Le but de cette programmation est d’optimiser au mieux le traitement antiépileptique et de réduire le risque de malformations fœtales pour le bébé à naître.
La grossesse fera l’objet d’un suivi échographique et biologique renforcé.
Le risque de crises pendant la grossesse n’est pas majoré dans la plupart des cas.
Programmer la grossesse pour arrêter les médicaments les plus tératogènes, Dépakine notamment.
Une supplémentation par acide folique (5 mg/j) est préconisée dès la période préconceptionnelle.
Le valproate de sodium est à bannir pendant la grossesse.
À ce jour, la lamotrigine et le lévétiracétam sont les 2 médicaments les plus recommandés (mais peu de données développementales).
Dépakine : prudence !
Ces données ont conduit l’Ansm à une restriction d’utilisation du valproate ou de toutes les spécialités en contenant : Dépakine (valproate de sodium), Dépakote (divalproate de sodium), Dépamide (valpromide), Micropakine (valproate de sodium + acide valproïque) et génériques chez la fillette et chez les femmes en âge de procréer.
Depuis juin 2015, la prescription de toutes ces spécialités est réglementée : initiation réservée aux neurologues, psychiatres ou pédiatres après un accord de soins signé tout à la fois par le médecin initiateur et par la patiente (ou son représentant légal), renouvellement de prescription (sans accord de soin) autorisé ensuite pour les médecins généralistes mais durant une période n’excédant pas 1 an, renouvellement annuel de l’accord de soins par l’un des trois spécialistes autorisés, ce document signé étant requis pour la délivrance du médicament par le pharmacien.
Désir de grossesse chez une femme sous Dépakine
Changer d’antiépileptique.
Programmer la grossesse 4 à 6 cycles après la dernière prise.
Ne pas arrêter brutalement (risque de récidive de crise, d’aggravation, d’état de mal épileptique ou même de mort subite…), mais baisser par paliers successifs (par exemple 1/2 comprimé de 500 mg en moins tous les 7 à 14 jours jusqu’à l’arrêt) en ajoutant des doses croissantes du nouvel antiépileptique (choisi par le neurologue).
Substitution sous surveillance clinique et si possible EEG pour évaluer les risques de crise et les précautions nécessaires (conduite automobile, sport, natation non surveillée…).
Que dire à vos patientes
La grossesse est possible chez les femmes épileptiques.
Elle doit à tout prix être programmée, une contraception adaptée est donc souhaitable en attendant.
Le but de cette programmation est d’optimiser au mieux le traitement antiépileptique et de réduire le risque de malformations fœtales pour le bébé à naître.
La grossesse fera l’objet d’un suivi échographique et biologique renforcé.
Le risque de crises pendant la grossesse n’est pas majoré dans la plupart des cas.
2. Tomson T, Battino D, Bonizzoni E, et al.; EURAP study group. Dose-dependent risk of malformations with anti- epileptic drugs: an analysis of data from the EURAP epilepsy and pregnancy registry. Lancet Neurol 2011;10: 609-17.
3. Meador K, Baker G, Browning N, et al.; NEAD Study Group. Cognitive function at 3 years of age after fetal exposure to antiepileptic drugs. N Engl J Med 2009; 360:1597-605.
4. Christensen J, Grønborg TK, Sørensen MJ, et al. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA 2013;309:1696-703.
5. Weston J, Bromley R, Jackson CF, et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child. Cochrane Database Syst Rev 2016;11:CD010224.

 Encadrés
Encadrés