Définition et épidemiologie
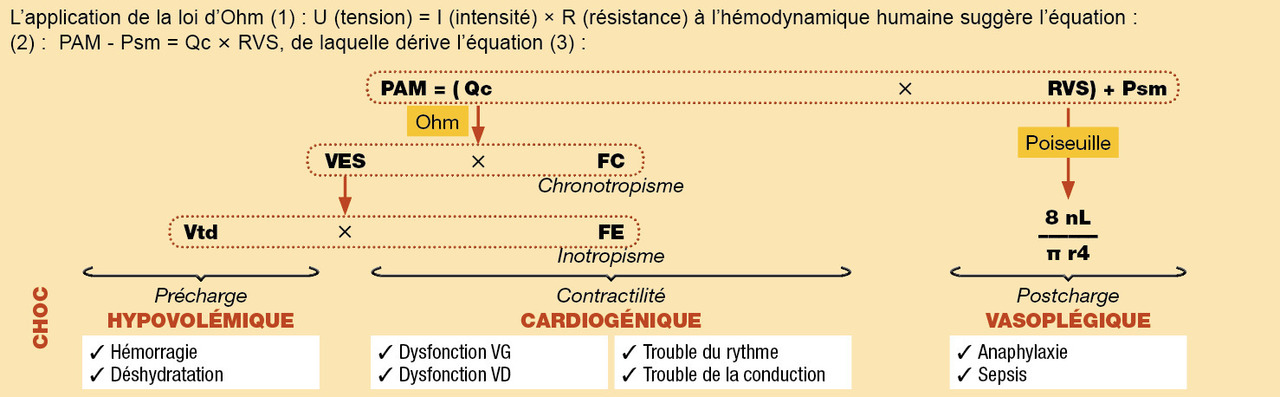
L’état de choc peut être secondaire à 4 mécanismes principaux (figure).
1. Le choc hypovolémique est dû à une diminution du retour veineux (précharge cardiaque) et donc du débit cardiaque, causée par une perte absolue (ex : hémorragie) ou relative (ex : fuite capillaire, troisième secteur) du volume intravasculaire.
2. Le choc cardiogénique est dû à une défaillance de la pompe cardiaque associée à un bas débit en raison d’une perte de la contractilité efficace (ex : infarctus, myocardite, cardiomyopathie à un stade terminal, valvulopathie sévère) ou d’une réduction de la fréquence des contractions efficaces (arythmie supraventriculaire ou ventriculaire, trouble conductif de haut degré).
3. Le choc obstructif est secondaire à une occlusion de la circulation au niveau des artères pulmonaires (embolie pulmonaire) ou du péricarde (tamponnade cardiaque ou pneumothorax sous tension).
4. Le choc vasoplégique ou distributif est dû à une perte du tonus vasculaire (postcharge cardiaque) par l’effet de médiateurs résultant d’une réaction exagérée de l’hôte à une agression, comme une infection (choc septique), ou un allergène (choc anaphylactique).
L’état de choc concerne environ un tiers des patients admis en soins critiques. Le choc septique représente plus de 60 % des états de choc, suivi par les chocs cardiogénique et hypovolémique (environ 15 % chacun). Le pronostic des états de choc est sévère, avec une mortalité de l’ordre de 40 % pour le choc septique et de 60 % pour le choc cardiogénique.
L’analyse du contexte (ex : traumatisme évoquant une hémorragie, infection évoquant un sepsis, douleur thoracique évoquant un infarctus) et l’évaluation clinique (ex : distension veineuse jugulaire évoquant une obstruction circulatoire, congestion pulmonaire évoquant une défaillance de la pompe cardiaque), permettent en général d’orienter de façon simple le diagnostic vers le mécanisme de l’état de choc. Par exemple, un état de choc survenant à la suite d’une blessure traumatique est probablement hypovolémique par hémorragie (en raison des pertes sanguines). Néanmoins, on peut observer une association de mécanismes chez le même patient. Ainsi :
- un choc obstructif (favorisé par une tamponnade péricardique ou un pneumothorax compressif) ou vasoplégique (favorisé par une lésion de la moelle épinière) peut également survenir dans les suites d’un polytraumatisme ;
- l’anaphylaxie et le sepsis s’accompagnent fréquemment d’une hypovolémie absolue ou relative, notamment à la phase initiale ;
- une dépression myocardique survient chez un tiers des patients au cours du choc septique et semble favorisée par des médiateurs circulants (cytokines) ;
- la réaction inflammatoire qui accompagne les formes sévères de choc cardiogénique peut provoquer un certain degré de vasoplégie. Cette complexité souligne l’importance d’une exploration hémodynamique pour préciser le(s) mécanisme(s) du choc, notamment au moyen d’un examen échocardiographique au chevet du patient.
Diagnostic et physiopathologie
Altération de la macrocirculation
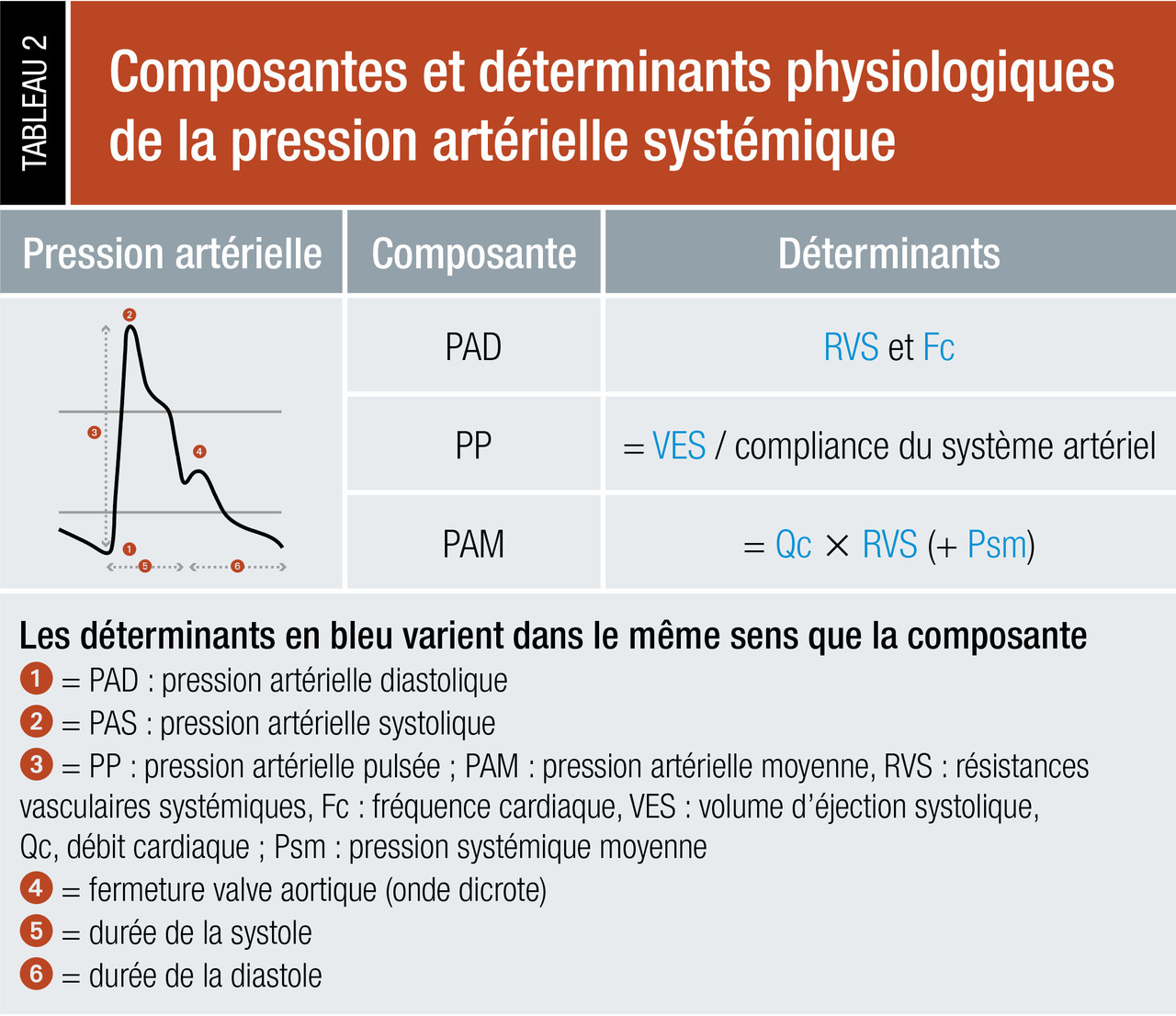
L’altération de la macrocirculation au cours du choc se manifeste classiquement par une hypotension artérielle systémique (définie chez l'enfant selon l'âge et chez l'adulte par une PAM < 65 mmHg ou une PAS < 90 mmHg ou baissant de plus de 40 mmHg par rapport au chiffre habituel du patient) ou la nécessité de perfuser des catécholamines pour maintenir une pression artérielle adéquate. Des mécanismes de compensation (particulièrement chez l'enfant), comme une tachycardie ou une vasoconstriction, peuvent préserver la pression artérielle au cours du choc, alors même que la perfusion tissulaire et l’oxygénation cellulaire sont considérablement réduites.
Altération de la microcirculation
En pratique clinique, l’altération de la microcirculation peut être facilement observée au niveau de la peau : froide, moite, pâle, décolorée, marbrée, ou cyanosée, avec allongement du temps de recoloration supérieur à 3 secondes ou augmentation du gradient de température centrale-périphérique. Elle peut aussi se faire avec des techniques spécifiques comme la spectroscopie dans le proche infrarouge ou la microvidéoscopie, mais qui ne sont pas encore recommandées en routine au cours du choc.
Dysoxie cellulaire
La saturation en oxygène du sang veineux mêlé (prélevé au niveau de l’artère pulmonaire, SvO2) ou central (prélevé au niveau d’une veine jugulaire ou sous-clavière, ScvO2), peut aussi fournir des informations sur la balance entre l’apport et la consommation en oxygène. En général, une ScvO2 basse (< 70 %) indique une extraction accrue d’oxygène en périphérie, signe d’un apport en oxygène insuffisant.
Hypoperfusion et dysfonction d’organe
Explorations hémodynamiques
D’autres outils de monitorage hémodynamique permettent l’évaluation de la fonction cardiovasculaire, comme la pression veineuse centrale, le cathéter artériel pulmonaire, les appareils de thermodilution transpulmonaire, l’analyse du contour de l’onde de pression artérielle sanglante, le Doppler œsophagien, ou la bioréactance.
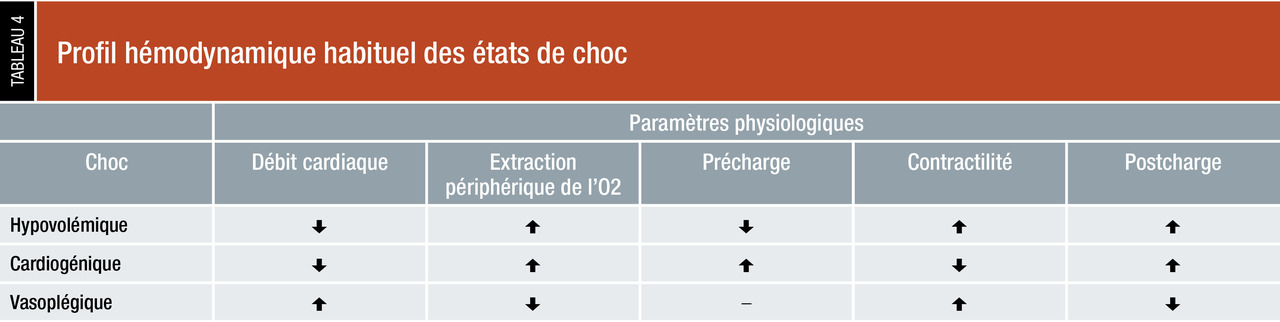
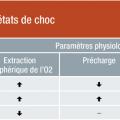
Il est recommandé d’utiliser une approche hémodynamique multiparamétrique pour caractériser l’état de choc (tableau 4). En général, on observe au cours des états de choc un état hypodynamique (la baisse du volume d’éjection systolique et du débit cardiaque est responsable de la diminution du transport artériel en oxygène), à l’exception du choc vasoplégique, qui est caractérisé par un état hyperdynamique (débit cardiaque élevé), le déficit principal se trouvant à la périphérie, avec perte du tonus vasculaire et altération de l’extraction de l’oxygène. Par ailleurs, le choc hypovolémique présente typiquement des indices de précharge bas, à l’inverse du choc cardiogénique où les indices de précharge VD et/ou VG sont élevés.
Traitement
À moins que l’état du patient ne s’améliore rapidement, un cathéter artériel doit être inséré pour surveiller la pression artérielle sanglante et effectuer les prélèvements sanguins. Des voies veineuses périphériques de bon calibre sont immédiatement mises en place pour initier le remplissage vasculaire et la perfusion des catécholamines, qui est poursuivie sur un cathéter veineux central s’il s’agit de vasopresseurs. La prise en charge initiale de l’état de choc vise deux objectifs : l’optimisation de la circulation et la correction de l’hypoxie tissulaire.
Optimiser la circulation
Remplissage vasculaire
Le remplissage vasculaire occupe une place centrale dans le traitement de l’état de choc, mais son importance varie selon le mécanisme : il est en général massif au cours du choc hypovolémique (en privilégiant les produits sanguins en cas d’hémorragie), important lors du choc septique (de l’ordre de 30 mL/kg à la phase initiale), modéré au cours du choc obstructif (en général limité à 500 mL) et minimal en cas de choc cardiogénique.Les solutions cristalloïdes sont les produits de choix pour le remplissage vasculaire, car elles sont bien tolérées et bon marché. En général, le remplissage est administré de façon séquentielle, par volume de 250 à 500 mL, sur une durée de 15-30 min. L’utilisation de colloïdes n’est pas recommandée en routine du fait de leur coût élevé, du risque d’effets secondaires (notamment de néphrotoxicité avec les hydroxyéthylamidons) et de l’absence de supériorité globale par rapport aux cristalloïdes.
La réponse favorable au remplissage vasculaire peut se juger sur la macrocirculation (ex : augmentation de la pression artérielle et/ou du débit cardiaque, baisse de la fréquence cardiaque), la microcirculation (ex : disparition des marbrures), la perfusion d’organe (ex : reprise de la diurèse) ou l’hypoxie tissulaire (ex : baisse de la lactatémie). Seulement la moitié des patients ont une réponse favorable au remplissage vasculaire en cas de choc obstructif ou après la phase initiale du choc septique. De nombreux indices prédictifs de l’augmentation du débit cardiaque en réponse au remplissage vasculaire (précharge-dépendance) ont été proposés, dont le test de levée de jambe passif, le mini-remplissage vasculaire, ou encore les tests d’interaction cardio-pulmonaire. Dans tous les cas, la réponse au remplissage vasculaire doit être évaluée, et ce traitement doit être surveillé pour éviter qu’un apport liquidien excessif puisse favoriser ou aggraver une congestion pulmonaire et/ou périphérique.
Vasopresseurs et inotropes
Les agonistes adrénergiques (catécholamines) sont utilisés en première intention car ils sont puissants et rapides, avec une demi-vie courte. La stimulation de chaque type de récepteur adrénergique a des effets potentiellement bénéfiques et néfastes (tableau 5) :- la noradrénaline est le vasopresseur de choix pour maintenir la pression artérielle ; elle possède principalement des propriétés alpha-adrénergiques, avec des effets b-adrénergiques modestes ;
- la dobutamine, avec des effets majoritairement bêta-adrénergiques, est l’agent inotrope de choix pour augmenter le débit cardiaque en cas de dysfonction contractile ;
- la dopamine, qui a des effets majoritairement bêta-adrénergiques à faibles doses et alpha-adrénergiques à doses élevées, n’est plus recommandée en routine, notamment en raison de son potentiel arythmogène ;
- l’adrénaline est un médicament plus puissant que les précédents, avec des effets bêta- et alpha-adrénergiques. Son administration peut être associée à des arythmies, une réduction du débit sanguin splanchnique et une hyperlactatémie par augmentation du métabolisme cellulaire ; elle est en général utilisée comme un agent de seconde intention pour les cas les plus graves.
Autres traitements
Une insuffisance surrénalienne relative (sans anomalie structurale de la glande surrénale) peut survenir au cours des états de choc, notamment septique. Certaines études suggèrent un bénéfice de faibles doses de corticoïdes (association hémisuccinate d’hydrocortisone et fludrocortisone) mais seulement chez les patients en choc septique sévère (avec au moins 2 dysfonctions d’organes et sous fortes doses de vasopresseur).La pose d’un ballon de contre-pulsion intra-aortique peut réduire la post-charge du ventricule gauche et augmenter le débit sanguin coronarien au cours du choc cardiogénique, mais ce traitement n’est plus recommandé car il n’a montré aucun bénéfice sur la mortalité. Une assistance circulatoire par membrane d’oxygénation extracorporelle (ECMO) peut être proposée en cas de choc cardiogénique réfractaire, notamment lorsqu’il s’agit d’une cause réversible et curable (infarctus du myocarde, myocardite fulminante, cardiomyopathie du post-partum).
Corriger l’hypoxie tissulaire
Conclusions
L’altération de la macrocirculation au cours du choc se manifeste classiquement (mais pas systématiquement) par une hypotension artérielle systémique ou la nécessité de perfuser des catécholamines pour maintenir une pression artérielle adéquate.
En pratique clinique, l’altération de la microcirculation peut être facilement observée au niveau de la peau.
L’hyperlactatémie est associée à un mauvais pronostic dans toutes les formes d’état de choc et doit être monitorée.
La défaillance viscérale peut toucher tous les organes au cours d’un état de choc.
L’échocardiographie est l’examen de première intention pour la caractérisation rapide du type d’état de choc.
Le traitement du choc comprend l’identification et la correction de la cause, l’optimisation de la circulation, et la correction de l’hypoxie tissulaire.
L’altération de la macrocirculation au cours du choc se manifeste classiquement (mais pas systématiquement) par une hypotension artérielle systémique ou la nécessité de perfuser des catécholamines pour maintenir une pression artérielle adéquate.En pratique clinique, l’altération de la microcirculation peut être facilement observée au niveau de la peau.L’hyperlactatémie est associée à un mauvais pronostic dans toutes les formes d’état de choc et doit être monitorée. La défaillance viscérale peut toucher tous les organes au cours d’un état de choc. L’échocardiographie est l’examen de première intention pour la caractérisation rapide du type d’état de choc. Le traitement du choc comprend l’identification et la correction de la cause, l’optimisation de la circulation, et la correction de l’hypoxie tissulaire.
Vincent JL, De Backer D. Circulatory shock, N Engl J Med 2013;369:1726-34.

 Encadrés
Encadrés