Les cancers du sein sont diagnostiqués soit à l’occasion d’une mammographie réalisée dans le cadre du dépistage organisé, soit à la suite du repérage d’une anomalie par la femme ou son médecin : palpation d’une masse mammaire ou d’une adénopathie axillaire, présence d’une rétraction cutanée ou d’un écoulement mamelonnaire. Le diagnostic repose sur l’examen clinique, le bilan d’imagerie, qui consiste d’abord à la réalisation d’une mammographie, suivie ou non d’une échographie bilatérale et d’une échographie axillaire, et d’un bilan anatomopathologique si indiqué.
Trois méthodes de prélèvement sont possibles en fonction de l’examen clinique et des résultats de l’imagerie : cytoponction à l’aiguille fine échoguidée, microbiopsies échoguidées pour les masses visibles en échographie, macrobiopsies sous stéréotaxie pour les microcalcifications et les masses non visibles à l’échographie.
Trois méthodes de prélèvement sont possibles en fonction de l’examen clinique et des résultats de l’imagerie : cytoponction à l’aiguille fine échoguidée, microbiopsies échoguidées pour les masses visibles en échographie, macrobiopsies sous stéréotaxie pour les microcalcifications et les masses non visibles à l’échographie.
Facteurs pronostiques
Les principaux facteurs pronostiques sont le stade, le type histologique et le grade
Stade
L’évaluation du stade de la tumeur repose sur les 3 critères TNM (Tumor, Nodes, Metastasis) : la taille de la tumeur (du plus grand nodule si tumeur multifocale), l’envahissement ganglionnaire axillaire et le statut métastatique. Lorsque le diagnostic de cancer du sein est établi par l’examen anatomopathologique, dans la plupart des cas le bilan clinique et l’imagerie initiale sont suffisants pour une correcte évaluation de l’extension locorégionale. Cependant, dans certains cas spécifiques, un bilan d’extension locorégionale et/ou à distance est recommandé.Un bilan locorégional par imagerie par résonance magnétique (IRM) mammaire (Haute Autorité de santé [HAS] 2010) doit être fait dans les cas suivants : patientes de moins de 40 ans en raison de une plus forte densité mammaire, présence d’une mutation BRCA avérée ou au 1er degré, haut risque familial, traitement néo-adjuvant programmé (examen recommandé), suspicion de cancers multiples en imagerie standard, ou discordance de l’évaluation tumorale entre l’examen clinique et l’imagerie standard ou entre la mammographie et l’échographie pouvant impacter l’acte chirurgical, cancer lobulaire infiltrant (option, hors recommandations de la HAS).
Le bilan d’extension à distance est indiqué en cas de diagnostic de cancer du sein infiltrant T3, T4 (ou pT3 pT4) quel que soit le statut ganglionnaire et pour tous les cancers avec une atteinte ganglionnaire macro-métastatique. Il repose sur la réalisation préthérapeutique d’une tomodensitométrie thoraco-abdomino-pelvienne et d’une scintigraphie osseuse (ou tomographie par émission de positons couplée à la tomodensitométrie [TEP-TDM] au 18-flurodésoxyglucose) et bilan biologique.
Type histologique
Sous-types histologiques
Le carcinome canalaire infiltrant est le sous-type histologique le plus fréquent, car il représente plus de 70 % de tous les carcinomes infiltrants. Le carcinome lobulaire infiltrant est un sous-type plus rare, diagnostiqué dans 5 à 15 % des cas. Il existe également plusieurs sous-types histologiques plus rares, ayant des caractéristiques spécifiques (Sous-types moléculaires
Au cours des dernières années, le croissant développement des analyses génomiques aux puces à ADN, ou microarrays, qui permettent d’analyser simultanément l’expression de nombreux gènes, a conduit à une nouvelle classification, dite « moléculaire », des cancers du sein, en fonction de leur profil d’expression génique, pour une meilleure définition du pronostic et des stratégies thérapeutiques. Les premières études, publiées en 2000,1 ont défini quatre types de carcinomes : luminal A, luminal B, basal-like, Her2/neu (surexpression du Her2). Ces analyses n’étant pas toujours réalisables en routine, en raison de leur coût et des difficultés techniques, plusieurs études ont démontré que l’immunohistochimie dans certains cas pourrait être un substitut au microarray pour définir de manière approximative les sous-types moléculaires de cancer du sein (Grade histopronostique
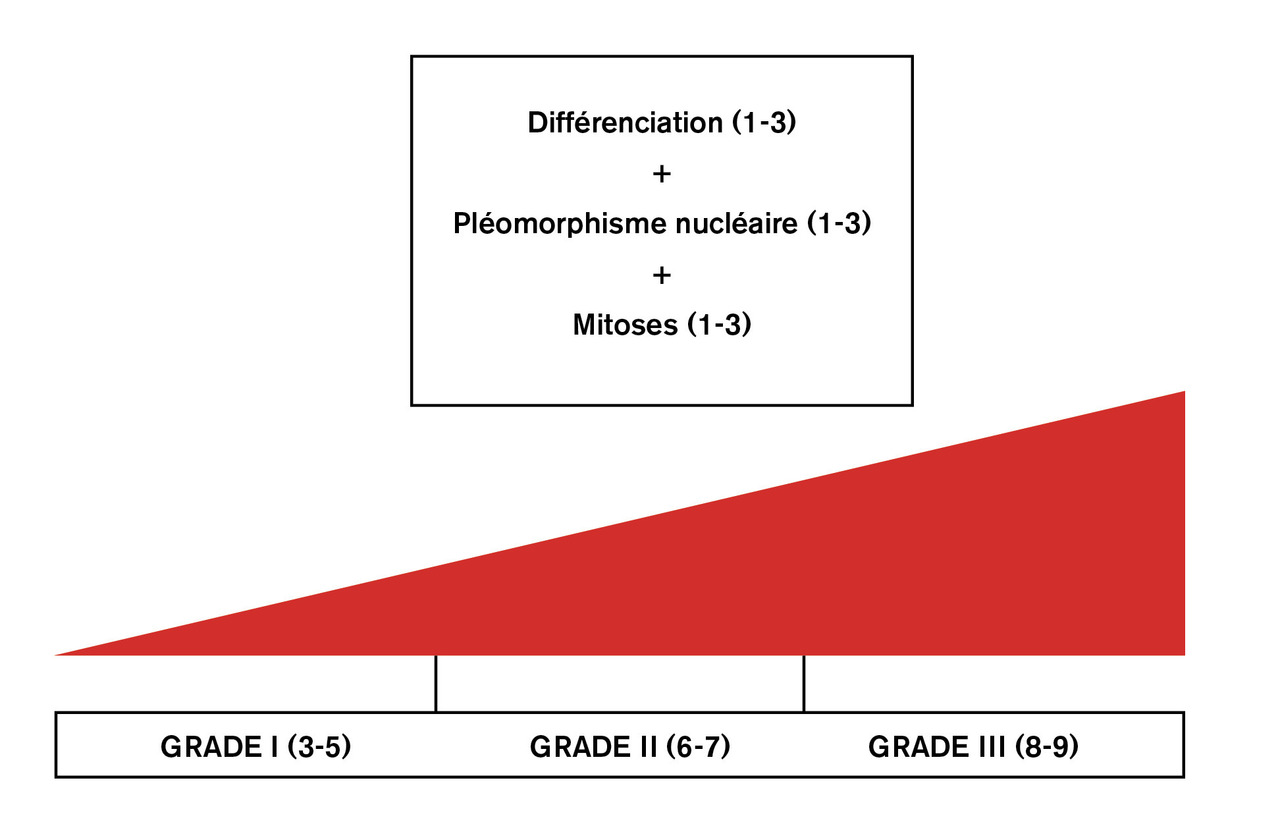
Le grade histopronostique d’Elston-Ellis comprend trois grades : I (tumeurs les moins agressives), II (intermédiaires) ou III (les plus agressives). Il est défini sur la base de trois critères : architecture, atypies cytonucléaires et nombre de mitoses. Les trois critères sont évalués par une note allant de 1 à 3, et le grade est déterminé par la somme des notes obtenues pour chacun des trois critères (v. figure ).
Prise en charge thérapeutique
Carcinomes in situ
Le traitement des carcinomes in situ comporte un traitement chirurgical par tumorectomie et radiothérapie complémentaire ou une mastectomie selon la taille tumorale et la taille du sein, avec des marges d’exérèse supérieures ou égales à 2 mm. La procédure du ganglion sentinelle est indiquée en cas de micro-invasion avérée ou suspectée sur la biopsie, de masse associée (clinique ou imagerie) ou de réalisation d’une mastectomie. La surveillance se fait ensuite par examen clinique et écho-mammographie annuelle à vie.
Carcinomes infiltrants
Traitements médicaux néo-adjuvants
Une chimiothérapie néo-adjuvante est, en règle générale, proposée dans les cas suivants : pour améliorer les chances de conservation sur une tumeur ayant dans tous les cas une indication de chimiothérapie : triple négatif, HER2+, et en option luminal de grade 3 très proliférant, à partir de 2 cm ou avec une atteinte ganglionnaire ; dans tous les cas de tumeurs localement avancées inopérables d’emblée ou localement très avancées : T4 a, c, d (et certains T4b) ; N3. Généralement, la chimiothérapie néo-adjuvante se fonde sur l’utilisation en séquence d’anthracyclines (adriamycine-cyclophosphamide [AC], épirubicine-cyclophosphamide [EC], toutes les 2 ou 3 semaines) et de taxanes (Taxotère, Taxol) avec ou sans trastuzumab (en cas de tumeurs avec une surexpression du HER2). Le taux de réponse pathologique complète (pCR) varie entre 20 et 25 % (pour les tumeurs RH+/HER2-) et entre 38 et 50 % pour les tumeurs HER2 positif ou triple négatives.Chirurgie
Le traitement de première intention, quand il est réalisable, est un traitement conservateur par tumorectomie après repérage préopératoire guidé par imagerie. Les marges d’exérèse pour le carcinome infiltrant doivent être en tissu sain. En cas de traitement néo-adjuvant précédent, la chirurgie doit être adaptée à la réponse à la thérapie néo-adjuvante et peut consister en une mastectomie totale ou une tumorectomie simple ou avec oncoplastie. En cas de réponse complète, l’exérèse est centrée sur le clip laissé lors de la biopsie préthérapeutique, aidée par un repérage métallique. L’exérèse du ganglion sentinelle est indiquée dans tous les cas d’une exploration axillaire négative (clinique, échographique avec ou sans cytoponction), sauf dans le cas de tumeurs de grosse taille (T4).Traitements adjuvants
Chimiothérapie. En général, après la chirurgie, la chimiothérapie adjuvante est indiquée en cas de cancer du sein triple négatif ou HER2+ à partir du stade T1b quelle que soit l’atteinte ganglionnaire et de cancer du sein luminal avec atteinte ganglionnaire ou de grade 3 de plus de 2 cm, ou en cas de test génomique haut risque.Au cours des dernières années, plusieurs signatures génomiques ont été développées et évaluées dans le cadre de larges analyses rétrospectives et prospectives, montrant la possibilité de prédire l’évolution clinique de cancers à risque intermédiaire avec une meilleure précision que les critères cliniques classiques.2 C’est pourquoi les différentes signatures génomiques (Oncotype Dx, Endopredict, PAM50, MammaPrint, etc.) permettent de mieux définir quelles sont les patientes qui peuvent bénéficier d’une chimiothérapie adjuvante, alors que ce n’est pas clairement établi selon les seuls critères cliniques, comme dans le cas de tumeurs avec expression des récepteurs, sans ganglions axillaires atteints et de grade histologique modéré. En général, la chimiothérapie adjuvante se base sur l’utilisation en séquence des anthracyclines (AC ou EC toutes les 2-3 semaines) et taxanes (Taxol ou docétaxel) plus ou moins trastuzumab (en cas de tumeurs avec surexpression du HER2). Voir le
Radiothérapie. La radiothérapie du sein est indiquée systématiquement en cas de traitement conservateur.
En cas d’atteinte ganglionnaire, on irradie également les aires ganglionnaires sus-claviculaires et la chaîne mammaire interne. Si plus de la moitié des ganglions axillaires sont atteints au curage, on fait également une irradiation axillaire. Après mastectomie, une irradiation complémentaire de la paroi est indiquée en cas de facteurs de risque de récidive.
Hormonothérapie. Toute patiente ayant un cancer du sein RE+ de taille supérieure ou égale à 5 mm reçoit une hormonothérapie pour une durée d’au moins 5 ans. Elle est débutée à la fin de la radiothérapie sauf pour les antiaromatases qui peuvent être démarrées en cours de radiothérapie.
Chez une femme non ménopausée avant traitement, et en l’absence de contre-indication (surtout antécédent de thrombose veineuse profonde), le traitement de référence est le tamoxifène. Cependant, en cas de patientes jeunes à haut risque de rechute, la suppression de la fonction ovarienne en association au tamoxifène ou à l’exémestane peut être proposée.
Chez une femme ménopausée et en l’absence de contre-indications (surtout risque cardiovasculaire majeur), on prescrit des antiaromatases, après avoir réalisé une ostéodensitométrie et un bilan lipidique de référence. En cas de tumeurs N+, une prolongation de l’hormonothérapie adjuvante pour un total de 10 ans doit être discutée avec la patiente afin de diminuer le risque de récidives tardives.4
En conclusion
Le pronostic et le traitement du cancer du sein sont dépendants de trois facteurs principaux : le stade, le grade et le type histologique. Puis, au cours des dernières années, le croissant développement des analyses génomiques aux puces à ADN a conduit à une meilleure connaissance du cancer du sein et à une nouvelle classification, dite « moléculaire », des cancers du sein, en fonction de leur profil d’expression génique. Mais ces analyses ne sont pas toujours réalisables en routine, en raison de leur coût et des difficultés techniques. Plusieurs études ont démontré que l’immunohistochimie dans certains cas pourrait être un substitut au microarray pour définir de manière approximative les sous-types moléculaires de cancer du sein.
Références
1. Perou CM, Sorlie T, Elisen MB, et al. Molecular portraits of human breast tumours. Nature 2000;406:747-52.
2. Haute Autorité de santé. Utilité clinique des signatures génomiques dans le cancer du sein de stade précoce. Rapport d’évaluation, HAS 2019. www.has-sante.fr ou https://bit.ly/3kUIMmx
3. Institut Curie, Gustave-Roussy. Cancers et pathologies du sein. Attitudes diagnostiques et thérapeutiques. Protocoles de traitement 2016-2017. www.gustaveroussy.fr ou https://bit.ly/2EeZP1C
4. Burstein HJ, Lacchetti C, Anderson H J. Adjuvant endocrine therapy for women with hormone receptor–positive breast cancer: ASCO clinical practice guideline focused update. J Clin Oncol 2018;37:423-38.
2. Haute Autorité de santé. Utilité clinique des signatures génomiques dans le cancer du sein de stade précoce. Rapport d’évaluation, HAS 2019. www.has-sante.fr ou https://bit.ly/3kUIMmx
3. Institut Curie, Gustave-Roussy. Cancers et pathologies du sein. Attitudes diagnostiques et thérapeutiques. Protocoles de traitement 2016-2017. www.gustaveroussy.fr ou https://bit.ly/2EeZP1C
4. Burstein HJ, Lacchetti C, Anderson H J. Adjuvant endocrine therapy for women with hormone receptor–positive breast cancer: ASCO clinical practice guideline focused update. J Clin Oncol 2018;37:423-38.