Le suivi des patients atteints de maladies inflammatoires chroniques de l’intestin (MICI) est fondé, en consultation, sur l’évaluation des symptômes digestifs. Cependant, si cette évaluation reste indispensable, elle doit être complétée par des évaluations plus objectives de l’activité de la maladie. En effet, jusqu’à la moitié des patients en rémission clinique montrent des signes d’activité en endoscopie.1 Or la persistance d’une activité inflammatoire asymptomatique est associée à un risque accru de rechute, d’hospitalisation et de geste chirurgical. Ainsi, même en l’absence de symptômes, des traitements sont introduits ou intensifiés en cas d’activité endoscopique isolée.2 À l’inverse, des symptômes peuvent persister en l’absence de toute activité objective de la MICI. L’endoscopie est toujours le gold standard pour évaluer l’activité des MICI. Néanmoins, sa disponibilité contrainte, l’acceptabilité médiocre des préparations coliques et des anesthésies générales, et sa performance limitée pour visualiser l’intestin grêle placent l’imagerie en coupe comme l’un des outils de choix pour le suivi au cours des MICI. Dès lors, la modalité radiologique de surveillance idéale est non invasive, disponible, simple à réaliser et à interpréter.
Échographie : un outil de suivi « au lit du malade »
L’échographie jouit de nombreux avantages pour le suivi des patients atteints de MICI. Il s’agit d’une technique non irradiante, peu onéreuse, facilement disponible et répétable à l’infini, permettant l’étude de toute la paroi digestive, et non de la seule muqueuse comme en endoscopie. Elle est cependant limitée par l’échogénicité du patient ainsi que par le faible nombre de praticiens formés à sa réalisation spécifiquement dans le domaine des MICI.
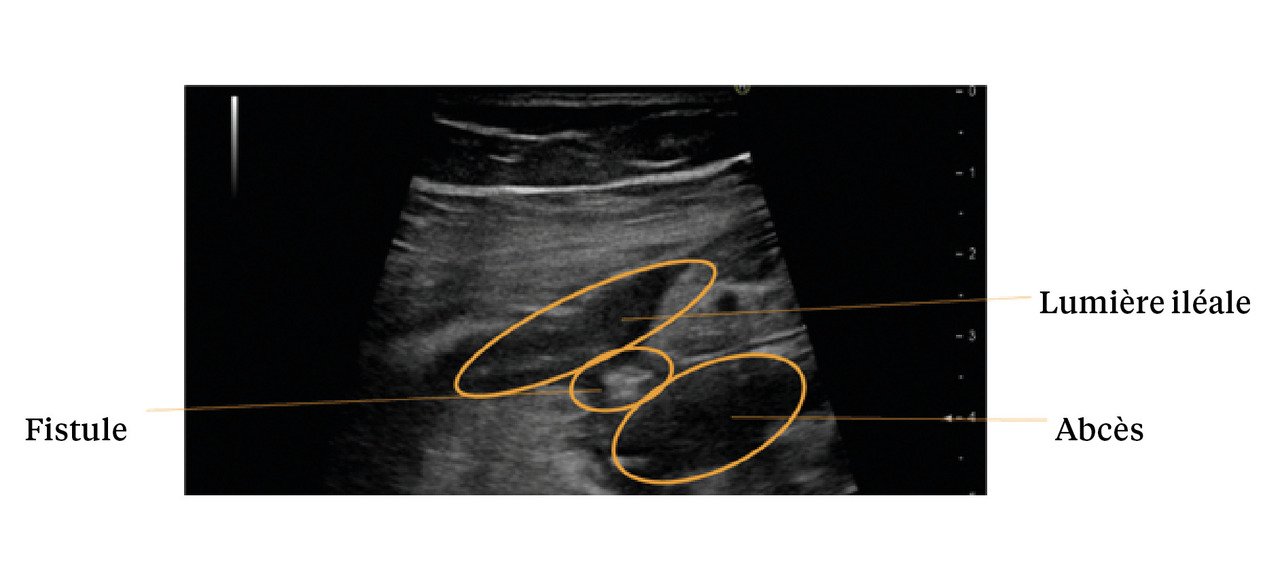
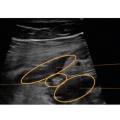
L’échographie permet la visualisation de l’ensemble du cadre colique, de la dernière anse iléale et des anses grêles, par balayage de l’épigastre jusqu’au pelvis. Les points analysés sont l’épaisseur pariétale (fig. 1), le signal doppler, les anomalies de la graisse mésentérique, la stratification pariétale, le péristaltisme, la présence d’ulcérations, d’adénopathies ou de complications (fistule, abcès, sténose ou épanchement intra-abdominal [fig. 2]). L’examen échographique permet de localiser ces éléments sémiologiques et de préciser la longueur de l’atteinte, le cas échéant.3
En pratique, une sonde convexe de 2,5 à 5 MHz et une sonde linéaire de 7 à 12 MHz peuvent être utilisées.4 Si la période post-prandiale modifie les flux doppler, le jeûne n’est pas indispensable, car il ne modifie pas les autres paramètres d’analyse (en particulier l’épaisseur pariétale).
Quelle place dans la maladie de Crohn ?
À partir de la valeur seuil d’épaisseur pariétale de 4 mm, la sensibilité de l’échographie, pour évoquer le diagnostic de la maladie de Crohn (à confirmer par l’endoscopie), est de 75 % et sa spécificité de 97 %.4 Si la précision est un peu plus faible en cas de maladie de Crohn limitée à l’intestin grêle, l’échographie permet des performances diagnostiques comparables à l’association de la coloscopie et de l’IRM dans la maladie de Crohn iléocolique.4,5 De même, l’échographie permet une bonne concordance avec l’endoscopie dans l’évaluation de la réponse au traitement par biothérapie et dans celle de la détection de la récidive postopératoire.4
Dans la RCH : l’exploration du rectum est limitée
Si l’échographie a été moins étudiée au cours de la rectocolite hémorragique (RCH) qu’au cours de la maladie de Crohn, elle dispose néanmoins de bonnes performances diagnostiques. L’épaisseur pariétale reste le déterminant majeur : à partir de la valeur seuil de 4 mm, la sensibilité est de 89 % et la spécificité de 87 %. L’association à la présence d’un flux doppler majore la spécificité à 100 %, au prix d’une sensibilité diminuée à 68 %.5 Comme dans la maladie de Crohn, l’échographie est un outil performant pour évaluer la réponse thérapeutique.4 En revanche, l’exploration du rectum est limitée par les contraintes anatomiques, et l’échographie est peu sensible dans l’évaluation de la rectite.4 Dans cette situation, la rectoscopie permet une évaluation plus sensible et sans contrainte de préparation ou d’anesthésie.
Entéro-IRM : un outil de suivi de la maladie de Crohn grêlique
Les avantages de l’entéro-IRM se définissent en creux par rapport aux limites de l’échographie digestive. Cela en fait deux techniques complémentaires dans la prise en charge de la maladie de Crohn grêlique. Ainsi, l’entéro-IRM permet une cartographie précise de l’atteinte grêlique du fait d’une sensibilité et d’une spécificité supérieures à celles de l’échographie pour l’évaluation de l’extension de la maladie (sensibilité de 80 % et spécificité de 95 %, contre respectivement 70 % et 81 % pour l’échographie).6 De même, elle permet de pallier la faible concordance entre les observateurs au cours de certaines évaluations échographiques.4
À l’inverse, l’entéro-IRM souffre d’une accessibilité limitée, d’un coût élevé et d’inquiétudes quant aux injections répétées de gadolinium. Enfin, l’évaluation du côlon en entéro-IRM est du ressort de certaines équipes universitaires spécialisées. De même, l’acceptabilité de l’entéro-IRM est plus faible, essentiellement du fait de la nécessaire ingestion préalable d’un produit osmolaire responsable de diarrhées et d’inconfort digestif.
Témoins d’inflammation : œdème pariétal et lésions muqueuses
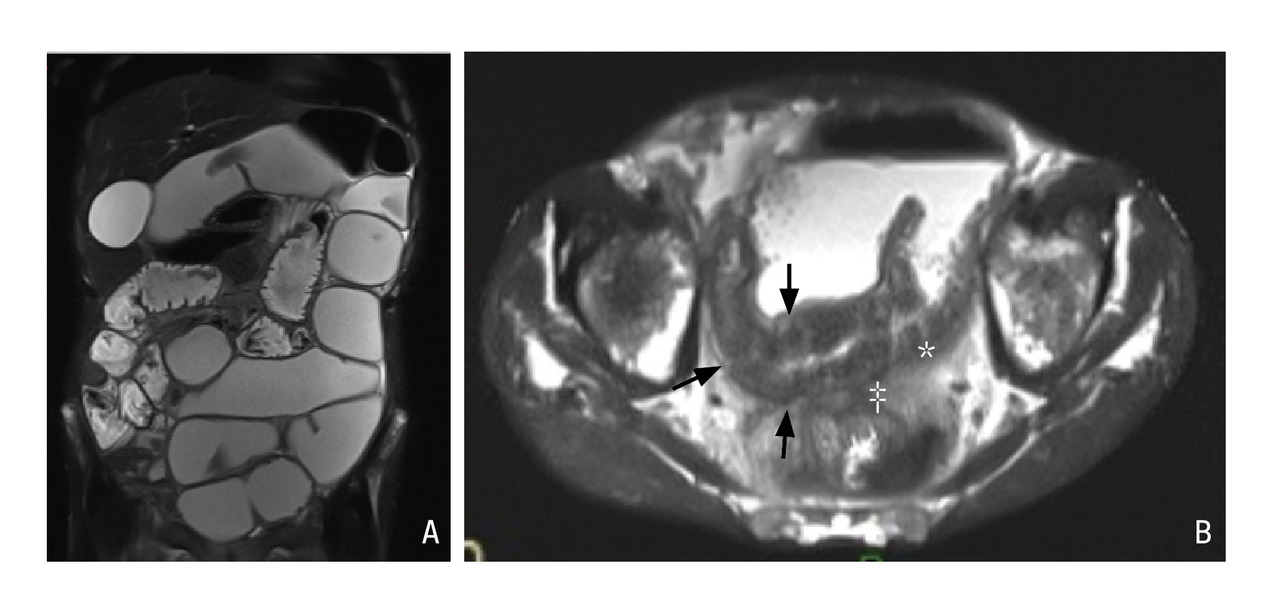
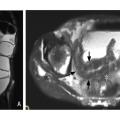
En pratique, les éléments les plus utiles pour l’évaluation de l’inflammation sont la recherche d’un hypersignal T2, témoin d’un œdème de la paroi, et la recherche de lésions muqueuses, en particulier d’ulcères ou de micro-abcès pariétaux (fig. 3).7
Comme à l’échographie, une hyperhémie ou un épaississement de la paroi au-delà de 4 mm sont considérés comme des signes d’inflammation pathologiques.7 Enfin, les séquences de diffusion facilitent le repérage des segments inflammatoires apparaissant en restriction de diffusion.
Dans le cas particulier de la sténose, le type de prise de contraste renseigne sur le degré de fibrose de la lésion : d’autant plus homogène que la sténose est fibreuse, et d’autant plus « en cocarde » ou stratifié au temps parenchymateux que la sténose est inflammatoire. Dans ce dernier cas, l’utilisation d’une biothérapie laisse présager d’une plus grande efficacité thérapeutique potentielle.
Comparable à l’endoscopie pour évaluer la réponse thérapeutique
À l’instar de l’échographie, l’entéro-IRM est une technique d’imagerie validée pour le suivi des sténoses, des fistules et des abcès au cours de la maladie de Crohn grêlique, ainsi que pour l’évaluation de la réponse thérapeutique.1 Ainsi, la concordance entre l’entéro-IRM et l’endoscopie dans la cicatrisation des ulcères de l’iléon terminal est de 90 %, et de 83 % pour l’évaluation de la cicatrisation endoscopique.8 Trois mois après l’introduction d’un nouveau traitement, les scores d’activité en entéro-IRM permettent une évaluation fiable de la réponse thérapeutique, avec des performances comparables à celle des scores d’activité endoscopique.8 En revanche, sa faible disponibilité ne permet pas son utilisation pour le diagnostic d’urgence des complications de la maladie de Crohn : d’autres modalités d’imagerie (TDM en particulier) lui sont ici préférées.1
Échographie et entéro-IRM : quand les réaliser ?
Après une modification thérapeutique, le délai au terme duquel juger de l’efficacité du traitement fait débat parmi les experts ; il dépend notamment du type de traitement et du type d’atteinte.2
Comme évoqué, des modifications sont observées précocement après l’instauration du traitement : dès la quatrième semaine en échographie et dès la douzième semaine en entéro-IRM.4,8 Cependant, en l’absence de signes précoces de réponse, le risque serait de conclure à tort et trop précocement à l’inefficacité du traitement. À titre de comparaison, l’évaluation endoscopique de l’efficacité se fait entre six et neuf mois après une modification thérapeutique ; l’amélioration des atteintes sténosantes est parmi les plus longues à se manifester en imagerie.2,4
De même, il n’existe pas aujourd’hui de consensus sur le rythme auquel il faut pratiquer les examens de surveillance. Les recommandations européennes proposent un intervalle de surveillance clinique de trois à six mois en fonction de la durée depuis laquelle le patient est en rémission. Dans le cadre de ce suivi, l’échographie paraît plus adaptée que l’IRM du fait de sa disponibilité, en complément des marqueurs biologiques.
Que dire à vos patients ?
Pour l’échographie du tube digestif, le jeûne n’est pas indispensable.
L’entéro-IRM est un examen plus contraignant que l’échographie, en particulier parce qu’il nécessite l’absorption de 1 à 1,5 L d’un mélange hyperosmolaire (polyéthylène glycol [PEG]) trente minutes avant l’examen, après une période de jeûne de quatre à six heures.
L’absence de symptômes au cours d’une MICI ne signifie pas une absence d’activité inflammatoire. Celle-ci doit être recherchée afin de prévenir les poussées et les complications.
2. Turner D, Ricciuto A, Lewis A, et al. STRIDE-II: An Update on the Selecting Therapeutic Targets in Inflammatory Bowel Disease (STRIDE) Initiative of the International Organization for the Study of IBD (IOIBD): Determining Therapeutic Goals for Treat-to-Target strategies in IBD. Gastroenterology 2021;160(5):1570-83.
3. Novak KL, Nylund K, Maaser C, et al. Expert Consensus on Optimal Acquisition and Development of the International Bowel Ultrasound Segmental Activity Score [IBUS-SAS]: A Reliability and Inter-rater Variability Study on Intestinal Ultrasonography in Crohn’s Disease. J Crohns Colitis 2021;15(4):609-16.
4. Yzet C, Aygalenq P, Joly JP, et al. Échographie et maladies inflammatoires chroniques de l’intestin. Hépato-Gastro & Oncologie Digestive 2021;28(6):706-12.
5. Allocca M, Fiorino G, Bonovas S, et al. Accuracy of Humanitas Ultrasound Criteria in Assessing Disease Activity and Severity in Ulcerative Colitis: A Prospective Study. J Crohns Colitis 2018;12(12):1385-91.
6. Taylor SA, Mallett S, Bhatnagar G, et al. Diagnostic accuracy of magnetic resonance enterography and small bowel ultrasound for the extent and activity of newly diagnosed and relapsed Crohn’s disease (METRIC): A multicentre trial. Lancet Gastroenterol Hepatol 2018;3(8):548-58.
7. Church PC, Turner D, Feldman BM, et al. Systematic review with meta-analysis: magnetic resonance enterography signs for the detection of inflammation and intestinal damage in Crohn’s disease. Aliment Pharmacol Ther 2015;41(2):153-66.
8. Ordás I, Rimola J, Rodríguez S, et al. Accuracy of magnetic resonance enterography in assessing response to therapy and mucosal healing in patients with Crohn’s disease. Gastroenterology 2014;146(2):374-82.

 Encadrés
Encadrés