La plupart des nodules thyroïdiens sont bénins et relèvent d’une surveillance clinique et échographique. Le diagnostic repose initialement sur l’évaluation clinique associée au dosage de la thyréostimuline (TSH), que complète parfois la scintigraphie mais le plus souvent l’échographie et, s’il est besoin, la cytoponction échoguidée. La thyroïdectomie totale s’impose pour les nodules suspects à l’issue de l’évaluation clinique, échographique et cytologique.
Un nodule thyroïdien correspond à une hypertrophie localisée s’individualisant au sein de la glande thyroïde (du latin nodulus, petit nœud). Il résulte de remaniements physiologiques liés au vieillissement de la thyroïde et de phénomènes adaptatifs aux conditions environnementales, comme la disponibilité en iode. Les nodules thyroïdiens sont détectés par la palpation cervicale chez 3 à 7 % des adultes (entre 20 et 76 % par l’évaluation échographique, et aux alentours de 50 % lors des enquêtes autopsiques). La prévalence s’accroît avec l’âge, le sexe féminin, la parité, en cas de déficience en iode, et après irradiation cervicale.1
La majorité des nodules thyroïdiens sont bénins (95 % des cas), correspondant à des adénomes ; ils apparaissent parfois isolés, s’inscrivent plus souvent dans le cadre de dystrophies thyroïdiennes diffuses progressivement constituées au fil des années. Environ 10 % des nodules bénins sont fonctionnels, captent l’iode et sont à risque de déterminer une hyperthyroïdie. Environ 5 % des nodules sont des cancers, ordinairement bien différenciés et de bon pronostic.
Diverses recommandations internationales,2, 3 les dernières en provenance de la Société française d’endocrinologie,4 ont permis d’apporter une vision plus claire quant aux modalités pratiques de l’évaluation et de la prise en charge des nodules thyroïdiens. Elles rationalisent les explorations, limitent les interventions chirurgicales à celles authentiquement justifiées et impliquent les patients dans le choix de la surveillance ou de la thérapeutique. Leur respect allège le poids des incidences médicolégales que font peser la méconnaissance de cancers évolutifs ou l’iatrogénie de traitements excessifs.
La majorité des nodules thyroïdiens sont bénins (95 % des cas), correspondant à des adénomes ; ils apparaissent parfois isolés, s’inscrivent plus souvent dans le cadre de dystrophies thyroïdiennes diffuses progressivement constituées au fil des années. Environ 10 % des nodules bénins sont fonctionnels, captent l’iode et sont à risque de déterminer une hyperthyroïdie. Environ 5 % des nodules sont des cancers, ordinairement bien différenciés et de bon pronostic.
Diverses recommandations internationales,2, 3 les dernières en provenance de la Société française d’endocrinologie,4 ont permis d’apporter une vision plus claire quant aux modalités pratiques de l’évaluation et de la prise en charge des nodules thyroïdiens. Elles rationalisent les explorations, limitent les interventions chirurgicales à celles authentiquement justifiées et impliquent les patients dans le choix de la surveillance ou de la thérapeutique. Leur respect allège le poids des incidences médicolégales que font peser la méconnaissance de cancers évolutifs ou l’iatrogénie de traitements excessifs.
Exploration des nodules thyroïdiens : de la clinique à l’imagerie
La prise en charge diagnostique d’un nodule thyroïdien repose initialement sur l’évaluation clinique, associée au dosage de la thyréostimuline ou TSH (thyroid-stimulating hormone) que complète parfois la scintigraphie mais le plus souvent l’échographie et, si besoin, la cytoponction échoguidée. Le but de cette évaluation initiale est de répondre à deux questions : le nodule est-il fonctionnel et responsable d’hyperthyroïdie ? Est-il suspect de malignité ?
L’évaluation clinique oriente l’étiologie
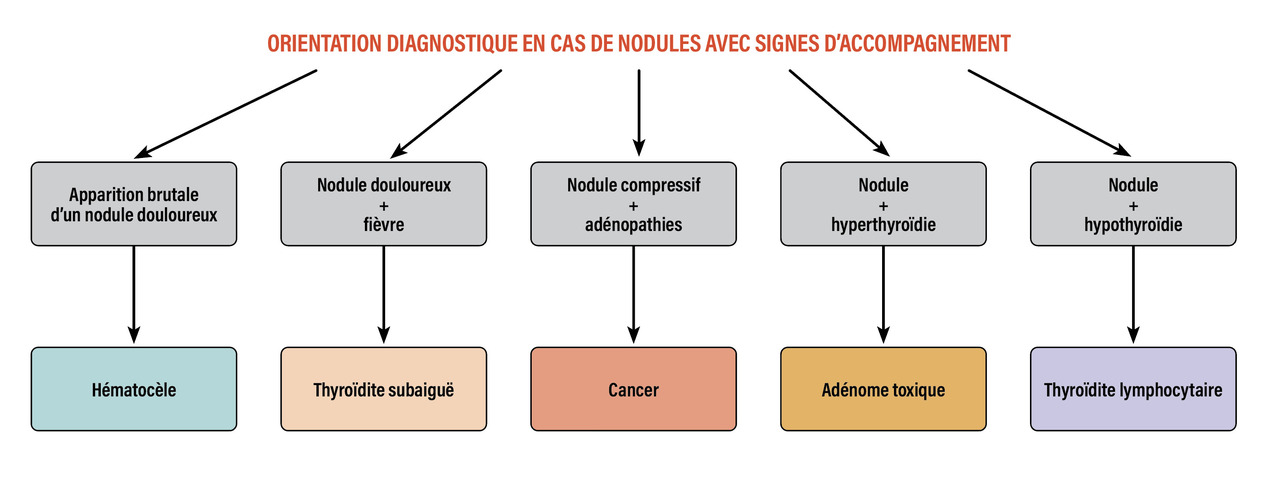
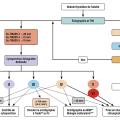
L’évaluation clinique est essentielle. Certaines circonstances de survenue orientent d’emblée vers une cause (fig. 1 ). Il est de règle de se méfier des nodules durs, irréguliers, rapidement évolutifs, compressifs. Les nodules sont plus suspects lorsqu’ils apparaissent chez l’homme, chez l’enfant et chez le sujet âgé, après irradiation externe ou dans certaines maladies générales (maladie de Cowden, polyadénomatose colique familiale isolée ou dans le cadre du syndrome de Gardner, complexe de Carney, maladie de von Recklinghausen, syndrome de McCune-Albright, syndrome DICER, etc.). Aucune situation inaugurale ne peut justifier de s’en tenir à une approche purement clinique.
Une douleur brutale évoque une hématocèle
Un nodule douloureux, d’apparition brutale est très évocateur d’une hématocèle, qui peut être pure ou correspondre à des remaniements hémorragiques au sein d’une lésion préexistante. Même si cette survenue brutale inquiète le patient, les hématocèles pures sont bénignes et sont, s’il est besoin, rapidement soulagées par la ponction évacuatrice. Les hématocèles récidivantes compliquant des nodules solides sont cependant à redouter ; elles correspondent dans 10 % des cas environ à des lésions cancéreuses (cystadénocarcinomes papillaires surtout).Thyroïdite aiguë infectieuse rare et en contexte particulier
La thyroïdite aiguë par infection bactérienne est une situation rare, survenant dans un contexte particulier (immunodépression, au décours d’infections régionales infantiles, fistule locale avec les voies aériennes, etc.). Elle se révèle alors sous forme d’une tuméfaction localisée extrêmement douloureuse dans un contexte fébrile. Au stade d’abcès, la ponction permet parfois l’identification du germe en cause.Thyroïdite subaiguë très inflammatoire
La thyroïdite subaiguë (ou thyroïdite de De Quervain ou de Crile) peut se présenter initialement sous forme d’une hypertrophie nodulaire unilatérale extrêmement douloureuse avec souvent une otalgie évoluant dans un contexte fébrile, s’accompagnant parfois de signes thyrotoxiques. Cette situation est précédée typiquement d’un épisode d’allure grippale. La protéine C-réactive (CRP) est élevée, témoignant de l’importance du syndrome inflammatoire.Thyroïdites lymphocytaires chroniques
Dans les thyroïdites lymphocytaires chroniques, l’accentuation de la lobulation thyroïdienne et la constitution de nodules sont possibles. Une TSH haute et l’accroissement du taux des anticorps antithyroperoxydase (Ac anti-TPO) et/ou des anticorps antithyroglobuline (Ac anti-Tg) étayent le diagnostic ; l’échographie permet souvent de distinguer les pseudonodules (qui ne refoulent pas les vaisseaux) d’authentiques nodules associés, souvent liés à la thyroïdite, même si leur nature maligne ou fonctionnelle n’est pas exclue.Nodule toxique
Le nodule autonome n’est cliniquement parlant qu’au stade de nodule toxique (responsable d’hyperthyroïdie).Évaluation biologique : dosage de la TSH impératif
Détecter une dysfonction thyroïdienne
Seul le dosage initial de la TSH s’impose.2, 5 Il permet de détecter précocement une dysfonction thyroïdienne, même subclinique :– une TSH élevée oriente vers un contexte de thyroïdite lymphocytaire. Alors seulement se justifie la mesure du taux des Ac anti-TPO et, si celui-ci est normal, des Ac anti-Tg. La difficulté est de préciser la signification du nodule dans ce contexte de thyroïdite lymphocytaire (dans lequel la lecture des informations échographiques et cytologiques est malaisée) : nodule ou pseudonodule de thyroïdite, nodule carcinomateux (3 à 4 % des cas), nodule « vicariant » correspondant à un parenchyme sain préservé par le processus de thyroïdite captant électivement l’iode123 ou le technétium et régressif sous traitement hormonal substitutif ; quant au lymphome, il est souvent rapidement diffus, avec une hypoéchogénicité marquée à l’échographie ;
– une TSH basse est suggestive d’un nodule fonctionnel, producteur d’hormone thyroïdienne. La confirmation en est obtenue typiquement par la scintigraphie thyroïdienne, même si l’évaluation en écho-Doppler couleur révèle aussi des aspects d’hypervascularisation centrale orientant vers cette situation ;
– si la TSH est normale, l’enjeu est de déterminer la nature bénigne ou maligne de cette formation sans dysfonction hormonale. La très grande majorité de ces tumeurs sont bénignes, mais les évaluations échographiques et, si besoin, cytologiques (
Dosage de la calcitonine au cas par cas
L’intérêt du dosage de la calcitonine (CT) fait encore l’objet de débats.1, 6En effet, une augmentation franche de la calcitonine circulante (supérieure à 100 pg/mL), corrélée au volume d’un nodule souvent situé à la partie externe de la jonction tiers moyen-tiers supérieur d’un lobe, oriente avec certitude vers le cancer médullaire de la thyroïde (CMT), lequel impose la chirurgie, conditionne le choix de la thyroïdectomie totale et d’un curage lymphatique adapté à confier à un chirurgien spécialisé.
Des élévations modérées de CT (20 à 100 pg/mL) sont une source d’ambiguïté, celles-ci pouvant résulter de microcarcinomes médullaires ou d’hyperplasies des cellules C ; elles sont favorisées par le tabagisme, l’obésité, elles sont aussi présentes dans l’insuffisance rénale, de rares tumeurs non thyroïdiennes, la pseudohypoparathyroïdie de type 1, ou évoquées dans les hypergastrinémies.
En pratique, le dosage de la CT est indispensable en cas de contexte familial de néoplasie endocrinienne multiple de type 2 (NEM 2) ou de CMT, de diarrhée motrice ou de flush, de suspicion de malignité, et avant toute thyroïdectomie. Une détection précoce du CMT joue un rôle primordial dans l’amélioration de son pronostic.6
Dosage de la thyroglobuline dans la surveillance postopératoire
La thyroglobuline (Tg) circulante ne constitue pas un marqueur de malignité. En pratique, sa détermination est simplement utile dans la surveillance des nodules cancéreux opérés (de manière anecdotique, dans l’évaluation étiologique des cancers métastatiques au niveau pulmonaire ou osseux, les taux de Tg sont très accrus dans les métastases diffuses des cancers thyroïdiens, si bien qu’une valeur modeste exclut la responsabilité d’éventuels nodules ou micronodules de la thyroïde).L’évaluation échographique caractérise le nodule
L’échographie est devenue l’examen d’imagerie de référence du nodule thyroïdien tant pour la détection, le diagnostic, la recherche de signes de malignité que pour la surveillance.5 Elle précise si la formation nodulaire palpée est unique ou s’associe déjà à une dystrophie nodulaire du reste de la glande. Elle apporte aussi des informations sur les caractéristiques du nodule : situation, dimensions, forme, échogénicité, contours.
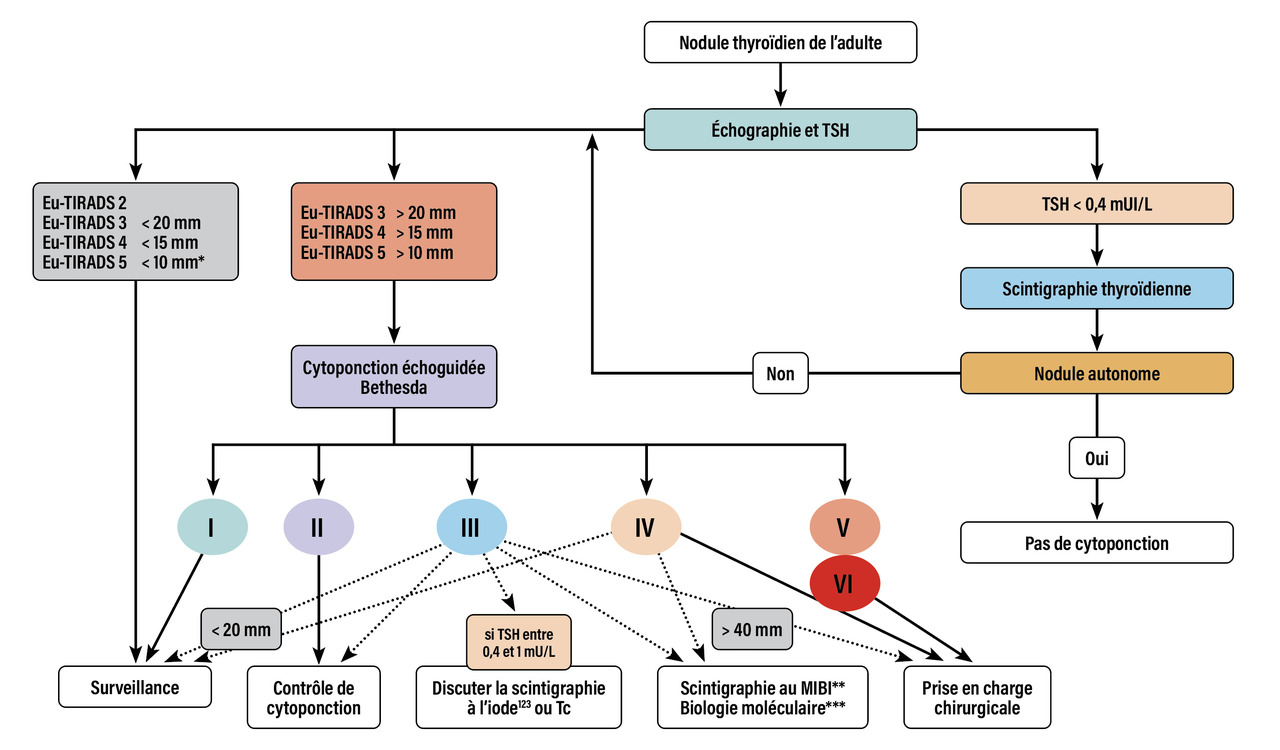
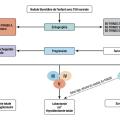
Les principaux signes échographiques de suspicion de malignité figurent dans la stratification et la codification du risque proposées en France par le Dr Gilles Russ (système Thyroid imaging-reporting and data system, TIRADS), puis adoptées au plan européen en 2017 (EU-TIRADS).7 Le caractère hyperéchogène ou anéchogène du nodule est ainsi plutôt en faveur de sa bénignité. À l’inverse sont suspects : le caractère solide hypoéchogène, la forme arrondie (nodule plus épais que large), l’irrégularité des contours, la présence de microcalcifications ou d’adénopathies. La classification échographique EU-TIRADS du risque de malignité permet également de guider l’indication de la réalisation d’une cytoponction (fig. 2 ).
Les principaux signes échographiques de suspicion de malignité figurent dans la stratification et la codification du risque proposées en France par le Dr Gilles Russ (système Thyroid imaging-reporting and data system, TIRADS), puis adoptées au plan européen en 2017 (EU-TIRADS).7 Le caractère hyperéchogène ou anéchogène du nodule est ainsi plutôt en faveur de sa bénignité. À l’inverse sont suspects : le caractère solide hypoéchogène, la forme arrondie (nodule plus épais que large), l’irrégularité des contours, la présence de microcalcifications ou d’adénopathies. La classification échographique EU-TIRADS du risque de malignité permet également de guider l’indication de la réalisation d’une cytoponction (
Évaluation cytologique grâce à la cytoponction échoguidée
L’évaluation cytologique à l’aide de la cytoponction échoguidée est l’outil diagnostique de base pour les nodules thyroïdiens. Deux ou trois ponctions sont effectuées au niveau de chaque nodule à évaluer. Le matériel recueilli est étalé sur lames ou analysé en phase liquide. La présentation des résultats est standardisée selon la classification Bethesda (Tableau ).8,9 De nouvelles ponctions peuvent être proposées soit de principe après quelques mois ou un an, soit en cas d’évolutivité morphologique du nodule : apparition de caractéristiques cliniques ou échographiques suspectes, augmentation de taille en un an supérieure à 20 % du plus grand diamètre ou supérieure à 2 mm dans deux diamètres.7 Elles sont aussi répétées en cas de prélèvement non contributif (Bethesda I) ou de lésion vésiculaire de signification indéterminée (Bethesda III).
Les études en immunocytochimie ont quelques indications reconnues, dans l’affirmation de certaines tumeurs médullaires ou neuroendocrines (étude de l’immunoréactivité vis-à-vis de la CT, antigène carcino-embryonnaire [ACE], synaptophysine, chromogranine), tumeurs anaplasiques (disparition de l’expression de TTF1 [thyroid transcription factor-1] et de Tg), lymphomes (cytométrie de flux), métastases (présence de TTF1 en cas de tumeur pulmonaire ou thyroïdienne), la reconnaissance de tissu parathyroïdien (TTF1, Tg, PTH [parathormone]). L’apport de l’immunocytochimie pour la reconnaissance des tumeurs folliculaires (galectine, HBME1, DPP4 [dipeptidyl-peptidase 4], TPO [thyroperoxydase]…) est considéré comme insuffisamment performant.5
Ces dernières années, une approche prometteuse a été développée afin d’améliorer l’évaluation diagnostique des nodules dont l’analyse cytologique est indéterminée (catégories III, IV et V de Bethesda). Il s’agit de rechercher, sur le produit de ponction à l’aiguille fine, des anomalies moléculaires permettant de confirmer ou d’exclure la malignité. La mutation V600E de BRAF est, par exemple, très spécifique des cancers papillaires. D’autres mutations peuvent être recherchées : réarrangements chromosomiques RET-PTC ou PAX8/PPARγ, mutations de RAS et du promoteur de TERT, etc. Les données de la littérature démontrent néanmoins que les analyses moléculaires se limitant au séquençage d’un nombre restreint de gènes n’ont pas de performances suffisantes pour être utilisées à visée diagnostique. Les technologies de séquençage à haut débit (next generation sequencing) ont en revanche permis aux industriels de développer des tests performants (ThyroSeq, Afirma GSC + Xpression Atlas, ThyGeNEXT/ ThyraMIR), qui restent malheureusement très coûteux et non commercialisés en France. Les évaluations de biologie moléculaire ne sont donc pas recommandées en routine (fig. 2 ).4, 10
Les études en immunocytochimie ont quelques indications reconnues, dans l’affirmation de certaines tumeurs médullaires ou neuroendocrines (étude de l’immunoréactivité vis-à-vis de la CT, antigène carcino-embryonnaire [ACE], synaptophysine, chromogranine), tumeurs anaplasiques (disparition de l’expression de TTF1 [thyroid transcription factor-1] et de Tg), lymphomes (cytométrie de flux), métastases (présence de TTF1 en cas de tumeur pulmonaire ou thyroïdienne), la reconnaissance de tissu parathyroïdien (TTF1, Tg, PTH [parathormone]). L’apport de l’immunocytochimie pour la reconnaissance des tumeurs folliculaires (galectine, HBME1, DPP4 [dipeptidyl-peptidase 4], TPO [thyroperoxydase]…) est considéré comme insuffisamment performant.5
Ces dernières années, une approche prometteuse a été développée afin d’améliorer l’évaluation diagnostique des nodules dont l’analyse cytologique est indéterminée (catégories III, IV et V de Bethesda). Il s’agit de rechercher, sur le produit de ponction à l’aiguille fine, des anomalies moléculaires permettant de confirmer ou d’exclure la malignité. La mutation V600E de BRAF est, par exemple, très spécifique des cancers papillaires. D’autres mutations peuvent être recherchées : réarrangements chromosomiques RET-PTC ou PAX8/PPARγ, mutations de RAS et du promoteur de TERT, etc. Les données de la littérature démontrent néanmoins que les analyses moléculaires se limitant au séquençage d’un nombre restreint de gènes n’ont pas de performances suffisantes pour être utilisées à visée diagnostique. Les technologies de séquençage à haut débit (next generation sequencing) ont en revanche permis aux industriels de développer des tests performants (ThyroSeq, Afirma GSC + Xpression Atlas, ThyGeNEXT/ ThyraMIR), qui restent malheureusement très coûteux et non commercialisés en France. Les évaluations de biologie moléculaire ne sont donc pas recommandées en routine (
Évaluations scintigraphiques en seconde intention
Les évaluations scintigraphiques trouvent une place lorsque l’abord échographique est difficile ou impossible chez les personnes âgées ou voûtées, en cas de nodule plongeant en arrière du plastron sternal, de cytoponctions non réalisables du fait d’altérations sévères des fonctions d’hémostase. La scintigraphie (technétium ou iode123) a été considérée comme un examen désuet sans indication de première intention, sauf en cas de TSH basse (fig. 2 ). En effet, le caractère fixant du nodule est en faveur de sa bonne différenciation et de la bénignité. La majorité des nodules sont hypofixants (80 à 90 % des cas) dont seuls 5 à 15 % sont malins, ce qui fait de la scintigraphie une exploration moins discriminante que la conjonction des évaluations clinique, échographique et cytologique.
Si le taux de TSH est diminué (inférieur à 0,4 mU/L) et même s’il se situe dans les valeurs basses des normes (entre 4 et 10 mU/L), la scintigraphie (utilisant idéalement l’iode123) peut repérer le caractère fonctionnel du nodule, captant les isotopes et partiellement extinctif vis-à-vis du reste du parenchyme thyroïdien. Le patient est alors à risque d’évoluer vers la thyrotoxicose, ce qui s’observe lorsque la taille du nodule excède 2 à 3 cm. Le recours actuel ou futur au traitement radio-isotopique est envisageable.
Se généralise la pratique de scintigraphies dites « de seconde intention » (fig. 2 ) lorsque la répétition des ponctions n’obtient pas de matériel suffisant (Bethesda I) ou conduit à des résultats considérés comme indéterminés (surtout Bethesda III ou IV). La fixation du technétium ou de l’iode123 laisse penser que le tissu thyroïdien est différencié, et non massivement malin. L’examen peut être couplé à l’étude de la fixation du technétium-99m (99mTc)-MIBI (méthoxy-isobutyl-isonitrite, ou plus simplement MIBI), électivement capté par les cellules en division : la fixation du MIBI constitue un indice de la cellularité des nodules. Le risque de malignité est faible, estimé à moins de 15 % pour les nodules captant l’iode, entre 0 et 5 % pour les nodules ne captant pas le MIBI ; à l’inverse, il avoisine 40 % en cas de nodule hypofixant à l’iode et captant le MIBI.11
Si le taux de TSH est diminué (inférieur à 0,4 mU/L) et même s’il se situe dans les valeurs basses des normes (entre 4 et 10 mU/L), la scintigraphie (utilisant idéalement l’iode123) peut repérer le caractère fonctionnel du nodule, captant les isotopes et partiellement extinctif vis-à-vis du reste du parenchyme thyroïdien. Le patient est alors à risque d’évoluer vers la thyrotoxicose, ce qui s’observe lorsque la taille du nodule excède 2 à 3 cm. Le recours actuel ou futur au traitement radio-isotopique est envisageable.
Se généralise la pratique de scintigraphies dites « de seconde intention » (
Prise en charge thérapeutique en manque de codification
Les stratégies thérapeutiques des nodules thyroïdiens sont imparfaitement codifiables. Elles dépendent de l’ensemble des informations recueillies par l’enquête clinique et les explorations, des habitudes des thérapeutes, du contexte général, de la psychologie du malade et du médecin.1,11,12
Thyroïdectomie totale, le plus souvent pour les nodules suspects
La chirurgie s’impose pour tous les nodules qui apparaissent suspects à l’issue de l’évaluation clinique, échographique et cytologique, parfois des données scintigraphiques ou en raison de l’accroissement franc du taux de la CT (supérieur à 100 pg/mL) corrélé avec la taille du nodule. En ces circonstances, l’intervention consiste ordinairement en une thyroïdectomie totale, avec un curage ganglionnaire adapté aux circonstances, notamment à l’évaluation échographique préopératoire.
En l’absence d’atteinte thyroïdienne controlatérale, d’atteinte ganglionnaire, et pour des cancers de petite taille, la lobectomie-isthmectomie peut se discuter.4
La chirurgie a aussi des indications pour des nodules volumineux, disgracieux, compressifs, hyperfonctionnels, plongeants ou endothoraciques, ou en cas d’adhésion insuffisante à la surveillance.4,1,12
Le patient doit être informé des risques opératoires (hématome, atteinte récurrentielle ou parathyroïdienne notamment, fistule chyleuse), avisé de la cicatrice, de l’opportunité de l’hormonothérapie thyroïdienne, de la prolongation de la surveillance et parfois de traitements complémentaires.
En alternative à la chirurgie ouverte par cervicotomie médiane sont proposés, dans certains centres spécialisés, la chirurgie endoscopique mini-invasive vidéo-assistée par voie cervicale ou endobuccale, ou robot-assistée par voie axillaire.
En l’absence d’atteinte thyroïdienne controlatérale, d’atteinte ganglionnaire, et pour des cancers de petite taille, la lobectomie-isthmectomie peut se discuter.4
La chirurgie a aussi des indications pour des nodules volumineux, disgracieux, compressifs, hyperfonctionnels, plongeants ou endothoraciques, ou en cas d’adhésion insuffisante à la surveillance.4,1,12
Le patient doit être informé des risques opératoires (hématome, atteinte récurrentielle ou parathyroïdienne notamment, fistule chyleuse), avisé de la cicatrice, de l’opportunité de l’hormonothérapie thyroïdienne, de la prolongation de la surveillance et parfois de traitements complémentaires.
En alternative à la chirurgie ouverte par cervicotomie médiane sont proposés, dans certains centres spécialisés, la chirurgie endoscopique mini-invasive vidéo-assistée par voie cervicale ou endobuccale, ou robot-assistée par voie axillaire.
Surveillance, progressivement espacée
La surveillance constitue une alternative à la chirurgie.4 Elle est proposée en l’absence d’élément immédiatement suspect. Elle est clinique, biologique (contrôle annuel de la TSH) et échographique ; elle est complétée par un nouvel examen cytologique de principe après quelques mois ou en cas d’évolutivité morphologique. Pour éviter une médicalisation excessive et inutile des nodules en apparence bénins, une surveillance progressivement espacée est recommandée : par exemple après six mois, un an, deux ans, cinq ans, dix ans…
La majorité des nodules sont stables. Une augmentation lente et progressive de leur taille ne remet pas en cause leur bénignité. Seuls sont considérés comme suspects les accroissements du plus grand diamètre et du volume supérieurs à 20 % en un an.
Pour les formations nodulaires initialement considérées comme bénignes, cliniquement et cytologiquement, l’évidence secondaire d’une malignité est possible mais rare : elle est estimée entre 0,85 et 2 %.5
La majorité des nodules sont stables. Une augmentation lente et progressive de leur taille ne remet pas en cause leur bénignité. Seuls sont considérés comme suspects les accroissements du plus grand diamètre et du volume supérieurs à 20 % en un an.
Pour les formations nodulaires initialement considérées comme bénignes, cliniquement et cytologiquement, l’évidence secondaire d’une malignité est possible mais rare : elle est estimée entre 0,85 et 2 %.5
Traitement hormonal, encore discuté
Le traitement hormonal frénateur possède une efficacité et une innocuité discutées. Dans l’enquête française du Groupe recherche thyroïde, la lévothyroxine à posologie frénatrice, en comparaison à un placebo, a obtenu une régression plus fréquente des nodules (60 % versus 41 %) et la moindre progression de la dystrophie périnodulaire.13
Techniques mini-invasives : alcoolisation et thermoablation
Durant ses dernières années se sont développées progressivement des techniques de destruction de nodules cytologiquement bénins dites « mini-invasives », par des injections répétées d’alcool absolu pour les nodules kystiques, ou par thermoablation pour les nodules solides, avec plusieurs techniques disponibles (principalement radiofréquence, laser et micro-ondes).14
Situations particulières
Chez l’enfant, un risque de malignité majoré
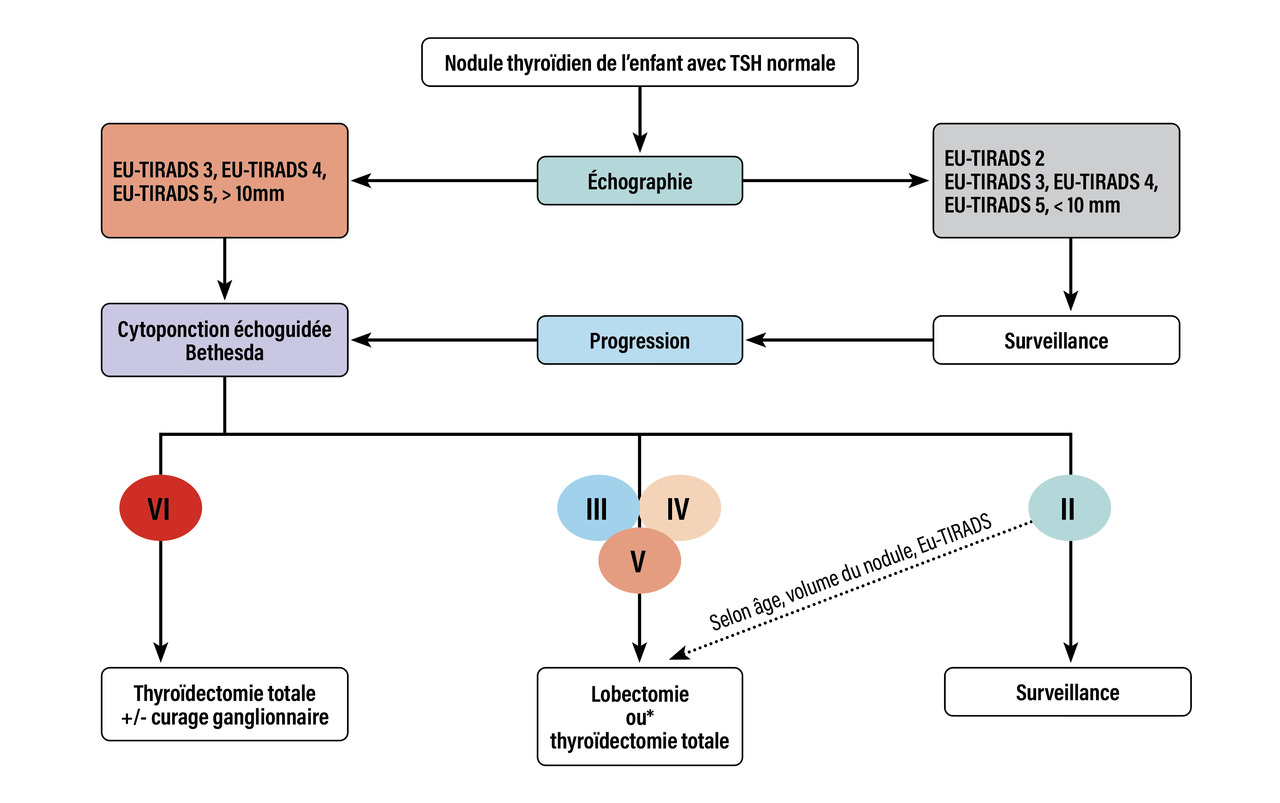
Les nodules thyroïdiens sont plus rares chez l’enfant que chez l’adulte, avec une prévalence difficile à estimer, entre 0,2 et 5 %. Cependant, le risque de malignité est estimé à 20 %, avec un risque particulier chez le garçon, avant l’âge de 10 ans et à distance d’irradiation.1
En raison de ce risque de malignité majoré chez l’enfant, la prise en charge diagnostique diffère un peu de celle de l’adulte. Elle a été actualisée dans les dernières recommandations de la Société française d’endocrinologie (fig. 3 ).4 La majorité de ces cancers sont des carcinomes papillaires, dont le pronostic chez l’enfant est excellent. Si l’indication opératoire est retenue, la thyroïdectomie totale réalisée par un chirurgien spécialisé est privilégiée en cas de dystrophie diffuse détectée à l’échographie. Les risques des interventions sont alors similaires à ceux observés chez l’adulte.
En raison de ce risque de malignité majoré chez l’enfant, la prise en charge diagnostique diffère un peu de celle de l’adulte. Elle a été actualisée dans les dernières recommandations de la Société française d’endocrinologie (
La grossesse n’influe pas sur le pronostic du cancer thyroïdien
La grossesse favorise l’augmentation du volume de la thyroïde et son remaniement nodulaire. Environ 1 femme sur 1 000 en âge de procréer est porteuse d’un cancer thyroïdien palpable à forme nodulaire. Cependant, les enquêtes épidémiologiques n’ont pas démontré que la grossesse constituait en elle-même un facteur modifiant l’évolution ou le pronostic du cancer thyroïdien. Les performances de la cytologie restent évidentes et ne sont en rien altérées par l’état gravide. Cet examen conserve sa primauté lorsque les caractéristiques cliniques et échographiques de la formation le justifient. Beaucoup des formations cliniquement, échographiquement, cytologiquement tranquilles peuvent bénéficier, durant la grossesse, de la seule surveillance. En revanche, la chirurgie peut être proposée au deuxième trimestre lorsqu’un nodule malin ou suspect est découvert en début de grossesse. Il est recommandé d’attendre le terme pour les formations suspectes découvertes plus tardivement.15
Maladie de Basedow, souvent associée à des nodules thyroïdiens
Chez 30 à 50 % des patients consultant pour une maladie de Basedow, des nodules thyroïdiens sont découverts à l’occasion d’une échographie. Dans une méta-analyse de 33 études, la proportion de cancers a été estimée à 0,07 %. De plus, leur pronostic n’est pas altéré par le contexte de thyroïdite ou l’expression des anticorps anti-récepteurs de la TSH.1 La majorité correspond à des microcarcinomes papillaires qui ne modifient pas la prise en charge de la maladie de Basedow. En revanche, les nodules de plus de 1 cm de diamètre méritent une évaluation. En fonction de leurs caractéristiques, une exérèse chirurgicale peut être recommandée. Le contexte de thyropathie auto-immune engendre des difficultés d’interprétation des données cytologiques.
La situation particulière du syndrome de Marine-Lenhart mérite d’être connue :1 cette entité rare correspond à la coïncidence d’un nodule toxique et d’une maladie de Basedow. Le renforcement de la fixation au niveau nodulaire n’apparaît pas nécessairement évident d’emblée lors de la scintigraphie à l’iode. Cet état, qui n’est pas guéri par le traitement médical prolongé, nécessite des doses plus élevées d’iode131 si, de préférence à la chirurgie, le traitement radio-isotopique est choisi.
La situation particulière du syndrome de Marine-Lenhart mérite d’être connue :1 cette entité rare correspond à la coïncidence d’un nodule toxique et d’une maladie de Basedow. Le renforcement de la fixation au niveau nodulaire n’apparaît pas nécessairement évident d’emblée lors de la scintigraphie à l’iode. Cet état, qui n’est pas guéri par le traitement médical prolongé, nécessite des doses plus élevées d’iode131 si, de préférence à la chirurgie, le traitement radio-isotopique est choisi.
Un nodule thyroïdien est d’abord suspect d’être bénin
La très grande majorité des nodules thyroïdiens sont bénins, et le resteront (stabilisation dans un tiers des cas, régression spontanée dans un tiers des cas, et augmentation dans un tiers des cas). Les nodules hyperfonctionnels sont à risque d’évolution vers une hyperthyroïdie et ne sont pratiquement jamais malins. Le risque carcinologique des nodules thyroïdiens est défini en échographie selon la classification EU-TIRADS, et en cytologie selon la classification de Bethesda. Le dosage de la TSH est le premier examen à réaliser en cas de nodule thyroïdien. La majorité des nodules thyroïdiens peuvent bénéficier de la seule surveillance. La probabilité de bénignité est à remettre en cause en présence de certaines présentations cliniques, des informations échographiques (EU-TIRADS 4 ou 5) et cytologiques (Bethesda IV, V ou VI), des données scintigraphiques (ne captant pas l’iode, fixant le MIBI), et enfin de l’évolution dans le temps. La lobectomie-isthmectomie ne constitue pas un procédé diagnostique et thérapeutique satisfaisant des nodules thyroïdiens (inutile si la formation est bénigne et souvent inadaptée si le nodule est malin). Un dosage de la calcitonine est à réaliser de manière systématique avant toute chirurgie thyroïdienne.
Références
1. Wemeau JL. Nodule thyroïdien. Les maladies de la thyroïde. Elsevier Masson; 2022, p. 79-92.
2. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association Guidelines Task Force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016;26:1-133.
3. Lee JY, Baek JH, Ha EJ, Sung JY, Shin JH, Kim J, et al. 2020 Imaging guidelines for thyroid nodules and differentiated thyroid cancer: Korean Society of Thyroid Radiology. Korean J Radiol 2021;22:840.
4. Borson-Chazot F, Buffet C, Decaussin-Petrucci M, Do Cao C, Drui D, Leboulleux S, et al. The SFE-AFCE-SFMN 2022 consensus deals with the management of thyroid nodules. Section 11: Synthesis and algorithms. Annales d’Endocrinologie 2022:S0003426622008605.
5. Tramalloni J, Wemeau JL. Consensus français sur la prise en charge du nodule thyroïdien : ce que le radiologue doit connaître. EMC - Radiologie et imagerie médicale : Cardiovasculaire - Thoracique - Cervicale 2012;7:1–18.
6. Elisei R. Routine serum calcitonin measurement in the evaluation of thyroid nodules. Best Practice & Research Clinical Endocrinology & Metabolism 2008;22:941-53.
7. Russ G, Bonnema SJ, Erdogan MF, Durante C, Ngu R, Leenhardt L. European Thyroid Association guidelines for ultrasound malignancy risk stratification of thyroid nodules in adults: The EU-TIRADS. Eur Thyroid J 2017;6:225-37.
8. Cibas ES, Ali SZ. The 2017 Bethesda system for reporting thyroid cytopathology. Thyroid 2017;27:1341-6.
9. Baloch ZW, LiVolsi VA, Asa SL, Rosai J, Merino MJ, Randolph G, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: A synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol 2008;36:425-37.
10. Nylén C, Mechera R, Maréchal-Ross I, Tsang V, Chou A, Gill AJ, et al. Molecular markers guiding thyroid cancer management. Cancers 2020;12:2164.
11. Benderradji H, Beron A, Wémeau J-L, Carnaille B, Delcroix L, Do Cao C, et al. Quantitative dual isotope 123iodine/99mTc-MIBI scintigraphy: A new approach to rule out malignancy in thyroid nodules. Annales d’Endocrinologie 2021;82:83-91.
12. Grani G, Sponziello M, Pecce V, Ramundo V, Durante C. Contemporary thyroid nodule evaluation and management. The Journal of Clinical Endocrinology & Metabolism 2020;105:2869–83.
13. Wemeau JL, Caron P, Schvartz C, Schlienger J-L, Orgiazzi J, Cousty C, et al. Effects of thyroid-stimulating hormone suppression with levothyroxine in reducing the volume of solitary thyroid nodules and improving extranodular nonpalpable changes: A randomized, double-blind, placebo-controlled trial by the French Thyroid Research Group. The Journal of Clinical Endocrinology & Metabolism 2002;87:4928-34.
14. Tramalloni J, Monpeyssen H. Échographie thyroïdienne et parathyroïdienne. 3e éd. Issy-les-Moulineaux: Elsevier Masson; 2021.
15. Papaleontiou M, Haymart MR. Thyroid nodules and cancer during pregnancy, post-partum and preconception planning: Addressing the uncertainties and challenges. Best Practice & Research Clinical Endocrinology & Metabolism 2020;34:101363.
2. Haugen BR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, Nikiforov YE, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association Guidelines Task Force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016;26:1-133.
3. Lee JY, Baek JH, Ha EJ, Sung JY, Shin JH, Kim J, et al. 2020 Imaging guidelines for thyroid nodules and differentiated thyroid cancer: Korean Society of Thyroid Radiology. Korean J Radiol 2021;22:840.
4. Borson-Chazot F, Buffet C, Decaussin-Petrucci M, Do Cao C, Drui D, Leboulleux S, et al. The SFE-AFCE-SFMN 2022 consensus deals with the management of thyroid nodules. Section 11: Synthesis and algorithms. Annales d’Endocrinologie 2022:S0003426622008605.
5. Tramalloni J, Wemeau JL. Consensus français sur la prise en charge du nodule thyroïdien : ce que le radiologue doit connaître. EMC - Radiologie et imagerie médicale : Cardiovasculaire - Thoracique - Cervicale 2012;7:1–18.
6. Elisei R. Routine serum calcitonin measurement in the evaluation of thyroid nodules. Best Practice & Research Clinical Endocrinology & Metabolism 2008;22:941-53.
7. Russ G, Bonnema SJ, Erdogan MF, Durante C, Ngu R, Leenhardt L. European Thyroid Association guidelines for ultrasound malignancy risk stratification of thyroid nodules in adults: The EU-TIRADS. Eur Thyroid J 2017;6:225-37.
8. Cibas ES, Ali SZ. The 2017 Bethesda system for reporting thyroid cytopathology. Thyroid 2017;27:1341-6.
9. Baloch ZW, LiVolsi VA, Asa SL, Rosai J, Merino MJ, Randolph G, et al. Diagnostic terminology and morphologic criteria for cytologic diagnosis of thyroid lesions: A synopsis of the National Cancer Institute Thyroid Fine-Needle Aspiration State of the Science Conference. Diagn Cytopathol 2008;36:425-37.
10. Nylén C, Mechera R, Maréchal-Ross I, Tsang V, Chou A, Gill AJ, et al. Molecular markers guiding thyroid cancer management. Cancers 2020;12:2164.
11. Benderradji H, Beron A, Wémeau J-L, Carnaille B, Delcroix L, Do Cao C, et al. Quantitative dual isotope 123iodine/99mTc-MIBI scintigraphy: A new approach to rule out malignancy in thyroid nodules. Annales d’Endocrinologie 2021;82:83-91.
12. Grani G, Sponziello M, Pecce V, Ramundo V, Durante C. Contemporary thyroid nodule evaluation and management. The Journal of Clinical Endocrinology & Metabolism 2020;105:2869–83.
13. Wemeau JL, Caron P, Schvartz C, Schlienger J-L, Orgiazzi J, Cousty C, et al. Effects of thyroid-stimulating hormone suppression with levothyroxine in reducing the volume of solitary thyroid nodules and improving extranodular nonpalpable changes: A randomized, double-blind, placebo-controlled trial by the French Thyroid Research Group. The Journal of Clinical Endocrinology & Metabolism 2002;87:4928-34.
14. Tramalloni J, Monpeyssen H. Échographie thyroïdienne et parathyroïdienne. 3e éd. Issy-les-Moulineaux: Elsevier Masson; 2021.
15. Papaleontiou M, Haymart MR. Thyroid nodules and cancer during pregnancy, post-partum and preconception planning: Addressing the uncertainties and challenges. Best Practice & Research Clinical Endocrinology & Metabolism 2020;34:101363.