L’environnement et les comportements individuels influent davantage sur le risque de cancer colorectal (CCR) que l’hérédité. La moitié des CCR sont liés à des facteurs de risque modifiables associés au mode de vie occidental tels que sédentarité, malbouffe, tabagisme et obésité. Le dépistage s’avère finalement le moyen le plus efficient de réduire le risque.
Avec plus de 43 000 nouveaux cas et 17 000 décès en 2018 en France, le cancer colorectal (CCR) est le 3e cancer le plus fréquent et la 2e cause de mortalité par cancer.1 Bon nombre de ces CCR et de ces décès sont évitables. L’hérédité joue un rôle moindre qu’environnement et comportement dans la genèse des CCR : 9 à 40 % d’entre eux sont attribués à des facteurs héréditaires, alors que la moitié sont liés à des facteurs de risque environnementaux et comportementaux modifiables associés au mode de vie occidental tels que sédentarité, malbouffe et obésité.2, 3
Dans notre pays, les recommandations de dépistage reposent sur le cahier des charges du programme national de dépistage organisé (DO) du CCR : DO par test immunochimique fécal (TIF) de recherche de sang occulte pour la population âgée de 50 à 74 ans à risque moyen ; dépistage opportuniste par coloscopie pour la population à risque élevé et très élevé.
Ces recommandations s’appuient sur trois niveaux de risque de CCR (moyen, élevé et très élevé) dont la définition est inchangée depuis 2002.4, 5 Pourtant, les connaissances ont évolué depuis : il est dorénavant démontré qu’un individu n’ayant qu’un ou deux adénomes mesurant moins de 10 mm en dysplasie de bas grade réséqués lors d’une coloscopie est à risque faible de CCR et non pas à risque élevé ;6 le sur-risque induit par des antécédents familiaux de CCR a été révisé à la baisse par plusieurs études récentes ;7-9 les progrès récents en génétique ont permis de décrire, en sus du syndrome de Lynch (SL) et de la polypose adénomateuse familiale (PAF), de nombreux nouveaux syndromes de prédisposition héréditaire associés à un risque très élevé de CCR ; enfin, les indications de coloscopie reposent sur des recommandations de 2004 n’intégrant ni le sur-risque environnemental et comportemental, ni certaines maladies ou situations sources d’un sur-risque de CCR telles que mucoviscidose, radiothérapie et survivant de cancer pédiatrique, ni l’utilisation du TIF.10
Les progrès récents en cancérologie nous apprennent que le CCR est une entité très hétérogène : il n’y a pas un CCR, mais de nombreux sous-types de CCR aux causes et caractéristiques propres. Chaque patient développe un processus unique de genèse du CCR, multifactoriel, résultant d’interactions entre des facteurs de risque endogènes (génétique et épigénétique) et exogènes (environnement, alimentation, mode de vie).3 Chaque CCR est génétiquement et épigénétiquement unique, associé à des anomalies moléculaires et des facteurs de risque spécifiques offrant des opportunités de prévention primaire (pour éviter l’apparition de la maladie, en réduire l’incidence) propres.
Les connaissances actuelles sur les facteurs de risque et facteurs protecteurs établis du CCR impliquent de nouvelles opportunités en matière de prévention primaire.
La déclinaison de ces acquis récents pour la prévention secondaire (dépistage) du CCR est abordée dans l’article « Médecine de précision et dépistage du cancer colorectal : une utopie ? » de la rubrique En débat, en
Incidence stable, baisse de la mortalité mais pronostic encore péjoratif
À l’échelle mondiale, la France est, à l’instar de tous les pays riches, un pays à risque élevé de CCR. À l’échelle européenne, elle se situe dans la moyenne, les incidences les plus fortes étant observées en Europe centrale, orientale et septentrionale. Bien que notre pays ait été l’un des tout premiers à déployer sur tout son territoire national un programme de DO dès 2009, l’incidence du CCR reste stable chez la femme et ébauche une baisse chez l’homme depuis 2005 (-1,4 % par an entre 2010 et 2018).1 En raison du vieillissement de la population, le nombre de nouveaux cas ne cesse cependant d’augmenter (+1,5 % par an entre 1990 et 2018). Au contraire, la mortalité par CCR ne cesse de diminuer en France au cours des dernières décennies (-1,6 % par an entre 1990 et 2018), principalement du fait des progrès réalisés dans leur prise en charge thérapeutique : anesthésie-réanimation, chirurgie, chimio- et radiothérapie adjuvantes. Le taux de survie nette standardisée à cinq ans s’améliore continuellement en France et atteint 63 % chez les personnes diagnostiquées entre 2010 et 2015, parmi les meilleurs d’Europe.12 Malgré tout, le CCR reste un cancer au pronostic péjoratif en comparaison aux autres cancers faisant l’objet d’un dépistage, organisé ou individuel : taux de survie nette standardisée à cinq ans de 88 % pour le sein, 63 % pour le col de l’utérus, et 93 % pour la prostate.12
Les principaux facteurs de risque sont bien connus
Les principaux facteurs de risque établis de CCR sont bien connus : âge ; sexe masculin ; obésité et surpoids ; sédentarité ; consommations d’alcool, tabac, viandes rouges et transformées ; diabète ; antécédent personnel ou familial de néoplasme colorectal ; maladie inflammatoire chronique intestinale (MICI) ; absence de dépistage… Aucun de ces facteurs n’induit un risque aussi fort que celui du tabac pour le cancer du poumon. L’association entre facteurs de risque et CCR varie significativement selon la localisation du CCR et sa voie de carcinogenèse. La classification habituelle en côlon proximal (droit et transverse), distal et rectum s’avère même trop schématique.
Par exemple, le risque de CCR associé à l’âge et aux antécédents familiaux est maximal dans le côlon proximal et diminue progressivement du cæcum au rectum ; le dépistage, en particulier par coloscopie, a une efficacité réduite pour les localisations proximales de CCR.13 Le tabac est un facteur de risque plus important pour les CCR issus de la voie festonnée de carcinogenèse que de la voie conventionnelle.14 C’est l’inverse pour la plupart des facteurs diététiques : un régime alimentaire de type occidental (riche en viandes rouges et transformées, sucres et céréales raffinées) est principalement associé à un sur-risque de CCR distal (côlon distal et rectum) issu de la voie conventionnelle de carcinogenèse.15 Dans la suite de l’article ne sont évoqués, sauf exception, que les facteurs de risque de CCR au sens large, toutes localisations et voies de carcinogenèse confondues.
Un certain nombre de facteurs de risque ne sont pas modifiables
Le risque augmente après 50 ans
L’âge est un des facteurs de risque les plus forts de CCR. L’incidence du CCR augmente nettement avec l’âge après 50 ans. En France, l’âge médian au diagnostic est de 71 ans chez l’homme, 73 ans chez la femme.1 Il était classique de considérer comme négligeable le risque d’être atteint de CCR avant l’âge de 50 ans. On assiste cependant à une augmentation significative et relativement ubiquitaire d’incidence des CCR chez les moins de 50 ans, probablement en lien avec l’essor de la malbouffe (junk food) [alimentation bon marché, facile d’accès, riche en produits ultra-transformés, viandes rouges et transformées, graisses saturées, sucres raffinés, et pauvre en fibres, céréales complètes, fruits et légumes] et de la sédentarité associées à une augmentation d’incidence du surpoids et de l’obésité.16 Malgré cette augmentation, l’incidence du CCR reste faible avant 50 ans dans notre pays : moins de 6 % des CCR en 2018.1 Au contraire, les cancers avant 50 ans représentent actuellement 12 % des nouveaux CCR aux États-Unis.16 La proportion de CCR proximal augmente avec l’âge : 35 % avant 50 ans, 60 % après 70 ans.3
Une incidence plus élevée chez l’homme
Le risque d’être atteint de CCR au cours de sa vie est similaire dans les deux sexes du fait de la longévité supérieure des femmes (4,4 % chez l’homme, 4,1 % chez la femme aux États-Unis).16 Pourtant, l’incidence du CCR est plus élevée chez l’homme que chez la femme, la différence apparaissant après 50 ans : 1,4 fois plus, en France, en 2018.1 Le sur-risque masculin de CCR serait multifactoriel : l’influence des facteurs environnementaux est plus importante chez l’homme ; les œstrogènes sont un facteur protecteur établi chez la femme.3 Schématiquement, on observe chez la femme les mêmes taux d’incidence avec un décalage de cinq à sept ans plus tard que chez l’homme (même incidence chez l’homme de 55 ans et la femme de 60-62 ans). La proportion de CCR proximal est plus importante chez la femme que chez l’homme (45 % versus 36 %, aux États-Unis).16
Antécédents personnels de CCR ou de polype colorectal
Un antécédent personnel de polype adénomateux était précédemment considéré comme synonyme de risque élevé de CCR, relevant d’une surveillance coloscopique « à vie ».4, 5 Cette notion est caduque. De nombreuses études ont démontré qu’une personne ayant un ou deux adénome(s) mesurant moins de 10 mm en dysplasie de bas grade réséqué(s) lors d’une coloscopie a un risque faible de CCR, inférieur à celui de la population générale, du fait de la réduction de risque conférée par la coloscopie et la polypectomie.6 En revanche, un antécédent personnel de CCR ou d’autres polypes (autres qu’hyperplasiques) confère toujours un risque élevé de CCR. Les recommandations professionnelles françaises ont été récemment actualisées en conséquence.6, 11
Des maladies sont associées à un sur-risque de CCR
Maladie inflammatoire chronique intestinale (MICI)
Le risque de CCR est doublé par rapport à celui de la population générale en cas de MICI atteignant le côlon, qu’il s’agisse de rectocolite hémorragique (RCH) ou de maladie de Crohn (MC). Les facteurs de risque de CCR spécifiques des MICI sont les suivants : début précoce de la maladie (avant 30 ans), durée d’évolution (supérieure à 7-10 ans), étendue (plus de 50 %) et sévérité de l’atteinte inflammatoire, association à une cholangite sclérosante primitive, et antécédent familial de CCR.17 Le risque de CCR vie entière dépasse 15 % chez un jeune adulte avec pancolite. Il est très élevé en cas de cholangite sclérosante primitive associée, pouvant atteindre 31 %. À l’inverse, le risque de CCR est diminué par une surveillance endoscopique régulière et la prise de 5-aminosalicylés (5-ASA) et probablement de thiopurines, raisons pour lesquelles il semble moindre dans les séries les plus récentes.17
Diabète de type 2
Le diabète est un facteur de risque indépendant de CCR. Le sur-risque de CCR est modeste, de l’ordre de 30 % supérieur à celui de la population générale. Une personne diabétique atteint le niveau de risque de la population générale avec cinq ans d’avance. Le risque de CCR est significativement réduit chez les patients traités par metformine comparés aux patients sans metformine.
Acromégalie
Le sur-risque de CCR en cas d’acromégalie est controversé : s’il est avéré, il est modeste (de l’ordre du double de celui de la population générale).
Mucoviscidose
La mucoviscidose augmente le risque de CCR (ratio d’incidence standardisé [SIR] = 10,9 pour le côlon), particulièrement en cas de transplantation.18
Survivants d’un cancer pédiatrique
Les survivants d’un cancer pédiatrique ont un risque accru de deuxième cancer à un jeune âge, ce d’autant qu’ils ont reçu certaines drogues de chimiothérapie (alkylants par exemple) et/ou une radiothérapie (risque dose-dépendant).18 Le risque de CCR est plus important en cas de radiothérapie abdomino-pelvienne antérieure (SIR = 8,5) que sans (SIR = 2,6).
Radiothérapie
Les patients traités par radiothérapie pour cancer gynécologique (col et corps utérins, ovaire) ou de la prostate ont un risque accru de CCR qui apparaît dix ans après le cancer initial.18
Transplantation d’organe
La transplantation induit un surrisque modéré de CCR (SIR entre 1,1 et 1,8 selon les études), nettement inférieur au sur-risque de lymphome non hodgkinien et de cancer cutané.19 Le sur-risque dépend du motif de transplantation, bien plus élevé en cas de mucoviscidose ou de cholangite sclérosante primitive. Le pronostic du CCR est significativement plus péjoratif chez le transplanté que dans la population générale (taux de survie à 5 ans de 30,7 % versus 63,5 % aux États-Unis).
Urétéro-sigmoïdostomie
Les patients porteurs d’une urétéro-sigmoïdostomie ont un risque accru de CCR dès dix ans après la chirurgie.
Cancer du sein avant 50 ans
Les patientes atteintes de cancer du sein n’ont pas de sur-risque ultérieur de CCR, à l’exception de celles atteintes avant l’âge de 50 ans (odds ratio [OR] = 2,5).20 Une mutation des gènes BRCA1 ou BRCA2 n’est pas associée à un sur-risque de CCR.
Risque familial accru de CCR
Syndromes de prédisposition héréditaire au CCR
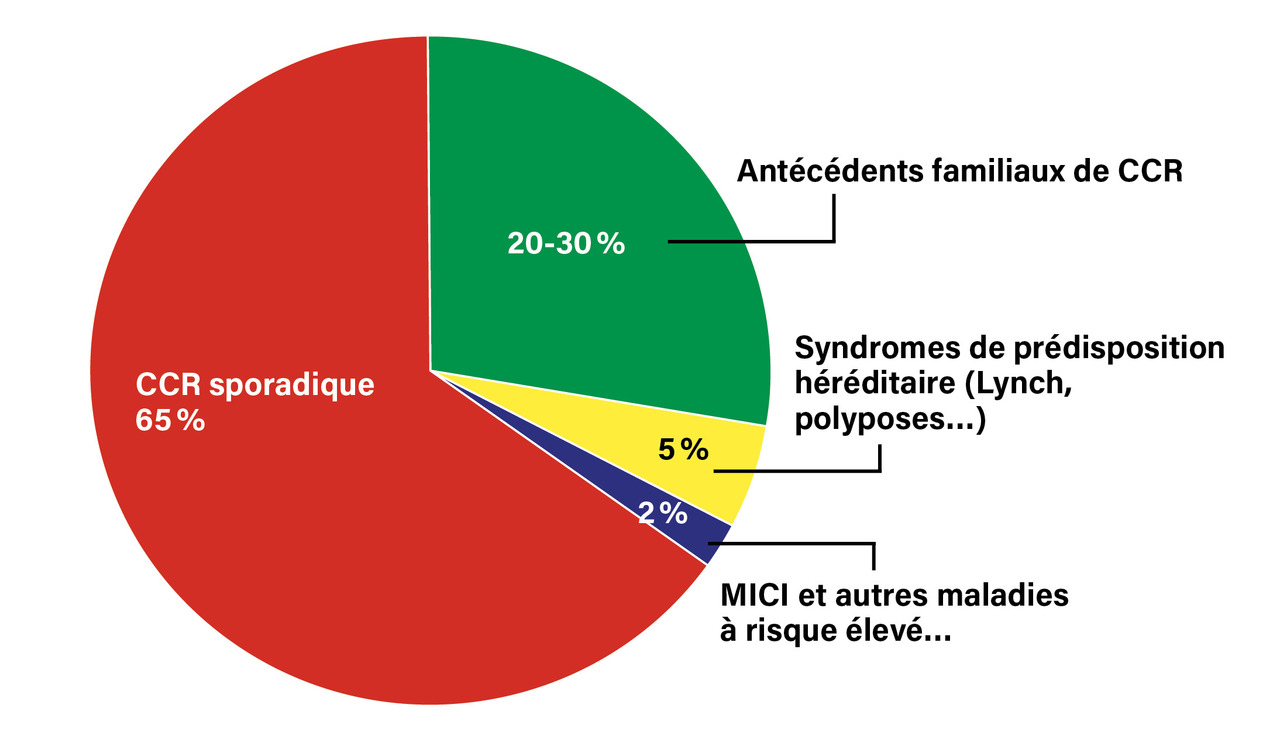
Ces syndromes sont responsables de moins de 5 % des CCR (
Le syndrome de Lynch (SL)
Le syndrome de Lynch (SL) est le plus fréquent des syndromes de prédisposition héréditaire au CCR et une des maladies génétiques les plus fréquentes. Le SL n’est plus synonyme de CCR héréditaire sans polypose (HNPCC), cette entité incluant le SL mais aussi le syndrome Lynch-like, le syndrome X et d’autres syndromes plus rares. De transmission autosomique dominante, le SL est responsable d’environ 2 à 3 % des CCR mais aussi d’autres cancers dits du spectre étroit (endomètre, grêle et voies excrétrices urinaires) ou large (ovaire, estomac, voies biliaires, pancréas, glioblastome, peau).9, 21 En cas de SL, la séquence adénome-carcinome est accélérée (1-3 ans versus 10-15 ans), le CCR survient à un jeune âge (40-50 ans en cas de mutation MLH1 et MSH2 ; 50-65 ans en cas de mutation MSH6), est plus souvent proximal, multiple, de meilleur pronostic que les CCR non SL. Il est dû à la mutation constitutionnelle mono-allélique d’un des quatre principaux gènes de réparation des mésappariements de l’ADN (système mismatch repair [MMR] : MLH1, MSH2, MSH6, PMS2) ou de la région 3’ du gène EPCAM, source d’instabilité microsatellitaire tumorale (MSI). Il faut y penser et adresser le patient à une consultation d’oncogénétique en cas de cancer du spectre du SL survenu à un âge jeune, de cancers multiples, d’agrégation familiale de cancers du spectre, ou d’instabilité microsatellitaire tumorale en l’absence d’hyperméthylation du promoteur du gène MLH1 ou de mutation du gène BRAF. Le diagnostic de déficience du système MMR est fait sur la tumeur par PCR (polymerase chain reaction ou réaction de polymérisation en chaîne) mettant en évidence une instabilité microsatellitaire (MSI) et/ou par immunohistochimie montrant une perte d’expression d’une des protéines MMR. Le diagnostic moléculaire de SL repose ensuite sur l’identification d’un variant pathogène d’un des gènes MMR. Le variant pathogène identifié, un test sanguin prédictif présymptomatique est proposé aux apparentés au premier degré après leur majorité. Son diagnostic étant relativement complexe, le SL est actuellement sous-diagnostiqué : moins d’un quart des patients atteints de CCR lié au SL seraient identifiés. Le risque cumulé d’être atteint de CCR avant 75 ans varie selon le gène muté, de 15 % pour MSH6 à 43 % pour MSH2 et 46 % pour MLH1.
Le syndrome Lynch-like (SLL)
Le syndrome Lynch-like (SLL) est hétérogène, défini par la survenue d’un CCR ou d’un cancer du spectre du SL avec instabilité microsatellitaire (MSI) mais sans mutation identifiée dans les gènes MMR ou EPCAM ni hyperméthylation du promoteur du gène MLH1 ni mutation du gène BRAF.21 Le risque cumulé de CCR dans ces familles (SIR = 2,1) est intermédiaire entre celui des familles avec SL (SIR = 6) et celui des familles avec CCR sporadique (SIR = 0,5). L’âge au diagnostic de CCR est plus tardif (55 ans) et le risque de cancer autre que colorectal est moindre que dans le SL.
Cancer colorectal familial de type X
Le CCR familial de type X (ou syndrome X) correspond à un groupe hétérogène de CCR familiaux qui remplissent les critères d’Amsterdam 1 (critères cliniques relativement spécifiques mais très peu sensibles utilisés historiquement pour repérer les familles suspectes de SL, à savoir au moins trois parents au 1er degré atteints de CCR, au moins deux générations successives, au moins un diagnostic de CCR avant 50 ans) mais sans instabilité microsatellitaire (MSS). Le risque de CCR est modérément élevé dans ces familles, multiplié par 2. En comparaison avec le SL, l’âge au diagnostic de CCR est plus tardif dans le syndrome X (de 50 à 60 ans), la localisation plus distale, le pronostic moins bon et il y a moins de cancers autres que colorectaux. Il n’y a pas de profil génétique spécifique : de nombreux gènes associés ont été décrits : BMPR1A, RPS20, SEMA4A, SETD6…
Syndrome de déficience constitutionnelle du système MMR
Le syndrome de déficience constitutionnelle du système MMR (constitutional mismatch repair deficiency [CMMRD]) est une prédisposition majeure aux cancers pédiatriques et du jeune adulte.22 Rare, il est dû à une mutation constitutionnelle bi-allélique d’un des quatre gènes MMR, le plus souvent PMS2. Il entraîne l’apparition précoce, le plus souvent dès l’enfance, de tumeurs multiples, CCR, tumeurs cérébrales et hémopathies. Quasiment tous les patients développent de multiples adénomes colorectaux ou une polypose atténuée avant 30 ans (ce syndrome est parfois classé dans les polyposes). La séquence adénome-CCR est la plus rapide de toutes les formes héréditaires de CCR. L’âge médian au diagnostic de CCR est de 16 ans.
Polyposes
Par définition, une polypose colorectale est constituée de nombreux polypes colorectaux, synchrones ou métachrones, sans seuil consensuel. Plusieurs polyposes, variant selon le type histologique des polypes, confèrent un risque très élevé de CCR, de 15 à 100 % sur la vie entière (
Antécédent familial de néoplasme colorectal
La majorité des CCR (65 % environ) sont sporadiques, survenant sans contexte familial ni MICI associé. Environ 20 à 30 % des patients atteints de CCR ont des antécédents familiaux de CCR sans être porteurs de gène de syndrome de prédisposition héréditaire au CCR connu (
Maladies NON associées à un sur-risque de CCR
Les données concernant l’hémochromatose génétique de type 1 sont contradictoires : les séries anciennes suggéraient un sur-risque de CCR, les plus récentes éliminent un sur-risque significatif. De même pour les antécédents de cholécystectomie : la plupart des études sont anciennes et leur méta-analyse rapporte un sur-risque de cancer du côlon (risque relatif [RR] = 1,30), pas du rectum. Une étude cas-témoins internationale récente n’observe pas de sur-risque de CCR.
La moitié des CCR sont liés à des facteurs de risque modifiables
Le Centre international de recherche sur le cancer (CIRC) a évalué à 48,6 % (55,8 % chez l’homme, 39,9 % chez la femme) la part des CCR attribuable à des facteurs de risque modifiables en France en 2015.2 Elle est évaluée à 54 % au Royaume-Uni et 55 % aux États-Unis. Autrement dit, la moitié des CCR pourraient être évités en modifiant l’exposition à des facteurs de risque environnementaux ou comportementaux, les principaux étant l’alimentation liée à 22,3 % des nouveaux cas (viande transformée 9,8 %, rouge 4,3 %), l’alcool (16,8 %), l’obésité (11,2 %), le tabac (6,6 %) et la sédentarité (2,3 %) [
Modifier l’alimentation
Les viandes transformées (charcuteries, viandes salées, séchées, fumées, en conserve) et rouges (hors volailles) sont classées comme agents respectivement « cancérogènes » et « probablement cancérogènes » par le CIRC, avec une relation dose-effet.3, 14, 28
L’influence du mode de cuisson de la viande rouge n’est pas formellement démontrée : les données expérimentales et épidémiologiques suggèrent un sur-risque de CCR associé à la viande « bien cuite » par le biais de la formation d’amines hétérocycliques, sans parler du sur-risque lié aux hydrocarbures aromatiques polycycliques issus d’une cuisson type barbecue. Les charcuteries (principalement jambon cuit, saucisses et saucissons cuits) sont la principale source (de 45 à 65 %) de nitrites alimentaires.29 Ils sont utilisés comme additifs alimentaires « conservateurs » pour leurs propriétés antioxydantes et antimicrobiennes et pour leur effet sur la couleur des produits. Classés « probablement cancérogènes » pour l’homme par le CIRC, les nitrites ingérés conduisent à la formation de composés endogènes nitrosés, notamment les nitrosamines.
Un rapport de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) [avis révisé en juillet 2022] confirme l’association entre exposition aux nitrates et/ou nitrites via la viande transformée et le risque de CCR.29 Il recommande de limiter l’utilisation des additifs nitrés dans les viandes transformées et de limiter leur consommation à 150 g par semaine.29
La consommation d’aliments ultratransformés est associée à un risque accru de cancers et notamment de cancers du sein.30 L’association avec le CCR n’est pas formellement démontrée, bien qu’une étude espagnole récente suggère un sur-risque de CCR (OR = 1,11 pour une augmentation de consommation de 10 %).31
Lutter contre le surpoids et l’obésité
De même, surpoids et obésité sont associés à une augmentation du risque de CCR.3, 14, 28
Des effets dose-dépendants pour l’alcool et le tabac
L’alcool, quel qu’il soit, est classé cancérogène par le CIRC, avec une relation dose-effet.28 Si toutes les études démontrent l’existence d’une augmentation significative du ris-que de CCR chez les buveurs de plus de deux verres par jour, l’effet d’une consommation légère à modérée reste controversé : certains observent que le risque de CCR augmente dès un verre par jour en moyenne, d’autres que la consommation de deux verres ou moins par jour est associée à une diminution du risque de CCR.32
Le tabagisme augmente de 15 à 20 % le risque de CCR avec une relation dose-dépendante, tant sur la quantité que sur la durée.33 Le sur-risque diminue après sevrage mais persiste durant environ vingt-cinq ans.
Faible sur-risque lié à l’exposition professionnelle à l’amiante, aux pesticides…
Le CIRC a évalué à 2 % (3,4 % chez l’homme, 0,4 % chez la femme) la part des CCR attribuable à une exposition professionnelle.2 Globalement, le sur-risque de CCR lié à une exposition professionnelle est relativement faible, évalué autour de 11 à 15 %, inférieur à celui lié au tabac et à l’alcool.30 Certains secteurs professionnels semblent plus particulièrement à risque : industries du cuir, du plastique, du caoutchouc, du fer et de l’acier, exposition à l’amiante.34 L’exposition à l’amiante est associée à un sur-risque de CCR (SIR évalué à 1,07 et 1,16 dans deux méta-analyses récentes).35 La littérature concernant les pesticides (générique désignant tout produit chimique destiné à lutter contre des organismes vivants considérés comme nuisibles tels que les herbicides, insecticides, fongicides, etc.) est très riche et ses résultats parfois contradictoires. La dernière revue de littérature portant sur 139 articles et 56 pesticides retient un sur-risque significatif de CCR associé aux produits suivants : aldicarbe, dicamba, fonofos, S-éthyl-dipropylthiocarbamate (EPTC), imazéthapyre, terbufos, trifluraline, toxaphène, pendiméthaline, dieldrine et aldrine, chlorpyrifos, carbaryl, heptachlore et acétochlore.36 L’usage de certains (pas tous) de ces produits est interdit en Europe et/ou aux États-Unis. En raison de leurs grandes difficultés méthodologiques, la plupart des études épidémiologiques échouent cependant à démontrer un sur-risque de CCR chez les personnes exposées aux pesticides en général, professionnellement ou non. Le CCR n’est pas cité dans les expertises « pesticides, effets sur la santé » de l’Institut national de la santé et de la recherche médicale (Inserm) de 2013 et 2021.
La pollution, associée à un sur-risque avéré
La pollution de l’air et de l’eau est associée à un sur-risque de CCR. Les particules fines en suspension dans l’air sont classées agents cancérogènes certains par le CIRC, l’association avec le cancer du poumon étant la mieux établie.2 Certains cancers digestifs sont aussi concernés. Une méta-analyse récente démontre l’association entre pollution atmosphérique évaluée par le taux de particules fines (particules au diamètre aérodynamique ≤ 2,5 μm [PM2,5]) et risque de CCR (RR = 1,35).37
De même, le rapport de l’ANSES confirme l’association entre taux élevés de nitrates dans l’eau de boisson et risque de CCR.29 Ces nitrates sont dus à la contamination de l’eau par des activités anthropiques (engrais azotés, épandage de lisiers, rejets d’origine urbaine ou industrielle) et représentent 20 à 25 % de l’exposition totale aux nitrates. L’ANSES recommande de renforcer les actions visant à préserver la qualité des ressources en eau d’une contamination par les nitrates et de réévaluer la pertinence du seuil de qualité et des valeurs dérogatoires maximales en vigueur.29
Peu d’effet pour les radiations ionisantes
Le CIRC évalue à 1,2 % la proportion de CCR attribuable aux radiations ionisantes d’origine médicale à visée diagnostique (radiologie et médecine nucléaire).2
Un statut socio-économique défavorable est péjoratif
Le CCR ne fait pas partie des cancers les plus influencés par le niveau socio-économique tels que ceux du poumon, des voies aérodigestives supérieures et du col de l’utérus.2 Néanmoins, de façon relativement ubiquitaire, le pronostic est plus péjoratif et la mortalité par CCR augmentée chez les personnes défavorisées (revenus, éducation, isolement…).38 Concernant son incidence, les données sont plus hétérogènes : une augmentation d’incidence du CCR est observée chez les personnes défavorisées en Amérique du Nord, pas en Europe.38 Plusieurs facteurs pourraient expliquer l’influence d’un statut socio-économique défavorable : tabagisme, alimentation déséquilibrée, obésité, absence de dépistage, retard au diagnostic, moindre accès aux soins…
Agir sur les facteurs protecteurs modifiables
Favoriser une alimentation riche en fibres et en produits laitiers
Les fibres alimentaires sont des glucides complexes indigestibles dans l’intestin grêle présents dans les aliments d’origine végétale : céréales complètes, légumes et fruits. Les aliments riches en fibres réduisent le risque de CCR, de même que les produits laitiers (lait d’origine animale exclusivement, yaourts, fromages, à l’exception du beurre, de la crème fraîche et des desserts lactés) [
L’activité physique diminue le risque
Une méta-analyse a montré une diminution de 19 % du risque de CCR pour les niveaux d’activité physique les plus élevés par rapport aux niveaux les plus faibles.
Pas ou peu d’intérêt pour la chimioprévention
On entend par chimioprévention l’utilisation d’agents chimiques pour réduire le risque de CCR. Si de nombreux agents ont été évalués, la plupart s’avèrent inefficaces et/ou toxiques, de sorte que leur utilisation n’est pas recommandée : calcium, vitamines dont vitamine D et acide folique, statines, anti-inflammatoires non stéroïdiens…39, 40 De même, le traitement hormonal substitutif de la ménopause réduit de 10 à 40 % le risque de CCR mais au prix d’une augmentation des risques de cancer mammaire et d’accident thromboembolique et cardiovasculaire.14 Certains agents réduisent le risque de CCR dans des groupes à risque spécifiques tels que la metformine en cas de diabète de type 2 et les amino-salicylés en cas de MICI colique.
L’aspirine est l’agent le plus étudié et donnant les meilleurs résultats. Il est démontré que la prise d’aspirine réduit le risque d’adénome, d’adénome avancé, de CCR (de 20 à 40 %) et de décès par CCR. Cet effet protecteur ne serait observé qu’après dix ans et ne serait que suspensif. Il serait observé dès la dose de 75 mg/j avec une relation dose-effet jusqu’à 325 mg/j. Cependant, cette relation dose-effet est aussi observée pour le risque de saignement digestif et intracrânien. Actuellement, la prise d’aspirine est recommandée aux États-Unis dans trois situations : à faible dose pour la prévention du CCR chez les personnes à risque moyen ayant un risque d’accident cardiovasculaire supérieur ou égal à 10 % à dix ans, âgées de moins de 70 ans et ayant une espérance de vie de plus de dix ans et sans risque élevé de saignement ; en cas de syndrome de Lynch ; chez les personnes ayant un antécédent personnel de CCR (prévention tertiaire).40 Plusieurs questions restent en suspens, et font l’objet d’études en cours : dose et durée optimales, population cible, balance bénéfices-risques. Il est donc prématuré d’utiliser l’aspirine en prévention primaire du CCR hors de ces cas particuliers.
Pour mémoire, aucun agent n’a démontré son efficacité pour retarder le recours à la (procto)colectomie prophylactique ou contrôler les polypes restant après chirurgie en cas de polypose adénomateuse familiale (sulindac, célécoxib, aspirine…).
Le dépistage réduit incidence et mortalité
Un des principaux facteurs de risque du CCR est l’absence de recours au dépistage. Le niveau de preuve de l’efficacité du dépistage est élevé. La plupart des modèles démontrent, à condition d’une adhésion théorique idéale de 100 %, l’équivalence des stratégies de dépistage par TIF, recto-sigmoïdoscopie et coloscopie en matière de réduction de mortalité par CCR.26 En revanche, les stratégies de dépistage endoscopique, recto-sigmoïdoscopique et coloscopique offrent une réduction d’incidence du CCR supérieure à celle du TIF. Les programmes de dépistage fondés sur le TIF (OC Sensor au seuil de 20 µg/g) réduisent la mortalité par CCR de 40 à 62 % entre participants et non participants et de 10 à 36 % entre invités et non invités, et réduisent l’incidence des CCR de 34 % entre participants et non participants et de 10 à 28 % entre invités et non invités.26 Les réductions de mortalité et d’incidence sont significativement plus importantes dans le côlon distal que dans le proximal, et chez l’homme que chez la femme.26 Enfin, le dépistage par TIF est la stratégie la plus rentable en matière de coût/efficacité, y compris avec un taux de participation de 30 %.26
Promouvoir dépistage et recommandations hygiéno-diététiques
Environnement et comportement jouent un rôle plus important que l’hérédité dans la carcinogenèse colorectale. La part des CCR attribuable à une exposition professionnelle, la pollution ou un statut socio-économique défavorable est faible (mais pas nulle), bien moindre que pour le cancer du poumon. La moitié au moins des CCR sont liés à des facteurs de risque modifiables associés au mode de vie occidental tels que sédentarité, malbouffe et obésité. On ne peut que regretter la relative impuissance des systèmes politiques, sanitaires et sociaux face à la puissance de l’industrie agroalimentaire et de ses lobbies, y compris ceux du tabac et de l’alcool, pour mettre en œuvre une politique de prévention primaire du CCR. Les recommandations hygiéno-diététiques destinées à la prévention primaire du CCR n’ont rien de spécifique : pratique d’une activité physique (au moins 30 minutes par jour), maintien d’un indice de masse corporelle entre 18 et 25 kg/m2, limitation des viandes rouges (500 g par semaine) et charcuteries (150 g par semaine), augmentation des fibres alimentaires et produits laitiers, réduction de la consommation d’alcool (maximum 2 verres par jour, pas tous les jours) et éviction du tabac.28 Il est prématuré d’utiliser l’aspirine en prévention primaire du CCR en dehors du syndrome de Lynch et d’un risque cardiovasculaire significatif associé. Le dépistage s’avère finalement le moyen le plus efficient de réduire le risque de CCR et de décès par CCR. Encore faut-il pouvoir évaluer précisément le niveau de risque de CCR pour proposer à chacun un dépistage personnalisé. L’article de la rubrique En débat dans ce même numéro (
1. Defossez G, Le Guyader-Peyrou S, Uhry Z, Grosclaude P, Colonna M, Dantony E, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 1 Tumeurs solides. 2019 ; 92-107. Disponible sur : www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-sein/documents/rapport-synthese/estimations-nationales-de-l-incidence-et-de-la-mortalite-par-cancer-en-france-metropolitaine-entre-1990-et-2018-volume-1-tumeurs-solides-etud
2. Les cancers attribuables au mode de vie et à l’environnement en France métropolitaine. Centre international de recherche sur le cancer. Lyon, 2018. Disponible sur : gco.iarc.fr/includes/PAF/PAF_FR_report.pdf
3. Keum N, Giovannucci E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol 2019;16:713-32.
4. Dépistage et prévention du cancer colorectal. Actualisation du référentiel de pratiques de l’examen périodique de santé (EPS). HAS juin 2013. Disponible sur : www.has-sante.fr/upload/docs/application/pdf/2013-07/referentieleps_format2clic_kc_colon-vfinale_2013-07-24_16-05-56_103.pdf
5. Cancer colorectal : modalités de dépistage et de prévention chez les sujets à risque élevé et très élevé. HAS, mai 2017. Disponible sur : www.has-sante.fr/upload/docs/application/pdf/2017-06/dir76/reco248_rapport_elaboration_cancer__colorectal.pdf
6. Robaszkiewicz M, Rahmi G, Lecomte T, Denis B, Vaillant E, Gronier O, et al. Modalités de surveillance après polypectomie colique. Hépato-Gastro & Oncologie digestive 2021;28:805-16.
7. Leddin D, Lieberman DA, Tse F, Barkun AN, Abou-Setta AM, Marshall JK, et al. Clinical practice guideline on screening for colorectal cancer in individuals with a family history of nonhereditary colorectal cancer or adenoma: The Canadian Association of Gastroenterology Banff Consensus. Gastroenterology 2018;155:1325-47.
8. Monahan KJ, Bradshaw N, Dolwani S, Desouza B, Dunlop MG, East JE, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut 2020;69:411-44.
9. van Leerdam ME, Roos VH, van Hooft JE, Balaguer F, Dekker E, Kaminski MF, et al. Endoscopic management of Lynch syndrome and of familial risk of colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:1082-93.
10. Recommandations pour la pratique clinique. Endoscopie digestive basse : indications en dehors du dépistage en population. Anaes, avril 2004. Disponible sur : www.has-sante.fr/upload/docs/application/pdf/endoscopie_2004_recommandations_mise_en_forme_2006.pdf
11. Denis B. Médecine de précision et dépistage du cancer colorectal : une utopie ? Rev Prat 2022;72(8):825-833
12. Launoy G, Cariou M, Bouvier AM, Bouvier V, Lecoffre C, Lafay L, et al. Survie des personnes atteintes de cancer en France métropolitaine 1989-2018. Côlon et rectum. 2021. Disponible sur : www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-colon-rectum/documents/enquetes-etudes/survie-des-personnes-atteintes-de-cancer-en-france-metropolitaine-1989-2018-colon-et-rectum
13. Wang L, Lo CH, He X, Hang D, Wang M, Wu K, et al. Risk factor profiles differ for cancers of different regions of the colorectum. Gastroenterology 2020;159:241-56.
14. Brenner H, Chen C. The colorectal cancer epidemic: A Challenges and opportunities for primary, secondary and tertiary prevention. Br J Cancer 2018;119:785-92.
15. Mehta RS, Song M, Nishihara R, Drew DA, Wu K, Qian ZR, et al. Dietary patterns and risk of colorectal cancer: Analysis by tumor location and molecular subtypes. Gastroenterology 2017;152:1944-53.
16. Siegel RL, Miller KD, Goding Sauer A, Fedewa SA, Butterly LF Anderson JC, et al. Colorectal cancer statistics, 2020. CA Cancer J Clin 2020;70:145-64.
17. Muller M, Broséus J, Feugier P, Beaugerie L, Peyrin-Biroulet L. Cancers digestifs et lymphomes au cours des maladies inflammatoires chroniques de l’intestin : quels sont les risques? Hépato-Gastro & Oncologie digestive 2021;28:485-90.
18. Hampton JS, Sharp L, Craig D, Rees CJ. Colorectal cancer screening and surveillance for non-hereditary high-risk groups-Is it time for a re-think? Curr Treat Options Gastroenterol 2021;19:48-67.
19. Prenner S, Levitsky J. Comprehensive review on colorectal cancer and transplant. Am J Transplant 2017;17:2761-74.
20. Lai JH, Park G, Gerson LB. Association between breast cancer and the risk of colorectal cancer. Gastrointest Endosc 2017;86:429-41.
21. Dhooge M, Perrod G. Polyposes digestives et syndromes de prédisposition au cancer colorectal. Quelle prise en charge en 2021 ? Hépato-Gastro & Oncologie digestive 2021;28:1112-32.
22. Colas C, Ribière S, Mariani P, Le Mentec M, Delhomelle H, Tzanis D, et al. Du nouveau dans le champ des polyposes adénomateuses colorectales : synthèse des données disponibles en 2020. Hépato-Gastro & Oncologie digestive 2020;27:386-95.
23. Buisine MP, Bonnet D, Bonadona V, Baert-Desurmont S, Bonnet D, Coulet F, et al. La polypose associée à MUTYH : synthèse des données disponibles en 2020 et actualisation des recommandations françaises établies en 2012 sous l’égide de l’Institut National du Cancer (INCa). Hépato-Gastro & Oncologie digestive 2020;27:396-406.
24. van Leerdam ME, Roos VH, van Hooft JE, Dekker E, Jover R, Kaminski MF, et al. Endoscopic management of polyposis syndromes: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:877-95.
25. Roos VH, Mangas-Sanjuan C, Rodriguez-Girondo M, Medina-Prado L, Steyerberg EW, Bossuyt PMM, et al. Effects of family history on relative and absolute risks for colorectal cancer: A systematic review and meta-analysis. Clin Gastroenterol Hepatol 2019;17:2657-67.
26. Denis B, Plastaras L, Fraser CG. Test immunochimique quantitatif de recherche de sang fécal occulte : le couteau suisse. Hépato-Gastro & Oncologie digestive 2022;29:165-80.
27. Tian Y, Kharazmi E, Brenner H, Xu X, Sundquist K, Sundquist J et al. Calculating the starting age for screening in relatives of patients with colorectal cancer based on data from large nationwide data sets. Gastroenterology 2020;159:159-68.
28. Cottet V. Nutrition et prévention primaire du cancer colorectal. Hépato-Gastro & Oncologie digestive 2021;28:561-8.
29. ANSES. Évaluation des risques liés à la consommation de nitrates et nitrites. Avis révisé de l’ANSES. Rapport d’expertise collective. Juillet 2022. Disponible sur : www.anses.fr/fr/system/files/ERCA2020SA0106Ra.pdf
30. Fiolet T, Srour B, Sellem L, Kesse-Guyot E, Allès B, Deschasaux M, et al. Consumption of ultra-processed foods and cancer risk: results from NutriNet-Santé prospective cohort. BMJ 2018;360:k322.
31. Romaguera D, Fernández-Barrés S, Gracia-Lavedán E, Vendrell E, Azpiri M, Ruiz-Moreno E, et al. Consumption of ultra-processed foods and drinks and colorectal, breast, and prostate cancer. Clin Nutr 2021;40:1537-45.
32. McNabb S, Harrison TA, Albanes D, Berndt SI, Brenner H, Caan BJ, et al. Meta-analysis of 16 studies of the association of alcohol with colorectal cancer. Int J Cancer 2020;146:861-73.
33. Botteri E, Borroni E, Sloan EK, Bagnardi V, Bosetti C, Peveri G, et al. Smoking and colorectal cancer risk, overall and by molecular subtypes: A meta-analysis. Am J Gastroenterol 2020;115:1940-9.
34. Oddone E, Modonesi C, Gatta G. Occupational exposures and colorectal cancers: A quantitative overview of epidemiological evidence. World J Gastroenterol 2014;20:12431-44.
35. Huang Q, Lan YJ. Colorectal cancer and asbestos exposure: an overview. Ind Health 2020;58:200-11.
36. Matich EK, Laryea JA, Seely KA, Stahr S, Su LJ, Hsu PC, et al. Association between pesticide exposure and colorectal cancer risk and incidence: A systematic review. Ecotoxicol Environ Saf 2021;219:112327.
37. Pritchett N, Spangler EC, Gray GM, Livinski AA, Sampson JN, Dawsey SM, et al. Exposure to outdoor particulate matter air pollution and risk of gastrointestinal cancers in adults: A systematic review and meta-analysis of epidemiologic evidence. Environ Health Perspect 2022;130:36001.
38. Manser CN, Bauerfeind P. Impact of socioeconomic status on incidence, mortality, and survival of colorectal cancer patients: A systematic review. Gastrointest Endosc 2014;80:42-60.
39. Katona BW, Weiss JM. Chemoprevention of colorectal cancer. Gastroenterology 2020;158:368-88.
40. Liang PS, Shaukat A, Crockett SD. AGA clinical practice update on chemoprevention for colorectal neoplasia: Expert Review. Clin Gastroenterol Hepatol 2021;19:1327-36.