Le cancer du poumon est la première cause de mortalité par cancer, avec plus de 30 000 décès par an en France.
Facteurs de risque des cancers du poumon
Tabac
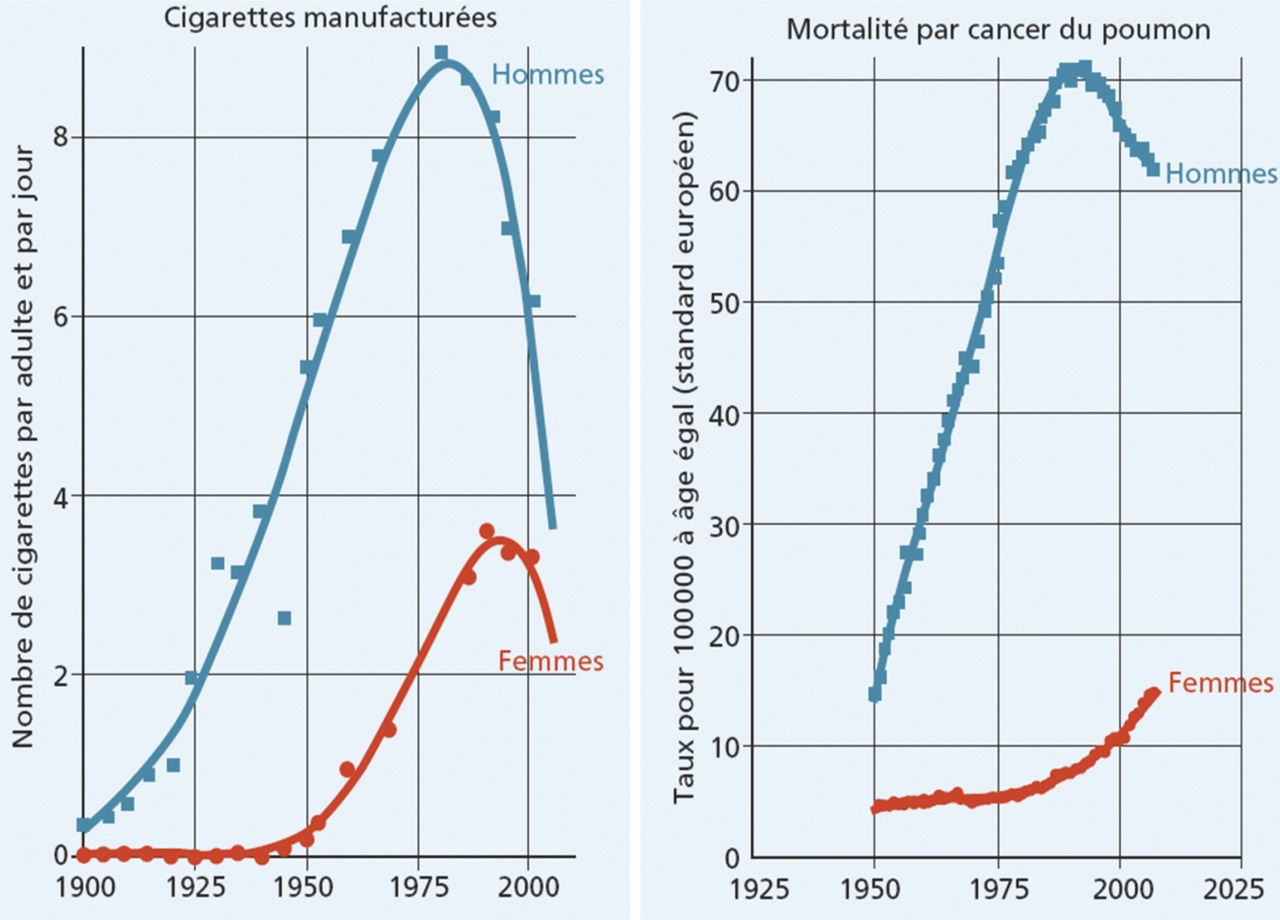
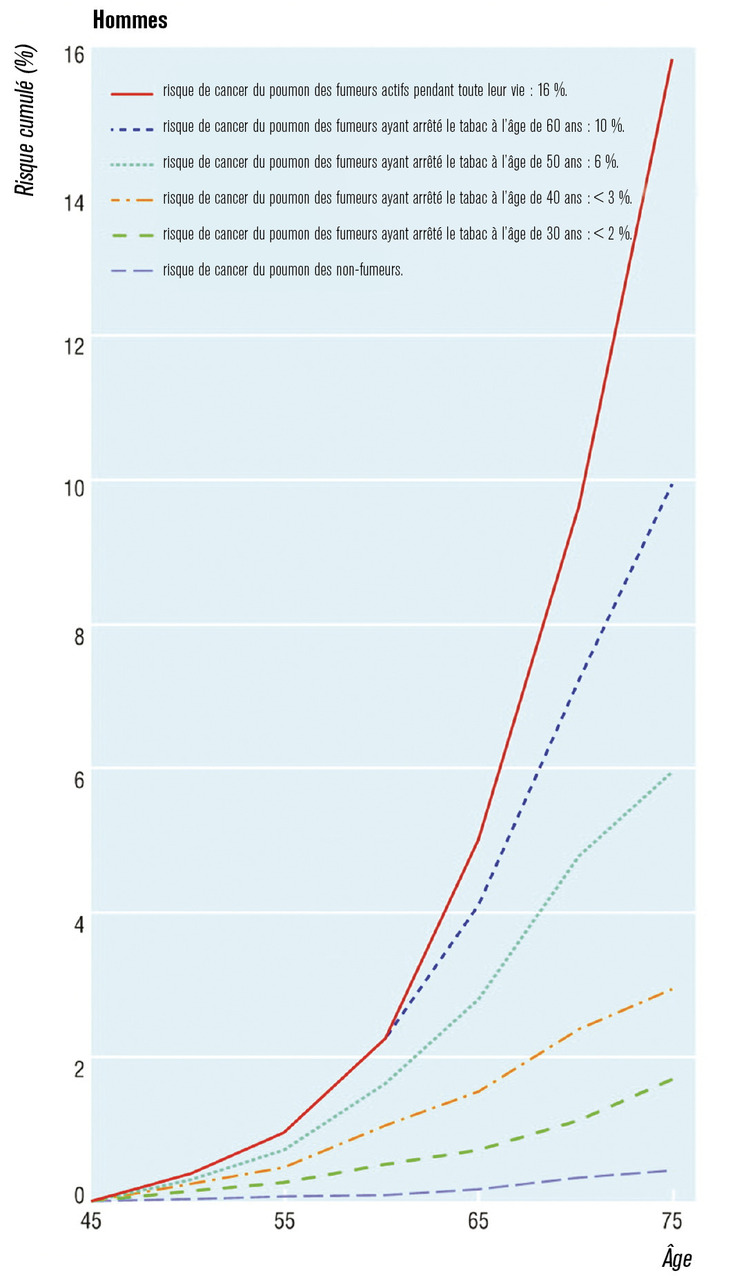
La très grande majorité (85 %) des cancers du poumon est due au tabac. L’évolution de la mortalité par cancer du poumon suit étroitement la consommation du tabac (fig. 1 ). Ce lien a été découvert dans les années 1950 et montre une réduction de l’espérance de vie des fumeurs en moyenne de 10 ans et un délai entre la consommation de tabac et la mortalité par cancer du poumon d’environ 20 ans.1, 2 La durée du tabagisme a un impact plus important sur le risque de cancer du poumon (risque exponentiel) que la quantité fumée (risque multiplicateur).3 Ainsi, le risque relatif de cancer du poumon chez le fumeur est multiplié par 1,4 à 14 selon la quantité fumée.4 Le risque est d’autant plus important que le tabagisme est débuté précocement. Il diminue avec le sevrage mais ne revient pas au risque d’un non-fumeur. Quel que soit l’âge auquel le sevrage a lieu, il y a un bénéfice à l’arrêt du tabac, et le risque diminue avec la durée de l’arrêt (fig. 2 ).
En France, la réduction récente de la mortalité par cancer du poumon dans la population masculine est une conséquence de la diminution du tabagisme chez les hommes depuis les années 1980. L’épidémie de cancers du poumon chez les femmes suit l’évolution de la consommation beaucoup plus récente du tabac dans cette population. La fumée de la cigarette contient plus de 4 000 substances, dont 60 reconnues comme carcinogènes, parmi lesquelles les benzopyrènes (goudrons), les nitrosamines et les métaux lourds. Fumer des cigarettes à faible teneur en nicotine ou « légères » augmente autant le risque de cancer du poumon que les cigarettes ordinaires parce que le fumeur inhale plus profondément pour avoir la même dose de nicotine.
En France, la réduction récente de la mortalité par cancer du poumon dans la population masculine est une conséquence de la diminution du tabagisme chez les hommes depuis les années 1980. L’épidémie de cancers du poumon chez les femmes suit l’évolution de la consommation beaucoup plus récente du tabac dans cette population. La fumée de la cigarette contient plus de 4 000 substances, dont 60 reconnues comme carcinogènes, parmi lesquelles les benzopyrènes (goudrons), les nitrosamines et les métaux lourds. Fumer des cigarettes à faible teneur en nicotine ou « légères » augmente autant le risque de cancer du poumon que les cigarettes ordinaires parce que le fumeur inhale plus profondément pour avoir la même dose de nicotine.
Tabagisme passif
Le tabagisme passif provient du courant latéral de la cigarette (courant secondaire) ou de la fumée émis par le fumeur (courant tertiaire). Ces courants sont encore plus riches en produits cancérogènes que la fumée inhalée par le fumeur (courant primaire). Le tabagisme passif augmente le risque de cancer du poumon et serait responsable d’environ 25 % des cancers du non-fumeur en France, soit entre 1 000 et 1 500 cas par an.5 Ce risque est décrit pour des non-fumeurs exposés à la fumée de tabac en milieu familial (conjoint[e] qui fume) ou sur le lieu de travail (bars et restaurants avant 2007).
Cannabis
Le cannabis est la première drogue illicite consommée en France. La fumée des joints est proche de celle de la cigarette. Contrairement aux effets bien décrits de la fumée de cigarette sur le poumon, les effets de la fumée de cannabis restent controversés. Dans une analyse systématique récente sur 8 études, aucune conclusion concernant le risque de cancer du poumon et la consommation de cannabis n’a pu être posée.6 Dans ces études, la plupart des fumeurs de cannabis fumaient également des cigarettes, ce qui rend difficile l’évaluation du lien de causalité. Des recherches supplémentaires sont nécessaires pour connaître les risques de cancer liés à la consommation de cannabis.
Facteurs de risque liés à l’environnement
Le risque de cancer du poumon est beaucoup plus élevé chez les travailleurs exposés à l’amiante ; ce risque se multiplie avec celui du tabac.7 L’interdiction de l’amiante en France en 1997 a considérablement réduit son utilisation. Mais il est encore présent dans de nombreuses maisons et autres bâtiments anciens, où il n’est généralement pas considéré comme nocif tant qu’il n’est pas détérioré.
Le radon est un gaz radioactif naturel qui résulte de la dégradation de l’uranium dans le sol et les roches. L’exposition au radon est importante dans certaines régions riches en granit en France (Corse, Bretagne). Ce gaz est la deuxième cause de cancer du poumon, en particulier chez les non-fumeurs.
D’autres cancérogènes trouvés dans certains lieux de travail, tels que les minerais radioactifs (uranium), les produits chimiques (arsenic, béryllium, cadmium, silice, chlorure de vinyle, etc.), peuvent augmenter le risque de cancer du poumon.
Dans les villes, la pollution de l’air semble augmenter légèrement le risque de cancer du poumon. Ce risque est bien inférieur au risque causé par le tabagisme, mais certains chercheurs estiment que, dans le monde entier, environ 5 % de tous les décès par cancer du poumon peuvent être dus à la pollution de l’air extérieur.8
Le radon est un gaz radioactif naturel qui résulte de la dégradation de l’uranium dans le sol et les roches. L’exposition au radon est importante dans certaines régions riches en granit en France (Corse, Bretagne). Ce gaz est la deuxième cause de cancer du poumon, en particulier chez les non-fumeurs.
D’autres cancérogènes trouvés dans certains lieux de travail, tels que les minerais radioactifs (uranium), les produits chimiques (arsenic, béryllium, cadmium, silice, chlorure de vinyle, etc.), peuvent augmenter le risque de cancer du poumon.
Dans les villes, la pollution de l’air semble augmenter légèrement le risque de cancer du poumon. Ce risque est bien inférieur au risque causé par le tabagisme, mais certains chercheurs estiment que, dans le monde entier, environ 5 % de tous les décès par cancer du poumon peuvent être dus à la pollution de l’air extérieur.8
Prévention des cancers du poumon
Le bénéfice maximal sur la réduction de la mortalité spécifique liée aux cancers du poumon pourrait être observé par le sevrage tabagique et le dépistage par tomodensitométrie thoracique.
Dépistage des cancers du poumon
L’objectif du dépistage est de diagnostiquer la maladie à un stade précoce pour opérer plus de patients et améliorer le pronostic. L’étude du National Lung Cancer Screening Trial (NLST) ainsi que l’étude belgo-néerlandaise NELSON ont montré dans la population générale (âge de 55 à 74 ans, fumeurs de plus de 30 paquets-années dans l’étude NLST et 25 paquets-années dans l’étude NELSON) que le dépistage du cancer du poumon par scanner thoracique à faible dose permettait de réduire la mortalité spécifique par cancer du poumon (20 % dans l’étude NLST et 26 % dans l’étude NELSON).9, 10 À la suite de la publication de ces données européennes, la position de la Haute Autorité de santé (HAS) sur le dépistage, actuellement non recommandé en France, devrait changer.
Cependant, dans l’étude NLST, l’arrêt du tabac dans le bras contrôle permettait dès la 7e année de réduire la mortalité spécifique par cancer du poumon au même niveau que le dépistage.11 Le bénéfice maximal serait observé avec la combinaison du sevrage tabagique et du dépistage par scanner thoracique à faible dose, avec une réduction estimée de 38 % de la mortalité spécifique par cancer du poumon dans l’étude NLST.11
Cependant, dans l’étude NLST, l’arrêt du tabac dans le bras contrôle permettait dès la 7e année de réduire la mortalité spécifique par cancer du poumon au même niveau que le dépistage.11 Le bénéfice maximal serait observé avec la combinaison du sevrage tabagique et du dépistage par scanner thoracique à faible dose, avec une réduction estimée de 38 % de la mortalité spécifique par cancer du poumon dans l’étude NLST.11
Arrêt du tabac
L’arrêt du tabac reste de loin la mesure la plus efficace pour limiter l’épidémie de cancer du poumon, mais également les autres pathologies respiratoires ou cardiovasculaires liées au tabac.
Mesures de santé publique pour favoriser le sevrage tabagique
Les mesures efficaces de lutte contre le tabac sont connues : interdiction de la publicité, message sanitaire sur les paquets, paquet neutre, augmentation importante du prix du tabac et promotion du sevrage. La mise en œuvre de ces mesures dépend essentiellement de la volonté politique dans la lutte contre le tabac. L’analyse des données françaises de vente de tabac montre une première baisse après l’application de la loi Évin en 1991 (interdiction de la publicité, interdiction de fumer dans les espaces publics), suivie d’une période de forte baisse d’environ 30 % lors de la mise en place du premier Plan cancer en 2002 (augmentation importante du prix du tabac) ; entre ces deux périodes, la consommation est restée en plateau. Si la baisse des ventes observées durant la période 1991-1997 s’était poursuivie pendant la période 1997-2001, près de 10 000 vies auraient pu être sauvées. En revanche, la mise en place du premier Plan cancer a permis de sauver 25 000 vies en seulement deux ans. L’instauration du paquet neutre ainsi que le remboursement des substituts nicotiniques et de la varénicline, la mise en place de l’événement national de prévention et d’aide au sevrage tabagique « Mois sans tabac » ont permis une forte baisse de la prévalence du tabagisme de 29,4 à 26,9 % entre 2016 et 2018, soit 1,8 million de fumeurs en moins. Cette baisse devrait se poursuivre en raison de l’augmentation importante du prix de paquet de cigarettes, à 10 euros depuis mars 2020.
Les deux modalités qui ont prouvé leur efficacité, sont le traitement pharmacologique par substituts nicotiniques, varénicline ou bupropion, ainsi que le suivi en consultation de tabacologie.
Les deux modalités qui ont prouvé leur efficacité, sont le traitement pharmacologique par substituts nicotiniques, varénicline ou bupropion, ainsi que le suivi en consultation de tabacologie.
Substituts nicotiniques
De nombreuses études et méta-analyses ont prouvé l’efficacité des substituts nicotiniques comparés à un placebo qui permet de multiplier par 2 le pourcentage de succès de sevrage à 1 an (20 % vs 10 %).12 Il existe différentes galéniques de substitution nicotinique, avec des cinétiques différentes : patchs, gommes, pastilles, inhaleurs et sprays.
Les patchs (16 ou 24 heures) délivrent de la nicotine de façon continue par voie transdermique sur 16 ou 24 heures. L’absorption se fait de façon continue, avec un plateau de nicotine obtenu une heure après la pose du premier timbre. En cas de troubles du sommeil, il est possible de retirer le patch la nuit. Cependant, la chute de la nicotine au cours du sommeil peut entraîner des envies de fumer matinales.
Les gommes (2 ou 4 mg) permettent une absorption de nicotine à travers la muqueuse buccale et soulagent le manque en quelques minutes. La gomme doit être gardée en bouche pendant 20 à 30 minutes et être mastiquée en cas d’envie de fumer. Les comprimés (2 ou 4 mg) sublinguaux ou à sucer ont une absorption et une efficacité similaires aux gommes.
L’inhaleur contient une cartouche imprégnée de nicotine qui est aspirée par le fumeur sous forme de fines gouttelettes, avec un passage au niveau de la muqueuse buccale. Son intérêt repose sur la reproduction de la gestuelle du comportement tabagique et une absorption un peu plus rapide que les gommes ou comprimés. Le spray a une absorption et une efficacité similaires à l’inhaleur.
Actuellement, il est recommandé de prescrire un patch à diffusion lente associé à une galénique à diffusion rapide (pastille, gomme, inhalateur, spray). Les substituts nicotiniques, à l’exception de l’inhaleur ou du spray, sont remboursés par la Sécurité sociale.
La stratégie de réduction de la consommation de tabac peut être proposée en cas d'échec du sevrage ou d’absence de motivation ; elle doit être envisagée avec l’utilisation de substituts nicotiniques. L’objectif est de réduire le nombre de cigarettes avant un arrêt complet. La réduction du tabac peut avoir une influence positive sur la motivation d’arrêt.
Les patchs (16 ou 24 heures) délivrent de la nicotine de façon continue par voie transdermique sur 16 ou 24 heures. L’absorption se fait de façon continue, avec un plateau de nicotine obtenu une heure après la pose du premier timbre. En cas de troubles du sommeil, il est possible de retirer le patch la nuit. Cependant, la chute de la nicotine au cours du sommeil peut entraîner des envies de fumer matinales.
Les gommes (2 ou 4 mg) permettent une absorption de nicotine à travers la muqueuse buccale et soulagent le manque en quelques minutes. La gomme doit être gardée en bouche pendant 20 à 30 minutes et être mastiquée en cas d’envie de fumer. Les comprimés (2 ou 4 mg) sublinguaux ou à sucer ont une absorption et une efficacité similaires aux gommes.
L’inhaleur contient une cartouche imprégnée de nicotine qui est aspirée par le fumeur sous forme de fines gouttelettes, avec un passage au niveau de la muqueuse buccale. Son intérêt repose sur la reproduction de la gestuelle du comportement tabagique et une absorption un peu plus rapide que les gommes ou comprimés. Le spray a une absorption et une efficacité similaires à l’inhaleur.
Actuellement, il est recommandé de prescrire un patch à diffusion lente associé à une galénique à diffusion rapide (pastille, gomme, inhalateur, spray). Les substituts nicotiniques, à l’exception de l’inhaleur ou du spray, sont remboursés par la Sécurité sociale.
La stratégie de réduction de la consommation de tabac peut être proposée en cas d'échec du sevrage ou d’absence de motivation ; elle doit être envisagée avec l’utilisation de substituts nicotiniques. L’objectif est de réduire le nombre de cigarettes avant un arrêt complet. La réduction du tabac peut avoir une influence positive sur la motivation d’arrêt.
Varénicline
La varénicline (Champix), agoniste partiel des récepteurs nicotiniques α4β2, augmente les chances de succès du sevrage tabagique à long terme.13 Les effets indésirables sous varénicline sont des nausées et des troubles du sommeil. Pour limiter ces effets, il est recommandé de prendre le comprimé de varénicline avec une collation et de prendre le comprimé du soir en début de soirée. La crainte d’effets indésirables graves (dépression, suicide) a longtemps limité son utilisation. En 2016, les résultats de l’étude randomisée en triple aveugle EAGLES, qui a comparé la varénicline aux substituts nicotiniques, au bupropion et au placebo dans deux cohortes, avec ou sans antécédent psychiatrique, ont été rapportés. Il n’y avait pas davantage de complications neuropsychiatriques (objectif principal) sous varénicline par rapport au placebo. Le taux de sevrage tabagique était significativement plus élevé sous varénicline que sous substitution nicotinique.14 La varénicline est depuis remboursée en deuxième intention, après échec des substituts nicotiniques chez les fumeurs fortement dépendants (test de Fagerström ≥ 7).
Pour favoriser une bonne tolérance du traitement, la posologie de la varénicline est augmentée progressivement (J1 à J3 0,5 mg le matin, puis J4 à J7 0,5 mg matin et soir, puis J8 jusqu’à la fin du traitement 1 mg matin et soir). L’arrêt du tabac doit intervenir au cours de la deuxième semaine de traitement. La durée recommandée du traitement est de 12 semaines.
Pour favoriser une bonne tolérance du traitement, la posologie de la varénicline est augmentée progressivement (J1 à J3 0,5 mg le matin, puis J4 à J7 0,5 mg matin et soir, puis J8 jusqu’à la fin du traitement 1 mg matin et soir). L’arrêt du tabac doit intervenir au cours de la deuxième semaine de traitement. La durée recommandée du traitement est de 12 semaines.
Bupropion
Le bupropion est un inhibiteur de la capture de la dopamine et de la noradrénaline. Il n’est pas remboursé et est peu utilisé dans le sevrage tabagique en raison des nombreuses contre-indications : antécédents de convulsions, tumeurs du système nerveux central, sevrage alcoolique ou tout autre médicament à risque convulsif, en particulier benzodiazépines.
Traitements non pharmacologiques
L’objectif des thérapies cognitives et comportementales réalisées au cours des consultations de tabacologie est d’aider le fumeur à se débarrasser de son comportement de fumeur par l’apprentissage d’un nouveau comportement. Cette prise en charge fait partie des recommandations de la HAS.
L’acupuncture, l’hypnose, l’homéopathie sont utilisées de longue date dans le sevrage tabagique. Ces techniques ne sont pas reconnues comme efficaces par la conférence de consensus. Elles peuvent être proposées en complément des traitements et techniques validés.
L’acupuncture, l’hypnose, l’homéopathie sont utilisées de longue date dans le sevrage tabagique. Ces techniques ne sont pas reconnues comme efficaces par la conférence de consensus. Elles peuvent être proposées en complément des traitements et techniques validés.
Place de l’e-cigarette
La place de la cigarette électronique dans le sevrage tabagique reste débattue. Dans l’analyse Cochrane portant sur trois essais randomisés contrôlés incluant 1 246 patients, la cigarette électronique multiplie par 2 le taux d’arrêt du tabac.15 Néanmoins, la qualité des preuves est incertaine en raison du faible nombre de fumeurs inclus et du plan d’analyse des différentes études. En 2019 a été publié un essai sur 886 fumeurs montrant un taux de sevrage tabagique à 1 an à 18 % avec la cigarette électronique contre 9,9 % avec les substituts nicotiniques.16
La HAS considère que la cigarette électronique peut être un outil d’aide au sevrage tabagique pour les populations fumeuses désireuses d’arrêter leur consommation de tabac. La cigarette électronique constitue un outil de réduction des risques du tabagisme, l’objectif étant d’arrêter complètement le tabac.
La HAS considère que la cigarette électronique peut être un outil d’aide au sevrage tabagique pour les populations fumeuses désireuses d’arrêter leur consommation de tabac. La cigarette électronique constitue un outil de réduction des risques du tabagisme, l’objectif étant d’arrêter complètement le tabac.
Dénormaliser le tabac
En France, les cancers du poumon sont la première cause de mortalité par cancer, avec plus de 30 000 décès par an. La très grande majorité (85 %) des cancers sont dus au tabac. Le tabagisme passif augmente aussi le risque de cancer du poumon du non-fumeur et serait responsable d’environ 25 % de ces cancers.
Le bénéfice maximal sur la réduction de la mortalité par cancer du poumon pourrait être observé par le sevrage tabagique et le dépistage par scanner thoracique. Le dépistage a montré son efficacité, mais n’est pas à ce jour recommandé en France.
L’arrêt du tabac est la mesure la plus efficace pour limiter l’épidémie de cancer du poumon. Les mesures de santé publique pour favoriser le sevrage tabagique sont connues et comportent des mesures pour dénormaliser le tabac (paquet neutre, interdiction de la publicité) ainsi que l’augmentation importante de son prix. Les traitements qui ont démontré leur efficacité dans le sevrage tabagique sont la substitution nicotinique et la varénicline. La cigarette électronique peut être considérée comme un outil d’aide au sevrage tabagique. Les thérapies cognitives et comportementales, qui permettent d’aider le fumeur à se débarrasser de son comportement, ont une place dans la prévention de la rechute.
Le bénéfice maximal sur la réduction de la mortalité par cancer du poumon pourrait être observé par le sevrage tabagique et le dépistage par scanner thoracique. Le dépistage a montré son efficacité, mais n’est pas à ce jour recommandé en France.
L’arrêt du tabac est la mesure la plus efficace pour limiter l’épidémie de cancer du poumon. Les mesures de santé publique pour favoriser le sevrage tabagique sont connues et comportent des mesures pour dénormaliser le tabac (paquet neutre, interdiction de la publicité) ainsi que l’augmentation importante de son prix. Les traitements qui ont démontré leur efficacité dans le sevrage tabagique sont la substitution nicotinique et la varénicline. La cigarette électronique peut être considérée comme un outil d’aide au sevrage tabagique. Les thérapies cognitives et comportementales, qui permettent d’aider le fumeur à se débarrasser de son comportement, ont une place dans la prévention de la rechute.
Références
1. Peto R, Darby S, Deo H, Silcocks P, Whitley E, Doll R. Smoking, smoking cessation, and lung cancer in the UK since 1950: combination of national statistics with two case-control studies. BMJ 2000;321:323‑9.
2. Hill C, Jougla E, Beck F. Le point sur l’épidémie de cancer du poumon dû au tabagisme. BEH 2010;19‑20:210‑3.
3. Doll R, Peto R. Cigarette smoking and bronchial carcinoma: dose and time relationships among regular smokers and lifelong non-smokers. J Epidemiol Community Health 1978;32:303‑13.
4. Gandini S, Botteri E, Iodice S, et al. Tobacco smoking and cancer: a meta-analysis. Int J Cancer 2008;122:155‑64.
5. Hill C. Les effets sur la santé du tabagisme passif. BEH 2011;20-21:233‑5.
6. Ghasemiesfe M, Barrow B, Leonard S, Keyhani S, Korenstein D. Association between marijuana use and risk of cancer: a systematic review and meta-analysis. JAMA Netw Open 2019;2:e1916318.
7. Klebe S, Leigh J, Henderson DW, Nurminen M. Asbestos, smoking and lung cancer: an update. Int J Environ Res Public Health 2019;17:258.
8. Raaschou-Nielsen O, Andersen ZJ, et al. Air pollution and lung cancer incidence in 17 European cohorts: prospective analyses from the European Study of Cohorts for Air Pollution Effects (ESCAPE). Lancet Oncol 2013;14:813‑22.
9. de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced lung-cancer mortality with volume CT screening in a randomized trial. N Engl J Med 2020;382:503‑13.
10. National Lung Screening Trial Research Team, Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011;365:395‑409.
11. Tanner NT, Kanodra NM, Gebregziabher M, et al. The association between smoking abstinence and mortality in the national lung screening trial. Am J Respir Crit Care Med 2015;193:534‑41.
12. Lindson N, Chepkin SC, Ye W, Fanshawe TR, Bullen C, Hartmann-Boyce J. Different doses, durations and modes of delivery of nicotine replacement therapy for smoking cessation. Cochrane Database of Systematic Reviews 2019;4:1-134. www.cochranelibrary.com ou https://bit.ly/36f30T8
13. Jorenby DE, Hays JT, Rigotti NA, et al. Efficacy of varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs placebo or sustained-release bupropion for smoking cessation: a randomized controlled trial. JAMA 2006;296:56‑63.
14. Anthenelli RM, Benowitz NL, West R, et al. Neuropsychiatric safety and efficacy of varenicline, bupropion, and nicotine patch in smokers with and without psychiatric disorders (EAGLES): a double-blind, randomised, placebo-controlled clinical trial. Lancet 2016;387:2507‑20.
15. Hartmann-Boyce J, McRobbie H, Bullen C, Begh R, Stead LF, Hajek P. Electronic cigarettes for smoking cessation. Cochrane Database Syst Rev 2016;9:CD010216.
16. Hajek P, Phillips-Waller A, Przulj D, et al. A randomized trial of e-cigarettes versus nicotine-replacement therapy. N Engl J Med 2019;380:629‑37.
2. Hill C, Jougla E, Beck F. Le point sur l’épidémie de cancer du poumon dû au tabagisme. BEH 2010;19‑20:210‑3.
3. Doll R, Peto R. Cigarette smoking and bronchial carcinoma: dose and time relationships among regular smokers and lifelong non-smokers. J Epidemiol Community Health 1978;32:303‑13.
4. Gandini S, Botteri E, Iodice S, et al. Tobacco smoking and cancer: a meta-analysis. Int J Cancer 2008;122:155‑64.
5. Hill C. Les effets sur la santé du tabagisme passif. BEH 2011;20-21:233‑5.
6. Ghasemiesfe M, Barrow B, Leonard S, Keyhani S, Korenstein D. Association between marijuana use and risk of cancer: a systematic review and meta-analysis. JAMA Netw Open 2019;2:e1916318.
7. Klebe S, Leigh J, Henderson DW, Nurminen M. Asbestos, smoking and lung cancer: an update. Int J Environ Res Public Health 2019;17:258.
8. Raaschou-Nielsen O, Andersen ZJ, et al. Air pollution and lung cancer incidence in 17 European cohorts: prospective analyses from the European Study of Cohorts for Air Pollution Effects (ESCAPE). Lancet Oncol 2013;14:813‑22.
9. de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced lung-cancer mortality with volume CT screening in a randomized trial. N Engl J Med 2020;382:503‑13.
10. National Lung Screening Trial Research Team, Aberle DR, Adams AM, Berg CD, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011;365:395‑409.
11. Tanner NT, Kanodra NM, Gebregziabher M, et al. The association between smoking abstinence and mortality in the national lung screening trial. Am J Respir Crit Care Med 2015;193:534‑41.
12. Lindson N, Chepkin SC, Ye W, Fanshawe TR, Bullen C, Hartmann-Boyce J. Different doses, durations and modes of delivery of nicotine replacement therapy for smoking cessation. Cochrane Database of Systematic Reviews 2019;4:1-134. www.cochranelibrary.com ou https://bit.ly/36f30T8
13. Jorenby DE, Hays JT, Rigotti NA, et al. Efficacy of varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs placebo or sustained-release bupropion for smoking cessation: a randomized controlled trial. JAMA 2006;296:56‑63.
14. Anthenelli RM, Benowitz NL, West R, et al. Neuropsychiatric safety and efficacy of varenicline, bupropion, and nicotine patch in smokers with and without psychiatric disorders (EAGLES): a double-blind, randomised, placebo-controlled clinical trial. Lancet 2016;387:2507‑20.
15. Hartmann-Boyce J, McRobbie H, Bullen C, Begh R, Stead LF, Hajek P. Electronic cigarettes for smoking cessation. Cochrane Database Syst Rev 2016;9:CD010216.
16. Hajek P, Phillips-Waller A, Przulj D, et al. A randomized trial of e-cigarettes versus nicotine-replacement therapy. N Engl J Med 2019;380:629‑37.