L’augmentation de la prévalence de l’hyperuricémie peut être liée à l’extension de l’épidémie d’obésité, à une modification de l’alimentation (aliments transformés, riches en purines, consommation excessive d’alcool, de sodas) et à l’utilisation plus fréquente de diurétiques.
Le rôle pathogénique de l’acide urique dans les maladies cardiométaboliques et rénales et le maintien d’un état inflammatoire de bas grade favorisé par les dépôts d’urate dans les tissus soulèvent la question du traitement d’une hyperuricémie asymptomatique : doit-on faire baisser l’uricémie et, si oui, à partir de quelle valeur seuil ?
Physiopathologie de l’hyperuricémie
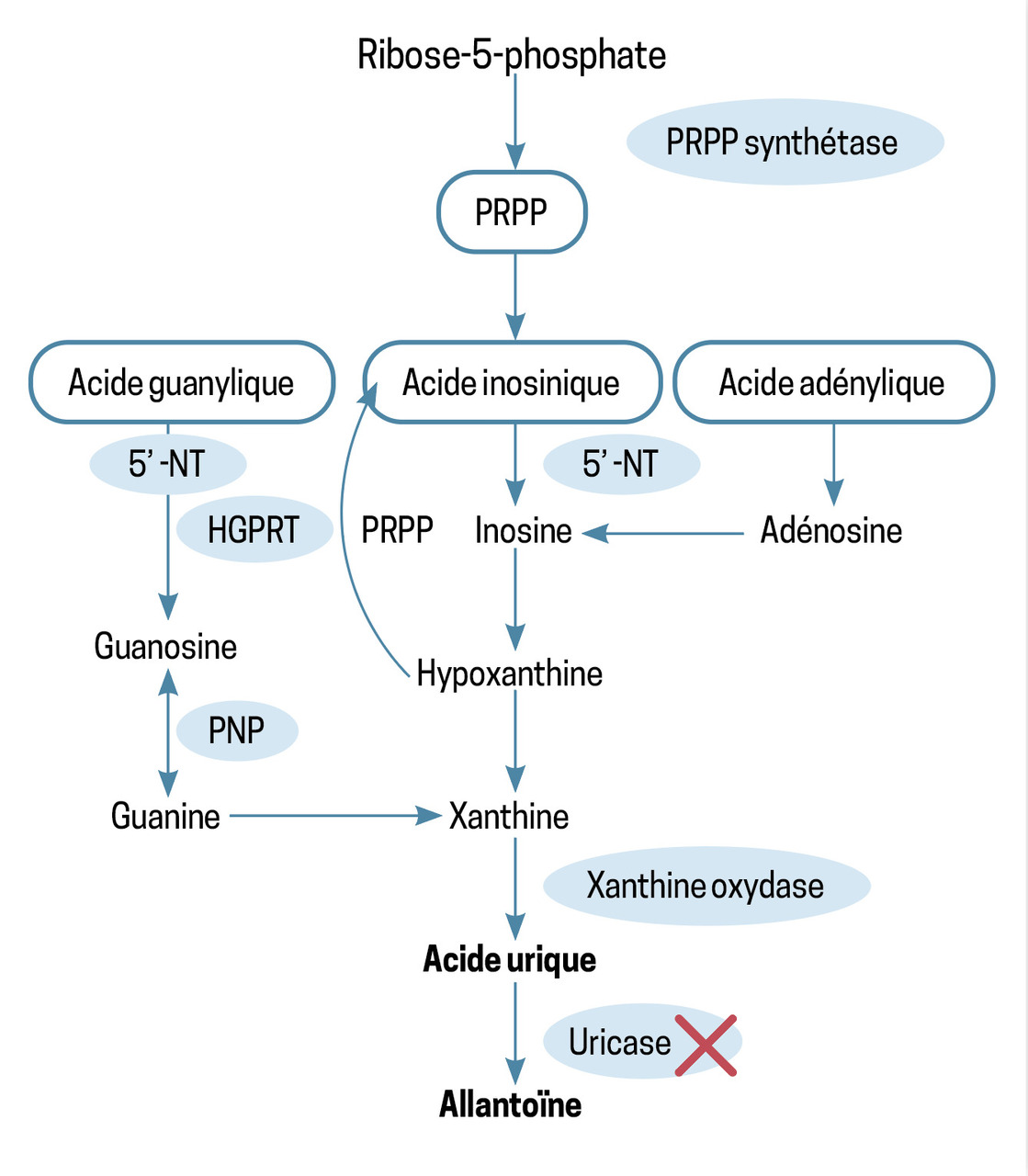
L’acide urique est le produit final du catabolisme des purines. Sa faible solubilité dans l’eau explique la pathologie de surcharge au cours de l’hyperuricémie.
Sa concentration plasmatique dépend d’un équilibre entre sa synthèse et son élimination, qui sont régulées par des facteurs génétiques et diététiques. L’acide urique provient des purines alimentaires, du catabolisme des acides nucléiques cellulaires et de la purinosynthèse de novo (figure). Les deux tiers de l’acide urique sont éliminés par voie rénale et le tiers restant par voie digestive.
De l’hyperuricémie asymptomatique à la goutte
La valeur pathogénique correspond au seuil de solubilité de l’urate de sodium dans le plasma, au-dessus duquel l’urate se cristallise. Reste à déterminer ce point de saturation en urate, défini le plus souvent dans la littérature par une uricémie supérieure à 68 mg (408 μmol/L) ou à 70 mg/L (420 μmol/L).
Le seuil de 60 mg/L (360 μmol/L) a été retenu dans les dernières recommandations de la Ligue européenne contre les rhumatismes (EULAR). Il s’agit d’une valeur seuil à la fois du risque de goutte et de l’objectif à atteindre (uricémie cible) après mise en place d’un traitement hypo-uricémiant.
Le seuil d’uricémie à partir duquel apparaît un risque cardiométabolique et/ou rénal n’est pas connu.
L’hyperuricémie est une condition nécessaire mais non suffisante pour l’apparition d’une goutte. Néanmoins, la présence de dépôts d’urate dans les articulations et les tendons chez des patients ayant une hyperuricémie asymptomatique chronique a été rapportée par plusieurs études d’imagerie en échographie et scanner double énergie.
Ces éléments ont conduit à proposer une nouvelle classification des stades évolutifs de la goutte, en introduisant un stade asymptomatique de dépôts de cristaux d’urate entre le stade d’hyperuricémie asymptomatique sans dépôts d’urate et le stade d’accès goutteux intermittents avec dépôts d’urate. Cette nouvelle classification selon les données de l’échographie serait-elle de nature à reconsidérer les indications du traitement hypo-uricémiant ?
Quand doser l’acide urique ?
L’acide urique est dosé de façon ciblée lors d’un bilan de comorbidités (hypertension artérielle, insuffisance rénale, diabète, dyslipidémie), lors de la prise de certains diurétiques, au décours d’un accès goutteux et dans le cadre d’une goutte chronique.
Un dosage en routine de façon systématique n’a pas d’intérêt.
Doit-on traiter l’hyperuricémie asymptomatique ?
Une association entre l’uricémie et le développement ou la progression d’une insuffisance rénale a été mise en évidence dans plusieurs études épidémiologiques ; cette association est également significative avec l’hypertension artérielle et le syndrome métabolique.
Cependant, le rapport bénéfice/risque d’un traitement hypo-uricémiant reste incertain. Les données sur l’efficacité de l’allopurinol ou du fébuxostat dans des indications « non goutteuses » sont limitées, avec un niveau de preuve insuffisant pour suggérer que la baisse de l’uricémie chez les sujets asymptomatiques pourrait prévenir la goutte, les maladies cardiométaboliques et l’insuffisance rénale. Il est important de souligner que la moitié des patients avec une hyperuricémie n’évoluent pas vers la goutte. De plus, le traitement n’est pas anodin : risque de réaction d’hypersensibilité grave avec l’allopurinol (incidence 0,1 à 0,4 % ; mortalité comprise entre 5 et 30 %) et risque de décompensation cardiaque sous fébuxostat.
Pour le moment, aucune société savante européenne (EULAR, British Society of Rheumatology) ni américaine (American College of Rheumatology) ne recommande l’utilisation d’un traitement hypo-uricémiant dans la prise en charge d’une hyperuricémie asymptomatique. Seule la Société japonaise de la goutte suggère la mise en place d’un traitement pour des taux très élevés d’acide urique (homme : 773 μmol/L ; femme : 595 μmol/L) ou en cas de comorbidités associées, notamment l’insuffisance rénale sévère.
Que faire en cas d’hyperuricémie asymptomatique ?
En l’absence de données suffisantes pour recommander le traitement de l’hyperuricémie asymptomatique, une prise en charge des comorbidités cardiométaboliques et rénales est prioritaire,de même que les mesures hygiénodiététiques.
Ainsi, avant toute intervention thérapeutique et devant une hyperuricémie asymptomatique, plusieurs mesures doivent être prises :
- identifier les causes ou facteurs modifiables de l’hyperuricémie (habitudes de vie, obésité, médicaments hyperuricémiants) ;
- lister les comorbidités (indice de masse corporelle, périmètre abdominal, pression artérielle, score de risque cardiovasculaire) et adapter leur traitement ;
- chercher des dépôts d’urate tissulaire (peau, articulations, reins) par l’examen clinique et l’échographie. Une surveillance régulière de l’uricémie et de la fonction rénale est de rigueur ;
- réaliser les bilans hématologique, hépatique, métabolique (glycémie, lipides), rénal et phosphocalcique. Le calcul de la fraction d’excrétion de l’urate et l’évaluation du pH urinaire sont à déterminer.
De plus, il convient de proposer et d’encourager :
- les mesures diététiques : supprimer la consommation de bière, d’alcools forts et de sodas sucrés contenant du fructose (voir l’étiquetage) ; limiter la consommation de protéines animales et de quelques aliments riches en purines (alterner viande maigre et poisson, à consommer avec modération) ; favoriser les laitages allégés et la vitamine C ;
- la perte de poids, susceptible de diminuer l’uricémie ;
- l’activité physique ;
- la prise en charge des comorbidités ; il faut essayer, dans la mesure du possible, d’arrêter les médicaments hyperuricémiants.
En cas de dyslipidémie, il est nécessaire de tenir compte des effets uricosuriques du fénofibrate ou des statines.
Le traitement de l’hypertension artérielle peut être adapté : remplacer des molécules hyperuricémiantes (diurétiques thiazidiques et bêtabloquants) par des molécules hypo-uricémiantes (losartan et inhibiteurs calciques) ; privilégier l’aspirine au clopidogrel ; choisir la spironolactone comme diurétique quand cela est possible.
Concernant le traitement du diabète, les biguanides sont à préférer.
Yip K, Cohen RE, Pillinger MH. Asymptomatic uricemia: is it really asymptomatic? Curr Opin Rheumatol 2020;32(1):71-9.
Petreski T, Ekart R, Hojs R, et al. Hyperuricemia, the heart, and the kidneys–to treat or not to treat. Ren Fail 2020;42(1):978-86.
Chalès G. How should we manage asymptomatic hyperuricemia? Joint Bone Spine 2019;86(4):437-43.
Abhishek A, Doherty M. Education and non-pharmacological approaches for gout. Rheumatology 2018;57(suppl_1):51-8.
Lopez-Pineda A, Cordero A, Carratala-Munuera C, et al. Hyperuricemia as a prognostic factor after acute coronary syndrome. Atherosclerosis 2018;269:229-35.
So A. Avancées récentes dans la physiopathologie de l’hyperuricémie et de la goutte. Rev Med Suisse 2007;3(103):720-4.