DIAGNOSTIQUER une fibrillation atriale. IDENTIFIER les situations d’urgence et PLANIFIER leur prise en charge. ARGUMENTER l’attitude thérapeutique et PLANIFIER le suivi du patient.
Malgré une amélioration de la prise en charge ces dernières années, la fibrillation atriale est associée à une morbidité cardiovasculaire significative, notamment un risque d’accident vasculaire cérébral (AVC) et la survenue d’une insuffisance cardiaque.
Par ailleurs, la mortalité des patients présentant une fibrillation atriale est 2 à 3 fois supérieure par rapport à une population témoin, sans fibrillation atriale. Ceci est en partie lié au fait que ce n’est pas une maladie isolée mais le plus souvent associée à une cardiopathie sous-jacente, qui elle-même entrave le pronostic.
Physiopathologie
- un trigger : le plus souvent une extrasystole particulièrement précoce (provenant en particulier des veines pulmonaires) ;
- un substrat : remodelage fibreux atrial secondaire à une surcharge en pression et/ou en volume de l’oreillette gauche, lit de mécanismes de « réentrées » électriques ;
- une ambiance autonomique favorisante (certaines FA sont dites vagales, c’est-à-dire démarrant le plus souvent en périodes vagales, d’autres plus adrénergiques).
Voilà pourquoi désormais les recommandations des sociétés savantes mettent en avant l’importance d’intervenir relativement précocement chez les patients atteints de fibrillation atriale symptomatique.
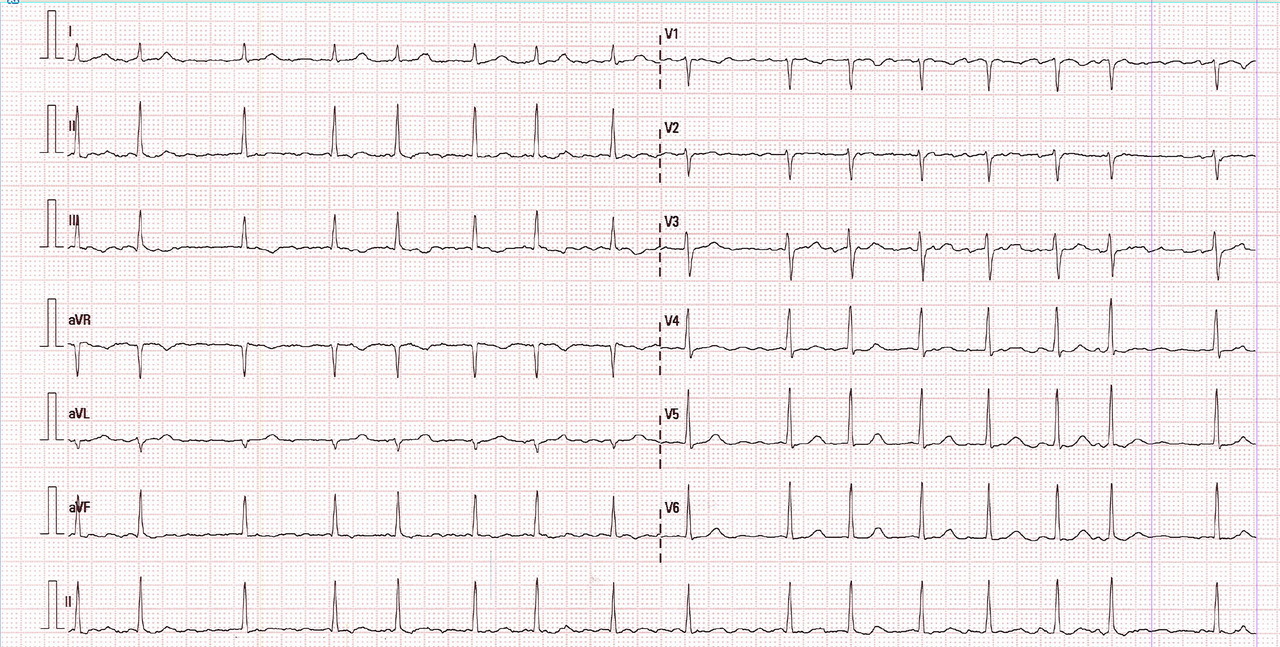
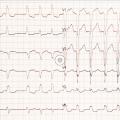
Le patient en fibrillation atriale présente donc des dépolarisations atriales extrêmement rapides (à environ 300-400/min), anarchiques, empêchant alors le nœud sinusal d’imposer son rythme. Parmi ces influx, certains passeront le nœud atrioventriculaire aléatoirement pour aller dépolariser les ventricules.
Définition
Diagnostic
Voilà pourquoi toute tachycardie irrégulière à QRS fins est a priori une fibrillation atriale (à l’exception du flutter à conduction variable).
Chez un patient se plaignant de palpitations intermittentes, un enregistrement de longue durée (Holter-ECG) peut être demandé afin objectiver de la fibrillation atriale concomitante de la symptomatologie.
Cas particuliers :
- si le patient est déjà sous traitement ralentisseur (du nœud atrioventriculaire), le rythme peut ne pas être tachycarde ;
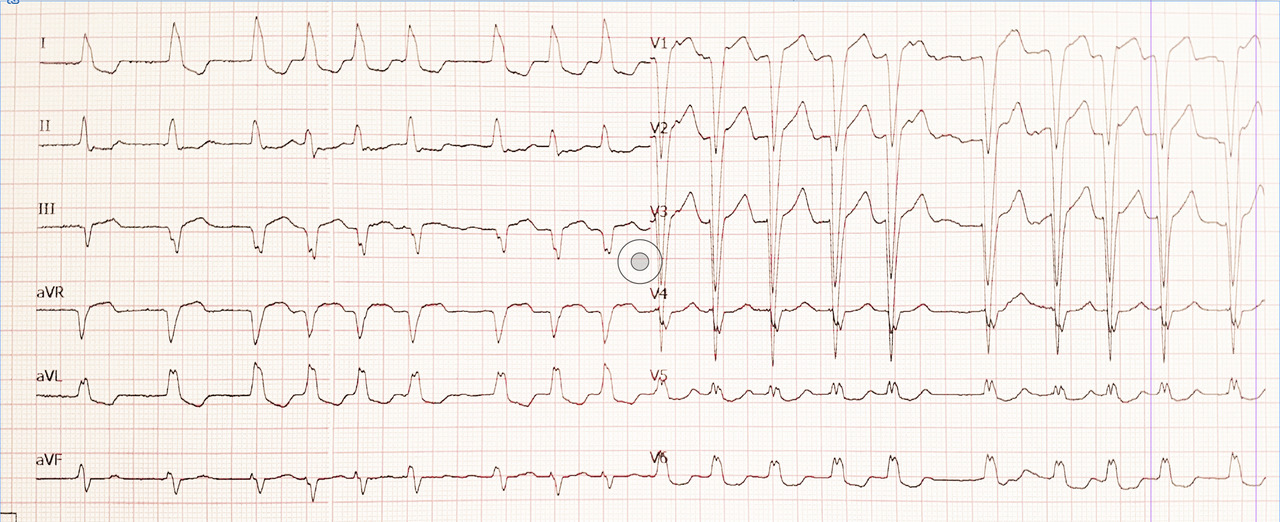
- en cas de présence d’un bloc de branche, la tachycardie sera irrégulière mais à QRS larges ;
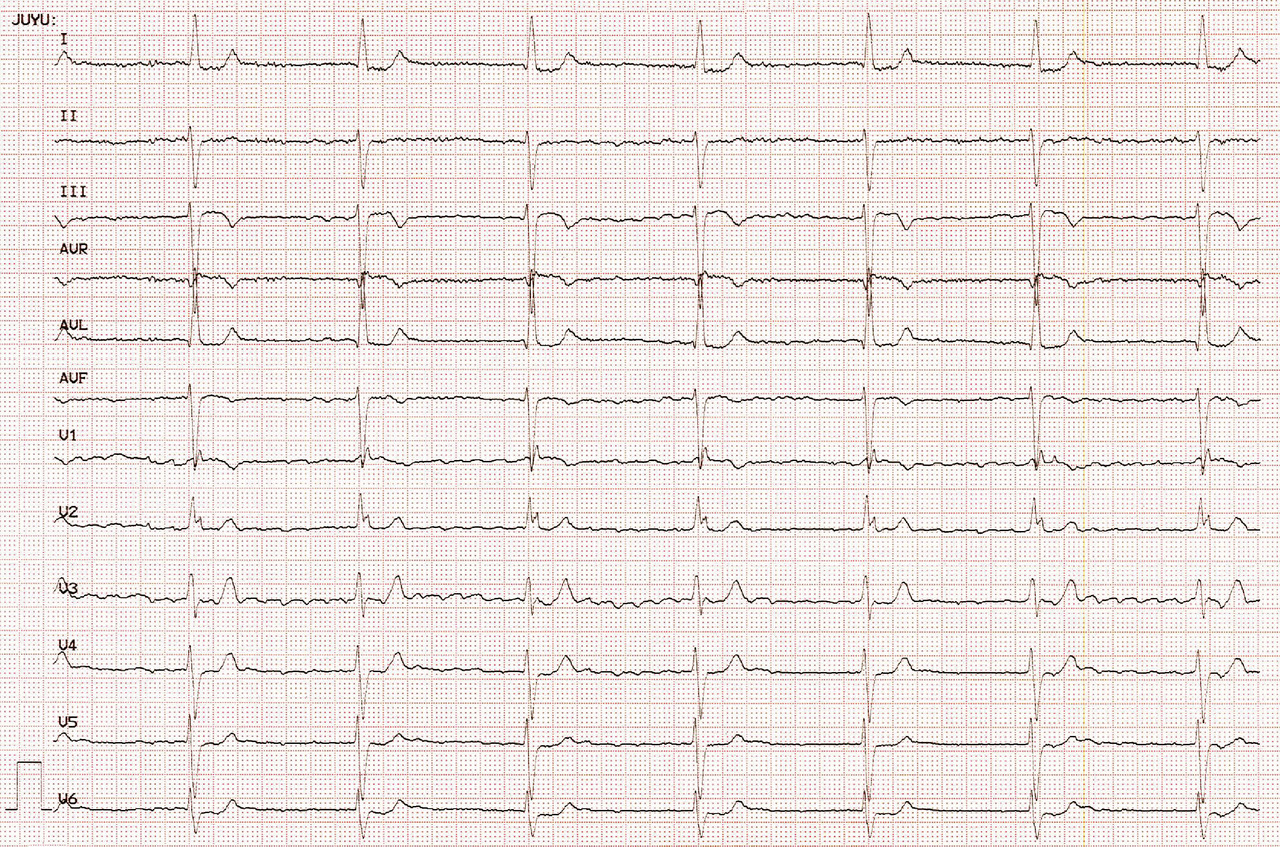
- si le patient présente un bloc atrioventriculaire complet associé à une fibrillation atriale, alors le tracé sera celui d’une fibrillation atriale régulière, avec un échappement ventriculaire. La largeur et la cadence de l’échappement dépendront de son niveau dans le tissu nodal : plus il sera bas situé, plus les complexes QRS seront larges et lents.
Classification
- Premier épisode ;
- Paroxystique : épisodes de fibrillation atriale résolutifs dans les 7 jours, spontanément ou par cardioversion ;
- Persistante : épisodes de fibrillation atriale durant plus de 7 jours ;
- Permanente (et non « chronique ») : fibrillation atriale acceptée par le médecin, c’est-à-dire qu’il n’y aura plus de tentative de contrôle du rythme (cardioversion/ablation), uniquement un contrôle de la fréquence ventriculaire par un traitement ralentisseur.
Étiologie
Il existe néanmoins des fibrillations atriales sur cœur sain, dites fibrillations atriales isolées (10 %).
Les principaux facteurs de risque de la fibrillation atriale sont : l’hypertension artérielle (HTA), l’insuffisance cardiaque ou de manière générale toute cardiopathie sous-jacente (du fait de la surcharge de pression et/ou de volume qui en résulte, entraînant le développement d’un remodelage atrial favorable à l’émergence d’un tel trouble du rythme), l’obésité, et le syndrome d'apnées du sommeil. Il convient de prendre en charge ces facteurs s’ils sont présents afin de mieux contrôler la fibrillation atriale.
Devant la découverte d’une fibrillation atriale, il faut rechercher les facteurs déclenchants aigus réversibles (triggers) : hypokaliémie, hyperthyroïdie, intoxication alcoolique aiguë, embolie pulmonaire, pneumopathie et fièvre.
Néanmoins, il conviendra de considérer ces patients comme à risque de refaire plus tard de la fibrillation atriale car même si la cause de leur épisode est aiguë et réversible, ils présentent assurément une propension anatomique à faire de la fibrillation atriale (substrat sous-jacent).
Le bilan (en plus de l'interrogatoire et de l'examen physique complet à la recherche d'une étiologie et/ou complication) devant toute découverte de fibrillation atriale doit donc comporter :
- ionogramme sanguin ;
- dosage de la thyroid stimulating hormon (TSH) ;
- créatinine et taux de prothrombine-temps de céphaline activée (TP/TCA) [bilan préthérapeutique pour les anticoagulants] ;
- échographie cardiaque transthoracique (recherche de cardiopathie sous-jacente).
Complications
Insuffisance cardiaque
Premièrement, le patient en fibrillation atriale perd sa systole (contraction) atriale qui agit normalement en fin de diastole. En effet, au lieu d’avoir un nœud sinusal qui vient dépolariser en une fois les oreillettes permettant une contraction efficace de celles-ci, les oreillettes en fibrillation atriale trémulent à une fréquence de 300-400/min, ne permettant pas une systole atriale efficace.
Deuxièmement, le plus souvent la cadence ventriculaire chez le patient en fibrillation atriale est rapide, entraînant donc des temps de remplissages ventriculaires plus courts. La diastole ventriculaire étant écourtée, le volume d’éjection systolique se retrouve alors diminué, contribuant au mécanisme d’insuffisance cardiaque.
Ceci explique que le principal traitement de l’insuffisance cardiaque sur fibrillation atriale rapide consiste à administrer des traitements ralentissant le nœud atrioventriculaire, et ainsi la fréquence cardiaque.
Risque embolique
Quel en est le mécanisme ? Le patient en fibrillation atriale perdant sa systole atriale, le sang va alors davantage stagner dans les oreillettes, en particulier dans l’auricule gauche (petite cavité appendue à l’oreillette gauche). Un thrombus pourra alors se former, avec un risque de migration dans la circulation systémique (AVC, mais également dans la rate, le rein, en ostéoarticulaire, un membre...).
La recherche de fibrillation atriale fait donc partie du bilan étiologique de toute ischémie distale de membre, a fortiori sans terrain athéromateux sous-jacent.
Certains facteurs de risque de former un thrombus ont été identifiés, formant le score de CHA2DS2-VASc à connaître (
Pour comprendre cela, chez les patients ayant un score CHA2DS2-VASc à 0, cela ne signifie pas qu’ils n’ont pas de risque d’embolie systémique (qui est en fait d’environ 0,5 %/an), mais que ce risque est inférieur au risque d’hémorragie grave sous anticoagulant (environ 1 %/an).
Stratégie de contrôle du rythme et de la fréquence
- la stratégie de « contrôle du rythme » dont l’objectif est de rétablir le patient en rythme sinusal, et de l’y maintenir grâce aux traitements antiarythmiques ;
- la stratégie de « contrôle de la fréquence » ventriculaire dont l’objectif est de ralentir la fréquence cardiaque d’un patient en fibrillation atriale, grâce aux traitements ralentisseurs.
Contrôle du rythme
- la première concerne le retour en rythme sinusal par cardioversion (électrique ou pharmacologique), après élimination d’un thrombus dans l’auricule gauche ;
- la seconde concerne le maintien en rythme sinusal, grâce aux antiarythmiques ou à l’ablation de fibrillation atriale.
Cardioversion
Lorsqu’un patient est en fibrillation atriale, le médecin peut décider de tenter une réduction par cardioversion, c’est-à-dire de provoquer un retour en rythme sinusal.Celle-ci peut se faire de deux façons :
- soit pharmacologique (par amiodarone, ou flécaïne si cœur sain, avec une dose de charge) ;
- soit par un choc électrique externe (biphasique, synchronisé au QRS pour éviter tout choc sur le sommet de l’onde T qui serait pourvoyeur de fibrillation ventriculaire).
Attention ! En cas de fibrillation atriale, le retour en rythme sinusal par la cardioversion va rétablir une contraction efficace des oreillettes, donc si le patient a un thrombus auriculaire il risque de l’emboliser. C’est pour cette raison qu’avant de réaliser une cardioversion, il faut s’assurer que le patient n’ait pas de thrombus dans son auricule. Ceci peut se faire de deux façons :
- soit par la prescription d’au moins 3 semaines d’anticoagulation (quel que soit le score de CHA2DS2-VASc du patient) pour s’assurer de la dissolution d’un éventuel thrombus ;
- soit par la réalisation d’une échographie transœsophagienne (ETO) pour observer directement l’auricule (mal visualisable par une échographie transthoracique). S’il n’y a pas de thrombus, alors la réduction peut se faire immédiatement (pas de risque d’AVC puisque pas de thrombus). S’il y a un thrombus, alors il faudra attendre au moins 3 semaines d’anticoagulation pour dissoudre ce dernier avant d’envisager une cardioversion (une ETO vérifiant la bonne dissolution du thrombus est alors préconisée).
Deux cas particuliers :
- si l’épisode de fibrillation atriale a débuté il y a moins de 48 heures alors il est possible de réduire directement sans faire d’échographie transœsophagienne et sans attendre 3 semaines d’anticoagulation, le rationnel étant que le patient n’a pas eu le temps de former un thrombus. Néanmoins, il faut avoir daté de manière fiable le début de cet épisode, donc cette situation a généralement lieu à l’hôpital avec la preuve d’un ECG en rythme sinusal à moins de 48 heures de l’épisode objectivé de fibrillation atriale (ou si le patient est extrêmement fiable dans sa description) ;
- si le patient est en choc cardiogénique sur une fibrillation atriale très rapide, alors il est autorisé de réaliser une cardioversion électrique en urgence, au risque de provoquer un AVC (balance bénéfice-risque : décès vs AVC). Ceci rejoint la notion générale selon laquelle « tout trouble du rythme mal toléré doit être choqué en urgence ».
Ce n’est qu’au terme de ces 4 semaines d’anticoagulation que sera calculé le score de CHA2DS2-VASc pour décider ou non d’une anticoagulation au long cours.
Imprégnation en antiarythmique : chez un patient programmé pour une cardioversion électrique, il est possible (mais non obligatoire) de l’imprégner en antiarythmique, c’est-à-dire de commencer à lui administrer quelques jours avant un antiarythmique à dose d’entretien. En effet, cette présence d’antiarythmique dans le sang lors de la cardioversion peut diminuer le risque immédiat de récidive de fibrillation atriale après le retour en rythme sinusal. Attention cependant car cette imprégnation peut réussir à elle seule à réduire le patient, donc elle ne doit commencer qu’après au moins 3 semaines d’anticoagulation.
Maintien en rythme sinusal
Médicaments antiarythmiques : chez un patient ayant eu un épisode de fibrillation atriale symptomatique et étant désormais retourné en rythme sinusal (spontanément ou par cardioversion), des médicaments dits antiarythmiques peuvent être prescrits, dont l’objectif est d’éviter de nouveaux passages en fibrillation atriale.Les antiarythmiques les plus couramment prescrits sont la flécaïne, le sotalol, et l’amiodarone.
Ils présentent des contre-indications à respecter :
- flécaïne : contre-indiquée si cardiopathie sous-jacente ;
- sotalol : contre-indiqué si insuffisance cardiaque ;
- amiodarone : possible quelle que soit la cardiopathie sous-jacente, notamment si insuffisance cardiaque.
En pratique :
- patient sans pathologie cardiaque hormis la fibrillation atriale (FA sur « cœur sain ») ➙ flécaïne ;
- patient ayant une coronaropathie isolée sans insuffisance cardiaque ➙ sotalol possible ;
- le reste (insuffisance cardiaque ou hypertrophie ventriculaire gauche) ➙ amiodarone.
Contrôle de la fréquence
- inhibiteurs calciques bradycardisants (non dihydropyridiniques, de type diltiazem ou vérapamil). Étant inotropes négatifs, ils sont contre-indiqués si la fraction d’éjection du ventricule gauche (FEVG) est < 40 % ou si le patient est en insuffisance cardiaque aiguë ;
- bêtabloquants (bisoprolol, carvédilol, métoprolol et nébivolol sont à préconiser) ;
- digoxine (attention au risque de surdosage en cas d'insuffisance rénale).
- si insuffisance cardiaque aiguë : bêtabloquants à leur plus petite dose, digoxine ;
- si FEVG < 40 % : bêtabloquants, digoxine ;
- si FEVG > 40 % : bêtabloquants, digoxine, inhibiteurs calciques bradycardisants.
Il n’existe pas de réel objectif de fréquence cardiaque chez un patient en fibrillation atriale que l’on souhaite ralentir, néanmoins il est généralement admis qu’il faut atteindre une fréquence cardiaque de repos comprise entre 60 et 100 batt/min.
Les patients chez qui un ralentissement de la fréquence cardiaque ne peut être obtenu malgré un traitement pharmacologique optimisé, et qui restent symptomatiques, peuvent se voir proposer une ablation du nœud atrioventriculaire (bloc atrioventriculaire complet artificiel) avec l’implantation d’un stimulateur au préalable : les influx provenant des oreillettes ne passeront plus vers les ventricules, et le pacemaker fonctionnera alors à sa propre fréquence, que l’on règlera.
Indications
La stratégie de contrôle du rythme est indiquée en cas de fibrillation atriale paroxystique ou persistante symptomatique, à l’exception du patient présentant un remodelage atrial majeur rendant un contrôle du rythme illusoire (récidive précoce assurée).
Donc, chez un patient faisant des épisodes de fibrillation atriale paroxystique ou persistante mais non symptomatique (silencieuse), il n’est pas nécessaire de lui prescrire un antiarythmique pour prévenir les récidives. Ceci est particulièrement vrai pour l’amiodarone, qui comporte de nombreux effets indésirables au long cours et dont le seul bénéfice est de diminuer le nombre d’épisodes de fibrillation atriale symptomatique.
Il faut d’ailleurs savoir que les antiarythmiques diminuent mais n’empêchent pas les récurrences de fibrillation atriale.
La stratégie de contrôle de la fréquence est indiquée chez un patient symptomatique :
- en attente de la stratégie du contrôle du rythme ;
- en cas d’échec de la stratégie du contrôle du rythme ;
- en 1re intention chez le patient chez qui le contrôle du rythme semble d’emblée illusoire (patient âgé, oreillette gauche très dilatée...).
Messages clés :
- les ralentisseurs se donnent chez un patient en fibrillation atriale, pour ralentir sa fréquence ventriculaire ;
- les antiarythmiques se donnent chez un patient en rythme sinusal, pour éviter qu’il repasse en fibrillation atriale.
Prévention des AVC emboliques
Comme indiqué précédemment, tous les patients doivent bénéficier avant une cardioversion soit d'une ETO, soit d'une anticoagulation d’au moins 3 semaines. Cette anticoagulation doit être poursuivie 4 semaines après la cardioversion, et ce n'est qu'au terme de ces 4 semaines que le score de CHA2DS2-VASc sera calculé pour décider d’une anticoagulation au long cours ou non.
À noter que tout patient chez qui l’on découvre une fibrillation atriale doit être immédiatement mis sous anticoagulants. L’idée est de commencer les 3 semaines d’anticoagulation en vue d’une éventuelle cardioversion en cas de persistance.
Quel traitement anticoagulant prescrire ?
Le dernier rapport de la Haute Autorité de santé en 2018 met au même niveau les anticoagulants oraux directs (AOD) et les anti-vitamine K (AVK) en première intention pour la fibrillation atriale non valvulaire, mais les recommandations européennes préconisent que l’anticoagulation de la fibrillation atriale non valvulaire doit se faire en première intention par AOD (apixaban, dabigatran ou rivaroxaban). En revanche, dans la fibrillation atriale valvulaire, seuls les AVK doivent être prescrits.
Attention ! à cause d’un risque immuno-allergique, l’ANSM contre-indique depuis 2018 l’initiation de Previscan (fluindione), qui ne peut désormais être prescrit qu’en renouvellement d’ordonnance.
Chez les patients à haut risque hémorragique (ayant une contre-indication formelle et définitive aux anticoagulants), mais avec une indication théorique aux anticoagulants de par un haut risque embolique, il est possible de surseoir à ceux-ci en proposant une fermeture de l’auricule gauche par voie percutanée.
Attention ! Les stratégies de contrôle de fréquence/rythme et la prévention de l’AVC par l’anticoagulation sont deux choses totalement indépendantes l’une de l’autre.
Un patient qui est de nouveau en rythme sinusal mais qui présente un CHA2DS2-VASc ≥ 1 (H) ou ≥ 2 (F) doit bien être traité avec une anticoagulation au long cours, même s’il est en rythme sinusal sous traitement antiarythmique ou après une ablation.
À l’inverse, un patient en fibrillation atriale permanente avec un CHA2DS2-VASc à 0 ne doit pas avoir d’anticoagulants au long cours.
Et la maladie rythmique de l’oreillette ?
En effet, la fibrose va favoriser des circuits de réentrées électriques et donc de la fibrillation atriale, mais lorsque le patient repasse en rythme sinusal cette fibrose étendue aussi dans la zone autour du nœud sinusal va empêcher l’influx sinusal de se transmettre aux oreillettes, provoquant alors un bloc sino-atrial (dit BSA ou dysfonction sinusale).
Si cette dysfonction sinusale est symptomatique, il faudra poser un stimulateur cardiaque, car tous les traitements antiarythmiques ont la caractéristique de ralentir la cadence sinusale.•
POINTS FORTS À RETENIR
Toujours rechercher un facteur favorisant évident (hypokaliémie, hyperthyroïdie…) lors d’une découverte de fibrillation atriale.
La cardioversion peut être médicamenteuse ou électrique. Il convient de s’assurer de l’absence de thrombus dans l’auricule avant la cardioversion, soit par une échographie transœsophagienne, soit par 3 semaines d’anticoagulation. Et ce quel que soit le score de CHA2DS2-VASc.
Il existe deux types de médicaments :
– les ralentisseurs prescrits chez les patients en fibrillation atriale rapide, dans le but de ralentir la fréquence ventriculaire : bêtabloquants, inhibiteurs calciques bradycardisants, digoxine ;
– les antiarythmiques prescrits chez les patients retournés en rythme sinusal, dans le but d’éviter la récidive d’épisodes de fibrillation atriale symptomatique : flécaïne, sotalol, amiodarone.
Leurs contre-indications respectives sont à connaître.
Les stratégies de contrôle de fréquence ou du rythme sont indépendantes de la stratégie de prévention du risque thromboembolique.
La fibrillation atriale permanente n’est pas plus à risque d’accident vasculaire cérébral embolique que la fibrillation atriale paroxystique ou persistante : l’indication d’anticoagulants au long cours ne se pose que sur le score de CHA2DS2-VASc, et non pas en fonction du rythme atrial (sinusal ou en FA).
Donc un patient qui fait de la fibrillation atriale paroxystique avec un CHA2DS2-VASc ≥ 1 (H) ou ≥ 2 (F) doit être sous anticoagulants au long cours, même s’il est en rythme sinusal.
À l’inverse, un jeune patient en fibrillation atriale permanente ayant un CHA2DS2-VASc à 0 ne présente pas d’indication à une anticoagulation au long cours.
L’anticoagulation au long cours d’une fibrillation atriale se fait par anticoagulants oraux directs, hormis la fibrillation atriale valvulaire (valve mécanique ou rétrécissement mitral modéré à sévère) et l’insuffisance rénale sévère, où seuls les AVK sont prescrits.
Haute Autorité de santé (HAS). Synthèse d’avis et fiches bon usage du médicament. Les anticoagulants oraux, mai 2018.

 Encadrés
Encadrés