Les fibroses pulmonaires sont des maladies caractérisées par une accumulation anormale de fibroblastes et de matrice extracellulaire, accompagnée d’une infiltration variable par des cellules inflammatoires. La plupart de ces fibroses sont progressives et aboutissent à une insuffisance respiratoire potentiellement mortelle. Différentes pathologies peuvent s’accompagner d’une fibrose pulmonaire : connectivites (sclérodermie ou polyarthrite rhumatoïde, par exemple), maladies environnementales liées à l’exposition à des particules inhalées (telles que l’amiante) ou à des antigènes responsables d’une pneumopathie d’hypersensibilité (comme les moisissures). Certaines fibroses compliquent des traitements pneumotoxiques (notamment certaines chimiothérapies). Enfin, des fibroses surviennent en dehors de contextes étiologiques identifiés. Parmi celles-ci, la fibrose pulmonaire idiopathique (FPI) est la plus fréquente. L’identification de formes familiales de fibrose pulmonaire, affectant près de 10 % des patients, la caractérisation de mutations génétiques associées à ces formes familiales et le développement de traitements antifibrosants sont les nouveautés majeures de la prise en charge.
Suspicion de fibrose pulmonaire idiopathique : diagnostiquer et surveiller
La FPI est une maladie rare dont l’incidence annuelle est estimée à 10 cas pour 100 000 personnes. L’incidence est plus importante chez les hommes (sex-ratio : 1,4) et augmente avec l’âge, pour atteindre 150 cas/100 000 après 75 ans.
Les signes cliniques de la FPI ne sont pas spécifiques : râles crépitants secs bilatéraux (précoces et quasiment constants), dyspnée, toux non productive. Un hippocratisme digital est présent dans près de 50 % des cas. La cyanose et les signes d’insuffisance ventriculaire droite ne s’observent qu’à un stade avancé, tout comme l’amaigrissement et l’altération de l’état général.
Les signes cliniques de la FPI ne sont pas spécifiques : râles crépitants secs bilatéraux (précoces et quasiment constants), dyspnée, toux non productive. Un hippocratisme digital est présent dans près de 50 % des cas. La cyanose et les signes d’insuffisance ventriculaire droite ne s’observent qu’à un stade avancé, tout comme l’amaigrissement et l’altération de l’état général.
Confirmer le diagnostic
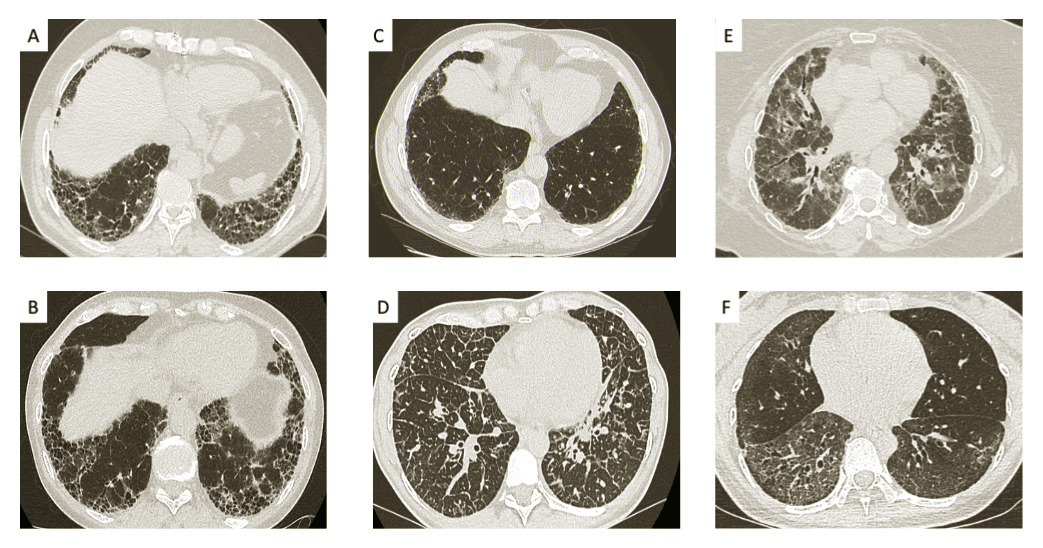
Le scanner thoracique est l’examen essentiel au diagnostic. Il doit être de qualité irréprochable et analysé par un radiologue ayant une expertise dans le domaine des pneumopathies interstitielles. Il identifie les signes de fibrose (fig. 1A et 1B ) qui associent des réticulations et des bronchectasies par traction affectant les bronches distales, éventuellement des opacités en rayon de miel, une perte de volume des lobes atteints et des distorsions des structures anatomiques (bronches, plèvre…).
Lorsque l’ensemble de ces signes est réuni, avec une prédominance des anomalies dans les régions sous-pleurales et dans les lobes inferieurs, on parle d’un aspect typique de pneumopathie interstitielle commune (PIC). Cet aspect est retrouvé dans 50 à 70 % des cas de FPI.
En l’absence de rayons de miel, les bronchectasies par traction associées aux réticulations permettent de parler de PIC probable (fig. 1C ).1
Les explorations fonctionnelles respiratoires ne sont pas d’une grande aide pour le diagnostic, mais elles peuvent montrer :
– un trouble ventilatoire restrictif au repos caractérisé par une diminution de la capacité pulmonaire totale et de la capacité vitale forcée ;
– une diminution précoce de la capacité de diffusion du monoxyde de carbone au repos (souvent seule anomalie détectée lors du diagnostic dans les formes précoces de FPI) ;
– une hypoxémie d’abord à l’effort, puis au repos ; elle peut être facilement mise en évidence lors de tests d’exercice (test de marche de 6 minutes, test de lever de chaise) révélant une désaturation à l’effort.
Lorsque l’ensemble de ces signes est réuni, avec une prédominance des anomalies dans les régions sous-pleurales et dans les lobes inferieurs, on parle d’un aspect typique de pneumopathie interstitielle commune (PIC). Cet aspect est retrouvé dans 50 à 70 % des cas de FPI.
En l’absence de rayons de miel, les bronchectasies par traction associées aux réticulations permettent de parler de PIC probable (
Les explorations fonctionnelles respiratoires ne sont pas d’une grande aide pour le diagnostic, mais elles peuvent montrer :
– un trouble ventilatoire restrictif au repos caractérisé par une diminution de la capacité pulmonaire totale et de la capacité vitale forcée ;
– une diminution précoce de la capacité de diffusion du monoxyde de carbone au repos (souvent seule anomalie détectée lors du diagnostic dans les formes précoces de FPI) ;
– une hypoxémie d’abord à l’effort, puis au repos ; elle peut être facilement mise en évidence lors de tests d’exercice (test de marche de 6 minutes, test de lever de chaise) révélant une désaturation à l’effort.
Chercher une cause
La seconde étape du diagnostic consiste à chercher une cause connue à la fibrose (tableau 1 ) : exposition environnementale (domestique ou professionnelle), prise médicamenteuse (bléomycine, nitrofurantoïne), maladie systémique (interrogatoire explorant d’éventuels signes extrarespiratoires évocateurs et bilan biologique comprenant la recherche d’auto-anticorps).
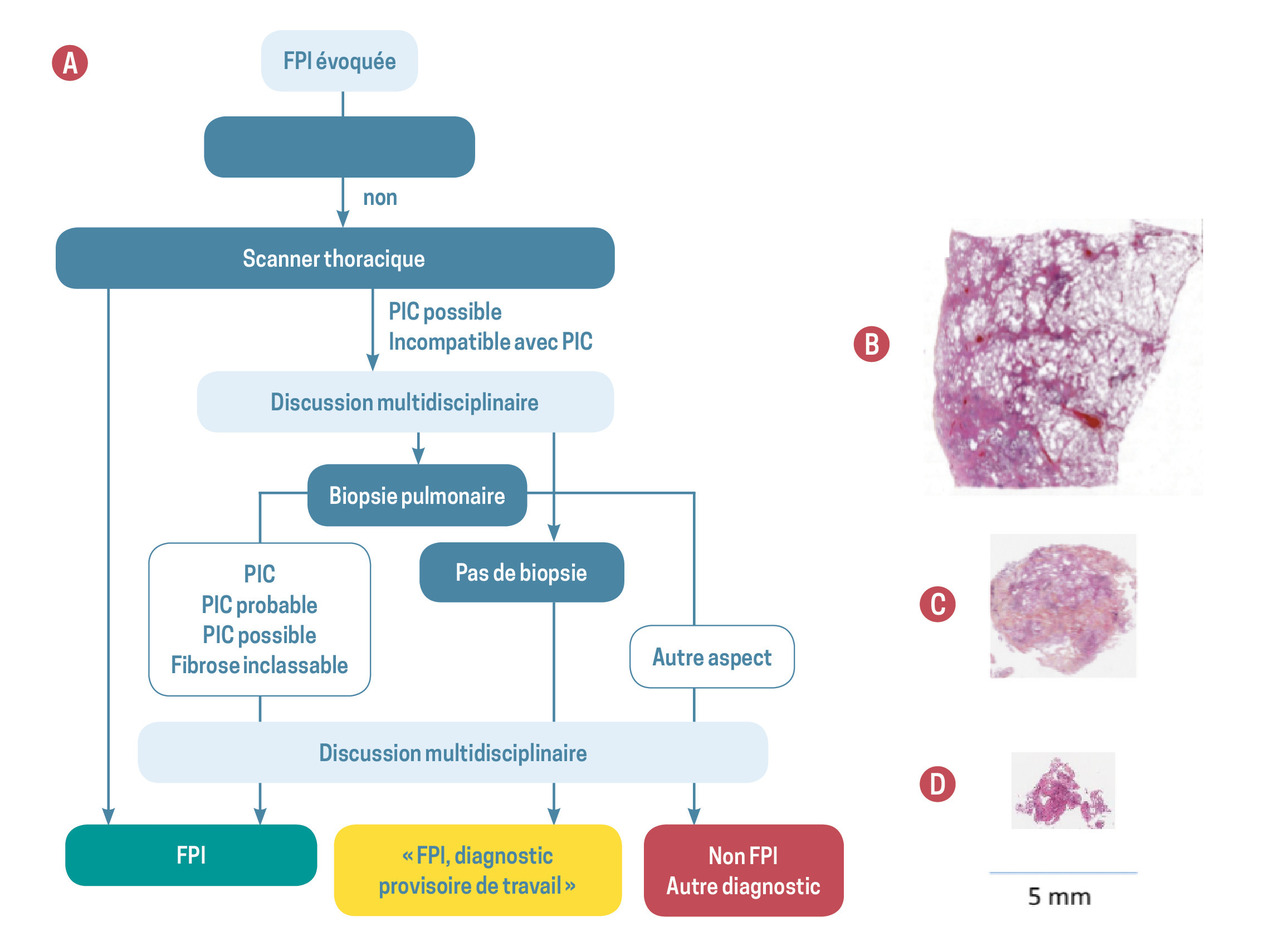
En l’absence de cause patente et lorsque l’imagerie trouve un aspect typique de pneumopathie interstitielle commune ou probable, on peut retenir le diagnostic de FPI (fig. 2A ).
Dans tous les autres cas, lorsque l’aspect du scanner n’est pas caractéristique de PIC (fig. 1D à 1F ), le diagnostic de certitude nécessite une biopsie pulmonaire.
La cryobiopsie transbronchique est une alternative à la biopsie pulmonaire chirurgicale, qui permet d’obtenir, au cours d’une endoscopie bronchique sous anesthésie générale, des fragments pulmonaires compatibles avec les besoins de l’analyse anatomopathologique des pneumopathies interstitielles. Il s’agit d’une technique endoscopique lors de laquelle une cryosonde est introduite par le canal opérateur. Cette sonde permet de congeler les tissus avoisinants sur plusieurs millimètres en quelques secondes. Des fragments de poumon congelé de 5 mm d’arête au moins peuvent ainsi être obtenus, ce qui permet une analyse histologique représentative du parenchyme pulmonaire (fig. 2B, C, D ). Saignement endobronchique et pneumothorax sont les deux complications principales liées à cette technique, qui nécessite une équipe expérimentée en endoscopie interventionnelle. La mortalité est estimée à 0,5 % dans des séries récentes.
Dans une étude prospective, si le degré de confiance dans le diagnostic était élevé, le diagnostic histologique proposé par cryobiopsie était concordant avec celui de la biopsie pulmonaire chirurgicale dans 95 % des cas. En revanche, quand le degré de confiance était plus faible, la classification était modifiée pour 23 % des patients entre cryobiopsie et biopsie chirurgicale.2,3
D’autres techniques encore moins invasives sont en cours de développement pour le diagnostic de FPI. En particulier, l’analyse transcriptomique des biopsies transbronchiques simples réalisées au cours d’une endoscopie bronchique est utilisée aux États-Unis, bien que les données soient pour l’instant encore limitées.
À noter que la recherche d’un syndrome d’apnées du sommeil associé doit également être systématique lors du diagnostic de FPI.
En l’absence de cause patente et lorsque l’imagerie trouve un aspect typique de pneumopathie interstitielle commune ou probable, on peut retenir le diagnostic de FPI (
Dans tous les autres cas, lorsque l’aspect du scanner n’est pas caractéristique de PIC (
La cryobiopsie transbronchique est une alternative à la biopsie pulmonaire chirurgicale, qui permet d’obtenir, au cours d’une endoscopie bronchique sous anesthésie générale, des fragments pulmonaires compatibles avec les besoins de l’analyse anatomopathologique des pneumopathies interstitielles. Il s’agit d’une technique endoscopique lors de laquelle une cryosonde est introduite par le canal opérateur. Cette sonde permet de congeler les tissus avoisinants sur plusieurs millimètres en quelques secondes. Des fragments de poumon congelé de 5 mm d’arête au moins peuvent ainsi être obtenus, ce qui permet une analyse histologique représentative du parenchyme pulmonaire (
Dans une étude prospective, si le degré de confiance dans le diagnostic était élevé, le diagnostic histologique proposé par cryobiopsie était concordant avec celui de la biopsie pulmonaire chirurgicale dans 95 % des cas. En revanche, quand le degré de confiance était plus faible, la classification était modifiée pour 23 % des patients entre cryobiopsie et biopsie chirurgicale.2,3
D’autres techniques encore moins invasives sont en cours de développement pour le diagnostic de FPI. En particulier, l’analyse transcriptomique des biopsies transbronchiques simples réalisées au cours d’une endoscopie bronchique est utilisée aux États-Unis, bien que les données soient pour l’instant encore limitées.
À noter que la recherche d’un syndrome d’apnées du sommeil associé doit également être systématique lors du diagnostic de FPI.
Évolution et surveillance
Peu utiles au moment du diagnostic, les explorations fonctionnelles respiratoires permettent en revanche de mesurer le retentissement fonctionnel de la maladie. La capacité vitale forcée et la diminution précoce de la capacité de diffusion du monoxyde de carbone sont les critères fonctionnels les plus utilisés dans le suivi des patients atteints de FPI, leur diminution étant reliée au pronostic.
Les patients atteints de FPI sont à risque de développer une exacerbation aiguë : aggravation rapide (en moins d’un mois) de la maladie pouvant conduire le patient en réanimation, et qui doit faire éliminer une pathologie infectieuse ou thrombo-embolique spécifiquement curable. La mortalité après un tel épisode d’exacerbation est estimée à 50 %.
Le développement d’un cancer bronchique est également fréquent au cours de la FPI (5 à 10 % des patients). Ces cancers posent des problèmes spécifiques de diagnostic et de traitement : insuffisance respiratoire associée et possible exacerbation de la fibrose dans les suites des traitements oncologiques. Le dépistage de ces cancers justifie la réalisation annuelle d’un scanner thoracique.
Les patients atteints de FPI sont à risque de développer une exacerbation aiguë : aggravation rapide (en moins d’un mois) de la maladie pouvant conduire le patient en réanimation, et qui doit faire éliminer une pathologie infectieuse ou thrombo-embolique spécifiquement curable. La mortalité après un tel épisode d’exacerbation est estimée à 50 %.
Le développement d’un cancer bronchique est également fréquent au cours de la FPI (5 à 10 % des patients). Ces cancers posent des problèmes spécifiques de diagnostic et de traitement : insuffisance respiratoire associée et possible exacerbation de la fibrose dans les suites des traitements oncologiques. Le dépistage de ces cancers justifie la réalisation annuelle d’un scanner thoracique.
Génétique des fibroses pulmonaires
Environ 10 % des patients atteints de pneumopathie interstitielle diffuse (PID) ont un apparenté lui-même atteint de PID. Ainsi, un bilan génétique est proposé en cas de forme familiale de fibrose si la maladie survient à un âge inférieur à 50 ans ou en présence d’éléments orientant vers un syndrome particulier comme celui des télomères courts.
En effet, environ 30 % des formes familiales sont expliquées par une mutation d’un gène lié à l’homéostasie des télomères, le gène TERT étant le plus fréquemment identifié. Le syndrome des télomères courts se caractérise par la présence, chez le patient ou chez un apparenté au premier degré, d’une anomalie hématologique (macrocytose, thrombopénie, voire aplasie médullaire), d’une cirrhose hépatique ou d’une canitie (blanchissement massif prématuré des cheveux, avant l’âge de 30 ans). Ces manifestations spécifiques compliquent la prise en charge et le conseil génétique des patients : après transplantation pulmonaire, ils sont plus à risque de complications hématologiques. Des adaptations des traitements immunosuppresseurs et cytotoxiques sont ainsi nécessaires.
Plus rarement, des mutations sur les gènes codant pour les protéines du surfactant sont détectées.
La susceptibilité génétique à développer une fibrose pulmonaire a été associée à un variant dans le promoteur du gène MUC5B, qui est présent dans environ 10 % de la population caucasienne. Ce variant est associé à une augmentation de la transcription de MUC5B. La présence de ce variant à l’état hétérozygote est associée à une augmentation du risque (multiplié par 6) de développer une FPI. Ce variant est détecté chez 35 % des patients atteints de FPI dans la population caucasienne. Il est beaucoup plus rare dans la population asiatique ou africaine. Il est également associé à une augmentation du risque de développer une fibrose pulmonaire non idiopathique dans des contextes étiologiques identifiés aussi variés que la polyarthrite rhumatoïde, l’asbestose ou la pneumopathie d’hypersensibilité.4 Cette découverte identifie donc des facteurs de risque génétiques commun entre la FPI et des fibroses pulmonaires secondaires, suggérant un continuum entre ces pathologies.
De plus, l’expression épithéliale de MUC5B place l’épithélium au centre de la physiopathologie de ces PID et justifie l’évaluation d’approches thérapeutiques dédiées, notamment d’études cliniques pour de nouveaux traitements par voie inhalée. Ces variants ne sont cependant pas utilisés actuellement pour le conseil génétique.
En effet, environ 30 % des formes familiales sont expliquées par une mutation d’un gène lié à l’homéostasie des télomères, le gène TERT étant le plus fréquemment identifié. Le syndrome des télomères courts se caractérise par la présence, chez le patient ou chez un apparenté au premier degré, d’une anomalie hématologique (macrocytose, thrombopénie, voire aplasie médullaire), d’une cirrhose hépatique ou d’une canitie (blanchissement massif prématuré des cheveux, avant l’âge de 30 ans). Ces manifestations spécifiques compliquent la prise en charge et le conseil génétique des patients : après transplantation pulmonaire, ils sont plus à risque de complications hématologiques. Des adaptations des traitements immunosuppresseurs et cytotoxiques sont ainsi nécessaires.
Plus rarement, des mutations sur les gènes codant pour les protéines du surfactant sont détectées.
La susceptibilité génétique à développer une fibrose pulmonaire a été associée à un variant dans le promoteur du gène MUC5B, qui est présent dans environ 10 % de la population caucasienne. Ce variant est associé à une augmentation de la transcription de MUC5B. La présence de ce variant à l’état hétérozygote est associée à une augmentation du risque (multiplié par 6) de développer une FPI. Ce variant est détecté chez 35 % des patients atteints de FPI dans la population caucasienne. Il est beaucoup plus rare dans la population asiatique ou africaine. Il est également associé à une augmentation du risque de développer une fibrose pulmonaire non idiopathique dans des contextes étiologiques identifiés aussi variés que la polyarthrite rhumatoïde, l’asbestose ou la pneumopathie d’hypersensibilité.4 Cette découverte identifie donc des facteurs de risque génétiques commun entre la FPI et des fibroses pulmonaires secondaires, suggérant un continuum entre ces pathologies.
De plus, l’expression épithéliale de MUC5B place l’épithélium au centre de la physiopathologie de ces PID et justifie l’évaluation d’approches thérapeutiques dédiées, notamment d’études cliniques pour de nouveaux traitements par voie inhalée. Ces variants ne sont cependant pas utilisés actuellement pour le conseil génétique.
Traitement des fibroses pulmonaires
Traitements non spécifiques
Tous les patients atteints de PID doivent bénéficier d’une prise en charge globale incluant une réhabilitation respiratoire, un sevrage tabagique ainsi que les vaccinations antigrippale, antipneumococcique et anti-Covid-19. La présence d’une FPI est un facteur de risque important démontré de mortalité au cours du Covid-19. La réhabilitation respiratoire améliore la capacité à l’exercice, les scores de dyspnée et la qualité de vie des patients atteints de fibrose. Parallèlement, une prise en charge de la dyspnée et de la toux doit être spécifiquement discutée, éventuellement en collaboration avec une équipe de soins palliatifs, y compris dans les formes précoces de la maladie.
Traitements de la fibrose pulmonaire idiopathique
Deux traitements antifibrosants oraux disponibles
Le nintédanib et la pirfénidone (disponibles en France depuis 2016 et 2012 respectivement) ont démontré un bénéfice dans la FPI en prise orale quotidienne.5,6Le nintédanib est un inhibiteur de la tyrosine kinase avec multicibles : VEGF (vascular endothelial growth factor), PDGF (platelet-derived growth factor), FGF (fibroblast growth factor), etc.
Le mécanisme précis de l’action de la pirfénidone est moins bien connu : probable inhibition du TGF-β (transforming growth factor beta).
Tous les patients atteints de FPI ont un déclin progressif de leur capacité vitale forcée, meilleur paramètre actuellement disponible pour évaluer l’effet d’un antifibrosant. L’efficacité des deux molécules antifibrosantes est sensiblement identique : déclin moyen de la capacité vitale forcée de 240 mL/an dans les groupes placebo contre 120 mL/an dans les groupes traités par antifibrosant. De plus, les études de cohorte ont rapporté une amélioration de la survie chez les patients ayant reçu un traitement antifibrosant.7 Ainsi, la survie moyenne actuelle après diagnostic est d’environ cinq ans.
Des effets secondaires non négligeables
Plus de 35 % des patients ont une photosensibilité secondaire à la prise de pirfénidone. Le nintédanib peut provoquer diarrhées et perte de poids. Jusqu’à 3 % des patients ont une cytolyse hépatique (transaminases augmentées à plus de 3 fois la normale) sous antifibrosants. S’il est rare de devoir arrêter le traitement pour cytolyse hépatique, plus de la moitié des patients l’arrêtent avant deux ans en raison d’une progression de la maladie ou d’une intolérance aux antifibrosants.8-10Quelles perspectives thérapeutiques ?
De nouveaux traitements antifibrosants sont à l’étude. Des résultats prometteurs ont, par exemple, été rapportés dans les essais de phase II avec le pamrevlumab (anticorps monoclonal anti-CTGF [connective tissue growth factor]).Par ailleurs, pour les patients porteurs d’une mutation sur un gène lié aux télomères, un traitement ciblé visant à activer le complexe télomérase pourrait potentiellement ralentir l’évolution de la fibrose. Ainsi, un androgène de synthèse activant le complexe télomérase fait actuellement l’objet d’un essai clinique en France, et il pourrait s’agir du premier traitement personnalisé des patients atteints de FPI.
Traitements des fibroses non idiopathiques
Jusqu’à récemment, le principal traitement des fibroses non idiopathiques était celui de leur cause (éviction de l’amiante pour l’asbestose, immunosuppresseur pour les connectivites).
Certains éléments communs à certaines pneumopathies interstitielles diffuses secondaires et idiopathiques (âge, sexe, tabac, aspect scanographique de PIC et facteurs de risque génétiques) ont fait évaluer l’effet des antifibrosants dans cette indication.
Deux études cliniques récentes ont ainsi démontré que le nintédanib pouvait ralentir le déclin de la fonction respiratoire chez les patients ayant une fibrose pulmonaire dans le contexte d’une sclérodermie, ou ayant des fibroses pulmonaires progressives non idiopathiques (notamment pneumopathie d’hypersensibilité, polyarthrite rhumatoïde). En parallèle, une étude suggère que la pirfénidone ralentit l’évolution des fibroses pulmonaires progressives inclassables.11
Plusieurs autres études sont en cours pour confirmer et affiner l’intérêt de ces traitements dans les formes secondaires.
Certains éléments communs à certaines pneumopathies interstitielles diffuses secondaires et idiopathiques (âge, sexe, tabac, aspect scanographique de PIC et facteurs de risque génétiques) ont fait évaluer l’effet des antifibrosants dans cette indication.
Deux études cliniques récentes ont ainsi démontré que le nintédanib pouvait ralentir le déclin de la fonction respiratoire chez les patients ayant une fibrose pulmonaire dans le contexte d’une sclérodermie, ou ayant des fibroses pulmonaires progressives non idiopathiques (notamment pneumopathie d’hypersensibilité, polyarthrite rhumatoïde). En parallèle, une étude suggère que la pirfénidone ralentit l’évolution des fibroses pulmonaires progressives inclassables.11
Plusieurs autres études sont en cours pour confirmer et affiner l’intérêt de ces traitements dans les formes secondaires.
Encadre
Que dire à vos patients ?
L’exposition à des toxiques inhalés (tabac, pollution, antigènes organiques par exemple) augmente le risque de développer une fibrose pulmonaire.
La fibrose pulmonaire est une maladie irréversible, mais les traitements antifibrosants en ralentissent l’évolution.
Compte tenu de la relative rareté des fibroses pulmonaires, un avis spécialisé dans un centre de référence est souvent nécessaire pour confirmer le diagnostic et orienter les thérapeutiques.
Liens utiles :– Protocole national de diagnostic et de soins de la fibrose pulmonaire idiopathique :
https://bit.ly/39lzN9f
– Filière des maladies respiratoires rares :
https://www.respifil.fr/
– Centre de référence des maladies pulmonaires rares de l’adulte :
http://www.maladies-pulmonaires-rares.fr/
– Associations de patients :– Association Pierre Enjalran Fibrose pulmonaire idiopathique :
https://fpi-asso.com/
– European Idiopathic Pulmonary Fibrosis and Related Disorders Federation :
https://www.eu-ipff.org/
Références
1. Raghu G, Remy-Jardin M, Myers JL, et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018;198(5):e44-68.
2. Ganganah O, Guo SL, Chiniah M, et al. Efficacy and safety of cryobiopsy versus forceps biopsy for interstitial lung diseases and lung tumours: A systematic review and meta-analysis. Respirol 2016;21(5):834-41.
3. Troy LK, Grainge C, Corte TJ, et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respir Med 2020;8(2):171-81.
4. Juge PA, Lee JS, Ebstein E, et al. MUC5B Promoter Variant and Rheumatoid Arthritis with Interstitial Lung Disease. N Engl J Med 2018;379(23):2209-19.
5. Richeldi L, Costabel U, Selman M, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011;365(12):1079-87.
6. Noble PW, Albera C, Bradford WZ, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011;377(9779):1760-9.
7. Guenther A, Krauss E, Tello S, et al. The European IPF registry (eurIPFreg): baseline characteristics and survival of patients with idiopathic pulmonary fibrosis. Respir Res 2018;19(1):141.
8. Cottin V, Koschel D, Günther A, et al. Long-term safety of pirfenidone: results of the prospective, observational PASSPORT study. ERJ Open Res 2018;4(4):00084-2018.
9. Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med 2019;381(18):1718-27.
10. Wells AU, Flaherty KR, Brown KK, et al. Nintedanib in patients with progressive fibrosing interstitial lung diseases-subgroup analyses by interstitial lung disease diagnosis in the INBUILD trial: a randomised, double-blind, placebo-controlled, parallel-group trial. Lancet Respir Med 2020;8(5):453-60.
11. Maher TM, Corte TJ, Fischer A, et al. Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: design of a double-blind, randomised, placebo-controlled phase II trial. BMJ Open Respir Res 2018;5(1):e000289.
12. Cottin V, Crestani B, Cadranel J, et al. Recommandations pratiques pour le diagnostic et la prise en charge de la fibrose pulmonaire idiopathique – Actualisation 2017. Version longue. Rev Mal Respir 2017;34(8):900-68.
2. Ganganah O, Guo SL, Chiniah M, et al. Efficacy and safety of cryobiopsy versus forceps biopsy for interstitial lung diseases and lung tumours: A systematic review and meta-analysis. Respirol 2016;21(5):834-41.
3. Troy LK, Grainge C, Corte TJ, et al. Diagnostic accuracy of transbronchial lung cryobiopsy for interstitial lung disease diagnosis (COLDICE): a prospective, comparative study. Lancet Respir Med 2020;8(2):171-81.
4. Juge PA, Lee JS, Ebstein E, et al. MUC5B Promoter Variant and Rheumatoid Arthritis with Interstitial Lung Disease. N Engl J Med 2018;379(23):2209-19.
5. Richeldi L, Costabel U, Selman M, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011;365(12):1079-87.
6. Noble PW, Albera C, Bradford WZ, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011;377(9779):1760-9.
7. Guenther A, Krauss E, Tello S, et al. The European IPF registry (eurIPFreg): baseline characteristics and survival of patients with idiopathic pulmonary fibrosis. Respir Res 2018;19(1):141.
8. Cottin V, Koschel D, Günther A, et al. Long-term safety of pirfenidone: results of the prospective, observational PASSPORT study. ERJ Open Res 2018;4(4):00084-2018.
9. Flaherty KR, Wells AU, Cottin V, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med 2019;381(18):1718-27.
10. Wells AU, Flaherty KR, Brown KK, et al. Nintedanib in patients with progressive fibrosing interstitial lung diseases-subgroup analyses by interstitial lung disease diagnosis in the INBUILD trial: a randomised, double-blind, placebo-controlled, parallel-group trial. Lancet Respir Med 2020;8(5):453-60.
11. Maher TM, Corte TJ, Fischer A, et al. Pirfenidone in patients with unclassifiable progressive fibrosing interstitial lung disease: design of a double-blind, randomised, placebo-controlled phase II trial. BMJ Open Respir Res 2018;5(1):e000289.
12. Cottin V, Crestani B, Cadranel J, et al. Recommandations pratiques pour le diagnostic et la prise en charge de la fibrose pulmonaire idiopathique – Actualisation 2017. Version longue. Rev Mal Respir 2017;34(8):900-68.

 Encadrés
Encadrés