La fièvre jaune est une arbovirose (virose transmise par un arthropode) due au virus amaril (amarillo : jaune, en espagnol), transmise par des moustiques (Aedes aegypti, Haemagogus). Elle se manifeste principalement par une fièvre et une hépatite potentiellement mortelle du fait des complications hémorragiques en cas de forme fulminante.1-3
Le virus, originaire d’Afrique, a été introduit en Amérique à la suite du commerce triangulaire au XVIe siècle. Plusieurs épidémies sont enregistrées aux XVIIIe et XIXe siècles en Afrique et en Amérique. Le rôle de vecteur d'Aedes aegypti est démontré par Carlos Finlay puis Walter Reed en 1901 par l’inoculation du virus à des sujets sains par des moustiques « gorgés » sur des malades. En 1927, le virus est isolé en Afrique, permettant la fabrication d’un vaccin vivant atténué utilisé pour la première fois en 1927. Les connaissances sur le cycle vectoriel permettent d’organiser la prophylaxie par la destruction des gîtes d’Aedes dès le début du XIXe siècle.
Le virus, originaire d’Afrique, a été introduit en Amérique à la suite du commerce triangulaire au XVIe siècle. Plusieurs épidémies sont enregistrées aux XVIIIe et XIXe siècles en Afrique et en Amérique. Le rôle de vecteur d'Aedes aegypti est démontré par Carlos Finlay puis Walter Reed en 1901 par l’inoculation du virus à des sujets sains par des moustiques « gorgés » sur des malades. En 1927, le virus est isolé en Afrique, permettant la fabrication d’un vaccin vivant atténué utilisé pour la première fois en 1927. Les connaissances sur le cycle vectoriel permettent d’organiser la prophylaxie par la destruction des gîtes d’Aedes dès le début du XIXe siècle.
Une maladie toujours d’actualité
L’Organisation mondiale de la santé (OMS) estime chaque année à 200 000 le nombre de cas de fièvre jaune et à 30 000 le nombre de décès.
La zone d’endémicité s’étend en Afrique intertropicale, du 15e degré de latitude nord au 15e degré de latitude sud. En Amérique elle inclut la zone intertropicale amazonienne, du Panama jusqu’au Brésil, mais elle est sortie de la forêt amazonienne récemment.4 L’Asie est épargnée bien que le vecteur y soit présent.
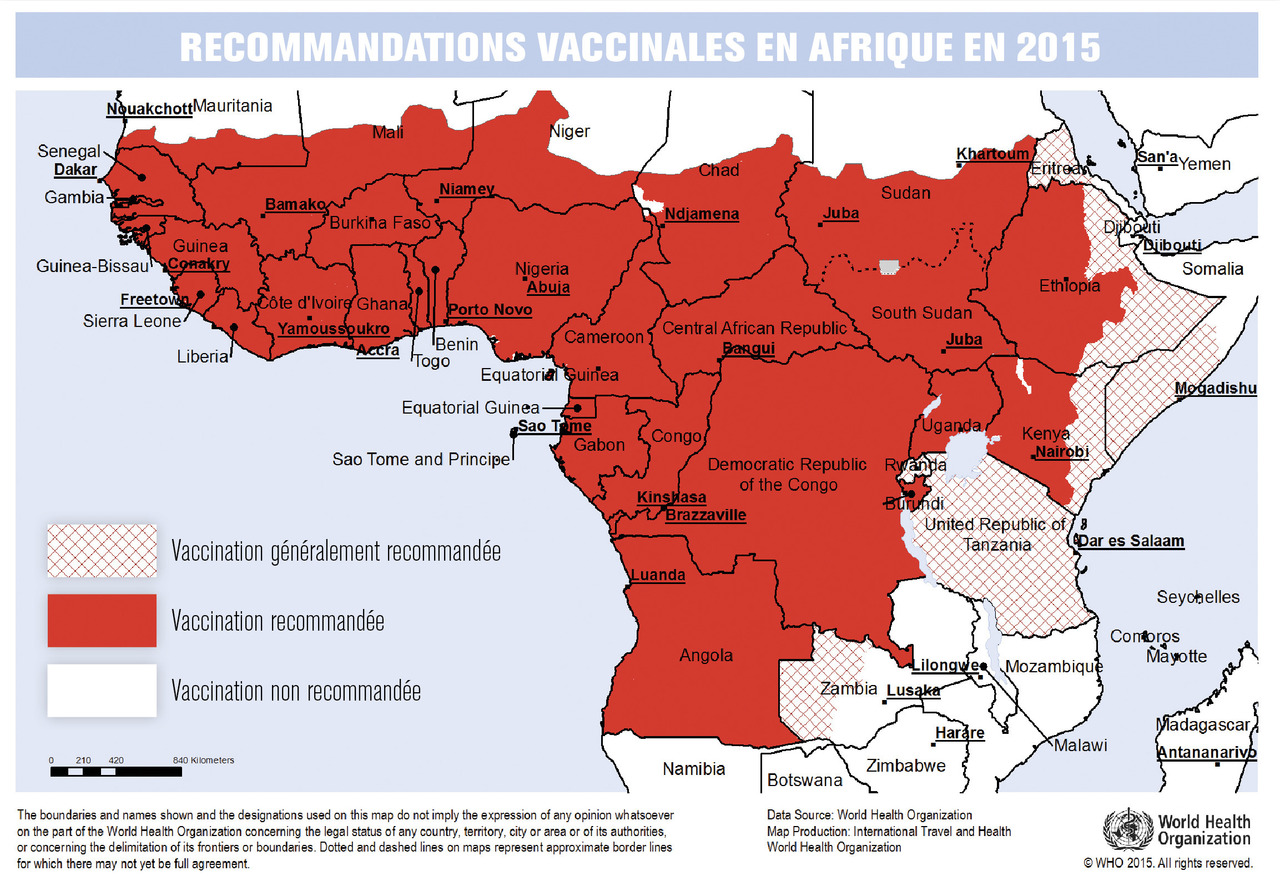
L’Afrique est le continent le plus touché, avec plus de 95 % des cas recensés. La fièvre jaune y est endémique et à l’origine d’épidémies régulières parfois urbaines. Ces épidémies se sont intensifiées ces dernières années (au Mali et au Soudan en 2005, en Côte d’Ivoire en 2008, en Angola, en République démocratique du Congo et en Ouganda en 2016) [fig. 1 et 2]. Cette augmentation est en partie liée à la multiplication des gîtes larvaires en milieu urbain favorisant la transmission d’homme à homme. Plus récemment, une épidémie a été observée au Nigeria, avec plus de 4 000 cas suspectés depuis septembre 2017, dont 250 entre janvier et février 2019.
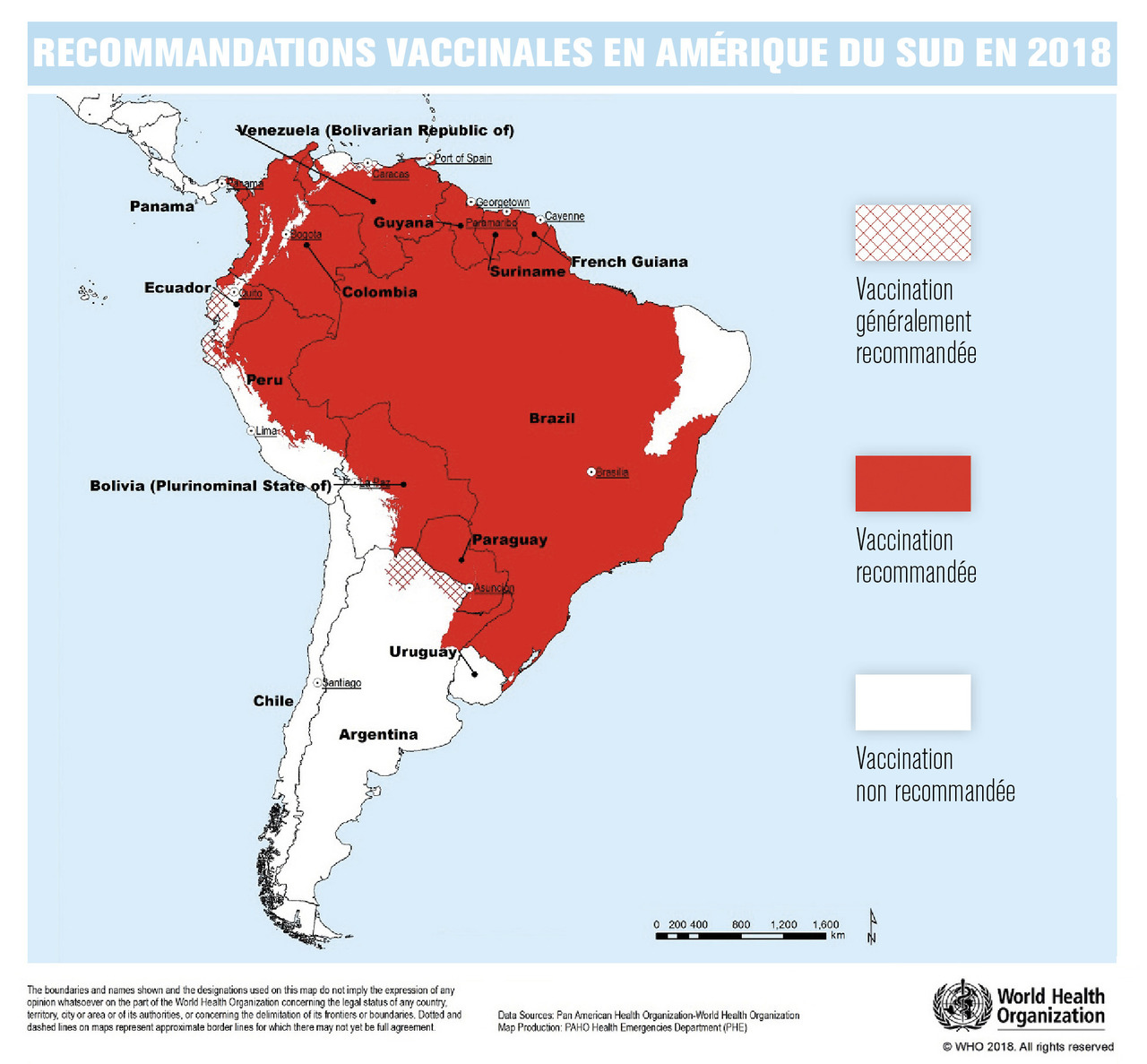
En Amérique du Sud, la fièvre jaune persistait depuis les années 1950 sous la forme de cas sporadiques dans le cadre d’un cycle primaire sylvatique. Cependant, depuis 2016, on observe une réémergence de la fièvre jaune dans plusieurs pays d’Amérique du Sud sous forme d’épidémies en milieu rural, touchant principalement des habitants des zones forestières mais également des voyageurs en dehors de la forêt amazonienne.5 Les pays les plus concernés sont le Brésil, le Pérou, la Colombie, la Guyane et la Bolivie. Durant la période épidémique estivale australe (entre décembre et mai), 778 cas avaient été recensés en 2016-2017, et 1 376 en 2017-2018. Depuis le début de la saison 2018-2019, 50 cas ont été recensés (données du 14 mars 2019).4 Le Brésil a été le pays le plus touché, notamment les États du Minas Gerais, de Sao Paulo et de Rio de Janeiro. La survenue de cas dans ces États très peuplés et à proximité de grandes métropoles a été particulièrement inquiétante du fait du risque de déclenchement d’un cycle épidémique urbain de grande ampleur. Ces régions étant par ailleurs très touristiques, elles sont à l’origine de la plupart des cas importés européens (avec plusieurs décès).5 Les campagnes de vaccination de grande ampleur menées au Brésil ont permis d’éviter une épidémie plus étendue.
L’Asie n’est pas une région à risque de fièvre jaune. Des cas importés ont été observés chez des voyageurs en provenance d’Afrique (Chinois au retour d’Angola) mais aucune transmission autochtone n’a jamais été observée, ce qui reste une interrogation épidémiologique mais ne veut pas dire que ce soit impossible.
La zone d’endémicité s’étend en Afrique intertropicale, du 15e degré de latitude nord au 15e degré de latitude sud. En Amérique elle inclut la zone intertropicale amazonienne, du Panama jusqu’au Brésil, mais elle est sortie de la forêt amazonienne récemment.4 L’Asie est épargnée bien que le vecteur y soit présent.
L’Afrique est le continent le plus touché, avec plus de 95 % des cas recensés. La fièvre jaune y est endémique et à l’origine d’épidémies régulières parfois urbaines. Ces épidémies se sont intensifiées ces dernières années (au Mali et au Soudan en 2005, en Côte d’Ivoire en 2008, en Angola, en République démocratique du Congo et en Ouganda en 2016) [
En Amérique du Sud, la fièvre jaune persistait depuis les années 1950 sous la forme de cas sporadiques dans le cadre d’un cycle primaire sylvatique. Cependant, depuis 2016, on observe une réémergence de la fièvre jaune dans plusieurs pays d’Amérique du Sud sous forme d’épidémies en milieu rural, touchant principalement des habitants des zones forestières mais également des voyageurs en dehors de la forêt amazonienne.5 Les pays les plus concernés sont le Brésil, le Pérou, la Colombie, la Guyane et la Bolivie. Durant la période épidémique estivale australe (entre décembre et mai), 778 cas avaient été recensés en 2016-2017, et 1 376 en 2017-2018. Depuis le début de la saison 2018-2019, 50 cas ont été recensés (données du 14 mars 2019).4 Le Brésil a été le pays le plus touché, notamment les États du Minas Gerais, de Sao Paulo et de Rio de Janeiro. La survenue de cas dans ces États très peuplés et à proximité de grandes métropoles a été particulièrement inquiétante du fait du risque de déclenchement d’un cycle épidémique urbain de grande ampleur. Ces régions étant par ailleurs très touristiques, elles sont à l’origine de la plupart des cas importés européens (avec plusieurs décès).5 Les campagnes de vaccination de grande ampleur menées au Brésil ont permis d’éviter une épidémie plus étendue.
L’Asie n’est pas une région à risque de fièvre jaune. Des cas importés ont été observés chez des voyageurs en provenance d’Afrique (Chinois au retour d’Angola) mais aucune transmission autochtone n’a jamais été observée, ce qui reste une interrogation épidémiologique mais ne veut pas dire que ce soit impossible.
Agent pathogène, réservoirs et agents vecteurs
Le virus amaril appartient à la famille des Flaviviridae, genre flavivirus.1-3 On distingue deux souches principales : la souche Asibi (dont dérive la souche 17D utilisée dans le vaccin vivant atténué) et la souche « française » de l’institut Pasteur de Dakar (dont dérive le virus français neurotrope [VFN]). Plusieurs génotypes coexistent en fonction de l’origine géographique.
La fièvre jaune est une zoonose dont les réservoirs vertébrés sont certains singes et l’homme.
L’agent vecteur est le moustique, principalement du genre Aedes en Afrique et Haemagogus en Amérique. Seules les femelles sont hématophages et interviennent donc dans la transmission du virus. Le moustique s’infecte lors d’un repas sanguin sur un homme ou un singe virémique et devient infectant en 4 à 10 jours.
La fièvre jaune est une zoonose dont les réservoirs vertébrés sont certains singes et l’homme.
L’agent vecteur est le moustique, principalement du genre Aedes en Afrique et Haemagogus en Amérique. Seules les femelles sont hématophages et interviennent donc dans la transmission du virus. Le moustique s’infecte lors d’un repas sanguin sur un homme ou un singe virémique et devient infectant en 4 à 10 jours.
Typologie épidémiologique
En Afrique comme en Amérique, on distingue trois cycles vectoriels différents :3
– un cycle primaire selvatique ; la transmission se fait de singe à singe en forêt principalement ; les cas humains sont sporadiques, observés chez des personnes vivant ou travaillant en zone forestière qui font souvent des infections asymptomatiques et ont un haut niveau d’immunité ;
– un cycle rural intermédiaire ; la transmission se fait du singe à l’homme notamment à la saison des pluies lors du contact de populations peu immunisées avec les habitats des singes et des vecteurs ; les cas sont groupés en petites épidémies en régions rurales ;
– un cycle urbain ; la transmission se fait d’homme à homme après introduction d’un réservoir humain virémique en zone urbaine, via des vecteurs urbains du genre Aedes principalement ; ce mode est à l’origine d’épidémies urbaines en Afrique, et n’a pas été observé en Amérique depuis les années 1950 (bien que des cas péri-urbains soient en cours d’investigation au Brésil dans le contexte de l’épidémie récente évoluant depuis 2017).
– un cycle primaire selvatique ; la transmission se fait de singe à singe en forêt principalement ; les cas humains sont sporadiques, observés chez des personnes vivant ou travaillant en zone forestière qui font souvent des infections asymptomatiques et ont un haut niveau d’immunité ;
– un cycle rural intermédiaire ; la transmission se fait du singe à l’homme notamment à la saison des pluies lors du contact de populations peu immunisées avec les habitats des singes et des vecteurs ; les cas sont groupés en petites épidémies en régions rurales ;
– un cycle urbain ; la transmission se fait d’homme à homme après introduction d’un réservoir humain virémique en zone urbaine, via des vecteurs urbains du genre Aedes principalement ; ce mode est à l’origine d’épidémies urbaines en Afrique, et n’a pas été observé en Amérique depuis les années 1950 (bien que des cas péri-urbains soient en cours d’investigation au Brésil dans le contexte de l’épidémie récente évoluant depuis 2017).
Physiopathologie
La phase initiale pseudo-grippale est due à la libération de cytokines par les cellules du système immunitaire en réponse à la virémie. Le virus se réplique dans les ganglions puis gagne le sang, les endothéliums vasculaires, les macrophages et les différents organes. Le syndrome hémorragique est dû à l’insuffisance hépatocellulaire, à la thrombopénie et à l’atteinte endothéliale.
Incubation, invasion, phase d’état
L’incubation est de 3 à 6 jours ; 10 à 50 % des cas sont asymptomatiques.1-3
La phase d’invasion débute de façon brutale, avec une fièvre intense jusqu’à 40 °C, des courbatures et des céphalées. On peut observer un œdème des paupières, une injection conjonctivale et un érythème du visage (« masque amaril »). Cette phase dure environ 72 heures et est suivie soit de la guérison, soit d’une courte rémission d’environ 24 heures avant la phase d’état.
La phase d’état débute donc vers le 4e ou 5e jour. La fièvre réapparaît, toujours intense, associée à une altération de l’état général et à une hépatonéphrite aiguë. Elle se manifeste par un ictère cutanéo-muqueux, des douleurs abdominales intenses, une oligurie et un syndrome hémorragique (purpura pétéchial et ecchymotique, gingivorragies, épistaxis).
En dehors de ce tableau typique, plusieurs formes cliniques peuvent être observées, de l’infection suraiguë mortelle en 72 heures au simple épisode pseudo-grippal banal. Des atteintes myocardiques ou encéphalitiques ont également été décrites.
La phase d’invasion débute de façon brutale, avec une fièvre intense jusqu’à 40 °C, des courbatures et des céphalées. On peut observer un œdème des paupières, une injection conjonctivale et un érythème du visage (« masque amaril »). Cette phase dure environ 72 heures et est suivie soit de la guérison, soit d’une courte rémission d’environ 24 heures avant la phase d’état.
La phase d’état débute donc vers le 4e ou 5e jour. La fièvre réapparaît, toujours intense, associée à une altération de l’état général et à une hépatonéphrite aiguë. Elle se manifeste par un ictère cutanéo-muqueux, des douleurs abdominales intenses, une oligurie et un syndrome hémorragique (purpura pétéchial et ecchymotique, gingivorragies, épistaxis).
En dehors de ce tableau typique, plusieurs formes cliniques peuvent être observées, de l’infection suraiguë mortelle en 72 heures au simple épisode pseudo-grippal banal. Des atteintes myocardiques ou encéphalitiques ont également été décrites.
Signes biologiques
Les examens biologiques montrent une cytolyse parfois majeure, une hyperbilirubinémie conjuguée, une insuffisance hépatocellulaire et une coagulopathie (diminution du taux de prothrombine, thrombopénie). L’atteinte rénale est secondaire à différents mécanismes (syndrome hépatorénal, nécrose tubulaire aiguë) et se traduit par une élévation de la créatininémie et de l’urée sanguine, une protéinurie et une hématurie micro- ou macroscopique. L’hémogramme peut montrer une leucopénie modérée et une thrombopénie.
Un diagnostic confirmé par la PCR
La clinique est aspécifique, notamment à la phase initiale, et ne permet pas de distinguer la fièvre jaune d’une autre arbovirose, d’une hépatite virale aiguë notamment à virus A, B ou E, d’un paludisme ou d’une leptospirose. La certitude diagnostique est apportée par les examens virologiques : détection d’anticorps de type IgM puis IgG, détection d’anticorps neutralisants et détection de génome viral par polymerase chain reaction (PCR) dans le sang.6
La détection d’anticorps de type IgM ou l’augmentation des taux d’IgM et IgG d’un facteur 4 en quelques semaines permet de confirmer le cas, en l’absence de vaccination récente (dans les 30 jours) et en l’absence de sérologie positive pour les autres flavivirus (dengue, Zika, West Nile). Si les sérologies des autres flavivirus sont positives, le diagnostic n’est pas certain, et peut être confirmé par un test de séroneutralisation qui permet de détecter des anticorps neutralisants spécifiques de la fièvre jaune. Une autre limite de la sérologie est le délai de positivation, qui peut être de quelques jours jusqu’à 2 semaines après l’infection pour les IgM.
La détection de génome viral par PCR permet un diagnostic à la phase aiguë à partir de J2 ou J3 après l’infection dans le sang et jusqu’à environ J10.
La PCR et le test de séroneutralisation sont réalisés uniquement dans le centre de référence des flavivirus à Marseille. Les résultats sont disponibles en plusieurs semaines généralement.
La biopsie hépatique n’est pas indiquée (voire contre-indiquée du fait des troubles de l’hémostase), mais montrerait des lésions évocatrices de désorganisation trabéculaire du lobule hépatique, stéatose microvacuolaire des hépatocytes et nécrose hyaline de certains hépatocytes aboutissant à la formation des corps de Councilman. La biopsie rénale retrouve un aspect aspécifique et n’est donc pas indiquée.
Au total, le diagnostic, orienté par la clinique et la notion de séjour en zone endémique, est confirmé par les examens biologiques, la PCR idéalement.
La détection d’anticorps de type IgM ou l’augmentation des taux d’IgM et IgG d’un facteur 4 en quelques semaines permet de confirmer le cas, en l’absence de vaccination récente (dans les 30 jours) et en l’absence de sérologie positive pour les autres flavivirus (dengue, Zika, West Nile). Si les sérologies des autres flavivirus sont positives, le diagnostic n’est pas certain, et peut être confirmé par un test de séroneutralisation qui permet de détecter des anticorps neutralisants spécifiques de la fièvre jaune. Une autre limite de la sérologie est le délai de positivation, qui peut être de quelques jours jusqu’à 2 semaines après l’infection pour les IgM.
La détection de génome viral par PCR permet un diagnostic à la phase aiguë à partir de J2 ou J3 après l’infection dans le sang et jusqu’à environ J10.
La PCR et le test de séroneutralisation sont réalisés uniquement dans le centre de référence des flavivirus à Marseille. Les résultats sont disponibles en plusieurs semaines généralement.
La biopsie hépatique n’est pas indiquée (voire contre-indiquée du fait des troubles de l’hémostase), mais montrerait des lésions évocatrices de désorganisation trabéculaire du lobule hépatique, stéatose microvacuolaire des hépatocytes et nécrose hyaline de certains hépatocytes aboutissant à la formation des corps de Councilman. La biopsie rénale retrouve un aspect aspécifique et n’est donc pas indiquée.
Au total, le diagnostic, orienté par la clinique et la notion de séjour en zone endémique, est confirmé par les examens biologiques, la PCR idéalement.
Un traitement uniquement symptomatique
Il n’existe aucun traitement antiviral à ce jour. Le traitement est donc uniquement symptomatique. Il peut comporter une rééquilibration hydroélectrolytique, des transfusions, voire une épuration extrarénale en cas de défaillance métabolique, ou une transplantation hépatique en cas d’hépatite fulminante.
Une évolution parfois défavorable
L’évolution peut être défavorable, avec un taux de létalité de 20 à 30 %.1-3 Le décès survient dans un contexte d’insuffisance hépatocellulaire, de coma urémique, ou de choc hémorragique.
Dans les autres cas, les signes s’améliorent progressivement en une dizaine de jours, et le patient guérit sans aucune séquelle. L’immunité acquise est alors définitive.
Les formes les plus sévères semblent survenir principalement à l’acmé des épidémies, peut-être en relation avec l’inoculation de doses plus importantes de virus du fait des piqûres multiples.
Dans les autres cas, les signes s’améliorent progressivement en une dizaine de jours, et le patient guérit sans aucune séquelle. L’immunité acquise est alors définitive.
Les formes les plus sévères semblent survenir principalement à l’acmé des épidémies, peut-être en relation avec l’inoculation de doses plus importantes de virus du fait des piqûres multiples.
Prophylaxie : lutte antivectorielle et vaccination
La prophylaxie contre la fièvre jaune comporte d’une part la lutte antivectorielle, d’autre part les mesures de prophylaxie individuelle, avec notamment la vaccination.
La lutte antivectorielle comporte la destruction des gîtes larvaires, l’élimination des moustiques et des larves par des insecticides, et la mise sous moustiquaire des malades en période épidémique.
La prophylaxie individuelle comporte des mesures personnelles de protection diurne contre les moustiques : port de vêtements longs et imprégnés d’insecticides, application de répulsifs sur les zones découvertes.
La vaccination est la mesure de prophylaxie la plus efficace.7 Le vaccin actuellement disponible est un vaccin vivant atténué utilisant la souche 17D, thermostable à 4 °C, nécessitant une conservation au réfrigérateur. Il est administré par une injection intramusculaire. Il existe quelques contre-indications et précautions d’emploi (v. tableau ).
La tolérance est bonne, avec de rares réactions anaphylactiques liées aux traces d’ovalbumine, et une fièvre observée dans 10 % des cas vers le 4e jour.
L’OMS recommande actuellement l’injection d’une seule dose, qui confèrerait une protection à vie, mais ce point est toujours un sujet de controverse (v . p. 317 ).8 Il est possible que cela soit vrai dans les pays d’endémie où les populations autochtones sont soumises à des rappels naturels par exposition au virus sauvage. Mais une épidémie brésilienne s’est produite alors que 3,8 % des malades avaient déjà été vaccinés, et plusieurs études montrent une baisse rapide (dans les 8 à 10 ans) des anticorps vaccinaux, notamment chez les enfants. Il est donc probable que la protection ne soit pas « à vie » chez les voyageurs, raison pour laquelle on recommande encore une deuxième injection dans certains cas particuliers :
– à partir de 6 ans pour les enfants vaccinés avant l’âge de 2 ans, en cas de nouveau voyage en zone d’endémie ;
– chez les femmes ayant reçu une première dose du vaccin en cours de grossesse et chez les personnes immunodéprimées ayant été vaccinées, en tenant compte des contre-indications ;
– chez les personnes ayant été vaccinées depuis plus de 10 ans, en cas d’épidémie signalée dans le pays visité.
L’éradication de la maladie est actuellement impossible du fait du réservoir sylvatique. La prévention en zone d’endémie repose donc sur la lutte antivectorielle et sur des campagnes de vaccination de masse.
La lutte antivectorielle comporte la destruction des gîtes larvaires, l’élimination des moustiques et des larves par des insecticides, et la mise sous moustiquaire des malades en période épidémique.
La prophylaxie individuelle comporte des mesures personnelles de protection diurne contre les moustiques : port de vêtements longs et imprégnés d’insecticides, application de répulsifs sur les zones découvertes.
La vaccination est la mesure de prophylaxie la plus efficace.7 Le vaccin actuellement disponible est un vaccin vivant atténué utilisant la souche 17D, thermostable à 4 °C, nécessitant une conservation au réfrigérateur. Il est administré par une injection intramusculaire. Il existe quelques contre-indications et précautions d’emploi (
La tolérance est bonne, avec de rares réactions anaphylactiques liées aux traces d’ovalbumine, et une fièvre observée dans 10 % des cas vers le 4e jour.
L’OMS recommande actuellement l’injection d’une seule dose, qui confèrerait une protection à vie, mais ce point est toujours un sujet de controverse (
– à partir de 6 ans pour les enfants vaccinés avant l’âge de 2 ans, en cas de nouveau voyage en zone d’endémie ;
– chez les femmes ayant reçu une première dose du vaccin en cours de grossesse et chez les personnes immunodéprimées ayant été vaccinées, en tenant compte des contre-indications ;
– chez les personnes ayant été vaccinées depuis plus de 10 ans, en cas d’épidémie signalée dans le pays visité.
L’éradication de la maladie est actuellement impossible du fait du réservoir sylvatique. La prévention en zone d’endémie repose donc sur la lutte antivectorielle et sur des campagnes de vaccination de masse.
Références
1. Monath TP, Pedro FC. Yellow fever. J Clin Virol 2015;64:160-73.
2. Broom AK, Smith DW, Hall RA, et al. Arbovirus infections. In: Cook GC, Zumla AI (editors). Manson’s Tropical Diseases (21st ed). Londres : Saunders ltd, 2003:725-64.
3. Tolou H. Arboviroses. In: Gentilini M, Caumes E, Danis M, et al. Médecine tropicale (6e éd). Paris : Éditions Lavoisier, 2012:711-36.
4. Promed. Yellow fever - Americas (04): PAHO/WHO, Bolivia, Brazil, Peru: 20190307.6355499. http://bit.ly/31Pynz2
5. Oliosi E, Corcos SE, Barroso PF, et al. Yellow fever in two unvaccinated French tourists to Brazil, January and March, 2018. Euro Surveillance 2018;23(21). http://bit.ly/2Hk65DI
6. Waggoner JJ, Rojas A, Pinsky BA. Yellow fever virus: diagnostics for a persistent arboviral threat. J Clin Microbiol 2018;56:e00827-18.
7. Santé publique France. Recommandations sanitaires pour les voyageurs, 2018 (à l’attention des professionnels de santé). Bull Epidemiol Hebd 2018;hors-série (mai 2018):7-10. http://bit.ly/2H x4Elv
8. Plotkin SA. Ten yearly yellow fever booster vaccinations may still be justified. J Travel Med 2018;25. doi: 10.1093/jtm/tay130. http://bit.ly/2SDKYRT
2. Broom AK, Smith DW, Hall RA, et al. Arbovirus infections. In: Cook GC, Zumla AI (editors). Manson’s Tropical Diseases (21st ed). Londres : Saunders ltd, 2003:725-64.
3. Tolou H. Arboviroses. In: Gentilini M, Caumes E, Danis M, et al. Médecine tropicale (6e éd). Paris : Éditions Lavoisier, 2012:711-36.
4. Promed. Yellow fever - Americas (04): PAHO/WHO, Bolivia, Brazil, Peru: 20190307.6355499. http://bit.ly/31Pynz2
5. Oliosi E, Corcos SE, Barroso PF, et al. Yellow fever in two unvaccinated French tourists to Brazil, January and March, 2018. Euro Surveillance 2018;23(21). http://bit.ly/2Hk65DI
6. Waggoner JJ, Rojas A, Pinsky BA. Yellow fever virus: diagnostics for a persistent arboviral threat. J Clin Microbiol 2018;56:e00827-18.
7. Santé publique France. Recommandations sanitaires pour les voyageurs, 2018 (à l’attention des professionnels de santé). Bull Epidemiol Hebd 2018;hors-série (mai 2018):7-10. http://bit.ly/2H x4Elv
8. Plotkin SA. Ten yearly yellow fever booster vaccinations may still be justified. J Travel Med 2018;25. doi: 10.1093/jtm/tay130. http://bit.ly/2SDKYRT
Dans cet article
- Une maladie toujours d’actualité
- Agent pathogène, réservoirs et agents vecteurs
- Typologie épidémiologique
- Physiopathologie
- Incubation, invasion, phase d’état
- Signes biologiques
- Un diagnostic confirmé par la PCR
- Un traitement uniquement symptomatique
- Une évolution parfois défavorable
- Prophylaxie : lutte antivectorielle et vaccination