Si les patients insuffisants rénaux ou ayant des comorbidités sont, dans la grande majorité, des exclus des essais cliniques, ils représentent une partie importante des patients vus quotidiennement en consultation d’oncologie. On estime par exemple qu’une insuffisance rénale chronique ou une maladie rénale chronique de stade égal ou supérieur à 3 (clairance < 60 mL/min) est présente dans un tiers à la moitié des cas chez les patients ayant un cancer de la vessie métastatique.1, 2
La gestion des traitements antitumoraux souvent responsables d’effets secondaires rénaux peut être source de difficultés pour l’oncologue. L’enjeu est de maintenir le traitement dans son indice thérapeutique afin d’éviter, soit un sous-dosage qui peut être responsable d’inefficacité, soit un surdosage synonyme de surtoxicité et donc de dégradation de la qualité de vie, d’arrêt de traitement et de perte d’efficacité antitumorale.
La gestion des traitements antitumoraux souvent responsables d’effets secondaires rénaux peut être source de difficultés pour l’oncologue. L’enjeu est de maintenir le traitement dans son indice thérapeutique afin d’éviter, soit un sous-dosage qui peut être responsable d’inefficacité, soit un surdosage synonyme de surtoxicité et donc de dégradation de la qualité de vie, d’arrêt de traitement et de perte d’efficacité antitumorale.
Trois cas cliniques
Les trois cas cliniques présentés ci-dessous sont tirés de notre expérience ; ils illustrent les problématiques néphrologiques du quotidien auxquelles sont confrontés les oncologues, et ouvrent sur les perspectives d’avenir que permet leur collaboration avec les néphrologues, les pharmacologues et les pharmaciens.
Cas clinique 1 : sels de platine et rein
Madame A. est une patiente de 72 ans sans antécédent médical et qui a un tabagisme sevré évalué à 10 paquets-années. Elle est suivie pour un carcinome urothélial métastatique d’emblée, avec une indication à un traitement par cisplatine 70 mg/m2 à J1, gemcitabine 1 000 mg/m2 à J1 et J8 ; J1 = J21 pour 6 cycles au total. Elle n’a pas d’insuffisance rénale (créatinine 55 µmol/L, soit une clairance à 100 mL/min/1,73 m2 calculée selon la formule MDRD) ou cardiaque et est donc « éligible » au cisplatine.
Cette notion d’« éligibilité » au cisplatine figure dans les recommandations américaines du National Comprehensive Cancer Network (NCCN) :3 un patient est « éligible » au cisplatine si l’évaluation de son débit de filtration glomérulaire (DFG) trouve une valeur supérieure à 60 mL/min/1,73 m2 selon MDRD et si l’évaluation de sa fraction ventriculaire gauche est évaluée à plus de 50 %, afin de permettre l’hyperhydratation associée à la chimiothérapie (néphroprotection pour prévenir la toxicité rénale du cisplatine [v. infra]).
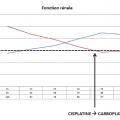
La patiente reçoit 4 cycles de chimiothérapie, avec des apports hydrosodés et en magnésium avant et pendant les cures. Elle dégrade peu à peu sa fonction rénale jusqu’à arriver à un DFG inférieur à 60 mL/min/1,73 m2 après 4 cures (fig. 1 ). Le cisplatine est alors relayé par du carboplatine pour les deux derniers cycles, molécule non contre-indiquée en cas d’insuffisance rénale.
Dans le cancer de la vessie, comme dans les tumeurs germinales, les tumeurs de la tête et du cou, les tumeurs bronchiques, l’œsophage et les tumeurs du col de l’utérus, le cisplatine a montré une supériorité en termes de taux de réponse et de survie par rapport au carboplatine.4, 5 La modification de la molécule de chimiothérapie du fait d’une toxicité rénale a donc un impact sur le pronostic oncologique de la patiente.
L’insuffisance rénale liée à la toxicité du cisplatine n’est pas un événement rare puisqu’il concerne 20 à 30 % des patients, le mécanisme étant celui d’une accumulation tubulaire de la molécule, responsable d’une tubulopathie caractéristique.6 L’hydratation et la supplémentation en magnésium ont montré un rôle dans la prévention de cette toxicité mais ne permettent pas de l’éviter systématiquement, comme en témoigne le cas de cette patiente.7
Une étude de phase II a comparé, chez des patients avec un cancer de la vessie localement avancé ou métastatique et un DFG inférieur à 60 mL/min/1,73 m2, le schéma standard dans cette situation avec du carboplatine à un schéma de fractionnement de dose du cisplatine sur deux semaines afin de diminuer la néphrotoxicité (cisplatine 35 mg/m2 à J1 et J8 au lieu de 70 mg/m2 à J1 ; J1 = J21). L’essai, dont les résultats ont été présentés à l’ASCO-GU (congrès américain portant sur les cancers génito-urinaires spécifiquement) de 2020 a dû être interrompu du fait de toxicités rénales trop importantes (42,1 % de toxicité nécessitant l’arrêt du traitement dans le bras cisplatine).8 Il n’existe ainsi pas, à l’heure actuelle, de schéma d’administration du cisplatine chez le patient insuffisant rénal. L’avenir est probablement dans le développement d’essais de protocoles d’administration de doses de cisplatine adaptés à l’évolution du chiffre de clairance de la créatinine.
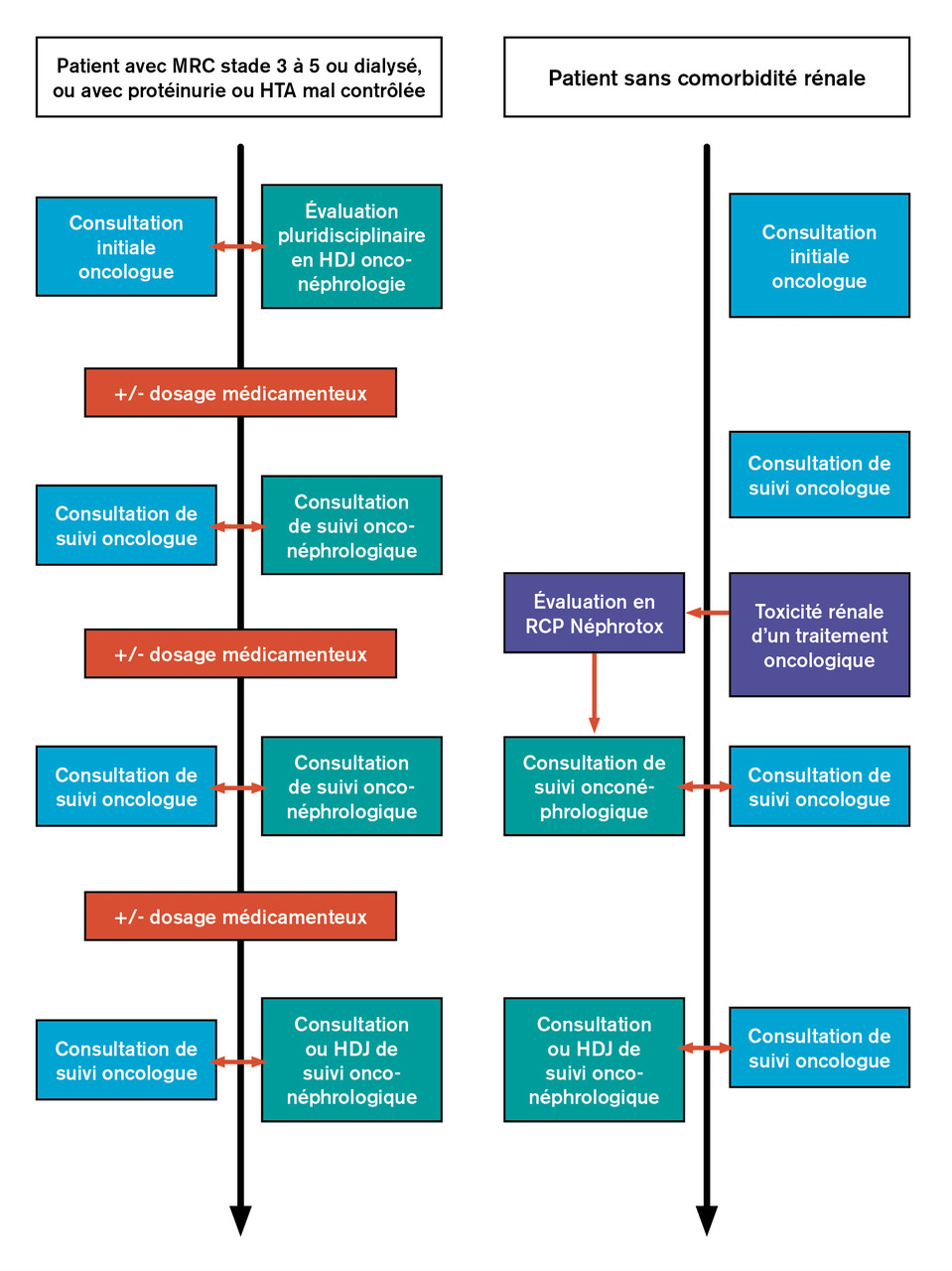
Afin de prévenir la survenue d’une insuffisance rénale liée au cisplatine, et donc de grever le pronostic du cancer, il est nécessaire de développer le suivi néphrologique spécifique de ces patients dès l’apparition d’une complication rénale (fig. 2 ). À l’inverse, en cas d’insuffisance rénale chronique rendant le patient « inéligible » au cisplatine,3 un suivi néphrologique peut se justifier après élimination d’une cause obstructive, et cela afin d’agir sur les facteurs réversibles diminuant la clairance (fig. 2 ). Les modalités de ce suivi peuvent consister en une consultation dédiée de néphro-oncologie, une évaluation pluridisciplinaire pouvant impliquer un néphrologue, un oncologue, un pharmacologue, un pharmacien, un diététicien, ou être réalisées à l’occasion d’une venue en hôpital de jour d’oncologie ou en néphrologie (fig. 2 ). Ces différentes modalités commencent à voir le jour puisqu’elles répondent à un besoin crucial, souvent sous le format d’initiatives locales, dont les modalités sont spécifiques à chaque centre (parcours de consultation onconéphrologique, hôpital de jour d’onconéphrologie et réunion de concertation pluridisciplianire Néphrotox à La Pitié-Salpêtrière).
Cette notion d’« éligibilité » au cisplatine figure dans les recommandations américaines du National Comprehensive Cancer Network (NCCN) :3 un patient est « éligible » au cisplatine si l’évaluation de son débit de filtration glomérulaire (DFG) trouve une valeur supérieure à 60 mL/min/1,73 m2 selon MDRD et si l’évaluation de sa fraction ventriculaire gauche est évaluée à plus de 50 %, afin de permettre l’hyperhydratation associée à la chimiothérapie (néphroprotection pour prévenir la toxicité rénale du cisplatine [v. infra]).
La patiente reçoit 4 cycles de chimiothérapie, avec des apports hydrosodés et en magnésium avant et pendant les cures. Elle dégrade peu à peu sa fonction rénale jusqu’à arriver à un DFG inférieur à 60 mL/min/1,73 m2 après 4 cures (
Dans le cancer de la vessie, comme dans les tumeurs germinales, les tumeurs de la tête et du cou, les tumeurs bronchiques, l’œsophage et les tumeurs du col de l’utérus, le cisplatine a montré une supériorité en termes de taux de réponse et de survie par rapport au carboplatine.4, 5 La modification de la molécule de chimiothérapie du fait d’une toxicité rénale a donc un impact sur le pronostic oncologique de la patiente.
L’insuffisance rénale liée à la toxicité du cisplatine n’est pas un événement rare puisqu’il concerne 20 à 30 % des patients, le mécanisme étant celui d’une accumulation tubulaire de la molécule, responsable d’une tubulopathie caractéristique.6 L’hydratation et la supplémentation en magnésium ont montré un rôle dans la prévention de cette toxicité mais ne permettent pas de l’éviter systématiquement, comme en témoigne le cas de cette patiente.7
Une étude de phase II a comparé, chez des patients avec un cancer de la vessie localement avancé ou métastatique et un DFG inférieur à 60 mL/min/1,73 m2, le schéma standard dans cette situation avec du carboplatine à un schéma de fractionnement de dose du cisplatine sur deux semaines afin de diminuer la néphrotoxicité (cisplatine 35 mg/m2 à J1 et J8 au lieu de 70 mg/m2 à J1 ; J1 = J21). L’essai, dont les résultats ont été présentés à l’ASCO-GU (congrès américain portant sur les cancers génito-urinaires spécifiquement) de 2020 a dû être interrompu du fait de toxicités rénales trop importantes (42,1 % de toxicité nécessitant l’arrêt du traitement dans le bras cisplatine).8 Il n’existe ainsi pas, à l’heure actuelle, de schéma d’administration du cisplatine chez le patient insuffisant rénal. L’avenir est probablement dans le développement d’essais de protocoles d’administration de doses de cisplatine adaptés à l’évolution du chiffre de clairance de la créatinine.
Afin de prévenir la survenue d’une insuffisance rénale liée au cisplatine, et donc de grever le pronostic du cancer, il est nécessaire de développer le suivi néphrologique spécifique de ces patients dès l’apparition d’une complication rénale (
Cas clinique 2 : antiangiogéniques et rein
Monsieur B., 68 ans, a pour principaux antécédents une artériopathie oblitérante des membres inférieurs, une hypertension artérielle et une cardiopathie ischémique. Il est pris en charge en oncologie pour un carcinome rénal à cellules claires métastatique pour lequel il est traité par sunitinib, un inhibiteur de tyrosine kinase ciblant plusieurs voies dont celles du vascular endothelial growth factor (VEGF/VEGFR) et possédant donc une action antiangiogénique. Son action concerne aussi des voies de prolifération tumorale comme la voie PI3K/AKT/mTOR et la voie RAS/MAPK/MAPKK, et le sunitinib appartient donc au groupe des inhibiteurs de kinase orale multicible.9 Cette action multicible a comme corollaire un éventail de toxicités très larges, les principales étant digestives, hématologiques, rénales, avec notamment une hypertension artérielle et une protéinurie.10
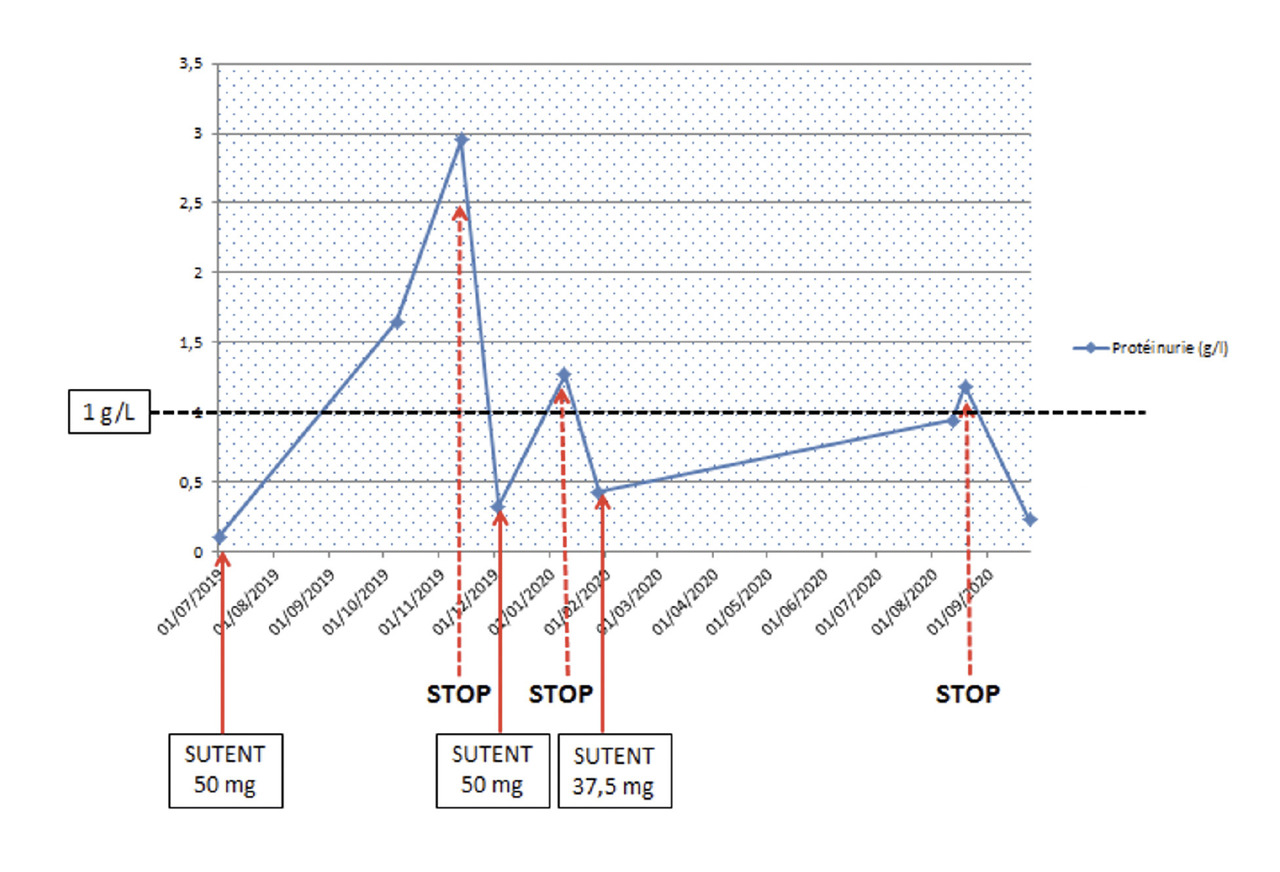
Le sunitinib est administré chez ce patient per os en dose unitaire de 50 mg et est pris 2 semaines sur 3, selon le schéma à l’étude dans l’essai de phase II SURF (Study to Assess Various sunitinib Schedules in Renal Cell Carcinoma, NCT02689167). Un suivi de la pression artérielle et de la protéinurie par bandelette urinaire plus ou moins associée à un dosage de la protéinurie est réalisé à chaque cycle pour anticiper la survenue de complications néphrologiques et hypertensives, et un avis néphrologique en vue d’une interruption du traitement antiangiogénique est recommandé quand la protéinurie dépasse le seuil de 1 g/g, comme préconisé par plusieurs sociétés savantes (Société de néphrologie, Société française d’hypertension artérielle, Association pédagogique nationale pour l’enseignement de la thérapeutique et Fédération francophone de cancérologie digestive).11
Dans le cas de M. B., une fluctuation de la protéinurie a entraîné un report de certaines semaines de traitement, une diminution de dose et finalement un arrêt de ce dernier, comme représenté dans lafigure 3 .
Plusieurs études ont montré que l’exposition au sunitinib chez un patient était directement corrélée à l’efficacité du traitement, celles-ci étant groupées dans une méta-analyse qui confirme que le temps jusqu’à progression tumorale est fonction de l’exposition à la molécule, évaluée par l’aire sous la courbe (AUC).12 À côté de cela, dans une autre étude, la survenue d’une toxicité semble aussi être le signe d’une bonne exposition au médicament.13 On pourrait donc imaginer une modulation des doses de médicaments chez chaque patient en fonction de la survenue d’une toxicité, qui correspondrait à un monitorage clinique de l’indice thérapeutique. C’est ce qui est fait par exemple avec l’axitinib, autre thérapie antiangiogénique utilisée dans le traitement du cancer du rein, pour lequel il est possible d’adapter la posologie selon les constatations cliniques. Dans les études citées, la protéinurie représentait très peu des toxicités décrites, et le lien entre exposition et toxicité est donc plus difficile à établir dans ce cas précis. Néanmoins, le fait que l’apparition d’une protéinurie soit associée à une meilleure survie dans certaines études va dans ce sens.14 Les données ne sont malgré tout pas suffisantes pour se satisfaire d’un monitorage clinique de l’indice thérapeutique.
Pour des molécules comme le sunitinib, dont les concentrations sont associées à l’efficacité, la réalisation de dosages médicamenteux dans le cadre du suivi thérapeutique pharmacologique semble pertinente, notamment chez les patients ayant une maladie rénale chronique de stade égal ou supérieur à 3, une protéinurie ou une hypertension mal contrôlée (fig. 2 ). Ces pratiques sont d’autant plus intéressantes qu’il existe un indice thérapeutique étroit, une variabilité interindividuelle importante ainsi que des situations pouvant modifier la pharmacocinétique, comme les prises alimentaires ou les comédications. Les dosages concernant la forme pharmacologiquement active doivent se pratiquer à l’état d’équilibre des concentrations et dans un timing précis.
Ils peuvent être réalisés pour plusieurs inhibiteurs de kinases, dont le sunitinib, dans de nombreux centres. Il y a une véritable nécessité au développement des dosages en routine pour les patients traités par inhibiteurs de kinases antiangiogéniques, avec à la clé une adaptation posologique dictée par le pharmacologue selon les recommandations.15
Le sunitinib est administré chez ce patient per os en dose unitaire de 50 mg et est pris 2 semaines sur 3, selon le schéma à l’étude dans l’essai de phase II SURF (Study to Assess Various sunitinib Schedules in Renal Cell Carcinoma, NCT02689167). Un suivi de la pression artérielle et de la protéinurie par bandelette urinaire plus ou moins associée à un dosage de la protéinurie est réalisé à chaque cycle pour anticiper la survenue de complications néphrologiques et hypertensives, et un avis néphrologique en vue d’une interruption du traitement antiangiogénique est recommandé quand la protéinurie dépasse le seuil de 1 g/g, comme préconisé par plusieurs sociétés savantes (Société de néphrologie, Société française d’hypertension artérielle, Association pédagogique nationale pour l’enseignement de la thérapeutique et Fédération francophone de cancérologie digestive).11
Dans le cas de M. B., une fluctuation de la protéinurie a entraîné un report de certaines semaines de traitement, une diminution de dose et finalement un arrêt de ce dernier, comme représenté dans la
Plusieurs études ont montré que l’exposition au sunitinib chez un patient était directement corrélée à l’efficacité du traitement, celles-ci étant groupées dans une méta-analyse qui confirme que le temps jusqu’à progression tumorale est fonction de l’exposition à la molécule, évaluée par l’aire sous la courbe (AUC).12 À côté de cela, dans une autre étude, la survenue d’une toxicité semble aussi être le signe d’une bonne exposition au médicament.13 On pourrait donc imaginer une modulation des doses de médicaments chez chaque patient en fonction de la survenue d’une toxicité, qui correspondrait à un monitorage clinique de l’indice thérapeutique. C’est ce qui est fait par exemple avec l’axitinib, autre thérapie antiangiogénique utilisée dans le traitement du cancer du rein, pour lequel il est possible d’adapter la posologie selon les constatations cliniques. Dans les études citées, la protéinurie représentait très peu des toxicités décrites, et le lien entre exposition et toxicité est donc plus difficile à établir dans ce cas précis. Néanmoins, le fait que l’apparition d’une protéinurie soit associée à une meilleure survie dans certaines études va dans ce sens.14 Les données ne sont malgré tout pas suffisantes pour se satisfaire d’un monitorage clinique de l’indice thérapeutique.
Pour des molécules comme le sunitinib, dont les concentrations sont associées à l’efficacité, la réalisation de dosages médicamenteux dans le cadre du suivi thérapeutique pharmacologique semble pertinente, notamment chez les patients ayant une maladie rénale chronique de stade égal ou supérieur à 3, une protéinurie ou une hypertension mal contrôlée (
Ils peuvent être réalisés pour plusieurs inhibiteurs de kinases, dont le sunitinib, dans de nombreux centres. Il y a une véritable nécessité au développement des dosages en routine pour les patients traités par inhibiteurs de kinases antiangiogéniques, avec à la clé une adaptation posologique dictée par le pharmacologue selon les recommandations.15
Cas clinique 3 : chimiothérapie et dialyse
Monsieur C. est un patient de 83 ans en hémodialyse chronique pour une insuffisance rénale terminale en raison d’une maladie de Berger. Il est pris en charge pour un carcinome urothélial de la vessie localisé.
Monsieur D., 72 ans, a une insuffisance rénale terminale multifactorielle nécessitant une dialyse péritonéale. Il est traité pour un carcinome urothélial de la voie excrétrice droite localisé. La dialyse concerne 1 million de patients dans le monde et il est désormais bien établi que ces patients ont un sur-risque de cancer avec, selon les séries et cohortes, un risque relatif estimé entre 1,1 et 1,8.16 Ce sur-risque concerne plusieurs cancers, les plus fréquents, hors cancers cutanés, étant les cancers du rein et les cancers urothéliaux.16
Pour ces deux patients, il a été décidé en réunion de concertation pluridisciplinaire de réaliser une chimiothérapie par carboplatine AUC 5 à J1, gemcitabine 1 000 mg/m2 à J1 et J8 ; J1 = J21 pour 4 cycles avant réévaluation.
La gestion des traitements oncologiques chez le patient dialysé fait l’objet de recommandations européennes qui reposent principalement sur des études rétrospectives de faible effectif ou de cohorte.17 L’administration des traitements se fait après adaptation des doses et à des jours définis par rapport aux jours de dialyse, différents en fonction des molécules de chimiothérapie. L’application en pratique de ces recommandations ne permet pas toujours d’éviter la survenue de toxicités sévères. Ces deux patients ont eu des toxicités hématologiques de grade 3-4 sur toutes les lignées (anémie, thrombopénie, neutropénie), avec nécessité d’un support transfusionnel et de report de séances de chimiothérapie, avec comme conséquence une diminution de la dose-intensité. M. C. n’a pu aller au bout de tous ses cycles de chimiothérapie en raison de cette surtoxicité.
Les modifications de pharmacocinétique des chimiothérapies chez le patient insuffisant rénal chronique et a fortiori dialysé ne concernent pas que l’élimination : les capacités d’absorption, le volume de distribution ou encore le métabolisme hépatique sont modifiés.18 Ainsi, pour certaines thérapies, cette situation pourrait être une bonne indication à un monitorage par dosage de la molécule dans le cadre d’un suivi thérapeutique pharmacologique ; ce monitorage, bien que non systématiquement réalisé en pratique, est recommandé dans cette situation17 (fig. 2 ).
Une collaboration entre oncologue et néphrologue est primordiale à toutes les étapes de la prise en charge de ces patients (fig. 2 ), et il est nécessaire de développer des recommandations spécifiques à cette population avec un plus fort niveau de preuve.
Monsieur D., 72 ans, a une insuffisance rénale terminale multifactorielle nécessitant une dialyse péritonéale. Il est traité pour un carcinome urothélial de la voie excrétrice droite localisé. La dialyse concerne 1 million de patients dans le monde et il est désormais bien établi que ces patients ont un sur-risque de cancer avec, selon les séries et cohortes, un risque relatif estimé entre 1,1 et 1,8.16 Ce sur-risque concerne plusieurs cancers, les plus fréquents, hors cancers cutanés, étant les cancers du rein et les cancers urothéliaux.16
Pour ces deux patients, il a été décidé en réunion de concertation pluridisciplinaire de réaliser une chimiothérapie par carboplatine AUC 5 à J1, gemcitabine 1 000 mg/m2 à J1 et J8 ; J1 = J21 pour 4 cycles avant réévaluation.
La gestion des traitements oncologiques chez le patient dialysé fait l’objet de recommandations européennes qui reposent principalement sur des études rétrospectives de faible effectif ou de cohorte.17 L’administration des traitements se fait après adaptation des doses et à des jours définis par rapport aux jours de dialyse, différents en fonction des molécules de chimiothérapie. L’application en pratique de ces recommandations ne permet pas toujours d’éviter la survenue de toxicités sévères. Ces deux patients ont eu des toxicités hématologiques de grade 3-4 sur toutes les lignées (anémie, thrombopénie, neutropénie), avec nécessité d’un support transfusionnel et de report de séances de chimiothérapie, avec comme conséquence une diminution de la dose-intensité. M. C. n’a pu aller au bout de tous ses cycles de chimiothérapie en raison de cette surtoxicité.
Les modifications de pharmacocinétique des chimiothérapies chez le patient insuffisant rénal chronique et a fortiori dialysé ne concernent pas que l’élimination : les capacités d’absorption, le volume de distribution ou encore le métabolisme hépatique sont modifiés.18 Ainsi, pour certaines thérapies, cette situation pourrait être une bonne indication à un monitorage par dosage de la molécule dans le cadre d’un suivi thérapeutique pharmacologique ; ce monitorage, bien que non systématiquement réalisé en pratique, est recommandé dans cette situation17 (
Une collaboration entre oncologue et néphrologue est primordiale à toutes les étapes de la prise en charge de ces patients (
Un équilibre étroit à trouver
L’oncologue est confronté au quotidien à des difficultés onconéphrologiques fréquentes, avec en particulier la gestion de thérapeutiques toxiques chez des patients fragiles, avec un équilibre étroit entre toxicité sévère et inefficacité antitumorale.
Il existe paradoxalement peu de données dans la littérature pour guider le praticien dans ces situations. Les recommandations se fondent souvent sur des études à bas niveau de preuve, et leur application dans la réalité montre des limites, comme en témoignent les cas cliniques présentés.
Plusieurs pistes sont développées pour améliorer l’utilisation de ces traitements au quotidien, qu’il s’agisse de dosages médicamenteux dans certaines situations bien définies, ou d’une évaluation pluridisciplinaire de ces patients complexes. Il existe un enjeu majeur au développement de la collaboration entre les oncologues et les néphrologues, pharmaciens et pharmacologues, tant sur le plan clinique au quotidien que sur le plan de la recherche. Les patients les plus à risque doivent être identifiés pour être intégrés dans des parcours de soins spécifiques multidisciplinaires dont l’efficacité doit être confirmée.
Il existe paradoxalement peu de données dans la littérature pour guider le praticien dans ces situations. Les recommandations se fondent souvent sur des études à bas niveau de preuve, et leur application dans la réalité montre des limites, comme en témoignent les cas cliniques présentés.
Plusieurs pistes sont développées pour améliorer l’utilisation de ces traitements au quotidien, qu’il s’agisse de dosages médicamenteux dans certaines situations bien définies, ou d’une évaluation pluridisciplinaire de ces patients complexes. Il existe un enjeu majeur au développement de la collaboration entre les oncologues et les néphrologues, pharmaciens et pharmacologues, tant sur le plan clinique au quotidien que sur le plan de la recherche. Les patients les plus à risque doivent être identifiés pour être intégrés dans des parcours de soins spécifiques multidisciplinaires dont l’efficacité doit être confirmée.
Références
1. Flannery K, Boyd M, Black-Shinn J, Robert N, Kamat AM. Outcomes in patients with metastatic bladder cancer in the USA: a retrospective electronic medical record study. Future Oncology 2019;15:1323-34.
2. Reesink DJ, van de Garde EMW, Peters BJM, et al. Treatment patterns and clinical outcomes of chemotherapy treatment in patients with muscle-invasive or metastatic bladder cancer in the Netherlands. Scientific Reports 2020;10:15822.
3. Flaig TW, Spiess PE, Agarwal N, et al. Bladder Cancer, Version 3.2020, NCCN Clinical Practice Guidelines in Oncology. J Nat Compr Canc Netw 2020;18:329-54.
4. Dogliotti L, Cartenì G, Siena S, et al. Gemcitabine plus cisplatin versus gemcitabine plus carboplatin as first-line chemotherapy in advanced transitional cell carcinoma of the urothelium: results of a randomized phase 2 trial. Eur Urol 2007;52:134‑41.
5. Petrioli R, Frediani B, Manganelli A, et al. Comparison between a cisplatin-containing regimen and a carboplatin-containing regimen for recurrent or metastatic bladder cancer patients. A randomized phase II study. Cancer 1996;77:344‑51.
6. Volarevic V, Djokovic B, Jankovic MG, et al. Molecular mechanisms of cisplatin-induced nephrotoxicity: a balance on the knife edge between renoprotection and tumor toxicity. J Biomed Sci 2019;26:25.
7. Hamroun A, Lenain R, Bigna JJ, et al. Prevention of cisplatin-induced acute kidney injury: a systematic review and meta-analysis. Drugs 2019;79:1567-82.
8. Mourey L, Flechon A, Tosi D, et al. Vefora, GETUG-AFU V06 study: Randomized multicenter phase II/III trial of fractionated cisplatin (CI)/gemcitabine (G) or carboplatin (CA)/g in patients (pts) with advanced urothelial cancer (UC) with impaired renal function (IRF)—Results of a planned interim analysis. JCO 2020;38(6_suppl):461‑1.
9. Aparicio-Gallego G, Blanco M, Figueroa A, et al. New insights into molecular mechanisms of sunitinib-associated side effects. Mol Cancer Ther 2011;10:2215‑23.
10. Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus Axitinib versus sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 2019;380:1116‑27.
11. Halimi JM, Azizi M, Bobrie G, et al. Vascular and renal effects of anti-angiogenic therapy. Nephrol Ther 2008;4:602‑15.
12. Houk BE, Bello CL, Poland B, Rosen LS, Demetri GD, Motzer RJ. Relationship between exposure to sunitinib and efficacy and tolerability endpoints in patients with cancer: results of a pharmacokinetic/pharmacodynamic meta-analysis. Cancer Chemother Pharmacol 2010;66:357‑71.
13. Westerdijk K, Krens SD, van der Graaf WTA, et al. The relationship between sunitinib exposure and both efficacy and toxicity in real-world patients with renal cell carcinoma and gastrointestinal stromal tumour. Br J Clin Pharmacol 1 mai 2020. DOI: 10.1111/bcp.14332
14. Sorich MJ, Rowland A, Kichenadasse G, Woodman RJ, Mangoni AA. Risk factors of proteinuria in renal cell carcinoma patients treated with VEGF inhibitors: a secondary analysis of pooled clinical trial data. British Journal of Cancer 2016;114:1313.
15. Yu H, Steeghs N, Nijenhuis CM, et al. Practical guidelines for therapeutic drug monitoring of anticancer tyrosine kinase inhibitors: focus on the pharmacokinetic targets. Clin Pharmacokinet 2014;53:305‑25.
16. Janus N, Launay-Vacher V, Ferrero JM, Thariat J. Risque de cancer chez les dialysés et transplantés rénaux. Bull Cancer 2012;99:285-93.
17. Pedrazzoli P, Silvestris N, Santoro A, et al. Management of patients with end-stage renal disease undergoing chemotherapy: recommendations of the Associazione Italiana di Oncologia Medica (AIOM) and the Società Italiana di Nefrologia (SIN). ESMO Open 2017;2:e000167.
18. Krens SD, Lassche G, Jansman FGA, £et al. Dose recommendations for anticancer drugs in patients with renal or hepatic impairment. Lancet Oncol 2019;20:e200‑7.
2. Reesink DJ, van de Garde EMW, Peters BJM, et al. Treatment patterns and clinical outcomes of chemotherapy treatment in patients with muscle-invasive or metastatic bladder cancer in the Netherlands. Scientific Reports 2020;10:15822.
3. Flaig TW, Spiess PE, Agarwal N, et al. Bladder Cancer, Version 3.2020, NCCN Clinical Practice Guidelines in Oncology. J Nat Compr Canc Netw 2020;18:329-54.
4. Dogliotti L, Cartenì G, Siena S, et al. Gemcitabine plus cisplatin versus gemcitabine plus carboplatin as first-line chemotherapy in advanced transitional cell carcinoma of the urothelium: results of a randomized phase 2 trial. Eur Urol 2007;52:134‑41.
5. Petrioli R, Frediani B, Manganelli A, et al. Comparison between a cisplatin-containing regimen and a carboplatin-containing regimen for recurrent or metastatic bladder cancer patients. A randomized phase II study. Cancer 1996;77:344‑51.
6. Volarevic V, Djokovic B, Jankovic MG, et al. Molecular mechanisms of cisplatin-induced nephrotoxicity: a balance on the knife edge between renoprotection and tumor toxicity. J Biomed Sci 2019;26:25.
7. Hamroun A, Lenain R, Bigna JJ, et al. Prevention of cisplatin-induced acute kidney injury: a systematic review and meta-analysis. Drugs 2019;79:1567-82.
8. Mourey L, Flechon A, Tosi D, et al. Vefora, GETUG-AFU V06 study: Randomized multicenter phase II/III trial of fractionated cisplatin (CI)/gemcitabine (G) or carboplatin (CA)/g in patients (pts) with advanced urothelial cancer (UC) with impaired renal function (IRF)—Results of a planned interim analysis. JCO 2020;38(6_suppl):461‑1.
9. Aparicio-Gallego G, Blanco M, Figueroa A, et al. New insights into molecular mechanisms of sunitinib-associated side effects. Mol Cancer Ther 2011;10:2215‑23.
10. Rini BI, Plimack ER, Stus V, et al. Pembrolizumab plus Axitinib versus sunitinib for Advanced Renal-Cell Carcinoma. N Engl J Med 2019;380:1116‑27.
11. Halimi JM, Azizi M, Bobrie G, et al. Vascular and renal effects of anti-angiogenic therapy. Nephrol Ther 2008;4:602‑15.
12. Houk BE, Bello CL, Poland B, Rosen LS, Demetri GD, Motzer RJ. Relationship between exposure to sunitinib and efficacy and tolerability endpoints in patients with cancer: results of a pharmacokinetic/pharmacodynamic meta-analysis. Cancer Chemother Pharmacol 2010;66:357‑71.
13. Westerdijk K, Krens SD, van der Graaf WTA, et al. The relationship between sunitinib exposure and both efficacy and toxicity in real-world patients with renal cell carcinoma and gastrointestinal stromal tumour. Br J Clin Pharmacol 1 mai 2020. DOI: 10.1111/bcp.14332
14. Sorich MJ, Rowland A, Kichenadasse G, Woodman RJ, Mangoni AA. Risk factors of proteinuria in renal cell carcinoma patients treated with VEGF inhibitors: a secondary analysis of pooled clinical trial data. British Journal of Cancer 2016;114:1313.
15. Yu H, Steeghs N, Nijenhuis CM, et al. Practical guidelines for therapeutic drug monitoring of anticancer tyrosine kinase inhibitors: focus on the pharmacokinetic targets. Clin Pharmacokinet 2014;53:305‑25.
16. Janus N, Launay-Vacher V, Ferrero JM, Thariat J. Risque de cancer chez les dialysés et transplantés rénaux. Bull Cancer 2012;99:285-93.
17. Pedrazzoli P, Silvestris N, Santoro A, et al. Management of patients with end-stage renal disease undergoing chemotherapy: recommendations of the Associazione Italiana di Oncologia Medica (AIOM) and the Società Italiana di Nefrologia (SIN). ESMO Open 2017;2:e000167.
18. Krens SD, Lassche G, Jansman FGA, £et al. Dose recommendations for anticancer drugs in patients with renal or hepatic impairment. Lancet Oncol 2019;20:e200‑7.