Centenaire, c’est la plus ancienne des greffes de tissus chez l’homme.
Pour en bénéficier, il faut un donneur, une banque de tissus, un centre de greffe et bien sûr un cadre législatif.1 L’Agence de la biomédecine est l’instance d’organisation, de régulation, de contrôle, et d’évaluation des activités de transplantation tissulaire en France.2
Grands principes
Le prélèvement est pratiqué soit sur donneur d’organes et de tissus au bloc opératoire, soit sur donneur décédé en arrêt hémodynamique à la morgue le jour du décès ou le lendemain. Équipes et lieux de prélèvement doivent répondre à des critères d’agrément définis. Leur fonctionnement est sous la responsabilité du médecin coordonnateur des greffes et de son équipe. Missions principales : s’assurer du respect des règles de consentement et de celui des contre-indications locales et générales au prélèvement.
Sur un plan technique, sauf situation particulière, seule la cornée avec sa collerette sclérale est prélevée. Le globe oculaire est laissé en place pour réduire les risques de délabrements et faciliter une restitution aussi parfaite que possible.
En France en 2016, les prélèvements ont été réalisés pour 84 % sur donneurs décédés à la morgue et pour 16 % lors de prélèvements d’organes.
La banque de tissus, véritable plaque tournante, gère les étapes fondamentales que sont la réception, le contrôle et la cession des cornées avec pour souci principal la qualité optimale du greffon délivré, sur les plans microbiologique (éviter de transmettre une infection locale ou une pathologie systémique au receveur) et fonctionnel (éviter l’échec primaire et réduire le risque de défaillance à long terme). En conséquence, le taux de non- conformité est élevé (de 54,2 % en 2015), équivalent à celui des pays européens.
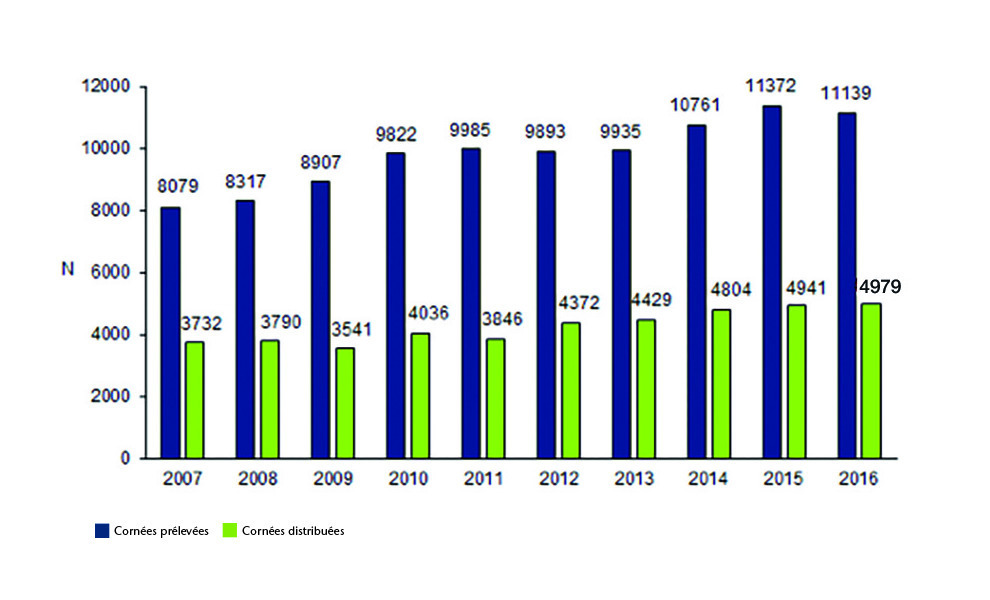
En France en 2016, 16 banques de tissus ont reçu 11 136 cornées et en ont distribué 4 979.
Le centre de greffe, constitué par un ou plusieurs chirurgiens ophtalmologistes, dûment signalé auprès de l’Agence de la biomédecine, a reçu un numéro d’enregistrement. Ce numéro est indispensable pour inscrire le patient en attente de l’organe sur le logiciel GLAC (gestion liste d’attente cornée) et sera exigé par la banque. Bien sûr des procédures existent pour répondre aux situations d’urgence.
Le chirurgien s’engage à déclarer toute greffe réalisée sur le logiciel GLAC et à participer à la biovigilance des tissus en signalant tout événement indésirable, local ou systémique, potentiellement lié à la greffe, à court, moyen et long terme.
Au cours de l’année 2016, 130 équipes ont déclaré une activité de greffe. Activité très disparate de moins de 24 greffes par an pour 84 d’entre elles à plus de 100 par an pour 14 centres réalisant ainsi plus de 55 % de l’activité.
Le patient doit être informé de toutes les étapes et notamment de la nature humaine de la greffe. Il donne son accord pour la réalisation du bilan viral prégreffe et la constitution d’une sérothèque. Au terme de l’intervention, il devient exclu ipso facto de tout don de sang, de cellules, de tissus et d’organes en raison du principe de précaution.
Cette transplantation, a priori complexe sur le plan organisationnel, est en progression. En témoignent les bilans annuels d’activité des banques de ces 10 dernières années, en termes de cornées réceptionnées (de 8 079 en 2007 à 11 136 en 2016 ; figure), délivrées (de 3 732 en 2007 à 4 979 en 2016) et le nombre de patients inscrits en liste d’attente qui croît de façon constante depuis 5 ans et s’établit en 2016 à 5 912.
Des disparités régionales persistent en termes de prélèvement (de 38 à 396 par million d’habitants) et de greffe (de 39 à 98 par million d’habitants) qui devront probablement faire l’objet de politiques correctives par l’Agence de la bio- médecine.
La situation française, certes perfectible, n’en demeure pas moins favorable au regard du délai d’attente entre la date d’inscription sur les listes d’attente et celle de la greffe. En 2016, ce délai a été de 1 mois pour 33,5 % des patients, 2 mois pour 54,5 %, 4 mois pour 76,5 %, 6 mois pour 86 % et 9 mois pour 91 %.
À l’échelon national, en 2016, l’adéquation entre les besoins et les ressources était satisfaisante malgré la persistance de disparités régionales.
Le nombre de greffes de cornée rapporté au nombre de Français est de 66,7 par million d’habitants et se situe dans la moyenne des pays européens.
Sur un plan technique, sauf situation particulière, seule la cornée avec sa collerette sclérale est prélevée. Le globe oculaire est laissé en place pour réduire les risques de délabrements et faciliter une restitution aussi parfaite que possible.
En France en 2016, les prélèvements ont été réalisés pour 84 % sur donneurs décédés à la morgue et pour 16 % lors de prélèvements d’organes.
La banque de tissus, véritable plaque tournante, gère les étapes fondamentales que sont la réception, le contrôle et la cession des cornées avec pour souci principal la qualité optimale du greffon délivré, sur les plans microbiologique (éviter de transmettre une infection locale ou une pathologie systémique au receveur) et fonctionnel (éviter l’échec primaire et réduire le risque de défaillance à long terme). En conséquence, le taux de non- conformité est élevé (de 54,2 % en 2015), équivalent à celui des pays européens.
En France en 2016, 16 banques de tissus ont reçu 11 136 cornées et en ont distribué 4 979.
Le centre de greffe, constitué par un ou plusieurs chirurgiens ophtalmologistes, dûment signalé auprès de l’Agence de la biomédecine, a reçu un numéro d’enregistrement. Ce numéro est indispensable pour inscrire le patient en attente de l’organe sur le logiciel GLAC (gestion liste d’attente cornée) et sera exigé par la banque. Bien sûr des procédures existent pour répondre aux situations d’urgence.
Le chirurgien s’engage à déclarer toute greffe réalisée sur le logiciel GLAC et à participer à la biovigilance des tissus en signalant tout événement indésirable, local ou systémique, potentiellement lié à la greffe, à court, moyen et long terme.
Au cours de l’année 2016, 130 équipes ont déclaré une activité de greffe. Activité très disparate de moins de 24 greffes par an pour 84 d’entre elles à plus de 100 par an pour 14 centres réalisant ainsi plus de 55 % de l’activité.
Le patient doit être informé de toutes les étapes et notamment de la nature humaine de la greffe. Il donne son accord pour la réalisation du bilan viral prégreffe et la constitution d’une sérothèque. Au terme de l’intervention, il devient exclu ipso facto de tout don de sang, de cellules, de tissus et d’organes en raison du principe de précaution.
Cette transplantation, a priori complexe sur le plan organisationnel, est en progression. En témoignent les bilans annuels d’activité des banques de ces 10 dernières années, en termes de cornées réceptionnées (de 8 079 en 2007 à 11 136 en 2016 ; figure), délivrées (de 3 732 en 2007 à 4 979 en 2016) et le nombre de patients inscrits en liste d’attente qui croît de façon constante depuis 5 ans et s’établit en 2016 à 5 912.
Des disparités régionales persistent en termes de prélèvement (de 38 à 396 par million d’habitants) et de greffe (de 39 à 98 par million d’habitants) qui devront probablement faire l’objet de politiques correctives par l’Agence de la bio- médecine.
La situation française, certes perfectible, n’en demeure pas moins favorable au regard du délai d’attente entre la date d’inscription sur les listes d’attente et celle de la greffe. En 2016, ce délai a été de 1 mois pour 33,5 % des patients, 2 mois pour 54,5 %, 4 mois pour 76,5 %, 6 mois pour 86 % et 9 mois pour 91 %.
À l’échelon national, en 2016, l’adéquation entre les besoins et les ressources était satisfaisante malgré la persistance de disparités régionales.
Le nombre de greffes de cornée rapporté au nombre de Français est de 66,7 par million d’habitants et se situe dans la moyenne des pays européens.
En pratique
Indications : a priori toutes les altérations de forme, de structure ou de transparence de la cornée responsables d’une déficience visuelle isolée ou associée. Avant d’envisager une transplantation, un bilan ophtalmologique complet clinique et paraclinique s’impose, à la recherche de pathologies associées qui pourraient soit être traitées en même temps, soit constituer une contre-indication absolue ou relative .
Quatre pathologies (dystrophie endothéliale primitive de Fuchs, décompensation endothéliale secondaire du pseudophaque – opéré du cristallin –, kératocône, échecs de greffes) motivent plus de 60 % des indications, même si leur taux respectif évolue dans le temps (par exemple pour la dystrophie endothéliale de Fuchs, 9 % en 2005 et 24,7 % en 2016).
Les progrès technologiques de dé-coupe manuelle ou laser du tissu cornéen dans son épaisseur ont permis de limiter la transplantation à la seule couche patho- logique.
On définit ainsi des greffes transfixiantes qui consistent à remplacer la totalité du tissu cornéen du receveur et lamellaires qui visent à ne remplacer que la partie pathologique. Ces dernières sont soit antérieures et ne concernent que l’épithélium et tout ou partie du stroma, soit postérieures : endothélium associé ou non à une partie du stroma postérieur.
Principaux avantages : réduction de la charge antigénique transplantée, baisse des réponses immunitaires, conservation de l’endothélium du receveur – couche fondamentale de la physiologie cornéenne et garante d’une meilleure survie à long terme –, réduction des complications, meilleures gestion postopératoire et qualité optique.
Le suivi est simple et se limite dans l’immense majorité des cas à un traitement topique et des consultations externes associés à des recommandations de bons sens visant notamment à prévenir les traumatismes (réduction des activités sportives).
La nécessaire immunosuppression repose sur une corticothérapie locale à doses dégressives au long cours. Si besoin : antibiotiques, antifongiques, antiviraux (HSV) topiques et systémiques et, dans de rares cas, immunosuppresseurs (haut risque de rejet).
Le suivi est mensuel la première année, puis semestriel pendant 2-3 ans, puis annuel. Une autosurveillance des signes évocateurs : douleur, rougeur, irritation, baisse d’acuité est sollicitée.
Objectifs : dépister les complications, adapter la thérapeutique, manipuler les sutures si nécessaires, optimiser la récupération visuelle et adapter la correction optique.
Le pronostic est lié avant tout au terrain receveur. Deux situations : les hauts risques d’échec (40-50 % de taux de succès), les faibles risques (80-90 % de succès).
Facteurs péjoratifs par ordre décroissant :
– échecs immunitaires des greffes antérieures (risque d’autant plus élevé que leur nombre l’est) ;
– néovascularisation cornéenne (le risque est proportionnel au nombre de quadrants atteints) ;
– hypertonies préopératoires non maîtrisées ;
– greffes de grand diamètre (> 9 mm) ;
– infections majeures ;
– âge (moins de 15 ans) ;
– contexte inflammatoire ;
– troubles trophiques (kératite neuro- paralytique) ;
– associations de plusieurs facteurs ;
à 10 ans, l’efficacité en termes de survie du greffon peut atteindre 70 % (90 % et plus pour les kératocônes, 50 % si haut risque).
Quatre pathologies (dystrophie endothéliale primitive de Fuchs, décompensation endothéliale secondaire du pseudophaque – opéré du cristallin –, kératocône, échecs de greffes) motivent plus de 60 % des indications, même si leur taux respectif évolue dans le temps (par exemple pour la dystrophie endothéliale de Fuchs, 9 % en 2005 et 24,7 % en 2016).
Les progrès technologiques de dé-coupe manuelle ou laser du tissu cornéen dans son épaisseur ont permis de limiter la transplantation à la seule couche patho- logique.
On définit ainsi des greffes transfixiantes qui consistent à remplacer la totalité du tissu cornéen du receveur et lamellaires qui visent à ne remplacer que la partie pathologique. Ces dernières sont soit antérieures et ne concernent que l’épithélium et tout ou partie du stroma, soit postérieures : endothélium associé ou non à une partie du stroma postérieur.
Principaux avantages : réduction de la charge antigénique transplantée, baisse des réponses immunitaires, conservation de l’endothélium du receveur – couche fondamentale de la physiologie cornéenne et garante d’une meilleure survie à long terme –, réduction des complications, meilleures gestion postopératoire et qualité optique.
Le suivi est simple et se limite dans l’immense majorité des cas à un traitement topique et des consultations externes associés à des recommandations de bons sens visant notamment à prévenir les traumatismes (réduction des activités sportives).
La nécessaire immunosuppression repose sur une corticothérapie locale à doses dégressives au long cours. Si besoin : antibiotiques, antifongiques, antiviraux (HSV) topiques et systémiques et, dans de rares cas, immunosuppresseurs (haut risque de rejet).
Le suivi est mensuel la première année, puis semestriel pendant 2-3 ans, puis annuel. Une autosurveillance des signes évocateurs : douleur, rougeur, irritation, baisse d’acuité est sollicitée.
Objectifs : dépister les complications, adapter la thérapeutique, manipuler les sutures si nécessaires, optimiser la récupération visuelle et adapter la correction optique.
Le pronostic est lié avant tout au terrain receveur. Deux situations : les hauts risques d’échec (40-50 % de taux de succès), les faibles risques (80-90 % de succès).
Facteurs péjoratifs par ordre décroissant :
– échecs immunitaires des greffes antérieures (risque d’autant plus élevé que leur nombre l’est) ;
– néovascularisation cornéenne (le risque est proportionnel au nombre de quadrants atteints) ;
– hypertonies préopératoires non maîtrisées ;
– greffes de grand diamètre (> 9 mm) ;
– infections majeures ;
– âge (moins de 15 ans) ;
– contexte inflammatoire ;
– troubles trophiques (kératite neuro- paralytique) ;
– associations de plusieurs facteurs ;
à 10 ans, l’efficacité en termes de survie du greffon peut atteindre 70 % (90 % et plus pour les kératocônes, 50 % si haut risque).
Perspectives
Optimiser la qualité de la greffe au long cours en termes de survie, qualité optique, suivi… surtout dans les pays industrialisés ; subvenir aux besoins mondiaux et rendre la greffe accessible au plus grand nombre, essentiellement dans les pays en voie de développement. On estime en effet qu’à l’échelle mondiale, 70 patients sont en attente pour une cornée disponible (soit 12,7 millions de personnes dans une étude de 2012).5
Si la cornée artificielle semble peu probable, deux voies paraissent plus prometteuses, celle des biomatériaux et celle de la xénotransplantation.
La première est fondée sur la colonisation de supports synthétiques par des cellules humaines (essentiellement endothéliales) traités in vitro pour optimiser la survie, réduire les risques immunitaires, améliorer la qualité optique et produits en quantité suffisante quasi industrielle pour subvenir aux besoins.
La seconde repose sur l’utilisation d’animaux sélectionnés, génétiquement modifiés (cornées compatibles, de structure et de qualités optiques similaires), élevés et produits pour cet usage. Le cochon serait le candidat idéal. Des essais thérapeutiques chez l’homme sont en cours.3
Si la cornée artificielle semble peu probable, deux voies paraissent plus prometteuses, celle des biomatériaux et celle de la xénotransplantation.
La première est fondée sur la colonisation de supports synthétiques par des cellules humaines (essentiellement endothéliales) traités in vitro pour optimiser la survie, réduire les risques immunitaires, améliorer la qualité optique et produits en quantité suffisante quasi industrielle pour subvenir aux besoins.
La seconde repose sur l’utilisation d’animaux sélectionnés, génétiquement modifiés (cornées compatibles, de structure et de qualités optiques similaires), élevés et produits pour cet usage. Le cochon serait le candidat idéal. Des essais thérapeutiques chez l’homme sont en cours.3
références
1. Borderie V, Baudrimont M, Bourcier T, Laroche L, Touzeau O. Les greffes en ophtalmologie. Paris: Elsevier Masson; 2004: 301 p.
2. Agence de la biomédecine. Bilan d’activité 2016. www.agence-biomedecine.fr
3. Kim MK, Hara H. Current status of corneal xenotransplantation. Int J Surg 2015;23(PtB):255-60
4. Ghezzi CE, Rnjak-Kovacina J, Kaplan DL. Corneal tissue engineering: recent advances and future perspectives. Tissue Eng Part B Rev 2015;21:278-87.
5. Gain P, Jullienne R, He Z, et al. Global survey of corneal transplantation and eye banking. JAMA Ophthalmol 2016;134:167-73.
2. Agence de la biomédecine. Bilan d’activité 2016. www.agence-biomedecine.fr
3. Kim MK, Hara H. Current status of corneal xenotransplantation. Int J Surg 2015;23(PtB):255-60
4. Ghezzi CE, Rnjak-Kovacina J, Kaplan DL. Corneal tissue engineering: recent advances and future perspectives. Tissue Eng Part B Rev 2015;21:278-87.
5. Gain P, Jullienne R, He Z, et al. Global survey of corneal transplantation and eye banking. JAMA Ophthalmol 2016;134:167-73.